急性脊髓损伤后最佳干预时间窗的实验研究*
李晓宁单筱淳吴 磊梁雪松迟 蕾刘双岭梅继林李 诺
(1.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001;2.黑龙江中医药大学,黑龙江哈尔滨 150040)
·实验报告·
急性脊髓损伤后最佳干预时间窗的实验研究*
李晓宁1单筱淳2吴 磊2梁雪松2迟 蕾2刘双岭1梅继林2李 诺2
(1.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001;2.黑龙江中医药大学,黑龙江哈尔滨 150040)
目的观察急性脊髓损伤(ASCI)后大鼠神经细胞凋亡出现的最早时间,明确早期干预的时间点。方法 将48只雌性Wistar大鼠,随机平分为两组:假手术组(Sham)及急性脊髓损伤组(ASCI),每组各分为4个亚组即1 h、3 h、6 h和8 h。于相应时间点进行造模后取材。HE染色法观察大鼠脊髓组织病理学形态变化;TUNEL染色法检测大鼠神经细胞凋亡情况,筛选出神经细胞凋亡出现最早时间点,确定早期干预的最佳时间点。结果1)HE染色结果显示,ASCI组大鼠术后1 h和3 h可见灰质小灶性斑片状出血;术后6 h细胞形态明显变化,神经细胞出现凋亡;术后8 h细胞损伤加重,形态进一步变小,仅见残存的神经细胞。2)TUNEL检测显示,ASCI组术后6 h细胞形态改变显著,可见凋散在凋亡神经细胞,与Sham组比较有显著差异(P<0.05);8 h后神经凋亡细胞数量明显增多,与Sham组比较具有显著性差异(P<0.05)。结论急性脊髓损伤后6 h内为本病最佳干预时间窗。
脊髓损伤 细胞凋亡 最佳干预时间窗
急性脊髓损伤(ASCI)是临床常见的严重疾病之一,年发病率约为20~40/100万,因其缺乏有效的治疗手段,ASCI患者死亡率和致残率都很高[1]。其发病的病因及病机复杂,神经细胞凋亡是本病继发性损伤重要的病理机制之一[2]。本研究通过观察急性脊髓损伤大鼠1 h、3 h、6 h和8 h 4个时间点相应的神经细胞病理形态学变化及神经细胞凋亡情况,进而寻求对ASCI大鼠进行干预的最佳时间窗。
1 材料与方法
1.1 实验动物 选取48只健康Wistar雌性大鼠(由辽宁长生生物技术有限公司提供),体质量(200±10)g。每日固定人工照明(12:12光/暗周期),在实验室常规饲养1周。
1.2 试药与仪器 二甲苯 (国药,X112051);苏木精(Solarbio,H8070);曙红Y,醇溶(国药,S23025101);原位细胞死亡检测工具(罗氏,11684817910);过氧化氢(国药,10011218);DAB显色液 (Solarbio,DA1010);Triton X-100(碧云天,ST795);打击器(美国Impactor Model-Ⅲspinal lord contusion system)。
1.3 分组与造模 1)动物分组:将48只大鼠依据随机数字表分为两组4个时间点,分别为假手术组(Sham组,24只)和急性脊髓损伤组(ASCI组,24只),每组又分为1 h、3 h、6 h和8 h 4个亚组,每组6只。Sham组:仅暴露脊髓,不撞击损伤,手术后常规饲养,不予任何处置。ASCI组:模型制备成功后,置于单笼饲养,同时不进行任何处置。2)模型制备:急性脊髓损伤模型制备[3-4],采用打击器打击制作大鼠ASCI模型(T10,中度损伤)。用10%水合氯醛腹腔麻醉,常规消毒,于T10行约3 cm的纵行切口,暴露T9-11棘突,锐性分离肌肉至关节突,充分暴露棘突和椎板,在T10部位行椎板摘除术,但不破坏硬脊膜。暴露以T10为中心段脊髓,并以10 g×50mm势能撞击脊髓,造成该段的急性脊髓中度损伤,冲洗伤口并缝合。
1.4 观察指标 HE染色观察脊髓组织病理学形态变化,经切片脱蜡至水、染色、脱水、透明、封片、镜检等步骤进行HE染色并镜下观察。TUNEL检测脊髓组织神经细胞凋亡,经透化、PBS漂洗、封闭、Labeling、苏木素复染、脱水、透明、封片镜检等步骤观察神经细胞凋亡。
1.5 统计学处理 应用SPSS19.0统计软件。计量资料以(±s)表示,先进行方差齐性检验。组间比较采用单因素方差分析(ANOVA),多个样本均数之间的多重分析行LSD-t检验。P<0.05为差异有统计学意义。
2 结 果

图1 各组大鼠脊髓组织病理形态学变化(HE染色,200倍)
2.1 各组脊髓组织病理形态学变化 见图1。HE染色结果显示,Sham组大鼠脊髓组织灰质、白质、脊髓前角和后角、中央管结构清晰,细胞核形态正常,未见炎性细胞浸润及神经细胞变性。ASCI组中1 h和3 h可见灰质小灶性斑片状出血,大部分细胞形态结构清晰,仅数个细胞萎缩,偶有神经元水肿;6 h可见细胞形态变化显著,胞体变小,胞核固缩碎裂,胞膜皱缩、浓染,神经细胞出现凋亡;8 h较6 h细胞损伤加重,仅见残存的神经细胞。以上结果表明,脊髓损伤后6 h神经元出现凋亡形态改变。
2.2 各组TUNEL法检测脊髓组织神经细胞凋亡 见表1,图2。TUNEL检测中,标记的阳性细胞的细胞核染色呈棕褐色,正常细胞核被苏木素复染成蓝色。检测结果显示,Sham组神经细胞形态正常,结构清晰,胞质淡染,胞核蓝色,未见明显凋亡细胞;ASCI组1 h时未见神经细胞形态明显变化,胞核蓝染;3 h神经细胞形态略有变化,失去正常多角形,略变圆,偶见染色质边集,呈斑片状聚集核膜周围,胞浆浓染,但细胞膜相对较完整;6 h神经细胞形态明显改变,多极形消失,部分细胞核裂解,染色质分割成块状,可见凋亡小体出现,见散在凋亡细胞,与假手术组相比,差异具有显著意义(P<0.05);8 h细胞进一步固缩,细胞间隙变大,残存的神经细胞减少,神经细胞凋亡明显增多,与Sham组比较差异显著(P<0.05)。以上结果表明,大鼠ASCI后6 h脊髓组织出现神经细胞凋亡,结果与HE染色所见组织病理改变相符。
表1 各组大鼠TUNEL法检测凋亡神经细胞数比较(±s)
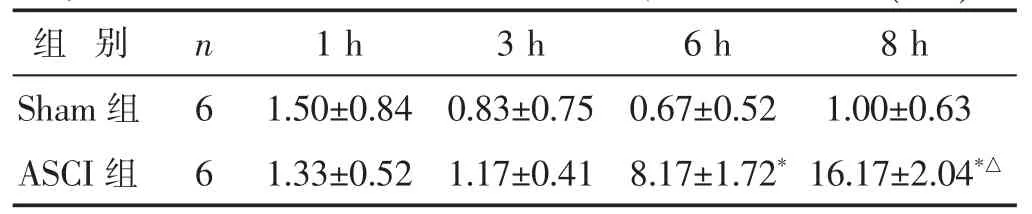
表1 各组大鼠TUNEL法检测凋亡神经细胞数比较(±s)
与Sham组比较,*P<0.05;与本组6 h时比较,△P<0.05。下同。
组别 n 1 h 3 h 6 h 8 h Sham组 61.50±0.84 0.83±0.75 0.67±0.52 1.00±0.63 ASCI组 61.33±0.52 1.17±0.41 8.17±1.72*16.17±2.04*△
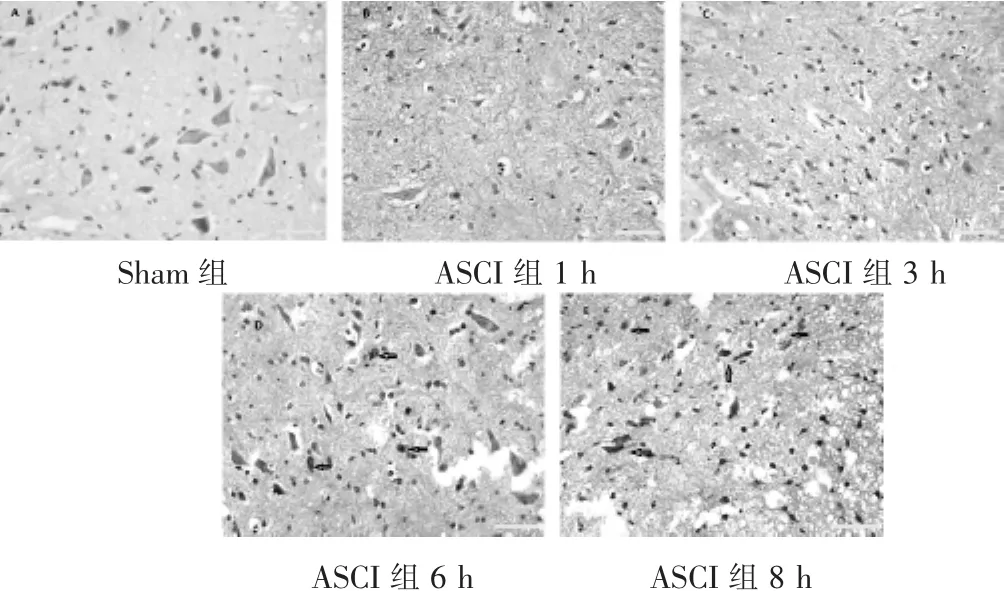
图2 各组大鼠凋亡神经细胞(TUNEL法,400倍)
3 讨 论
急性脊髓损伤后引发脊髓微环境系列变化的机制十分复杂,目前研究主要目标为组织神经细胞的凋亡,研究内容包括一系列的炎症反应和神经细胞凋亡[5]、兴奋性氨基酸的毒性作用、线粒体途径产生的促凋亡蛋白等。万勇[6]在研究中,将损伤后不同时间点腹腔注射重组人红细胞生成素(rHuEPO),观察大鼠后肢运动功能及脊髓神经细胞凋亡情况,发现对急性脊髓损伤后脊髓神经元保护作用的用药时间窗为6 h。急性脊髓损伤后,会因迟发性神经细胞坏死及凋亡造成继发性损伤。研究表明[7],当急性脊髓损伤早期,会出现组织出血、水肿、坏死及神经细胞凋亡,随后炎性细胞和胶质细胞发生聚集,最后实质细胞萎缩、形成慢性坏死囊腔及胶质瘫痕[8]。因此在准确时间窗对大鼠ASCI后进行干预是减少神经细胞凋亡,降低急性脊髓损伤并发症的发生率,促进脊髓功能恢复的关键。
神经元丢失主要原因之一为细胞凋亡[9],凋亡同样也是具有时间依赖性。王健等[10]在研究中发现,急性脊髓损伤后6 h出现神经细胞大量凋亡,凋亡的高峰时间从损伤后6 h开始。由此得出:早期应用药物川芎嗪干预治疗,可有效抑制脊髓损伤后大鼠神经细胞凋亡。研究发现,早期电针干预能更好的减轻大鼠ASCI细胞凋亡,可保护脊髓组织和神经元细胞,促进神经细胞的修复,保护部分运动功能[11]。因此,明确大鼠ASCI后神经细胞凋亡发生的时间,最大限度挽救神经元,有助于促进损伤后的运动功能的恢复[12-15]。本研究证实大鼠ASCI后明显的神经细胞凋亡出现在损伤后6 h,其治疗的“最佳时间窗”应在损伤后6 h以内。
[1] 唐祎周,孙忠人,张翀.夹脊电针对脊髓损伤大鼠内质网应激相关因子IRE1影响的实验研究[J].针灸临床杂志,2013,29(8):55-58.
[2] 李晓宁,王宁.电针对大鼠脊髓损伤后细胞凋亡PARP-1全长影响的研究[J].针灸临床杂志,2011,27(5):57-59.
[3] Alvarez-Mejia L1,Morales J.Functional recovery in spinal cord injured ratsusing polypyrrole/iodine implantsand treadmill training[J].JMater SciMaterMed,2015,26(7):209.
[4] Basso DM1,Beattie MS,Bresnahan JC.Graded histological and locomotor outcomes after spinal cord contusion using the NYU weight-drop device versus transection[J].Exp Neurol,1996,139(2):244-256.
[5] 张纪浩,张俐.中药对脊髓缺血再灌注损伤微环境的作用及机制研究[J].中华中医药杂志,2014,29(1):208-211.
[6] 万勇,徐磊.重组人红细胞生成素治疗大鼠急性脊髓损伤的用药时间窗探讨[J].中国脊柱脊髓杂志,2010,20(9):760-761.
[7] 孙福荣.脊髓康对大鼠脊髓损伤后轴突再生微环境的作用机制研究[D].南京:南京中医药大学,2013.
[8] 方超,徐祝军,杨民,等.不同时间点应用甲氨蝶呤对大鼠脊髓损伤后神经细胞凋亡的影响[J].中国修复重建外科杂志,2016,4(9):466-472.
[9] 张林,孙忠人.近10年电针治疗脊髓损伤机制的实验研究进展[J].针灸临床杂志,2012,1(5):39-41.
[10]王健,贾玉柱.川芎嗪对急性脊髓损伤大鼠神经细胞早期凋亡和Caspase-3mRNA表达的影响[J].中华中医药学刊,2011,29(12):2662-2665.
[11]孙立明,李岩.火针对脊髓损伤模型大鼠凋亡相关蛋白表达的影响[J].针灸临床杂志,2010,12(3):36-37.
[12]刘亚东,陈学名.大鼠脊髓损伤后大脑运动皮质神经元凋亡的观察[J].中国脊柱脊髓杂志,2013,6(4):23-24.
[13]李一帆,陈东,薛辉,等.甲强龙、电针联合羊膜上皮细胞移植对脊髓损伤大鼠轴浆运输功能及GFAP表达的影响[J].吉林大学学报:医学版,2010,36(4):620-624.
[14]DM Basso,MSBeattie,JCBresnahan.A sensitive and reliable locomotor rating scale for open field testing in rats[J].JNeurotrauma,1995,12(1):1-21.
[15]贾祎佳.转SHH基因的骨髓间充质干细胞修复大鼠脊髓损伤的实验研究[D].山西医科大学,2014.
Experimental Study of the Proper Time W indow of Intervention after Acute Spinal Cord Injury
LIXiaoning,SHAN Xiaochun,WU Lei,et al. The Second Affiliated Hospital of Heilongjiang University of Chinese Medicine,Heilongjiang,Harbin 150001,China.
Objective:To observe the earliest time of neuronal apoptosis in rats after acute spinal cord injury(ASCI),and to determine the time of early intervention.M ethods:48 female Wister rats were random ly divided into the sham operation group(Sham)and acute spinal cord injury group(ASCI),and each group was divided into four subgroups:1 h,3 h,6 h and 8 h.The ratswere sacrificed at the corresponding time point after themodelwas made.HE staining was used to observe the pathological changes of the spinal cord in rats,and TUNEL staining was used to detect the apoptosis of rats to select the earliest time point of apoptosis and to determine the best time of early intervention.Results:1)HE staining showed that1 h and 3 h after operation,there was Graymatter focal patchy hemorrhage in ASCIgroup,and 6 h after operation,the cellmorphology changed obviously,and the nerve cells showed apoptosis,and 8h after operation,cellmorphological damage grew serious,further smaller,only surviving nerve cells.2)TUNEL assay showed 6 h after operation,themorphological changes of the cells were obvious,and the apoptosis was found in the apoptotic neurons.There was a significant difference compared with the Sham group(P<0.05).8 h after operation,the number of apoptotic cells increased significantly.Compared with group Sham,the difference was significant(P<0.05).Conclusion:The best intervention time window iswithin six hours after acute spinal cord injury.
Spinal cord injury;Apoptosis;Proper timewindow of intervention
R651.2
A
1004-745X(2017)07-1213-03
10.3969/j.issn.1004-745X.2017.07.026
2017-03-25)
国家自然科学基金(面上)项目(81373715)

