水杨醛缩乙二胺希夫碱与牛血清白蛋白的相互作用及抑菌活性研究①
庞绪良 赵培然 董建方 叶新辉 李连之
(聊城大学化学化工学院,山东聊城252059)
水杨醛缩乙二胺希夫碱与牛血清白蛋白的相互作用及抑菌活性研究①
庞绪良 赵培然 董建方 叶新辉 李连之
(聊城大学化学化工学院,山东聊城252059)
合成了水杨醛缩乙二胺希夫碱化合物.利用紫外可见吸收光谱、荧光光谱和圆二色光谱法研究了水杨醛缩乙二胺希夫碱与牛血清白蛋白(BSA)的相互作用.结果表明,该希夫碱化合物与BSA形成了复合物,导致BSA的构象发生变化,使BSA的内源性荧光发生静态猝灭,计算得到了希夫碱化合物与BSA相互作用的热力学参数.体外抑菌实验表明该希夫碱对大肠杆菌具有一定的抑菌活性.
水杨醛缩乙二胺希夫碱,牛血清白蛋白,光谱,抑菌活性
0 引言
希夫碱(Schiff base)是指由醛或酮与伯氨缩合而成的含有亚胺或甲亚胺的一类有机化合物,希夫碱化合物是由H. Schiff在1864年首次发现而得名[1],随后希夫碱化合物被广泛深入的研究[2].希夫碱中含有碳氮双键,其杂化轨道上的N原子具有孤对电子,因而在化学和生化反应中具有重要意义.希夫碱是一类重要的化学分析试剂和良好的有机化学配体,其本身还具有一定的抗菌、抗炎、抗肿瘤、抗病毒的生物学活性[3].研究表明,希夫碱及其衍生物已广泛应用于医疗、催化、材料、生化反应等方面.蛋白质作为生命功能的执行者,是生物体的重要组成成分.血清白蛋白是可溶性蛋白质,许多小分子化合物药物通过与人血清白蛋白结合运输到体内.近些年来,有很多关于希夫碱及其衍生物与BSA相互作用的研究报道[4-6].因此,研究药物分子与蛋白的结合方式及其在血液中的运输机制是非常重要的[7].我们曾报道过L-丝氨酸水杨醛希夫碱镍(Ⅱ)配合物的合成、结构及与DNA的相互作用[8].本文中我们合成了水杨醛缩乙二胺希夫碱化合物,利用紫外可见吸收光谱、荧光光谱和圆二色光谱法研究了该化合物与牛血清白蛋白(BSA)的相互作用.
1 实验部分
1.1 试剂与仪器
乙二胺、水杨醛、无水甲醇均为市售分析纯试剂,BSA购自北京拜尔迪生物技术有限公司,三羟甲基氨基甲烷(Tris)购自AMRESCO公司,BSA存储液用10 mmol·L-1Tris-HCl (pH=7.1)缓冲液配制,浓度由(ε280=43 824 L·mol-1·cm-1确定.
Nicolet 460 型红外光谱仪(KBr压片),X-4显微熔点仪(未经矫正),Lambda 750型紫外分光光度计(Perkin Elmer, 美国),F-7000荧光光谱仪,JASCO J-810 型圆二色光谱仪(Japan).
1.2 希夫碱化合物的合成与表征
量取0.05 mol(3.5 ml)的乙二胺于圆底烧瓶中,并加入30 mL甲醇,在50 ℃的条件下加热搅拌0.5 h,然后慢慢滴加0.1 mol (21 mL)的水杨醛溶液,加热回流2 h后泠却至室温,过滤至平底试管中,在室温下缓慢挥发,一周后得到黄色片状晶体,产率约76%.该希夫碱晶体熔点为125 ℃.希夫碱化合物的IR(cm-1):3 433.6 (s, υO-H);1 636.2 (s, υC=N).希夫碱的结构在Bruker Smart-1000 CCD 型单晶衍射仪上进行了测定.
1.3 希夫碱化合物与BSA的相互作用
1.3.1 紫外可见吸收光谱.用10 mmol·L-1Tris-HCl(pH=7.1)缓冲溶液配制一系列试样,保持BSA(8.0 μmol·L-1)的浓度不变,希夫碱化合物的浓度逐渐增大,将配好的试样混合均匀后放置在室温条件下2.5 h后测定BSA的紫外可见吸收光谱,用缓冲溶液或不同浓度化合物的溶液作为参比,光谱在240-400 nm 波长范围内测定.
1.3.2 荧光光谱.用10 mmol·L-1Tris-HCl (pH=7.1)缓冲溶液配制一系列试样,保持BSA(8.0 μmol·L-1)浓度不变,逐渐加大希夫碱化合物的浓度.将试样混合均匀,然后在室温条件下放置2.5 h,分别于298 K、303 K和308 K三个温度下恒温后测定BSA的荧光光谱.激发波长: 280 nm,发射波长范围:290-460 nm,狭缝宽度:Ex=Em=2.5 nm;扫描速度:600 nm·min-1.
1.3.3 圆二色光谱测定.用10 mmol·L-1Tris-HCl(pH=7.1)缓冲液配制试样,其中BSA浓度为4.5×10-7mol·L-1,化合物的浓度是10 μmol·L-1,测定时以同浓度的缓冲溶液或化合物缓冲溶液作为参比,分别测定BSA及BSA与化合物混合液在190-250 nm波长范围内的圆二色光谱,混合均匀室温下放置2.5 h后测定.扫描速度为200 nm·min-1,路径长度为 1 cm,响应时间为1 s,累积次数为3次.
1.4 抑菌实验
用纸片扩散法进行体外抑菌实验.将大肠杆菌(E.coli) BL21(DE3)菌液(A550= 0.75)均匀地涂在M-H琼脂培养基的培养皿上,然后将灭菌过的滤纸片(8.0 mm)平铺在培养皿上,缓慢向滤纸片上注上10 μL浓度为2.5 mmol·L-1希夫碱的水溶液,另取一个滤纸片注上10 μL蒸馏水作为参比,最后放在恒温培养箱内在32 ℃培养20 h,观察抑菌圈,测量抑菌圈的直径.
2 结果与讨论
2.1 化合物的表征
红外光谱采用KBr压片法, 在400-4 000 cm-1范围收集数据.希夫碱化合物在3 433.6 cm-1处的强吸收峰是由于O-H的伸缩振动,1 636.2 cm-1处强而尖的特征吸收峰可以说明希夫碱(CN)结构的生成.化合物的晶体结构测定结果与文献[9]一致.图1为该希夫碱化合物的分子结构图.

图1 希夫碱化合物的分子结构
2.2 希夫碱化合物与BSA的作用
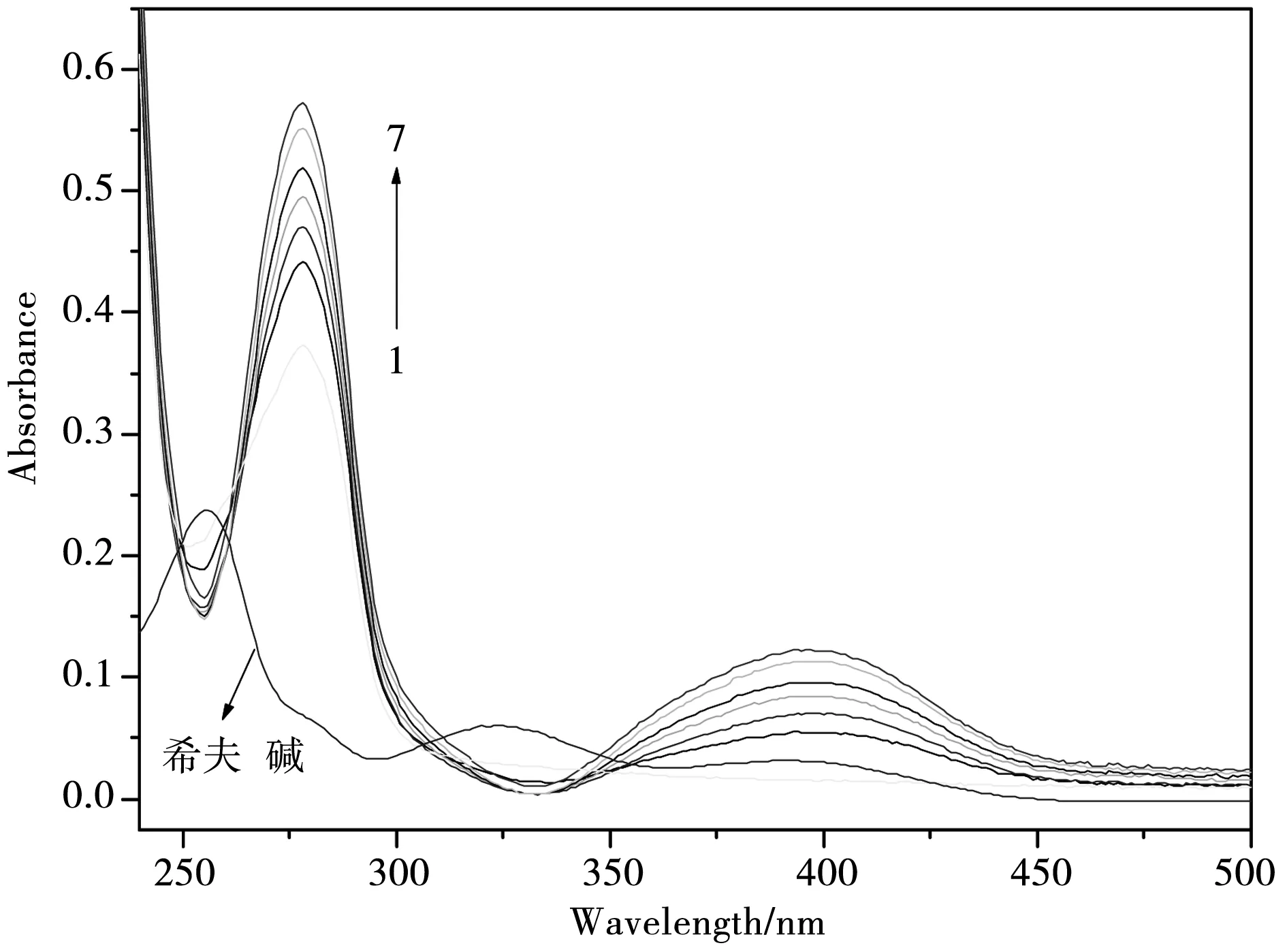
图2 不同浓度的希夫碱存在时BSA的紫外吸收光谱,[BSA]=8.0×10-6mol·L-1,[希夫碱]=0, 8.3×10-6, 1.66×10-5,2.49×10-5,3.32×10-5,4.15×10-5, 4.98×10-5 mol·L-1.
2.2.1 紫外可见吸收光谱.在研究小分子化合物与蛋白质的作用中,常用紫外可见吸收光谱来检测蛋白质的构象变化.BSA在280 nm左右的吸收峰是由于蛋白质肽链上色氨酸、酪氨酸和苯丙氨酸上的杂环π-π*和n-π*的跃迁引起的[10].图2为不同浓度的希夫碱存在时BSA的紫外吸收光谱(希夫碱化合物本身在278 nm处吸收很弱,没有吸收峰).从图2中可以看出,随着希夫碱浓度的增加,在278 nm处的吸收峰逐渐上升且略有蓝移,而且在400 nm处出现了一个新的吸收峰,此峰随着希夫碱浓度的增加明显增大.这说明该希夫碱化合物与BSA上的氨基酸残基发生了相互作用,形成了基态复合物.
2.2.2 荧光光谱.荧光光谱法具有选择性好且灵敏度高的优点.因此,被广泛应用于研究药物分子与蛋白的作用中.BSA中的色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)是荧光生色基团,而且这些氨基酸残基对微环境的变化都较敏感,通常作为荧光光谱的检测靶标.在一定激发波长下,BSA的荧光光谱的变化在一定程度上反映了蛋白质荧光生色基团的微环境变化[11].图3、图4和图5为不同温度下,不同浓度的希夫碱对BSA溶液的荧光猝灭光谱.由图3可以看出,随着希夫碱浓度的增加,BSA在330 nm处的荧光强度逐渐降低,说明该希夫碱化合物与BSA发生了相互作用,影响了蛋白质荧光生色团微环境的变化,从而导致BSA的内源性猝灭.
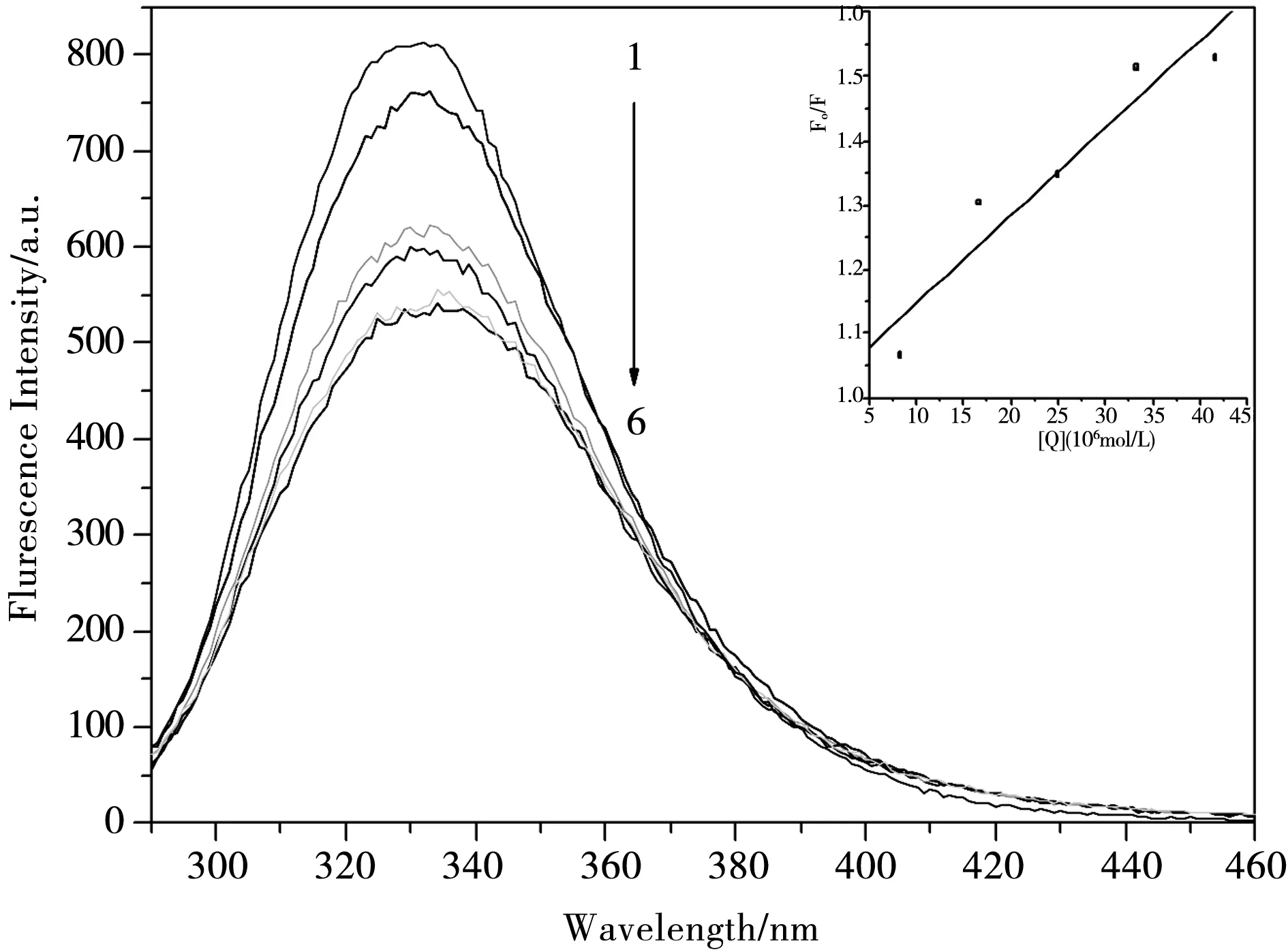
图3 298 K下,希夫碱化合物对BSA 的荧光猝灭光谱,[BSA]=1.38×10-6 mol·L-1;[希夫碱]=0, 8.33×10-6, 1.66×10-5, 2.49×10-5, 3.32×10-5, 4.15×10-5 mol·L-1内嵌图为F/F0对[Q]作图
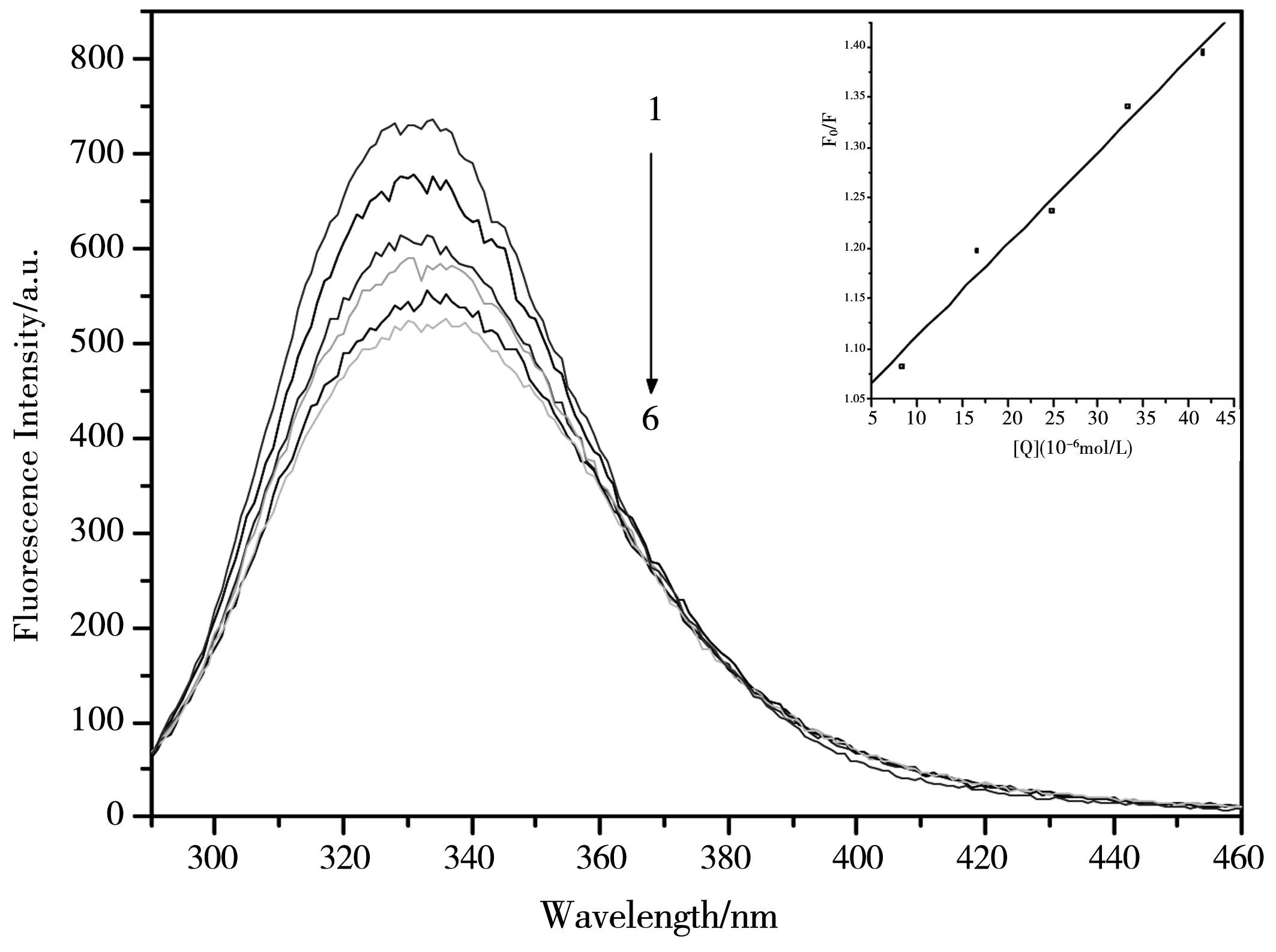
图4 303 K下,希夫碱化合物对BSA 的荧光猝灭光谱,[BSA]=1.38×10-6 mol·L;[希夫碱]=0, 8.33×10-6, 1.66×10-5, 2.49×10-5, 3.32×10-5 , 4.15×10-5 mol·L-1内嵌图为F/F0对[Q]作图
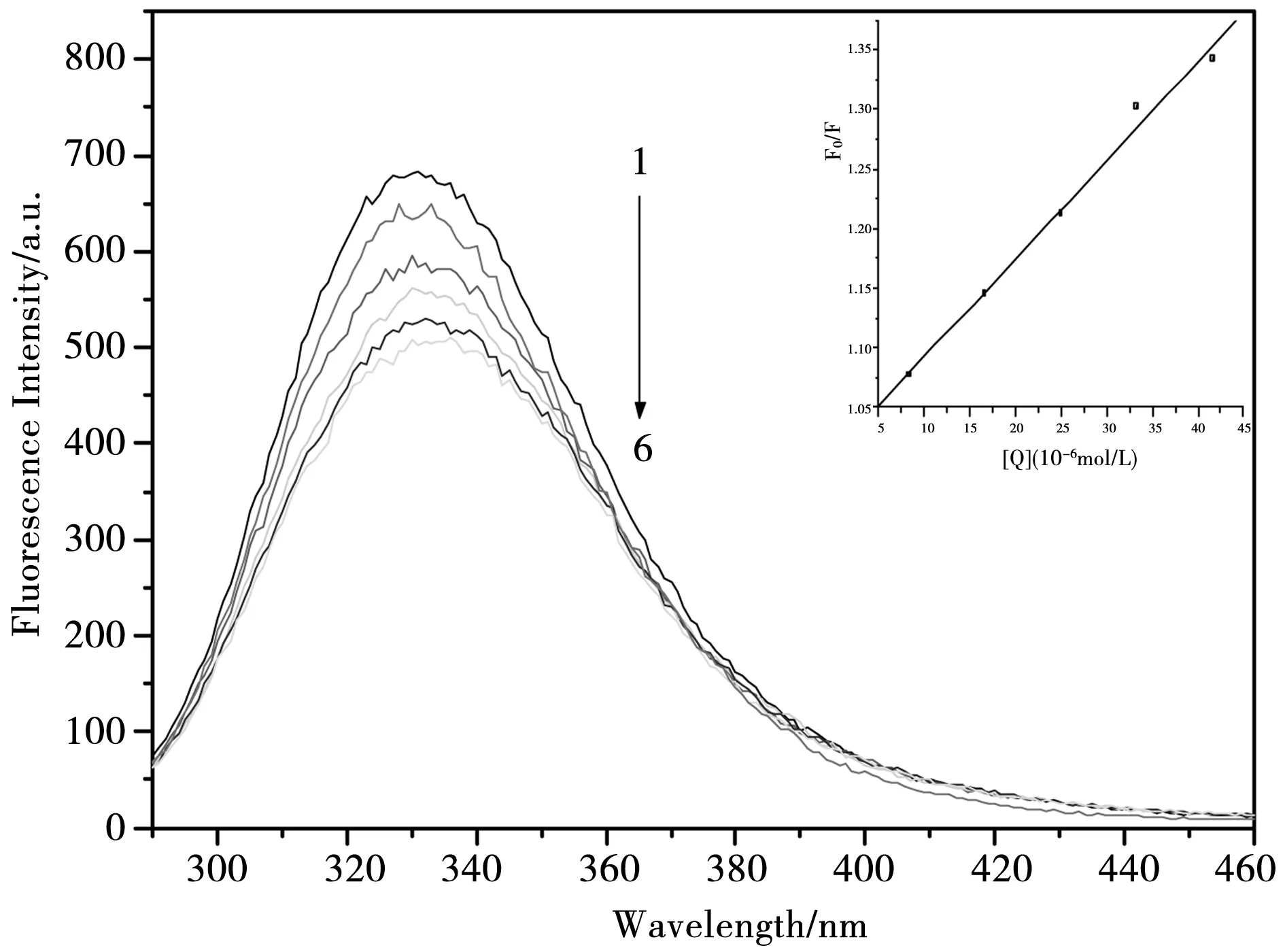
图5 308 K下,希夫碱化合物对BSA 的荧光猝灭光谱,[BSA]=1.38×10-6 mol·L;[希夫碱]=0, 8.33×10-6, 1.66×10-5, 2.49×10-5, 3.32×10-5 , 4.15×10-5 mol·L-1 内嵌图为F/F0对[Q]作图
荧光猝灭有静态猝灭和动态猝灭两类.动态猝灭是与扩散有关的,当温度升高时,溶液的黏度将会下降,从而导致分子的运动加快,从而使分子的扩散系数增大,猝灭常数就会增大.当发生静态猝灭时,随着温度的升高会引起复合物的稳定性降低,使猝灭程度减弱,猝灭常数就会减小.为了解希夫碱化合物对BSA的猝灭类型,通常先按动态猝灭处理,常使用Stern-Volmer方程[12]
F0/F=1 +Kqτ0[Q]=1 +Ksv[Q],
(1)
式中用F0和F分别表示未加入希夫碱和加入希夫碱后的荧光峰强度;Kq是BSA猝灭常数,τ0为没有加猝灭剂时荧光物质的荧光寿命,其值约为10-8s;Ksv是Stern-Volmer 猝灭常数;[Q]来表示希夫碱化合物的浓度.图3、图4和图5中的内嵌图分别为该体系在不同温度下的荧光猝灭光谱和F0/F对[Q]作图.由F0/F对[Q]作图求得化合物的猝灭常数Ksv(298 K)= 1.36×104L·mol-1,Ksv(303 K)=9.22×103L·mol-1,Ksv(308 K)=8.25×103L·mol-1. 进而可求得Kq(298 K)=1.36×1012L·mol-1·s-1,Kq(303 K)=9.22×1011L·mol-1·s-1,Kq(308 K)=8.25×1011L·mol-1·s-1.可以看出,希夫碱化合物的Kq要远远大于最大扩散碰撞猝灭速率常数2×1010L·mol-1·s-1.随着温度的升高,其猝灭常数也逐渐减小,进一步说明了该希夫碱化合物对BSA的猝灭过程并不是由分子碰撞和扩散所产生的动态猝灭,而是希夫碱化合物与BSA相互作用后形成了不发光的基态复合物而引起的静态猝灭.
希夫碱化合物对BSA的作用方式属于两者之间形成复合物的静态猝灭.通常假设BSA上有n个且相同的结合位点,则BSA的荧光强度与希夫碱化合物浓度的关系可以用下面的双对数公式进行描述[13]
lg[(F0-F)/F] = lgKA+nlg[Q],
(2)
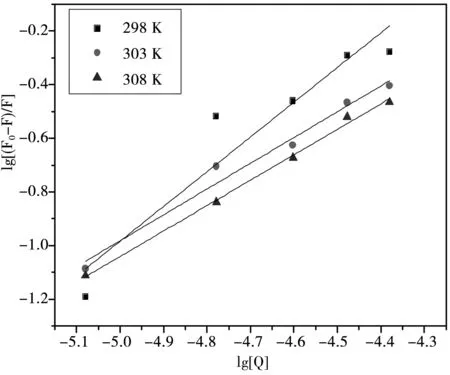
图6 lg[(F0-F)/F]对lg[Q]作图
式中KA是结合常数,n是结合位点数,[Q]是猝灭剂的浓度.图6是lg[(F0-F)/F]对lg[Q]作图,由该图可以求得在不同温度下的结合常数分别为KA(298 K)=3.07×105L·mol-1,KA(303 K)=6.69×103L·mol-1,KA(308 K)=4.96×103L·mol-1;结合位点数分别为:n(298 K) = 1.3,n(303 K)=0.92,n(308 K)=0.95.这说明该希夫碱化合物与BSA是以1∶1结合的,即两者之间存在一个结合位点.
从热力学的观点可考察希夫碱化合物与BSA之间的结合力(氢键、疏水键、静电作用或范德华力等).根据求得的不同温度下的结合常数(KA),运用热力学公式(3)来计算反应的自由能变值(ΔG).
ΔG=-RTlnKA,
(3)
ΔG=ΔH-TΔS.
(4)
通过计算求得ΔG(298 K) =-31.3 kJ·mol-1,ΔG(303 K) =-22.2 kJ·mol-1,ΔG(308 K) =-21.8 kJ·mol-1.利用反应自由能变值对温度作图求得焓变(ΔH)和熵变(ΔS)分别为:ΔH=-313.0 kJ·mol-1,ΔS=-950 J·mol-1·K-1.Ross[14]等人经过大量的研究,得出了小分子与蛋白质的结合作用力与热力学参数之间的关系,当焓变与熵变同时大于零时,可认为疏水作用力占主导;当焓变与熵变同时小于零时,则可认为是氢键或者范德华力;如果焓变较小(或接近于零)且熵变大于零,则可能为静电作用力.因此,我们得出希夫碱与BSA之间主要靠氢键或范德华力相互作用.但由于BSA的结构复杂,它与希夫碱化合物之间不可能是单一的作用力,而是多种作用力之间的相互结合.
2.2.3 圆二色光谱.圆二色光谱法是研究蛋白质构象变化及与小分子作用的一种快捷、较准确的方法.图7是该希夫碱化合物对BSA圆二色光谱的影响图.由图7得知,BSA在208 nm和222 nm处有两个明显的特征负峰,这是典型的α-螺旋结构[15].加入化合物后,谱图的形状和峰位没有发生显著的变化,但峰强度减弱.这说明化合物的加入对BSA产生了影响,导致BSA的构象发生了变化.我们可通过公式⑸求出α-螺旋值[16]
α%=[(-[θ]280-4 000)/(33 000-4 000)]×100% ,
(5)
MRE280=CD/10cpnl,
(6)
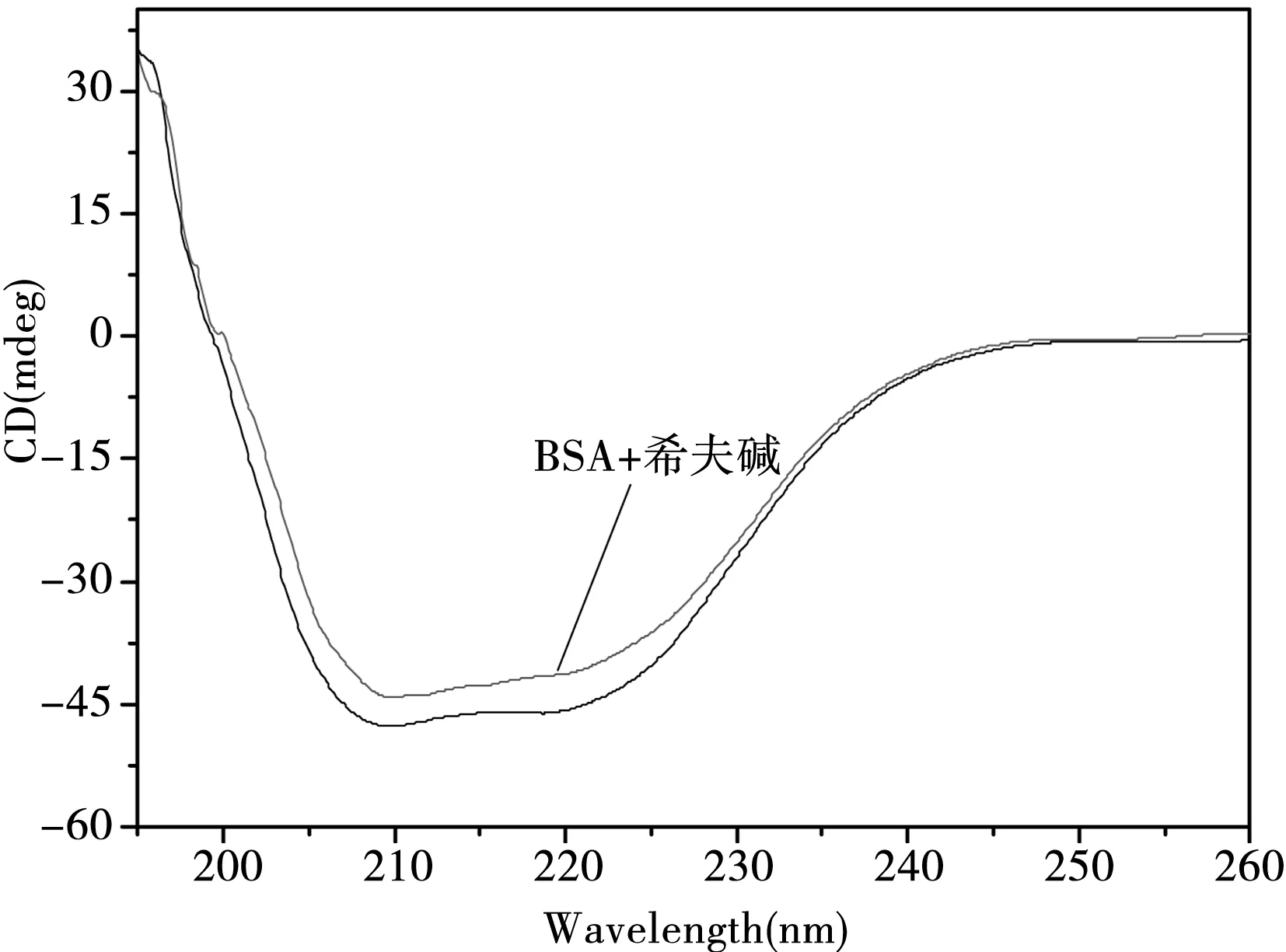
图7 希夫碱化合物对BSA作用的圆二色光谱图[ BSA]=4.5× 10-7 mol·L-1, [希夫碱]=1.0 ×10-5 mol·L-1.
式中cp是BSA的摩尔浓度,n是氨基酸残基数(BSA为583),l是路径长度(1 cm).计算得BSA的α-螺旋值含量在加入化合物后从原来47.6%降到41.4%,说明希夫碱化合物与BSA的相互作用使BSA的二级结构产生了影响.原因可能是希夫碱化合物通过氢键等作用与α-螺旋的氨基酸残基发生相互作用,从而改变了α-螺旋结构,导致BSA中的α-螺旋量降低.
2.3 抗菌实验
初步体外抑菌实验结果说明该希夫碱化合物对大肠杆菌E.coliBL21(DE3)有较好的抑菌活性,其平均抑菌圈直径约为15 mm.对于其它菌落的抑菌活性需要进一步的研究,希望能为探索高效低毒的抗菌药物提供一定的参考.
3 结论
合成了水杨醛缩乙二胺希夫碱化合物,利用紫外可见吸收光谱、荧光光谱和圆二色光谱法研究了水杨醛缩乙二胺希夫碱与BSA的相互作用.结果表明,该希夫碱化合物与BSA形成1∶1的复合物,使BSA的内源性荧光发生静态猝灭,导致BSA的α-螺旋含量减少.体外抑菌实验表明该希夫碱对大肠杆菌具有一定的抑菌活性.这些结果为探讨希夫碱化合物与BSA相互作用的分子机理提供了有用的信息.
[1] Schiff H. Mittheilungen aus dem Universitäts laboratorium in pisa: eine neue reihe organischer basen[J]. Eur J Org Chem, 2010, 131(1):118-119.
[2] Choudhary N F, Leigh G J, Hitchcock P B. Six-coordinate vanadyl tetradentate Schiff base complexes with methanol, methoxide, water or fluoride as the sixth ligand[J]. Inorg Chim Acta, 2000, 310(1):10-20.
[3] Desai S Β, Desai P B, Desai K R. Synthesis of some schiff bases, thiazolidinones and azetidinones derived from 2,6-diaminobenzo[1,2-d:4,5-d'] bisthiazole and their anticancer activities[J]. Heterocycl Commun, 2001, 7(1):83-90.
[4] Raynor J B, Labauze G. Use of electron spin resonance spectroscopy to study the interaction between cobalt schiff base complexes and phosphines or phosphites in solution[J]. Inorg Chim Acta, 1980, 40(1):X10- X10.
[5] Zhang Q, Ni Y, Kokot S. Combined voltammetric and spectroscopic analysis of small molecule-biopolymer interactions: The levodopa and serum albumin system[J]. Talanta, 2012, 88(1):524-532.
[6] Zhang L, Cai Q Y, Cai Z X, et al. Interactions of bovine serum albumin with anti-cancer compounds using a proteon XPR36 array biosensor and molecular docking.[J]. Molecules, 2016, 21(12):1706.
[7] Sathyadevi P, Krishnamoorthy P, Alagesan M, et al. Synthesis, crystal structure, electrochemistry and studies on protein binding, antioxidant and biocidal activities of Ni(II) and Co(Ⅱ) hydrazone complexes[J]. Polyhedron, 2012, 31(1):294-306.
[8] 丁菲菲,丁名成,魏强,等.L-丝氨酸水杨醛希夫碱镍(Ⅱ)配合物的合成、结构及与DNA的相互作用[J]. 聊城大学学报:自然科学版,2016,29(1):37-42.
[9] Pahor N B, Calligaris M, Nardin G, et al. N, N′-ethylenebis(salicylideneimine)[J]. Acta Crystallogr B, 1978, 34(4):1 360-1 363.
[10] Wang Y Q, Zhang H M, Zhang G C, et al. Interaction of the flavonoid hesperidin with bovine serum albumin: A fluorescence quenching study[J]. J Lumin, 2007, 126(1):211-218.
[11] Toneatto J, Argüello G A. New advances in the study on the interaction of [Cr(phen)2(dppz)]3+, complex with biological models; association to transporting proteins[J]. J Inorg Biochem, 2011, 105(5):645-651.
[12] Albrecht C. Joseph R. Lakowicz: Principles of fluorescence spectroscopy, 3rd Edition[J]. Anal Bioanal Chem, 2008, 390(5):1 223-1 224.
[13] Hu Y J, Liu Y, Wang J B, et al. Study of the interaction between monoammonium glycyrrhizinate and bovine serum albumin[J]. J Pharm Biomed Anal, 2004, 36(4):915-919.
[14] Ross P D, Subramanian S. Thermodynamics of protein association reactions: forces contributing to stability[J]. Biochemistry, 1981, 20(11):3096.
[15] Liu J, Tian J, He W, et al. Spectrofluorimetric study of the binding of daphnetin to bovine serum albumin[J]. J Pharm Biomed Anal, 2004, 35(3):671-677.
[16] Purdie N, Swallows K A. Analytical applications of polarimetry, optical rotatory dispersion, and circular dichroism[J]. Anal Chem, 1989, 61(2):77A-89A.
Synthesis,BSA Interactions and Antibacterial Properties of Schiff Base of N,N-Ethylenebis(salicylideneimine)
PANG Xu-liang ZHAO Pei-ran Dong Jian-fang YE Xin-hui LI Lian-zhi
(School of Chemistry and Chemical Engineering, Liaocheng University, Liaocheng 252059, China)
A Schiff base compound, N,N-ethylenebis(salicylideneimine), has been synthesized. The interaction of the compound with bovine serium albumin(BSA) was studied by UV-Vis absorption, fluorescence and circular dichroism spectroscopies. The results indicate that the Schiff base and BSA formed a complex, thus leading a conformational change of BSA and quenching BSA’s intrinsic fluorescence. The thermodynamic parameters of their interaction were calculated. The result of ntibacterial experiment of the Schiff base onE.coliin vitro showed that it has a good antibacterial activity.
N,N-ethylenebis(salicylideneimine), bovine serium albumin, spectroscopy, antibacterial activity
2017-03-20
山东省自然科学基金项目(Y2004B02);聊城大学大学生科技文化创新基金(26312160514)资助
李连之,E-mail:lilianzhi1963.@163.com
O626
A
1672-6634(2017)02-0045-05

