IL-37通过促进巨噬细胞M2型极化在缺氧/复氧诱导的肝细胞损伤中的保护作用
朱 迪 李婷婷 陈青松 牟 童 汤成泳
(1重庆医科大学附属第一医院肝胆外科, 2 药学部 重庆 400016)
IL-37通过促进巨噬细胞M2型极化在缺氧/复氧诱导的肝细胞损伤中的保护作用
朱 迪1李婷婷1陈青松1牟 童1汤成泳2△
(1重庆医科大学附属第一医院肝胆外科,2药学部 重庆 400016)
目的 探讨IL-37通过促进巨噬细胞M2型极化在缺氧/复氧(hypoxia/reoxygenation,H/R)诱导的肝细胞损伤中的保护作用及其相关分子机制。方法 实时荧光定量PCR (qRT-PCR)和Western blot检测在不同极化类型的人单核巨噬细胞THP-1中IL-37 mRNA和蛋白质水平。通过慢病毒转染构建稳定过表达IL-37的细胞株,qRT-PCR检测CD206、CD86、ARG1和iNOS mRNA水平,流式细胞术检测CD163、CD86蛋白质水平。通过Transwell法将THP-1细胞与人肝细胞L02细胞共培养并构建H/R模型,CCK-8法及流式细胞术检测L02细胞存活率及凋亡率,ELISA检测细胞培养液中谷丙转氨酶(alanine transaminase,ALT)和谷草转氨酶(aspartate aminotransferase,AST)含量,HE染色观察细胞形态变化。Western blot检测THP-1细胞中STAT6及其磷酸化水平。结果 M2型巨噬细胞中IL-37 mRNA及蛋白质水平上调。IL-37促进巨噬细胞M2型极化。IL-37诱导的M2型巨噬细胞与L02细胞共培养,在H/R状态下显著提高肝细胞存活率(P=0.015),并降低细胞凋亡率和ALT、AST水平(P<0.001),减轻细胞损伤。 Western blot提示过表达IL-37的 THP-1细胞中STAT6蛋白质磷酸化水平上调(P<0.01)。结论 IL-37能促进巨噬细胞M2型极化,并对H/R诱导的肝细胞损伤有保护作用,其机制可能与STAT6信号通路有关。
IL-37; 巨噬细胞; 缺氧/复氧; 肝细胞损伤
肝缺血再灌注损伤 (hepatic ischemia reperfusion injury,HIRI) 指肝脏因各种原因导致血流中断或不足,在恢复血供之后不仅不能使器官功能恢复,反而加重其功能障碍和结构损伤的现象。在肝外科及肝移植手术中HIRI是造成肝功能损害的重要因素,其损伤机制及脏器保护机制越来越受到重视。巨噬细胞是机体重要的固有免疫细胞,在不同的微环境下可极化为经典活化型(M1型)和替代活化型(M2型)[1]。巨噬细胞在肝[2-3]、肾[4]、心[5]、肠[6]等器官缺血再灌注损伤中起保护作用,且M2型极化可能在其中起重要作用。IL-37是IL-1家族成员,可起到抑制固有免疫的作用,可能对巨噬细胞的极化起到潜在的影响,但其具体作用及机制尚不明确[7]。Wang等[8]的研究提出对人肝细胞系L02进行缺氧/复氧(hypoxia reoxygenation,H/R)处理可建立有效的HIRI体外实验模型。
为了研究IL-37基因与巨噬细胞极化的关系,探讨其对H/R诱导的肝细胞损伤的作用,本研究检测IL-37基因在不同极化类型的人单核巨噬细胞系THP-1的表达情况,将表达IL-37基因和空载体的慢病毒转染至THP-1细胞,与人肝细胞系L02共培养,建立细胞H/R损伤模型,并进行相关功能和机制检测,探讨IL-37是否通过诱导巨噬细胞M2型极化在H/R状态下对L02细胞发挥保护作用。
材 料 和 方 法
主要试剂和药品 THP-1和L02细胞由重庆医科大学附属第一医院实验研究中心赠予;RPMI 1640培养基、胎牛血清购自美国Hyclone公司;TranswellTM小室(0.4 μm孔径)购自美国Corning公司;CCK-8试剂盒购自日本同仁化学研究所;Annexin V-PE试剂盒购自江苏凯基生物技术股份公司;谷丙转氨酶(alanine transaminase,ALT,)及谷草转氨酶(aspartate aminotransferase,AST)微板测试盒购自南京建成生物工程研究所;人重组IL-4、IL-13、γ-干扰素(interferon-γ,IFN-γ)及LPS购自生工生物工程(上海)股份有限公司;鼠抗IL-37单克隆抗体购自英国Abcam公司;兔抗STAT6单克隆抗体购自北京中杉金桥生物技术有限公司;佛波酯(phorbol 12-myristste 3-acetate,PMA)及兔抗磷酸化STAT6 [phosphor-STAT(Tyr641),p-STAT6]抗体购自美国CST公司;兔抗GAPDH抗体购自重庆惠而利生物技术有限公司;Trizol、PrimeScript RT试剂盒购自TaKaRa-宝生物工程(大连)有限公司;qPCR Master Mix试剂购自美国Selleck中国公司;PCR引物购自生工生物工程(上海)股份有限公司;RIPA蛋白质裂解液、BCA试剂盒、HE染色试剂盒购自上海碧云天生物技术有限公司;人IL-37重组慢病毒表达载体和对照载体购自上海吉凯基因化学技术有限公司,重组质粒构建和慢病毒包装由本研究小组前期完成[9]。
细胞培养 用含10%胎牛血清的RPMI 1640培养基在37 ℃、5% CO2中培养THP-1和L02细胞株。THP-1细胞隔天加入2 mL新鲜培养基并小心吹打混匀,L02细胞每天更换2 mL新鲜培养基。
稳定过表达IL-37的细胞株构建 将THP-1细胞接种于12孔板中,用人IL-37重组慢病毒表达载体(LV-37)和对照载体(LV-NC)感染细胞,病毒接触细胞12 h后更换新鲜培养基。72 h后,培养液中加入质量浓度1 μg/mL的嘌呤霉素并培养1周。在药物筛选下最后存活的细胞为稳定株。
Transwell共培养及H/R模型的建立 将孔径为0.4 μm的Transwell小室置于6孔板中,上下室分别加入1 mL含有150 nmol/L PMA的新鲜培养基,并在上室中加入1×106个左右的THP-1细胞,孵育24 h将其诱导分化为THP-1源性巨噬细胞。24 h后镜下观察细胞已贴壁,弃培养基,用PBS清洗2次并更换新鲜培养基。将L02细胞接种于6孔板中,孵育24 h使其充分贴壁,镜下观察细胞汇合度60%~70%左右时,将种有THP-1源性巨噬细胞的Transwell小室放入接种有L02细胞的6孔板中进行共培养。上下室分别用PBS清洗后,更换不含血清的RPMI 1640培养基,将细胞置于三气培养箱(1% O2、5% CO2、94% N2)中缺氧培养12 h,移至正常培养箱中复氧4 h,构建H/R模型。
巨噬细胞实验分组 将THP-1细胞调整为1×106/mL的细胞悬液,接种于6孔板中,每孔1.5 mL,并加入150 nmol/L PMA,避光孵育24 h,镜下观察细胞已贴壁,表明THP-1已分化为巨噬细胞。弃培养基,用37 ℃预热的PBS清洗2次,更换新鲜培养基。分为3组进行处理:M1组,加入IFN-γ 20 ng/mL和脂多糖(lipopolysaccharides,LPS) 10 g/mL孵育24 h,使其极化为M1型巨噬细胞;M2组,加入IL-4 20 ng/mL和IL-13 20 ng/mL孵育24 h,使其极化为M2型巨噬细胞;M0组,不作任何处理,为空白对照组。
H/R实验分组 将Transwell共培养的细胞分为4组建立H/R模型,空白对照组:不进行H/R处理,与转染LV-NC阴性对照病毒的THP-1源性巨噬细胞共培养;IL-37实验组:不进行H/R处理,与转染LV-37病毒的THP-1源性巨噬细胞共培养;H/R处理组:进行H/R处理,与转染LV-NC阴性对照病毒的THP-1源性巨噬细胞共培养;H/R+LV-37实验组:进行H/R处理,与转染LV-37病毒的THP-1源性巨噬细胞共培养。
qRT-PCR检测mRNA水平 取经过处理的各组THP-1细胞,根据Trizol试剂盒说明书提取总RNA,并按PrimeScript RT试剂盒说明书逆转录为cDNA。根据qPCR反应混合物说明书,进行qRT-PCR检测IL-37 mRNA水平,反应条件:95 ℃下10 min;95 ℃下5 s、60 ℃下30 s,共40个循环;95 ℃下10 s。GAPDH为内参基因,以2-ΔΔCt值表示IL-37 mRNA水平。引物序列见表1。

表1 qRT-PCR反应所用引物序列
F:Forward;R:Reverse.
Western blot法检测蛋白质水平 取经过处理的各组THP-1细胞,按照RIPA蛋白质裂解液说明书提取细胞总蛋白,用BCA法测定蛋白质浓度。以每孔50 μg蛋白质进行SDS-PAGE,然后湿转至PVDF膜上,5%脱脂奶粉封闭2 h,加入一抗稀释液(稀释比例1∶1 000) 4 ℃孵育过夜。次日以TBST充分洗涤后加入二抗稀释液(稀释比例1∶5 000) 37 ℃孵育1 h。TBST充分洗涤后以ECL显影剂显色并进行灰度值分析。
CCK-8检测细胞存活率 分别将转染LV-37和LV-NC的THP-1细胞接种于6孔板并诱导分化为THP-1源性巨噬细胞。24 h后更换为不含血清的RPMI 1640培养基,在细胞培养箱孵育24 h后吸取上清,800×g离心10 min去除残余细胞,收集上清备用。将L02细胞接种于96孔板中,在细胞培养箱孵育24 h,待细胞汇合率达70%左右时进行H/R实验,分组同H/R实验分组,PBS冲洗2次后,LV-37组加入200 μL转染LV-37的THP-1源性巨噬细胞上清,LV-NC组加入200 μL 转染LV-NC的THP-1源性巨噬细胞上清。另设除零组(只加入培养基,不接种细胞)和空白组(加入200 μL不含血清的RPMI 1640培养基,不进行H/R处理)。H/R组建立H/R模型,方法同上。复氧结束后,每孔加入20 μL CCK-8溶液,37 ℃孵育2 h,酶标仪检测450 nm波长处吸光度值D450。

流式细胞仪检测细胞表面标记物表达 用0.25%的胰蛋白酶消化经建模处理后的各组THP-1细胞,60×g离心5 min收集细胞,PBS洗涤2次,用100 μL PBS重悬细胞,以每5 μL含1×106个细胞的比例分别加入APC抗人CD86荧光抗体和PE抗人CD163荧光抗体,混匀后避光冰上放置30 min,每10 min轻柔震荡5 s,PBS洗涤2次,用200 μL PBS重悬细胞,使用流式细胞仪检测细胞荧光染色情况。
流式细胞仪检测细胞凋亡 用0.25%的胰蛋白酶消化经建模处理后的各组L02细胞,60×g离心5 min,收集细胞,按Annexin V-PE细胞凋亡试剂盒说明书处理细胞,使用流式细胞仪检测细胞凋亡率。
检测ALT、AST活力 取经建模处理后的各组L02细胞培养液,800×g离心10 min,去除残存细胞,收集上清,按ALT、AST微板测试盒说明书操作,测定ALT、AST活力。
HE染色 取经建模处理后的各组L02细胞,按照HE染色试剂盒说明书操作,进行HE染色,并于100倍光镜下观察、拍照。

结 果
M2型巨噬细胞中IL-37mRNA及蛋白质水平上调 分别提取M1、M2和M0型THP-1源性巨噬细胞的总mRNA和总蛋白,采用qRT-PCR检测CD206、CD86和IL-37mRNA水平(图1A),M2型巨噬细胞中CD206mRNA水平显著高于M1型(P=0.004)和M0型(P=0.008),M1型巨噬细胞中CD86mRNA水平显著高于M2型(P=0.001)和M0型(P=0.002),提示诱导分化成功;IL-37mRNA水平显著高于M1型和M0型(P<0.001);采用Westernblot检测IL-37蛋白质水平(图1B),M2型巨噬细胞中IL-37蛋白质水平显著高于M1型(P=0.042)和M0型(P=0.002)。
建立稳定过表达IL-37的THP-1细胞株 将人IL-37重组慢病毒表达载体(LV-37)和对照载体(LV-NC)转染入THP-1细胞。采用qRT-PCR和Westernblot检测IL-37表达水平,结果显示,LV-37THP-1细胞的IL-37mRNA水平(图2A,P=0.011)和蛋白质水平(图7,P=0.03)明显高于LV-NCTHP-1细胞,差异有统计学意义,证明稳定过表达IL-37的THP-1细胞株构建成功。
IL-37促进巨噬细胞M2型极化 使用LV-37及LV-NC慢病毒转染THP-1细胞,诱导其分化为THP-1源性巨噬细胞后构建H/R模型,分别提取LV-37组和LV-NC组细胞的总mRNA,采用qRT-PCR检测IL-37、M2型巨噬细胞标记物CD206、ARG1和M1型巨噬细胞标记物CD86、iNOS的mRNA水平,并收集各组细胞采用流式细胞仪检测M2型巨噬细胞表面标记物CD163和M1型巨噬细胞表面标记物CD86蛋白质水平。qRT-PCR结果显示,LV-37组CD206 (P=0.001)和ARG1(P=0.02)的mRNA水平高于LV-NC组,CD86 (P=0.001)和iNOS(P=0.015)的mRNA水平低于LV-NC组(图2A)。流式细胞术结果显示,LV-37组CD163荧光染色阳性率为57.933%±1.443%,CD86荧光染色阳性率为31.867%±1.960%;LV-NC组CD163荧光染色阳性率为22.433%±2.307%,CD86荧光染色阳性率为50.267%±2.970%(图2B)。与LV-NC组相比,LV-37组CD163表达显著提高(P<0.001),同时CD86表达显著降低(P=0.001)。以上结果证明,IL-37表达上调可在mRNA和蛋白质水平增加M2型巨噬细胞标记物的表达水平,说明IL-37可促进巨噬细胞M2型极化。
IL-37诱导的M2型巨噬细胞在H/R状态下提高肝细胞存活率LV-37组和LV-NC组THP-1源性巨噬细胞与L02细胞共培养并构建H/R模型,通过CCK-8检测L02细胞存活率,结果显示,空白对照组、IL-37实验组、H/R处理组、H/R+IL-37实验组细胞存活率分别为100.381%±6.220%、97.109%±7.558%、53.472%±4.996%和68.668%±4.876%。如图3所示,与空白对照组相比,H/R处理组和H/R+IL-37实验组细胞存活率显著降低(P<0.001);与H/R处理组相比,H/R+LV-37实验组细胞存活率显著提高(P=0.015)。
IL-37诱导的M2型巨噬细胞在H/R状态下降低肝细胞凋亡率 通过流式细胞术检测L02细胞凋亡率,空白对照组、IL-37实验组、H/R处理组、H/R+IL-37实验组细胞凋亡率分别为4.597%±0.405%、5.060%±1.608%、16.247%±1.486%和IL-37诱导的M2型巨噬细胞在H/R状态下降低ALT、AST水平 比较各组细胞培养液中ALT和AST水平,与空白对照组相比,H/R处理组和H/R+LV-37实验组细胞ALT、AST活力显著上升(P<0.001);与H/R处理组相比,H/R+LV-37实验组ALT水平显著降低(P=0.006,图5A);同时,H/R+LV-37实验组AST水平较H/R处理组也显著降低(P=0.005,图5B)。
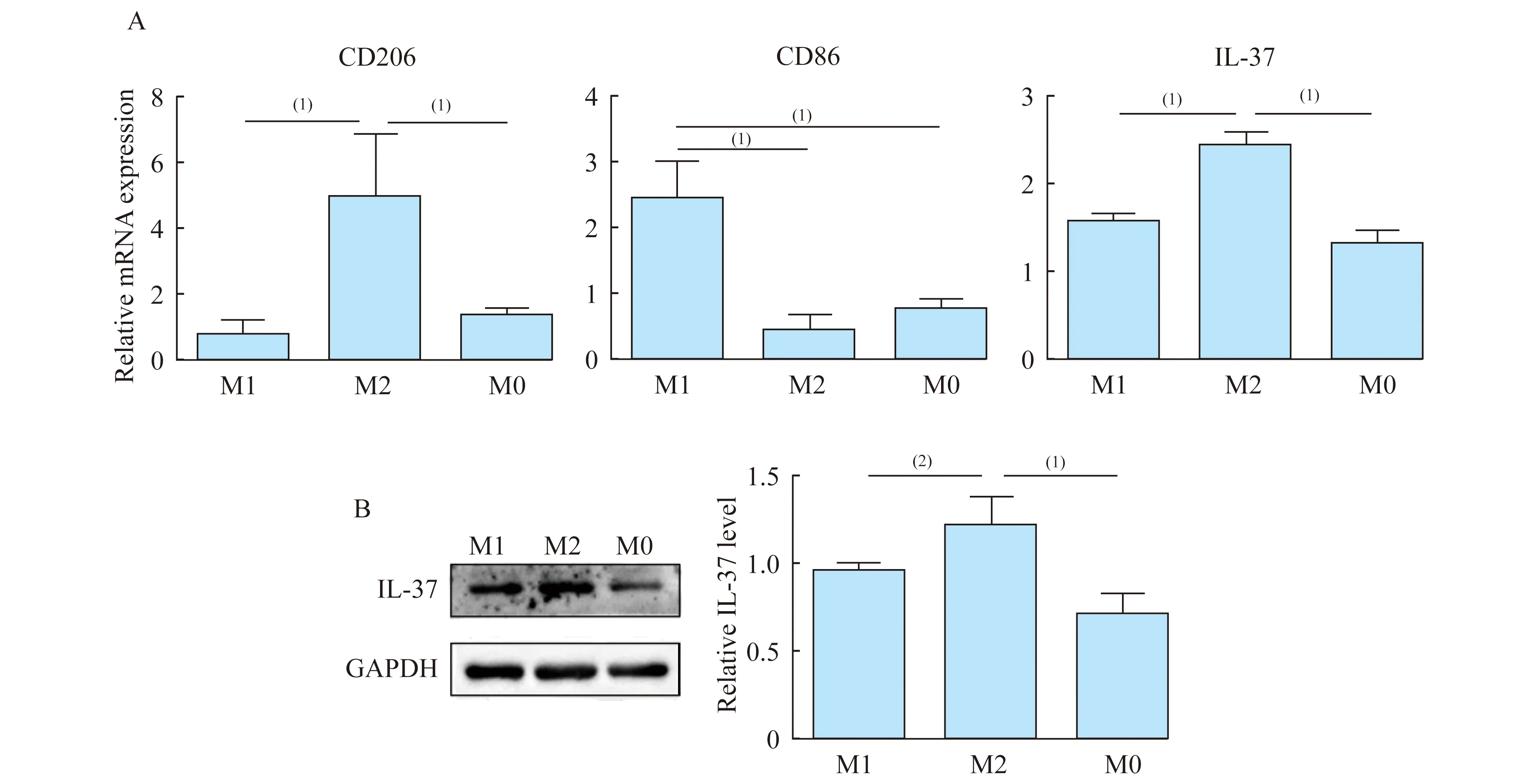
(1)P<0.005,(2)P<0.05.
图1 M2型巨噬细胞中IL-37 mRNA及蛋白质水平
Fig 1 mRNA and protein levels of IL-37 in M2 macrophages
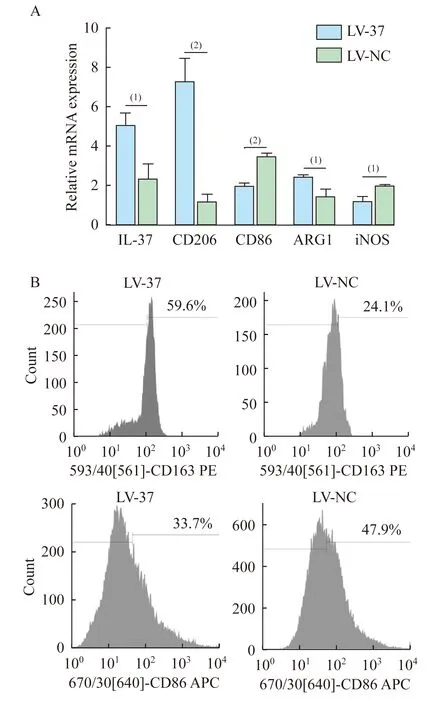
(1)P<0.05,(2)P<0.005.
图2 IL-37促进巨噬细胞M2型极化
Fig 2 IL-37 induces polarization of M2-type macrophages
10.480%±0.942% (图4)。与空白对照组相比,H/R处理组和H/R+IL-37实验组细胞凋亡率显著上升(P<0.001);与H/R处理组相比,H/R+LV-37实验组细胞凋亡率显著降低(P<0.001)。
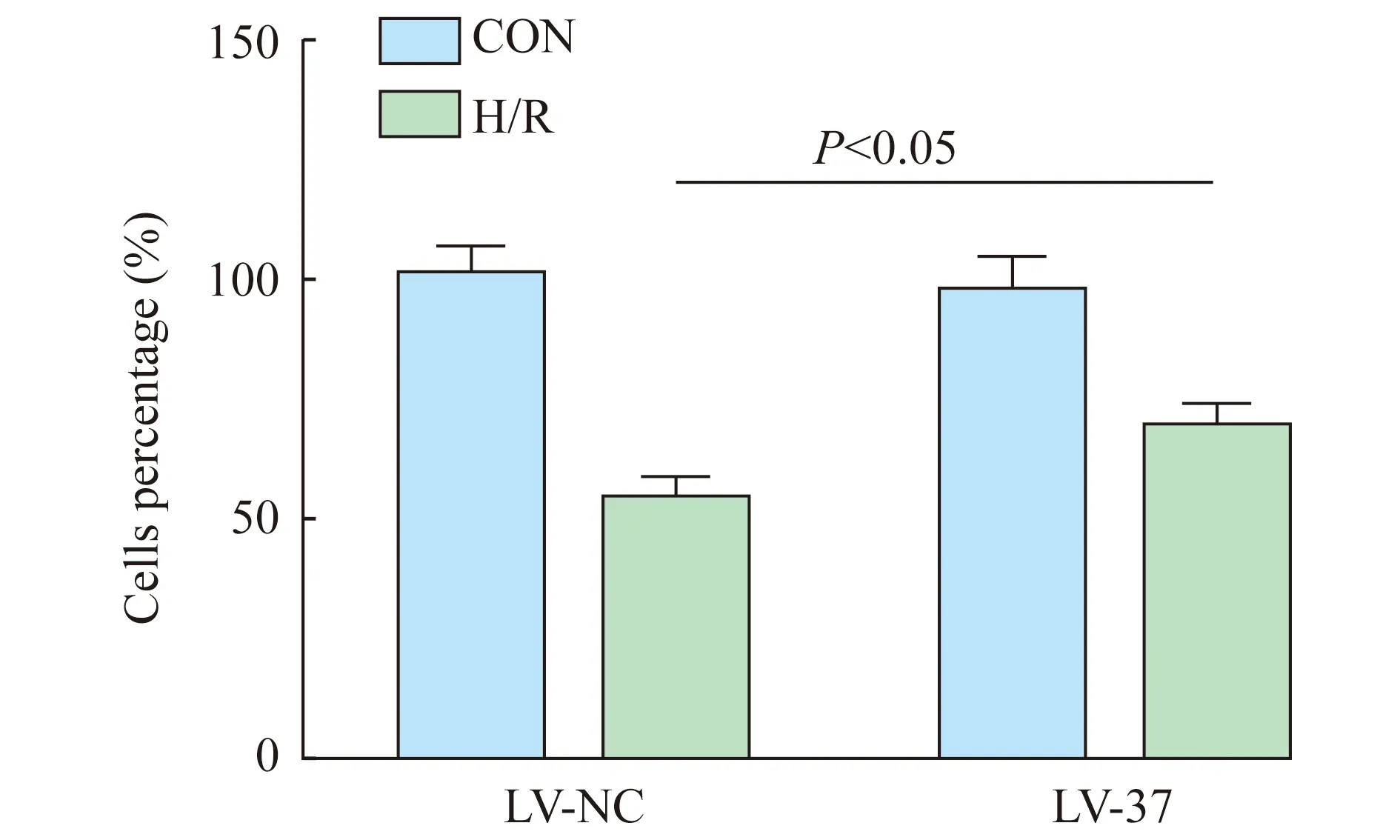
图3 H/R状态下IL-37诱导的THP-1细胞共培养对L02细胞存活的影响
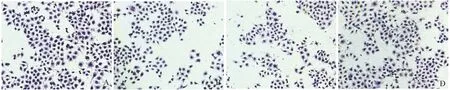
HE染色观察细胞形态学变化 取经建模处理后的各组L02细胞采用HE染色法观察细胞形态学变化。在光镜下观察,空白对照组和IL-37实验组细胞生长状态好,形状较规则,呈多角形或梭形。与空白对照组相比,H/R处理组细胞皱缩、体积缩小,形态欠规则,细胞核固缩碎裂,培养液中有较多细胞碎片存在。与H/R处理组相比,H/R+IL-37实验组细胞形态学变化较小,受损细胞明显减少(图6)。
IL-37促进THP-1细胞中STAT6蛋白质磷酸化 通过Western blot检测THP-1细胞中STAT6蛋白质及其磷酸化水平(图7),在人单核巨噬细胞THP-1中,相对于LV-NC组,过表达IL-37的LV-37组显著促进STAT6蛋白质磷酸化(P<0.001)。
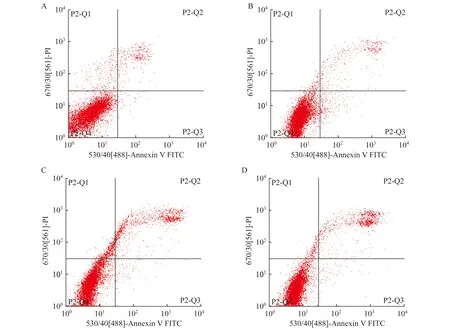
A:Control group;B:IL-37 group;C:H/R group;D:H/R + IL-37 group.
图4 H/R状态下IL-37诱导的THP-1细胞共培养对L02细胞凋亡的影响
Fig 4 Apoptosis of L02 cells co-cultured with IL-37 drived THP-1 cells following H/R
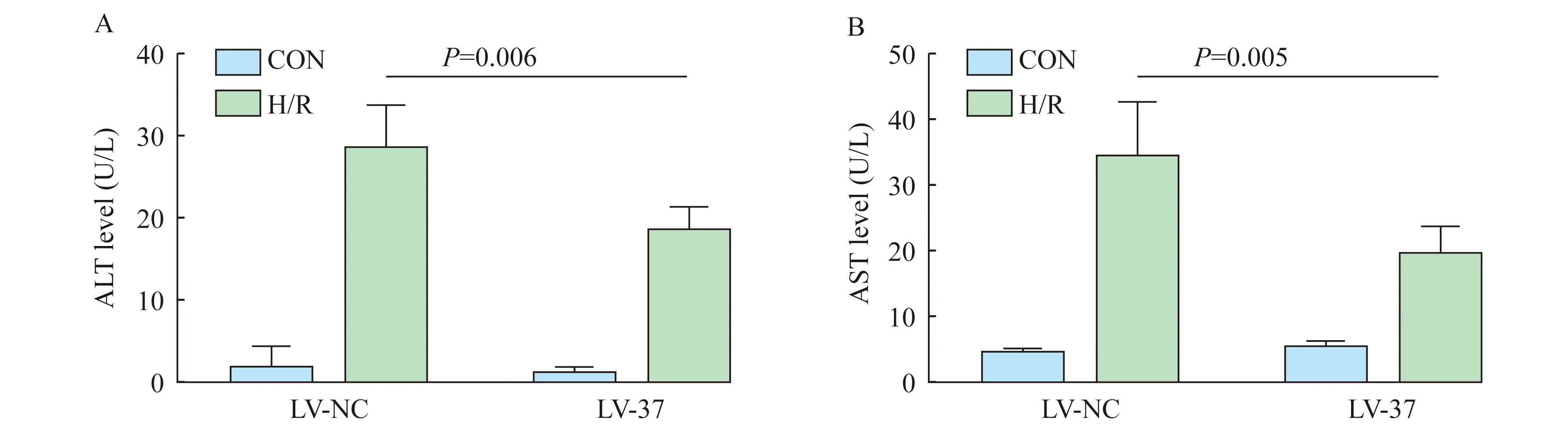
图5 H/R状态下IL-37诱导的THP-1细胞共培养对L02细胞上清液中ALT、AST水平的影响
A:Control group;B:IL-37 group;C:H/R group;D:H/R+IL-37 group.
图6 L02细胞形态学变化(HE,100×)
Fig 6 Morphology change of L02 cells (HE,100×)
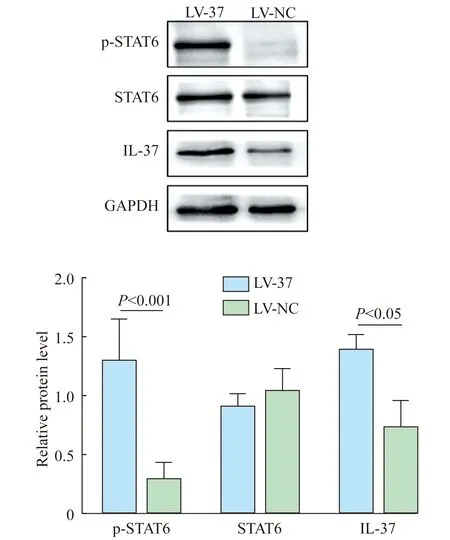
图7 IL-37对人单核巨噬细胞THP-1中STAT6蛋白质及其磷酸化水平的影响
讨 论
缺血再灌注(ischemic/reperfusion,I/R)由短暂性缺血伴随再灌注造成,是各种病理状况(如栓塞、中风、休克、外科手术和器官移植等)期间器官损伤的关键机制。再灌注早期产生的活性氧和氮物质引发的炎性反应是造成细胞损伤的重要因素[10]。巨噬细胞作为机体重要的免疫细胞,在炎性反应介导的HIRI中起到了怎样的作用,又有何机制对其进行调控仍待进一步研究。IL-37作为一种抗炎因子,其对脑、肾、心I/R损伤的保护作用已有报道[11-12],但是IL-37通过影响巨噬细胞极化对HIRI的保护作用及其机制在国内外却鲜见报道。因此,本研究以H/R处理共培养的THP-1和L02模拟肝缺血再灌注模型,探讨IL-37对巨噬细胞极化的影响及其对HIRI的作用。研究结果发现:(1) M2型巨噬细胞中IL-37 mRNA及蛋白质水平上调;(2) IL-37促进巨噬细胞M2型极化;(3) IL-37诱导的M2型巨噬细胞在H/R状态下提高肝细胞存活率;(4) IL-37诱导的M2型巨噬细胞在H/R状态下降低肝细胞凋亡率;(5) IL-37诱导的M2型巨噬细胞在H/R状态下降低ALT、AST水平;(6) IL-37促进THP-1细胞中STAT6蛋白质磷酸化。本研究证明IL-37能够诱导巨噬细胞M2型极化,进而在H/R状态下抑制巨噬细胞介导的细胞炎性反应,从而发挥对细胞的保护作用,而IL-37对巨噬细胞极化的诱导作用可能与STAT6磷酸化激活有关。
IL-37是近年新发现的细胞因子,属于IL-1家族,主要作为抗炎因子调节机体免疫。既往研究证明,IL-37主要通过两种不同的机制发挥抗炎作用。其一是IL-37与IL-18Rα/SIGIRR结合,参与多种炎症相关信号通路的调控从而起到抗炎作用[7,13]。其二则是通过与SMAD3结合抑制一些炎症相关细胞因子的合成和释放[14-15]。此外,有研究证实,LPS可增加IL-37 mRNA转录稳定性并增加其蛋白质水平[16]从而发挥更强的抗炎作用。本研究发现,经药物诱导极化的M2型巨噬细胞与M0型比较,IL-37表达显著上调,这提示IL-37可能与巨噬细胞M2型极化密切相关。同时,与M0型巨噬细胞比较,M1型巨噬细胞中IL-37的蛋白质水平也有一定上调,这可能与LPS增加其转录稳定性相关。
iNOS、CD86是M1型巨噬细胞的表面标记物[17],同时,ARG1、CD206和CD163是M2型巨噬细胞的表面标记物[18]。本研究发现,IL-37过表达的巨噬细胞在H/R状态下,CD206、CD163和ARG1的表达显著高于对照组,CD86和iNOS的表达显著低于对照组,提示IL-37在H/R状态下促进巨噬细胞M2型极化并抑制了M1型极化。
细胞凋亡率、细胞存活率和ALT、AST活力以及细胞形态变化[19]是评价肝细胞损伤情况的重要指标。本研究发现,在H/R状态下L02细胞的存活率显著降低,同时凋亡率及细胞上清液中ALT、AST活力显著提高,提示L02细胞在H/R状态下受到严重损伤。然而,与过表达IL-37的THP-1源性巨噬细胞共培养能够显著提高H/R状态下L02的存活率,降低凋亡率及细胞上清液中ALT、AST活力,提示IL-37诱导的M2型巨噬细胞可能对L02细胞产生保护作用。
本研究还发现在过表达IL-37的细胞中,pSTAT6水平较对照组显著上调,提示STAT6的磷酸化激活可能与IL-37的表达上调有关。已有研究证明,STAT6信号通路参与巨噬细胞M2型极化的调控[20]。因此,我们猜测IL-37对巨噬细胞M2型极化的调控可能与STAT6的磷酸化激活有一定联系,为IL-37调控巨噬细胞M2型极化提供了可能的理论依据。
综上所述,本研究证明了IL-37能够诱导巨噬细胞M2型极化,并通过构建共培养条件下的细胞H/R损伤模型证明了IL-37诱导的M2型巨噬细胞能够在H/R状态下对肝细胞起保护作用,初步解释了IL-37调控巨噬细胞M2型极化的可能机制。在后续的实验中,我们计划增加动物实验及STAT6通路相关实验,以探究IL-37诱导巨噬细胞M2型极化的确切机制及其在HIRI过程中的保护作用。
[1] BISWAS SK,MANTOVANI A.Macrophage plasticity and interaction with lymphocyte subsets:cancer as a paradigm[J].NatImmunol,2010,11(10):889-896.
[2] OHKUBO H,ITO Y,MINAMINO T,etal.VEGFR1-positive macrophages facilitate liver repair and sinusoidal reconstruction after hepatic ischemia/reperfusion injury[J].PLoSOne,2014,9(8):e105533.
[3] DEVEY L,FERENBACH D,MOHR E,etal.Tissue-resident macrophages protect the liver from ischemia reperfusion injury via a heme oxygenase-1-dependent mechanism[J].MolTher,2009,17(1):65-72.
[4] LU L,FAUBEL S,HE Z,etal.Depletion of macrophages and dendritic cells in ischemic acute kidney injury[J].AmJNephrol,2012,35(2):181-190.
[5] GAO XM,LIIU Y,WHITE D,etal.Deletion of macrophage migration inhibitory factor protects the heart from severe ischemia-reperfusion injury:a predominant role of anti-inflammation[J].JMolCellCardiol,2011,50(6):991-999.
[6] LIU WF,WEN SH,ZHAN JH,etal.Treatment with Recombinant Trichinella spiralis Cathepsin B-like Protein Ameliorates Intestinal Ischemia/Reperfusion Injury in Mice by Promoting a Switch from M1 to M2 Macrophages[J].JImmunol,2015,195(1):317-328.
[7] NOLD-PETRY CA,LO CY,RUDLOFF I,etal.IL-37 requires the receptors IL-18Ralpha and IL-1R8 (SIGIRR) to carry out its multifaceted anti-inflammatory program upon innate signal transduction[J].NatImmunol,2015,16(4):354-365.
[8] WANG Z,WU S,LIAO J,etal.Interleukin-6 and rs1800796 locus single nucleotide polymorphisms in response to hypoxia/reoxygenation in hepatocytes[J].IntJMolMed,2016,38(1):192-200.
[9] LIU R,TANG C,SHEN A,etal.IL-37 suppresses hepatocellular carcinoma growth by converting pSmad3 signaling from JNK/pSmad3L/c-Myc oncogenic signaling to pSmad3C/P21 tumor-suppressive signaling[J].Oncotarget,2016,7(51):85079-85096.
[10] MUKHOPADHYAY P,HORVATH B,ZSENGELLER Z,etal.Mitochondrial reactive oxygen species generation triggers inflammatory response and tissue injury associated with hepatic ischemia-reperfusion:therapeutic potential of mitochondrially targeted antioxidants[J].FreeRadicBiolMed,2012,53(5):1123-1138.
[11] YANG Y,ZHANG ZX,LIAN D,etal.IL-37 inhibits IL-18-induced tubular epithelial cell expression of pro-inflammatory cytokines and renal ischemia-reperfusion injury[J].KidneyInt,2015,87(2):396-408.
[12] YANG T,FANG F,CHEN Y,etal.Elevated plasma interleukin-37 playing an important role in acute coronary syndrome through suppression of ROCK activation[J].Oncotarget,2017,8(6):9686-9695.
[13] NOLD MF,NOLD-PETRY CA,ZEPP JA,etal.IL-37 is a fundamental inhibitor of innate immunity[J].NatImmunol,2010,11(11):1014-1022.
[14] SHARMA S,KULK N,NOLD MF,etal.The IL-1 family member 7b translocates to the nucleus and down-regulates proinflammatory cytokines[J].JImmunol,2008,180(8):5477-5482.
[15] BULAU AM,NOLD MF,LI S,etal.Role of caspase-1 in nuclear translocation of IL-37,release of the cytokine,and IL-37 inhibition of innate immune responses[J].ProcNatlAcadSciUSA,2014,111(7):2650-2655.
[16] LIU Y,BI T,WANG Z,etal.Oxymatrine synergistically enhances antitumor activity of oxaliplatin in colon carcinoma through PI3K/AKT/mTOR pathway[J].Apoptosis,2016,21(12):1398-1407.
[17] SU L,ZHANG W,WU X,etal.Glycocalyx-mimicking nanoparticles for stimulation and polarization of macrophages via specific interactions[J].Small,2015,11(33):4191-4200.
[18] KIGUCHI N,KOBAYASHI Y,SAIKA F,etal.Peripheral interleukin-4 ameliorates inflammatory macrophage-dependent neuropathic pain[J].Pain,2015,156(4):684-693.
[19] WANG PX,ZHANG R,HUANG L,etal.Interferon regulatory factor 9 is a key mediator of hepatic ischemia/reperfusion injury[J].JHepatol,2015,62(1):111-120.
[20] CHEN W,XU Y,ZHONG J,etal.MFHAS1 promotes colorectal cancer progress by regulating polarization of tumor-associated macrophages via STAT6 signaling pathway[J].Oncotarget,2016,7(48):78726-78735.
IL-37 protects hepatocyte injury against hypoxia/reoxygenation by promoting polarization of M2-type macrophages
ZHU Di1, LI Ting-ting1, CHEN Qing-song1, MOU Tong1, TANG Cheng-yong2△
(1DepartmentofHepatobiliarySurgery,2DepartmentofPharmacy,theFirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China)
Objective To investigate the protective effect of IL-37 on hepatocyte injury against hypoxia/reoxygenation (H/R) by promoting polarization of M2-type macrophages and its molecular mechanisms. Methods Real-time fluorescent quantitative PCR (qRT-PCR) and Western blot were used to detect the levels of IL-37 mRNA and protein in human monocyte-macrophage THP-1 cells with different polarizations.The lentivirus withIL-37 gene was infected into THP-1 cells.The levels of CD206,CD86,ARG1 and iNOS mRNA was detected by qRT-PCR.The levels of CD163 and CD86 protein was detected by flow cytometric analysis.THP-1 cells and L02 cells were co-cultured by Transwell and treated with H/R.The survival rate and apoptotic rate of L02 cells were detected.The levels of alanine transaminase (ALT) and aspartate aminotransferase (AST) in culture medium were
measured.The levels of STAT6 and its phosphorylation in THP-1 cells were detected by Western blot.Results The levels of IL-37 mRNA and protein were up-regulated in M2-type macrophages.IL-37 promoted the polarization of M2-type macropahges.M2-type macrophages induced by IL-37 were co-cultured with L02 cells,the survival rate was significantly increased by H/R treatment (P=0.015),while the apoptotic rate,ALT level and AST level were significantly decreased (P<0.001).The level of phosphorylated STAT6 in THP-1 cells overexpressing IL-37 was up-regulated (P<0.01).Conclusions IL-37 can induce polarization of M2-type macrophages and protect hepatocyte injury against H/R.Its mechanism may be related to STAT6 signal pathways.
IL-37; macrophages; hypoxia/reoxygenation; hepatocyte injury
R575,R364.4,R392-33
A
10.3969/j.issn.1672-8467.2017.04.010
2017-03-15;编辑:王蔚)
重庆市科委基金(CSTC2015shmszx120019)
△Corresponding author E-mail:wzjtcy@126.com
* This work was supported by the Foundation of Chongqing Science and Technology Commission (CSTC2015shmszx120019).

