重组AthrobacterramosusS34MTSase和MTHase的酶学性质及其制备海藻糖的应用条件优化
王魁, 宿玲恰, 吴敬, 陈晟*
1(江南大学, 食品科学与技术国家重点实验室,江苏 无锡,214122) 2(江南大学,生物工程学院工业生物技术教育部重点实验室,江苏 无锡,214122)
研究报告
重组AthrobacterramosusS34MTSase和MTHase的酶学性质及其制备海藻糖的应用条件优化
王魁1,2, 宿玲恰1,2, 吴敬1,2, 陈晟1,2*
1(江南大学, 食品科学与技术国家重点实验室,江苏 无锡,214122) 2(江南大学,生物工程学院工业生物技术教育部重点实验室,江苏 无锡,214122)
以淀粉为底物,通过麦芽寡糖基海藻糖合成酶(maltosyltrehalose synthase, MTSase)和麦芽寡糖基海藻糖水解酶(maltosyltrehalose hydrolase,MTHase)的共同作用生产海藻糖是一种经济高效的方法。对ArthrobacterramosusS34来源并分别在E.coliBL21(DE3)中表达的MTSase和MTHase的酶学性质进行研究,发现MTSase的最适温度为45 ℃,最适pH为7.0,MTHase的最适温度为55 ℃,最适pH为6.0。随后用2种酶共同作用生产海藻糖,优化反应条件,考查反应温度、初始pH、底物DE值、加酶量以及底物浓度等因素对酶转化过程中海藻糖产率的影响。最佳酶转化条件为反应温度45 ℃、初始pH5.5,底物DE值8.5,加酶量分别为MTSase最小加量15.75 U/g淀粉,MTHase最小加量7.5 U/g淀粉。
海藻糖;麦芽寡糖基海藻糖合成酶(maltosyltrehalose synthase, MTSase);麦芽寡糖基海藻糖水解酶(maltosyltrehalose hydrolase, MTHase);酶学性质;酶转化
海藻糖是一种在自然界中普遍存在的非还原性二糖,以稳定的α-1,1-糖苷键连接,不能被α-葡萄糖苷酶分解[1]。海藻糖无毒,作为糖类能够为生物体提供能量和碳源。另有研究表明,当海藻糖与蛋白质、脂质、组织、器官等共存时,能够帮助它们抵抗环境压力,因此海藻糖还可用于生物物质的保存[2-3]。
不同的酶系统可以有效地以麦芽糖、蔗糖和淀粉作为底物分别产生海藻糖[4-6]。1994年,有研究所发现,2种不同的酶,麦芽寡糖基海藻糖合成酶(maltosyltrehalose synthase, MTSase)和麦芽寡糖基海藻糖水解酶(maltosyltrehalose hydrolase, MTHase)在以淀粉作为反应起始底物时,在产生海藻糖的过程中起重要作用[7]。之后,又有研究人员报道了以蔗糖为底物通过3种不同的酶(海藻糖磷酸化酶,蔗糖磷酸化酶和葡萄糖异构酶)进行海藻糖代谢的合成[4]。1998年,经研究发现,通过海藻糖合酶可以使以α-1,4-糖苷键连接的麦芽糖重组转变为以α-1,1-糖苷键连接的海藻糖,实现以麦芽糖为底物合成海藻糖[8-9]。
考虑工业应用中的成本因素,双酶法所用的底物是比蔗糖和麦芽糖更便宜的淀粉,因此以MTSase和MTHase生产海藻糖是最具成本效益的方法。在双酶法生成海藻糖的过程中,淀粉液化后,位于糊精末端的2个葡萄糖分子间的α-1,4-糖苷键可在MTSase的催化下转化为α-1,1-糖苷键,使其变成带有1分子海藻糖的糊精。此后,经MTHase的水解作用将其水解成2部分,一部分为目标产物海藻糖分子,另一部分为减少2个葡萄糖分子的糊精,而第二部分的糊精则作为底物参与下一轮反应,继续生产海藻糖[7]。
国内外研究人员已经对根瘤菌[10]、谷氨酸棒状杆菌[11]、微黄短杆菌[6]、节杆菌[12]、分支节杆菌[7]、芝田硫化叶菌[13]以及嗜热硫矿硫化叶菌[14]来源的MTSase和MTHase两种酶基因进行了克隆表达,并对2种酶的酶学性质及在生产海藻糖过程中的应用条件进行了研究。
MTSase和MTHase两种酶分别由基因treY和treZ控制表达,本实验室于前期构建了分别含有treY和treZ的基因工程菌E.coliBL21(DE3)/pET-24a-treY和E.coliBL21(DE3)/pET-24a-treZ,经过发酵优化,发现目的基因源自于ArthrobacterramosusS34的2株基因工程菌的发酵酶活明显高于已报道的该来源2种酶的发酵酶活,具有较高的应用价值。此来源的2种酶在E.coliBL21(DE3)中的重组表达之前未见报道。本研究对这2种重组酶的酶学性质以及在制备海藻糖过程中的条件优化进行了研究。
1 材料与方法
1.1材料与试剂
海藻糖、麦芽四糖、麦芽六糖,美国Sigma公司。
1.2仪器与设备
安捷伦1200高效液相色谱系统,美国Agilent公司。
1.3方法
1.3.1 MTSase和MTHase酶活力的测定
MTSase酶活测定:10 μL稀释一定倍数的 MTSase酶液(空白加高温灭活的MTSase),加到190 μL的10 g/L的麦芽六糖溶液中(20 mmol/L pH 6.0的磷酸盐缓冲液配制),45 ℃反应10 min,100 ℃沸水中煮10 min终止反应。取100 μL反应液于10 mL具塞试管中,注入900 μL水和1 mL DNS溶液,沸水中煮7 min,加水补至10 mL,最后在540 nm波长下测定吸光度值。MTSase的酶活单位定义为:在45 ℃时,其他条件恒定,单位时间内每消耗1 μmol麦芽六糖所需的酶量。酶活计算公式:
MTSase的酶活=

MTHase酶活测定:10 μL MTSase浓缩酶液加到490 μL 10 g/L的麦芽六糖溶液中(20 mmol/L pH 6.0的磷酸盐缓冲液配制),45 ℃反应2 h,100 ℃沸水中煮10 min终止反应。待溶液冷却后,加入10 μL 稀释一定倍数的MTHase酶液(空白加高温灭活的MTHase)到190 μL的处理过的底物中,55 ℃反应10 min,100℃沸水中煮10 min终止反应,取100 μL反应液,加入900 μL水和1 mL DNS溶液,沸水中煮7 min,加水补至10 mL,最后在540 nm波长下测定吸光度值。MTHase的酶活单位定义为:在55 ℃时,其他条件恒定,单位时间内转化生成1 μmol麦芽四糖所需的酶量。酶活计算公式:
MTHase的酶活=

1.3.2 重组蛋白酶学性质的研究
1.3.2.1 重组MTSase和MTHase的最适温度
分别将底物置于35、40、45、50、55、60、65 ℃水浴中预热3 min,按照1.3.1所述方法测定酶活,算出百分比。定义最高酶活为100%。
1.3.2.2 重组MTSase和MTHase的温度稳定性
将酶液置于45℃中保温,定期取样按照1.3.1操作步骤测定残余酶活,算出百分比(设定0 h酶活为100%)。
1.3.2.3 重组MTSase和MTHase的最适pH
将酶液分别置于20 mmol/L pH为 4.0~8.0(梯度为0.5)的缓冲液中,在相应温度下预热3 min,按照1.3.1所述方法测定相应pH条件下的酶活,算出百分比,定义最高酶活为100%。
1.3.2.4 重组MTSase和MTHase的pH稳定性
将酶分别置于20 mmol/L pH 4.0~8.0(梯度为0.5)缓冲液中,于4 ℃静置24 h,按照1.3.1操作步骤测定剩余酶活,算出百分比(设定0 h酶活为100%)。
1.3.3 MTSase和MTHase制备海藻糖的工艺条件优化
1.3.3.1 反应温度的优化
200 g/L的玉米淀粉液化至DE值10,初始pH为6.0,加入5 U/g淀粉的普鲁兰酶,30 U/g 底物的 MTSase和MTHase在150 r/min的水浴摇床中进行反应。温度分别设置为35、40、45、50、55 ℃,反应36 h后终止反应并煮沸处理。产物稀释沉淀后用液相测定其中海藻糖含量,算出产率。
1.3.3.2 底物DE值的优化
200 g/L的玉米淀粉液化至DE值分别达到3.5、6.5、8.5和10.5,初始pH为6.0,加入5 U/g淀粉的普鲁兰酶,30 U/g的 MTSase和MTHase在45 ℃,150 r/min水浴摇床中反应36 h后终止反应并煮沸处理。液相测定其中海藻糖含量,算出产率。
1.3.3.3 初始pH的优化
200 g/L的玉米淀粉液化至DE值8.5,加入5 U/g淀粉的普鲁兰酶,30 U/g的 MTSase和MTHase,分别调节初始pH为4.5、5.0、5.5、6.0、6.5、7.0在45 ℃,150 r/min水浴摇床中反应36 h后终止反应并煮沸处理。测定其中海藻糖含量,算出产率。
1.3.3.4 加酶量的优化
200 g/L的玉米淀粉液化至DE值8.5,初始pH为5.5,加入5 U/g淀粉的普鲁兰酶,再分别加入终浓度为114、75.5、38、19、7.5、3.75、1.875 U/g 底物的 MTHase和终浓度为31.5 U/g底物的MTSase。另外分别加入终浓度为31.5、15.75、7.875、3.15、1.575 U/g 的MTSase和终浓度为114 U/g底物的 MTHase在45 ℃,150 r/min水浴摇床中反应36 h后终止反应并煮沸处理。液相测定其中海藻糖含量,算出产率。
1.3.3.5 底物含量的优化
分别配置170、240、270、320 g/L的玉米淀粉作为底物,液化至DE值8.5,初始pH为5.5,加入5 U/g淀粉的普鲁兰酶,30 U/g 底物的 MTSase和MTHase在45 ℃,150 r/min的水浴摇床中反应36 h后终止反应并煮沸处理。测定其中海藻糖含量,算出产率。
1.3.4 底物转化率的测定
产物中的海藻糖含量采用高效液相色谱检测,NH2柱,体积分数80%的乙腈溶液,流速为0.8 mL/min,柱温为40 ℃。
1.3.5 底物转化率的计算
1.3.6 优化条件下反应过程中海藻糖产量的测定
170 g/L的玉米淀粉液化至DE值8.5,初始pH为5.5,加入5 U/g淀粉的普鲁兰酶,15.75 U/g底物的MTSase和7.5 U/g底物的 MTHase在45 ℃,150 r/min的水浴摇床中反应。反应过程中每隔6 h取样并煮沸处理,36 h后终止反应。测定其中海藻糖含量,算出产率。
2 结果与讨论
2.1重组MTSase和MTHase的酶学性质
2.1.1 重组蛋白最适温度及温度稳定性
蛋白酶的催化反应速率与反应温度密切相关。如图1示,MTSase的最适温度为45 ℃,MTHase的最适温度为55 ℃。在一定温度范围内,重组MTSase和MTHase的酶活性随着温度的升高也呈现逐渐升高的趋势,由于过高的温度会使蛋白质性质发生不可逆的改变,当温度高于45 ℃时,MTSase的活性随着温度的升高开始降低;当温度高于55 ℃时,MTHase的活性开始降低。MTSase和MTHase在45 ℃、50 ℃下的稳定性结果显示在图2中。MTSase和MTHase在45 ℃的半衰期分别为96 h和6 h,在50 ℃的半衰期分别为50 h和3 h。可以看出,MTSase在45 ℃和50 ℃时具有较高的稳定性,MTHase在2种温度下的稳定性都比较差。
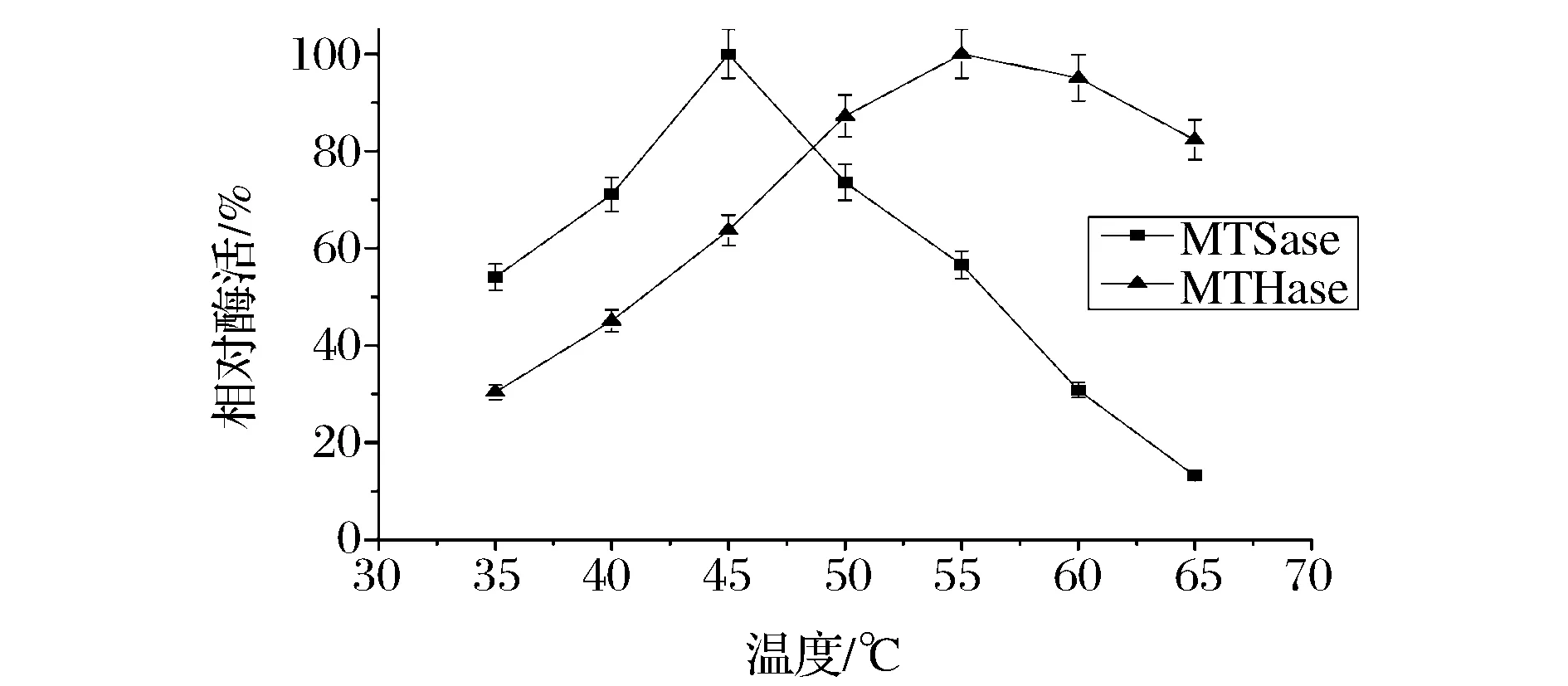
图1 MTSase和MTHase的最适温度Fig.1 Optimum temperature of MTSase and MTHase

a-MTSase在45 ℃和50 ℃的稳定性;b-MTHase在45 ℃和50 ℃的稳定性图2 MTSase和MTHase的温度稳定性Fig.2 Temperature stability of MTSase and MTHase
2.1.2 重组蛋白最适pH及pH稳定性
酶反应的反应速率会受到环境pH的影响。如图3所示,MTSase在pH值5.5~8.0的范围内均有70%以上的酶活,并在pH7.0的环境下,测得的酶活最高,大于或小于7.0的pH环境都会使酶活逐渐降低。MTHase的最适pH为6.0,在大于6.0的pH环境下,MTHase的活性急速降低,如当pH为6.5时,酶活相对值迅速降低至57.9%;而在小于6.0大于5.0的pH时,MTHase的酶活能够稳定在一定的范围,达到酶活相对值85%以上;在更低的pH(<5.0)时,MTHase的酶活相对值则急速降低到42%以下。综上,重组MTHase适合的pH范围应为5.0~6.0。另外,pH稳定性结果(图4)表明,在4 ℃时,MTSase和MTHase在pH 4.0~8.0均能保证较好的稳定性。
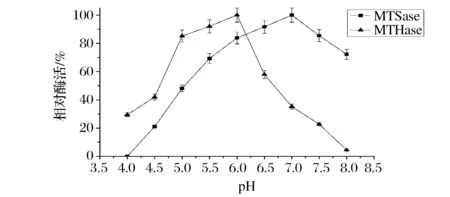
图3 MTSase和MTHase的最适 pHFig.3 Optimum pH of MTSase and MTHase

图4 MTSase和MTHase的pH稳定性Fig.4 pH stability of MTSase and MTHase
2.2重组MTSase和重组MTHase制备海藻糖的工艺条件
2.2.1 反应温度与底物转化率的关系
如图5所示,在反应温度逐渐升高时,海藻糖的转化率也随着提高,并在45 ℃时到达最高值,为54.2%。但在45℃之后,海藻糖的转化率随着温度的升高快速下降,这可能是高温使得MTHase快速失活而导致的。综合以上因素,最终选择45℃作为转化产海藻糖的反应温度。

图5 温度与底物转化率的关系Fig.5 The relationship between temperature and trehalose conversion
2.2.2 底物液化DE值与底物转化率的关系
底物玉米淀粉液化结束时的DE值会对与海藻糖的转化率之间也有着密切的联系。如图6所示,海藻糖的转化率随着DE值的升高而增加,并在DE值为8.5时达到最大值56.8%。这可能是因为在DE值过低时,糊化过的淀粉底物在温度自然下降的过程中更易发生老化,使得淀粉内部已被破坏的分子氢键再次结合,随着部分分子的有序排列,即造成结晶沉淀,从而使得底物利用率大大降低[15]。而当底物DE值达到8.5时,更高的DE值代表着更低的聚合度,由于MTSase和MTHase在反应过程中只会对聚合度3的糖链起作用[7],因此在一定范围内,底物转化成海藻糖的转化率会随着淀粉底物聚合度的降低而减少,因此,在DE值为8.5时,最适合进行底物制备海藻糖的反应。
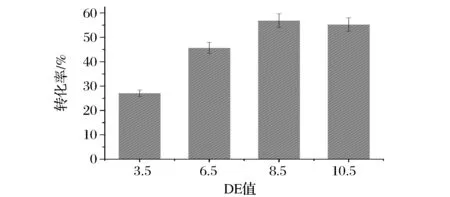
图6 DE值与底物转化率的关系Fig.6 The relationship between DE value and trehalose conversion
2.2.3 初始pH与底物转化率的关系
由图7可以看出,重组MTSase和重组MTHase转化底物生成海藻糖的最适初始pH为5.5。
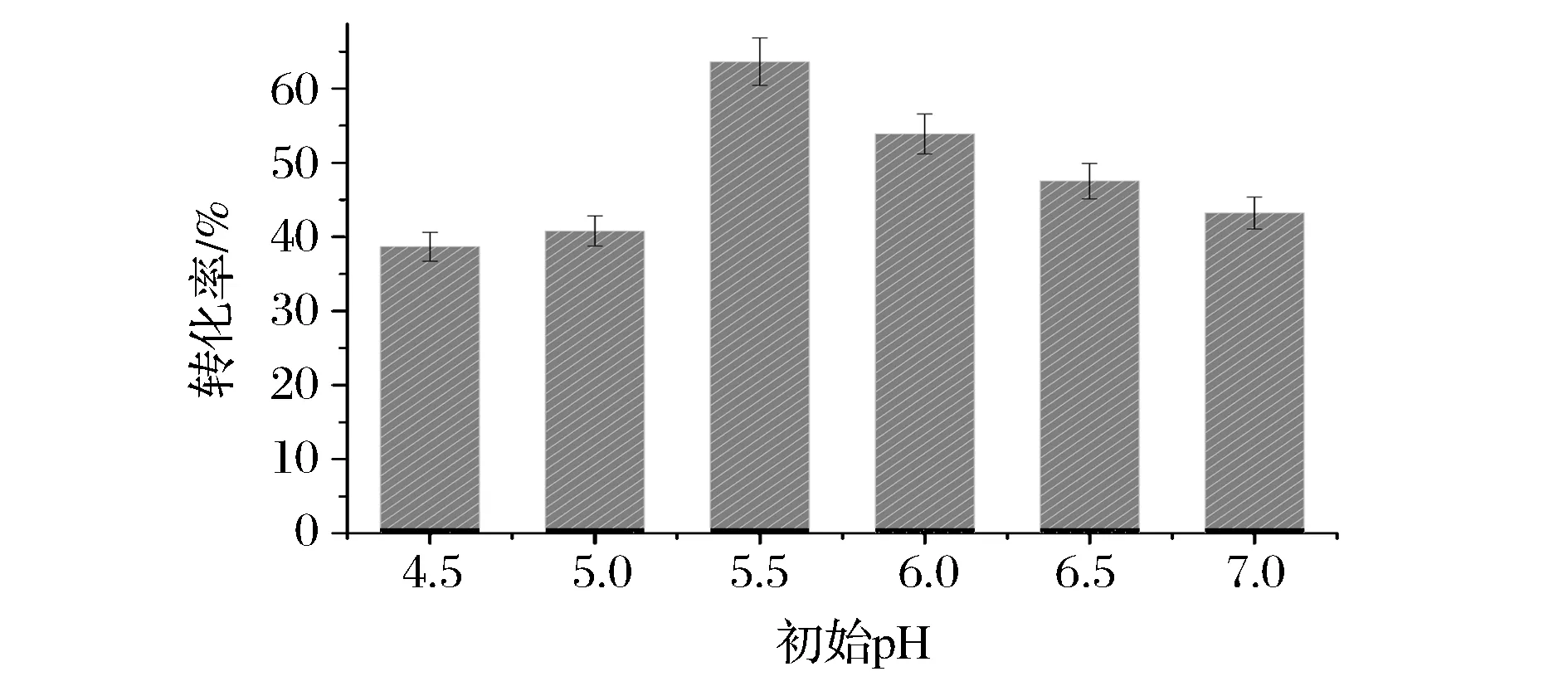
图7 初始pH与底物转化率的关系Fig.7 The relationship between initial pH and trehalose conversion
初始pH低于5.5或过高时,底物转化率显著降低,很可能是一方面过高或过低的pH使得酶活性中心的构象发生改变,甚至改变了酶分子的整体结构使其变形失活,导致酶分子的稳定性大大降低;另一方面可能是不同pH会对酶活性中心附近相关基团的解离状态产生一定的影响,造成活性部位与底物结合难易度的区别[16]。当初始pH处于5.5~6.5之间时,底物转化率也逐渐减少,可能是因为在该pH范围内,不同pH导致酶稳定性的变化,而这种变化对海藻糖产率的影响高于酶最适pH对其的影响。综上考虑,选择5.5作为反应的初始pH。
2.2.4 加酶量与底物转化率的关系
由于海藻糖的转化需要MTSase和MTHase的共同作用,因此对2种酶的加量进行了研究。如图8所示,在加酶量充足的情况下,2种酶的加量比例对海藻糖的转化率没有明显的影响。在转化过程中,如要保证一定的底物转化率,2种酶都有对应的最少加量。如图8(a),加入足量恒定的MTHase时,控制MTSase的加量,当其降低到15.75 U/g时,依然能够保持65%以上的转化率,而当MTSase的加量降低到7.875 U/g时,底物转化率则直接降低到55%。如图8(b),加入足量恒定的MTSase时,控制MTHase的加量,在其加量7.5 U/g时,底物转化率可始终稳定在63%以上。因此,在酶转化产海藻糖过程中,MTSase和MTHase的最少加量分别为15.75 U/g和7.5 U/g。
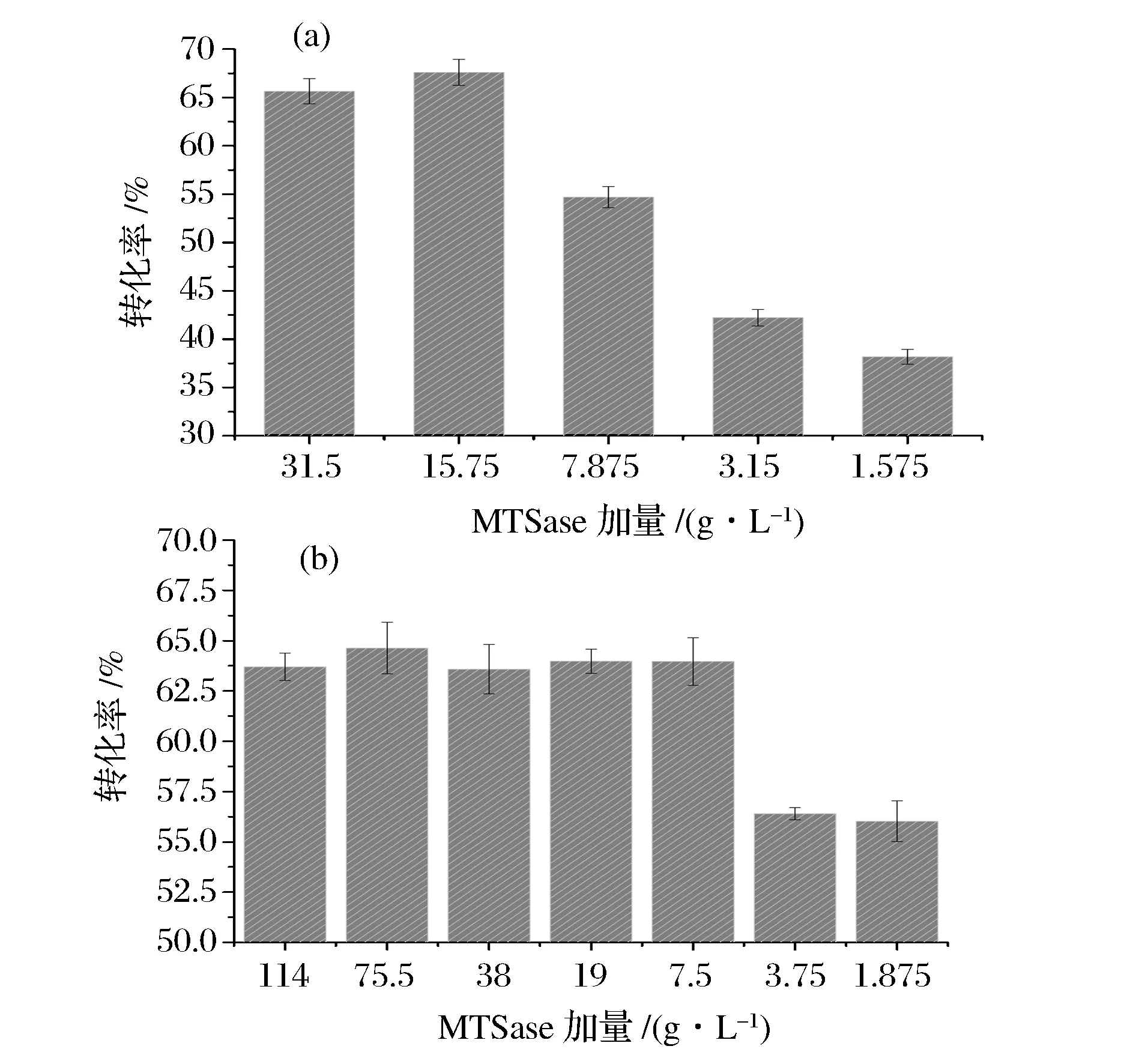
a-不同MTSase加量;b-不同MTHase加量图8 加酶量与底物转化率的关系Fig.8 The relationship between enzyme dosage and trehalose conversion
2.2.5 底物浓度与海藻糖转化率的关系
为了提高工业生产中制备底物的效率,研究了底物浓度对2种酶共同作用生成海藻糖的转化率的影响,分别在17%、24%、27%、32%四个不同的底物浓度下对其进行研究。结果(图9)显示,更高的底物浓度会伴随有更低的底物转化率,其转化率最高点在底物浓度为17%时达到,为67.7%。虽然底物转化率随着底物浓度的升高而逐渐降低,但考虑到工业生产中进行一批生产所需的人力物力是一定的,因此在具体生产过程中,应对总体成本进行核算,以选取最佳底物浓度。

图9 底物浓度与底物转化率的关系Fig.9 The relationship between substrate concentration and trehalose conversion
2.2.6 优化条件下海藻糖产量的过程研究
经条件优化后得知,MTHase和MTSase协同作用产海藻糖在45 ℃时能达到最高的产率。考虑到MTHase在45 ℃时的半衰期为6 h,因此在45 ℃下对海藻糖转化进行过程研究。同时,作为对照,在反应进行到12 h时,向反应体系中补加终浓度为7.5 U/g底物的 MTHase,继续反应至36 h。结果(图10)表明,补加MTHase对海藻糖最终的转化率没有明显提高。主要的转化过程在前24 h完成,在24~30 h,海藻糖含量的增速降低,但依然在增加,直到转化进行到30~36 h之间时,海藻糖含量开始稳定。这表明在整个反应过程中,MTHase均有着合适的酶活性来保证反应的进行,分析原因可能是当酶液与底物共同存在时,底物对MTHase具有保护作用。
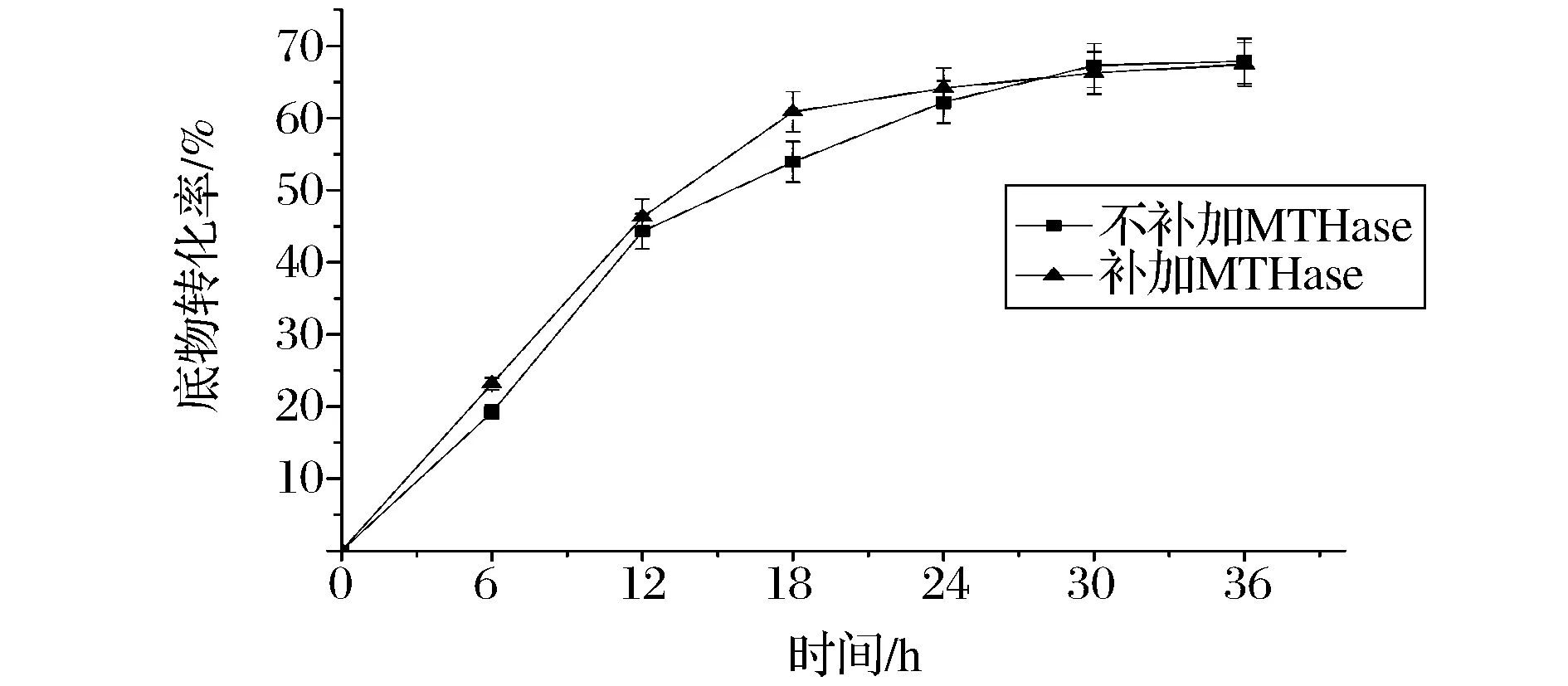
图10 优化条件下底物转化率产量随时间的变化Fig.10 Changes of trehalose yield over time under optimized conditions
3 结论
本研究中重组菌E.coliBL21(DE3)/pET-24a-treY和E.coliBL21(DE3)/pET-24a-treZ能够分别高效表达MTHase和MTSase,MTSase的最适温度为45℃,最适pH为7.0,MTHase的最适温度为55℃,最适pH为6.0。在2种酶的产海藻糖应用研究中发现其最适转化温度和pH为45℃、初始pH5.5,这与其酶学性质研究结果相对应。另外,其最适底物DE值为8.5,过高和过低的DE值对其转化率的影响都较大,因此后期在实际工厂生产中应严格控制底物淀粉的液化时间,以使其DE值达到8.5左右,保证底物转化率。在反应过程中,MTSase和MTHase最小加量分别为15.75 U/g淀粉和7.5 U/g淀粉,并且过量的2种酶对海藻糖的转化率都没有明显的影响。因此,在生产过程中,可以适当地增加MTSase和MTHase两种酶的加量,保证反应的正常进行。最后,底物浓度对反应的进行也有着较大的影响,在其他条件恒定时,转化率在一定范围内随着底物浓度的升高而降低。同时考虑到生产过程中的成本问题,应当结合具体情况,全面考虑以选择最优的底物浓度。
[1] RICHARDSAB.Trehalose:a review of properties,history of use and human tolerance,and results of multiple safety studies[J].Food and Chemical Toxicology,2002,40(7):871-898.
[2] ELEUTHERIO EC,ARAUJO PS,PANEK AD.Protective role of trehalose during heat stress inSaccharomycescerevisiae[J].Cryobiology,1993,30(6):591-596.
[3] OHTAKE S,WANG YJ.Trehalose:current use and future applications[J].J Pharm Sci,2011,100(6):2 020-2 053.
[4] SCHICK I,HALTRICH D,KULBE KD.Trehalose phosphorylase from Pichia fermentans and its role in the metabolism of trehalose[J].Applied Microbiology and Biotechnology,1995,43(6):1 088-1 095.
[5] SAITO K, KASE T, TAKAHASHI E, et al. Purification and characterization of a trehalose synthase from the basidiomyceteGrifolafrondosa[J].Applied and Environmental Microbiology,1998,64(11):4 340-4 345.
[6] KIM Y H, KWON T K, PARK S, et al. Trehalose synthesis by sequential reactions of recombinant maltooligosyltrehalose synthase and maltooligosyltrehalosetrehalohydrolase fromBrevibacteriumhelvolum[J].Appl Environ Microbiol,2000,66(11):4 620-4 624.
[7] YAMAMOTOT T, MARUTA K, WATABABE H, et al.Trehalose-producing operontreYZfromArthrobacterramosusS34[J].BiosciBiotechnol Biochem,2001,65(6):1 419-1 423.
[8] SUKHOON Koh, HYUNJAE Shin, JOONGSU, Kim, et al. Trehalose synthesis from maltose by a thermostable trehalose synthase fromThermuscaldophilus[J].Biotechnology Letters,1998,20(8):757-761.
[9] CHO Y J,PARK O J,SHIN HJ.Immobilization of thermostable trehalose synthase for the production of trehalose[J].Enzyme and Microbial Technology,2006,39(1):108-113.
[10] MARUTA K,HATTORI K,NAKADAT,et al.Cloning and sequencing of trehalose biosynthesis genes fromRhizobiumsp.M-ll[J].Bioscience, Biotechnology,and Biochemistry,1996,60(4):717-720.
[11] CARPINELLI J,KRAMER R,AGOSINE.Metabolic engineering ofCorynebacteriumglutamicumfor trehaloseoverproduction:role of theTreYZtrehalose biosynthetic pathway[J].Applied and Environmental Microbiology,2006,72(3):1 949-1 955.
[12] MARUTA K,HATTORI K,NAKADAT,etal.Cloning and sequencing of trehalose biosynthesis genes fromArthrobactersp.Q36[J].Biochimica et BiophysicaActa (BBA)-General Subjects,1996,1 289(1):10-13.
[13] Di LERNIA I,MORANA A,OTTOMBRINOA,etal.Enzymes fromSulfolobusshibataefor the production of trehalose and glucose from starch[J].Extremophiles,1998,2(4):409-416.
[14] FANG TY,TSENG WC,GUO MS,etal.Expression,purification, and characterization of the maltooligosyltrehalose trehalohydrolase from the thermophilic archaeonsulfolobussolfataricusATCC 35092[J].Journal of Agricultural and Food Chemistry,2006,54(19):7 105-7 112.
[15] 唐联坤.淀粉糊化、老化特性与食品加工[J].西部粮油科技,1996,21(3):26-29.
[16] 王宁,吴丹,陈晟,等.利用来源于Paenibacillusmacerans的α-CGTase突变体Y89D制备α-环糊精[J].食品科学,2011,32(3):165-170.
EnzymaticpropertiesofrecombinantAthrobacterramosusS34MTSaseandMTHaseandoptimizationofapplicationconditionsforproductionoftrehalose
WANG Kui1,2, SU Ling-qia1,2, WU Jing1,2, CHEN Sheng1,2*
1(State Key Laboratory of Food Science and Technology, Jiangnan University,Wuxi 214122, China) 2(School of Biotechnology and Key Laboratory of Industrial Biotechnology Ministry of Education, Jiangnan University, Wuxi 214122, China)
The production of trehalose from starch is an effective method under the combined action of maltosyltrehalose synthase (MTSase) and maltosyltrehalose hydrolase (MTHase). The optimum temperature of MTSase was 45℃, the optimal pH was 7.0, and the optimal temperature of MTHase was 55℃, the optimum pH was 6.0. Then trehalose was produced by the two enzymes together, and the reaction conditions were optimized. The effects of reaction temperature, initial pH, substrate DE value, enzymes amounts and substrate concentration on trehalose yield were investigated. The optimal conditions were as follows: the reaction temperature was 45℃, the initial pH was 8.5, the substrate DE value was 8.5 and the amount of MTSase and MTHase was 15.75 U/g and 7.5 U/g, respectively.
trehalose; maltosyltrehalosesynthase(MTSase); maltosyltrehalose hydrolase(MTHase); enzymatic properties; enzyme transformation
10.13995/j.cnki.11-1802/ts.013741
硕士研究生(陈晟副教授为通讯作者,E-mail:chensheng@jiangnan.edu.cn)。
国家杰出青年基金(31425020);江苏高校优秀科技创新团队项目(吴敬)
2017-01-03,改回日期:2017-03-09

