CTLA-4Ig对大鼠同种异体肾移植移植肾功能的影响
周浩, 王芳, 黄江波, 杨邵波, 于淼, 曾顺, 朱文辉, 潘滢
(1湖南中医药大学第二附属医院 泌尿外科,湖南 长沙 410005;2南华大学附属第二医院 泌尿外科,湖南 衡阳 421001;3长沙民政职业技术学院 康复医学系,湖南 长沙410004)
CTLA-4Ig对大鼠同种异体肾移植移植肾功能的影响
周浩1,2, 王芳3, 黄江波1, 杨邵波1, 于淼1, 曾顺1, 朱文辉1, 潘滢1
(1湖南中医药大学第二附属医院 泌尿外科,湖南 长沙 410005;2南华大学附属第二医院 泌尿外科,湖南 衡阳 421001;3长沙民政职业技术学院 康复医学系,湖南 长沙410004)
目的 研究CTLA-4Ig对大鼠同种异体肾移植移植肾功能的影响,为CTLA-4Ig作为一种新型的生物免疫抑制剂应用于临床提供实验依据。方法 以LEW大鼠作为受体,BN大鼠作为供体,建立大鼠同种异体肾移植模型。受体LEW大鼠随机分四组,每组35只:①对照组:术中给予等体积生理盐水;②CTLA-4Ig低浓度组:术中给予CTLA-4Ig 1 mg/kg;③CTLA-4Ig中浓度组:术中给予CTLA-4Ig 10 mg/kg;④CTLA-4Ig高浓度组:术中给予CTLA-4Ig 20 mg/kg。给药途径为腹腔注射。分别于实验前、术后2小时、术后4小时、术后12小时、术后24小时、术后2天及术后3天收集血液标本,检测血浆CTLA-4Ig浓度及血清肌酐水平。结果 对照组大鼠血浆中未检测到明显的CTLA-4Ig。给予不同浓度的CTLA-4Ig,大鼠血浆CTLA-4Ig浓度随之变化。给予CTLA-4Ig 1 mg/kg能有效保护同种异体肾移植的移植肾功能,保护作用随着浓度增加而增加,但CTLA-4Ig 10 mg/kg时保护作用已是最大,再加大给药浓度对移植肾功能保护没有意义。结论 CTLA-4Ig能减轻排斥反应,有效保护大鼠同种异体肾移植的移植肾功能。
CTLA-4Ig;肾移植;免疫耐受
T细胞活化不仅需要特异性抗原提供第一信号,还需要由 APC和T细胞表面粘附分子结合提供的第二信号,即共刺激信号。相关实验[1]证明,若仅有第一信号而无第二信号的辅助,T细胞将处于克隆无能或无应答状态。CTLA-4Ig融合蛋白是CTLA-4的胞外结构域和人IgG1重链恒定区构建的一种重组的可溶性嵌合蛋白,CTLA-4Ig的亲和力显著高于CD28,可作为CD28和B7结合的竞争抑制剂[2],通过阻断B7和CD28共刺激信号,抑制T细胞的激活,诱导T细胞 “克隆无能”,使移植物获得特异性抗原的免疫耐受,延长其存活时间。CTLA-4Ig动物模型中已有研究显示CTLA-4Ig可降低皮肤移植[3]、胰岛移植[4]、 肝移植[5]、 心脏移植[6]后移植器官或组织的排斥反应,是一种新型的生物免疫抑制剂,但尚未见CTLA-4Ig单独应用于肾移植的研究。因此,本实验主要研究CTLA-4Ig对大鼠同种异体肾移植移植肾功能的影响,为CTLA-4Ig作为免疫抑制剂应用于临床提供实验依据,现报道如下。
1 材料和方法
1.1 动物、试剂及仪器
大鼠 (长沙瑞凌农业科技有限公司),CTLA-4Ig(BD Pharmingen),大鼠 CTLA-4Ig抗体 (BD Pharmingen),R&D Systems蛋白封闭缓冲液 (Invitrogen),冲洗缓冲液 (Invitrogen),Enzyme conjugate(Invitrogen),substrate solution(Invitrogen),分光光度计 (上海棱光)。
1.2 实验分组
以LEW大鼠作为受体,BN大鼠作为供体。将受体LEW大鼠随机分为四组,每组35只:①对照组:术中给予等体积的生理盐水;②CTLA-4Ig低浓度组:术中给予CTLA-4Ig 1 mg/kg;③CTLA-4Ig中浓度组:术中给予CTLA-4Ig 10 mg/kg;④CTLA-4Ig高浓度组:术中给予CTLA-4Ig 20 mg/kg。给药途径均为腹腔注射。
1.3 同种异体肾移植术
1.3.1 供体BN大鼠肾脏摘取
①切口:腹部正中切口。②游离肾脏:充分游离肾脏前面及肾上极。③分离肾蒂血管:充分将肾下极暴露,显露肾静脉。多个分支的肾静脉很少见,常常在肠系膜上动脉的起点处汇合。小心地分离肾脏后面,向前翻转肾脏,从而使肾动脉充分显露。完成肾蒂解剖时,只有动脉、静脉和输尿管未离断。④分离、切断输尿管:分离输尿管时要注意保护输尿管的血供,防止输尿管缺血坏死。在髂血管交叉水平切断输尿管,用于进行输尿管膀胱吻合。⑤取出肾脏:在肾动脉分叉上方钳夹腹主动脉,然后切断腹主动脉。在肾静脉汇入下腔静脉下方钳夹下腔静脉,然后切断下腔静脉,整块取出两侧肾脏。⑥修剪肾脏,分离左、右肾脏。
1.3.2 受体LEW大鼠肾脏移植
①切口:下腹正中切口。②显露血管:切开皮肤及皮下各层,剪开腹膜。将小肠推向内侧,从而显露后腹膜,剪开后腹膜,便可见下腔静脉及腹主动脉。③吻合血管前准备:侧壁钳分别钳夹下腔静脉和腹主动脉部分血管壁,在钳夹好的下腔静脉和腹主动脉壁上剪一开口,大小适度,用于和供肾静脉、动脉进行吻合。用肝素盐水冲洗管腔。④静脉吻合:作供肾静脉与下腔静脉端侧吻合。用5-0尼龙线连续缝合吻合口。⑤动脉吻合:对肾动脉进行斜切以扩大吻合口。作供肾动脉与腹主动脉端侧吻合。用6-0尼龙线连续缝合吻合口。⑥接通血流供应:先后放开钳夹下腔静脉的侧壁钳和钳夹腹主动脉的侧壁钳。可见肾脏颜色红润,张力恢复,并可见清亮的尿液从输尿管的断端流出。⑦重建尿路:在膀胱底部靠近右侧输尿管开口的外上方大约1~1.5 cm处,剪开一小孔。剪掉多余的输尿管,纵形剪开输尿管断端的一侧,从而扩大输尿管吻合面,有利于进行输尿管膀胱吻合。用5-0可吸收线间断缝合输尿管的断端与膀胱。⑧分离、切除大鼠双侧原位肾脏:分别分离肾脏的前面、后面、上端、下端、肾蒂及输尿管,将两侧肾脏分别取出。
1.4 ELISA法测定血浆CTLA-4Ig浓度
分别于实验前、术后2小时、术后4小时、术后12小时、术后24小时、术后2天及术后3天收集各组大鼠的血液标本于15%EDTA的抗凝试管内。3 600 r/min离心分离血浆。将血浆移至另一无菌试管中,-80℃保存,待测。采用ELISA法检测CTLA-4Ig浓度,具体操作严格按照要求进行。
1.5 检测血清肌酐水平
分别于实验前、术后2小时、术后4小时、术后12小时、术后24小时、术后2天及术后3天收集各组大鼠的血液标本于普通无菌的试管内。3 600 r/min离心分离血清。将血清移至另一无菌试管中,-80℃保存,待测,检测血清肌酐水平。
1.6 统计学分析
2 结果
2.1 大鼠同种异体肾移植模型建立
本实验共完成大鼠同种异体肾移植术150例。成功移植140例,成功率为93.33%。采用供体大鼠肾动脉、肾静脉与受体大鼠腹主动脉、腔静脉行端侧吻合能成功建立大鼠同种异体肾移植模型,此方法简单、可靠。
2.2 ELISA法测定血浆CTLA-4Ig浓度
将实验前、术后2小时、术后4小时、术后12小时、术后 24小时、术后2天及术后3天收集的大鼠血液标本采用ELISA法检测血浆CTLA-4Ig浓度。见表1。
由表中数据可知,实验前,各组大鼠的血浆中均未检测到明显的CTLA-4Ig。在CTLA-4Ig高浓度组、中浓度组、低浓度组中,各时间点的大鼠血浆CTLA-4Ig浓度均随着CTLA-4Ig给药浓度增加而增加,在术后2小时达到高峰,之后逐渐下降。术后3天,CTLA-4Ig低浓度组未检测到CTLA-4Ig,CTLA-4Ig中浓度组和 CTLA-4Ig高浓度组的 CTLA-4Ig浓度均低于 30 ng/mL。
由于各组实验前均未检测到明显的CTLA-4Ig,故只对CT LA-4Ig低浓度组、CTLA-4Ig中浓度组和CTLA-4Ig高浓度组术后不同时间点的血浆CTLA-4Ig浓度值进行分析,经检验均服从正态分布,Levene法方差齐性检验,P均>0.10,认为三组术后不同时间点血浆中CTLA-4Ig浓度值总体方差均齐同,采用LSD法行单因素方差分析,检验水准为0.05,进行两两之间比较,结果见表2。
表1 各组不同时间点的血浆CTLA-4Ig浓度 (±s,ng/mL)
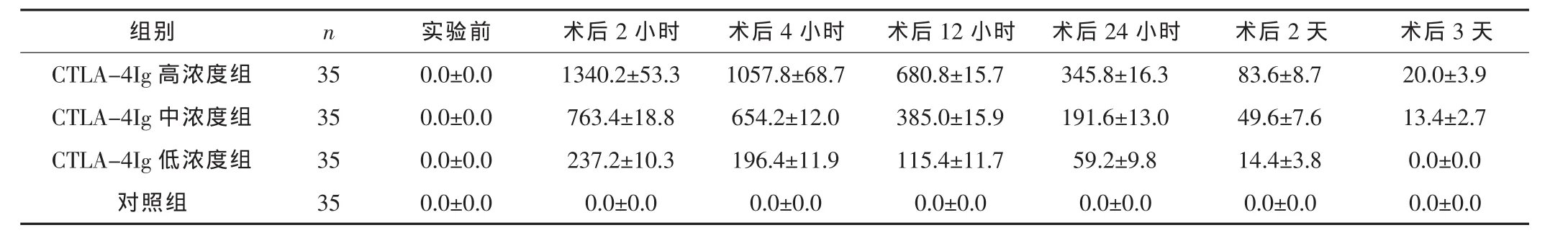
表1 各组不同时间点的血浆CTLA-4Ig浓度 (±s,ng/mL)
组别 n 实验前 术后2小时 术后4小时 术后12小时 术后24小时 术后2天 术后3天CTLA-4Ig高浓度组 35 0.0±0.0 1340.2±53.3 1057.8±68.7 680.8±15.7 345.8±16.3 83.6±8.7 20.0±3.9 CTLA-4Ig中浓度组 35 0.0±0.0 763.4±18.8 654.2±12.0 385.0±15.9 191.6±13.0 49.6±7.6 13.4±2.7 CTLA-4Ig低浓度组 35 0.0±0.0 237.2±10.3 196.4±11.9 115.4±11.7 59.2±9.8 14.4±3.8 0.0±0.0对照组 35 0.0±0.0 0.0±0.0 0.0±0.0 0.0±0.0 0.0±0.0 0.0±0.0 0.0±0.0
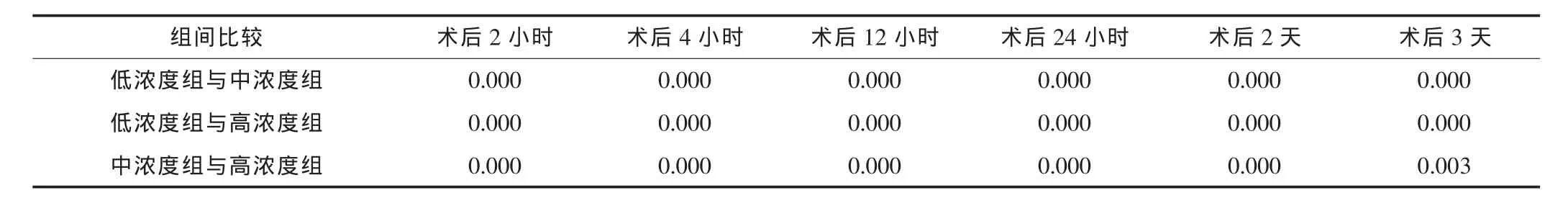
表2 不同时间点三组的血浆CTLA-4Ig浓度两两比较的P值
表3 各组不同时间点血清肌酐值 (±s,μmol/L)
组别 n 实验前 术后2小时 术后4小时 术后12小时 术后24小时 术后2天 术后3天CTLA-4Ig高浓度组 35 67.8±7.9 102.2±9.5 121.4±4.1 106.0±13.3 100.4±12.6 106.4±10.1 98.2±12.5 CTLA-4Ig中浓度组 35 72.4±10.0 121.0±5.6 121.8±4.3 114.4±8.3 106.0±7.4 104.0±8.6 100.6±12.7 CTLA-4Ig低浓度组 35 72.6±11.9 145.6±5.9 185.8±8.5 283.4±10.5 499.0±15.6 662.0±26.3 765.8±62.7对照组 35 69.6±13.8 178.2±7.9 235.6±16.8 367.0±10.2 542.8±18.0 828.2±35.8 1059.6±80.6
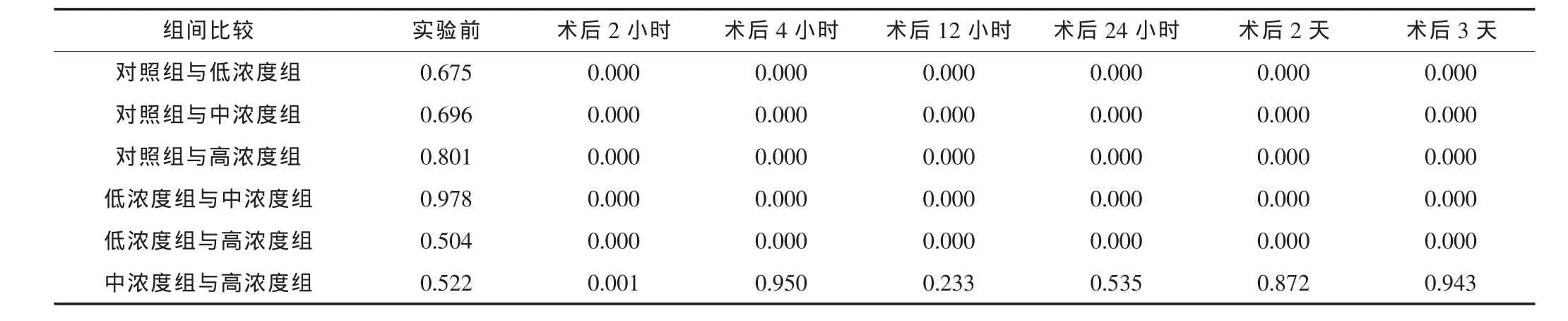
表4 不同时间点四组的血清肌酐两两比较P值
结果提示,术后CTLA-4Ig低浓度组、CTLA-4Ig中浓度组和CTLA-4Ig高浓度组各时间点的血浆CTLA-4Ig浓度值,任意两组比较差异均有统计学意义 (P<0.05)。说明给予不同浓度的CTLA-4Ig,大鼠血浆CTLA-4Ig浓度值随之变化。
2.3 于各个时间点检测各组的血清肌酐水平
分别于实验前、术后2小时、术后4小时、术后12小时、术后24小时、术后2天及术后3天收集血液标本,检测血清肌酐水平。见表3。
由表中数据可知,术前大鼠血清肌酐水平约为70 μmol/L。进行大鼠同种异体肾移植术后,对照组和CTLA-4Ig低浓度组随着术后时间的延长,血清肌酐水平逐渐增高;CTLA-4Ig中浓度组和CTLA-4Ig高浓度组的血清肌酐水平在术后2小时和术后4小时较实验前有稍微的增高,之后的血清肌酐水平一直维持在100 μmol/L左右。
四个实验组各时间点的血清肌酐水平经检验均服从正态分布,Levene法方差齐性检验,P均>0.10,认为四组各时间点的血清肌酐水平总体方差均齐同,采用LSD法行单因素方差分析,检验水准为0.05,进行两两之间比较。结果见表4。
结果提示,实验前,各组大鼠的血清肌酐水平比较差异无统计学意义 (P>0.05);术后2小时,任意两组的血清肌酐水平比较,差异均有统计学意义 (P<0.05);术后4小时及以后,CTLA-4Ig中浓度组和CTLA-4Ig高浓度组的血清肌酐水平比较差异无统计学意义 (P>0.05),其他任意两组的血清肌酐水平比较, 差异均有统计学意义 (P<0.05)。 该结果说明给予CTLA-4Ig 1 mg/kg能够有效地保护同种异体肾移植的移植肾功能,随着浓度的增加,保护作用增加,但达到 CTLA-4Ig 10 mg/kg时保护作用已为最大,再增加给药浓度对移植肾功能保护没有意义。
3 讨论
3.1 器官移植是治疗终末期器官功能衰竭的有效治疗手段之一,排斥反应常导致器官移植失败
目前运用于临床的免疫抑制剂虽然能够较好地防止移植排斥反应,保证移植物在一定时间内存活,但具有诱发肿瘤、机会菌感染、移植物失功等毒副作用,且价格昂贵,需要终身服药,给患者的生理、心理及经济上带来沉重负担[7],例如他克莫司 (tacrolimus,FK506)。虽然FK506具有很强的免疫抑制作用, 但它可引发多种副作用[8], 如移植术后糖尿病(PTDM)、感染等;环孢菌素A也具有较好的免疫抑制作用,但长期用药容易出现肾毒性,引发不可逆的慢性移植肾肾病。因此,积极探寻一种新型的、副作用较小的免疫抑制剂具有重要的临床意义。
3.2 CTLA-4的生物学特性与功能以及CTLA-4Ig对免疫应答的影响
CTLA-4是B7/CD28家族成员。CTLA-4与CD28具有结构上的相似性,两者的DNA水平有70%的同源性,氨基酸水平则有31%的同源性。CTLA-4与CD28均为表达于T细胞表面的跨膜受体[9],且具有相同的配体,即表达在APC表面的B7分子,包括B7-1(CD80)和B7-2(CD86)。CD28与B7分子结合,可协同刺激T细胞激活,而CTLA-4与B7分子结合后会产生强烈的抑制信号,终止 T细胞的增殖与活化[10]。由于CTLA-4对T细胞具有负性调节作用,因此它在介导自身耐受、防止自身免疫疾病和移植排斥反应等方面能够发挥重要的作用[11],可以此为基础进行药物开发研究。
CTLA-4Ig是用基因工程方法将CTLA-4分子胞外功能区与人免疫球蛋白IgG1的重链恒定区重组构建的融合蛋白,它与B7分子具有高度的亲和力,可与CD28竞争结合APC上的B7分子,从而阻断CD28与B7的信号传导通路,抑制T细胞对抗原识别第二信号的产生[12],导致T细胞的免疫失能,诱导对特异性抗原的免疫耐受,延长移植物的存活时间。
3.3 CTLA-4Ig的研究现状
已有许多报道称,利用CTLA-4Ig交联调控共刺激通路对不同疾病中的T细胞激活进行抑制,尤其可治疗临床上的自身免疫疾病, 如系统性红斑狼疮 (SLE)[13]、 重症肌无力[14]等。国外已有研究[15]将可溶型CTLA-4蛋白直接应用于寻常型银屑病的临床治疗中,取得了满意的疗效。此外,CTLA-4Ig动物模型中已有研究表明CTLA-4Ig能够降低皮肤移植、肝移植[16]、 胰岛移植[17]、 心脏移植[18]后移植器官或组织的排斥反应。因此,对共刺激信号进行人工干预调控可抑制T细胞的活化以及抑制B细胞的增殖分化,诱导自身免疫耐受产生[19],因此,调控共刺激信号有望能成为临床治疗免疫性疾病的一种新途径。
本实验进一步证实:①采用供体大鼠肾动脉、肾静脉与受体大鼠腹主动脉、腔静脉行端侧吻合能够成功建立大鼠同种异体肾移植模型。此方法简单、可靠。②对照组大鼠血浆中并未检测到明显的 CTLA-4Ig。在其余三组中,给予不同浓度的CTLA-4Ig,大鼠血浆 CTLA-4Ig浓度值随之变化。③给予CTLA-4Ig 1 mg/kg能够有效地保护同种异体肾移植的移植肾功能,随着浓度的增加,保护作用增加,但达到 CTLA-4Ig 10 mg/kg时保护作用已是最大,再增加给药浓度对移植肾功能保护没有意义。
综上所述,CTLA-4Ig能减轻排斥反应,有效保护大鼠同种异体肾移植的移植肾功能。本实验为CTLA-4Ig作为一种新型的生物免疫抑制剂应用于临床提供了实验依据。
[1] 赵慧,王晶,魏晓丽,等.调节性T细胞相关负性分子与感染免疫[J].免疫学杂志,2012,28(2):169-173.
[2] 马小倩,王佳,王维.CTLA4在T调节细胞诱导异种抗原免疫耐受中的机制研究 [J].激光生物学报,2016,25(4):342-349.
[3] 刘晓杰,高学军,蔡霞,等.CTLA-4Ig联合髓腔内骨髓移植诱导小鼠同种异体皮肤移植耐受的研究 [J].解剖科学进展,2013,19 (3):239-242.
[4] 张剑,张琪,姜楠,等.CTLA4Ig和CD40LIg基因修饰骨髓间充质干细胞在异种胰岛移植排斥反应中的作用 [J].第三军医大学学报, 2011,33(23):2450-2453.
[5] 陆森,李国强,王学浩,等.腺相关病毒载体介导的CTLA4Ig表达对大鼠肝移植免疫抑制作用的实验研究 [J].南京医科大学学报:自然科学版,2005,25(4):224-227.
[6] 王晓亮,彭民浩,杨定华,等.CTLA4-Ig联合骨髓细胞诱导小鼠心脏移植耐受 [J].广西医科大学学报,2008,25(3):361-364.
[7] 王春阳,倪少滨,陈起引.未成熟树突状细胞在移植免疫耐受中的研究进展 [J].国际移植与血液净化杂志,2006,4(3):38-41.
[8] Hooper DK,Fukuda T,Gardiner R,et al.Risk of tacrolimus toxicity in CYP3A5 nonexpressors treated with intravenous nicardipine after kidney transplantation[J].Transplantation,2012,93(8):806-812.
[9] 王凤英.细胞毒性T淋巴细胞相关抗原4的研究进展 [J].国际免疫学杂志,2007,30(1):43-47.
[10]Zhu L,Guo Q,Guo H,et al.Versatile characterization of glycosylation modification in CTLA4-Ig fusion proteins by liquid chromatographymass spectrometry[J].MAbs,2014,6(6):1474-1485.
[11]金海龙.重组免疫毒素CTLA4-ScFv-Mel的构建、制备及活性研究[D].北京:中国人民解放军军医进修学院,2012.
[12]郭怡,蔡常洁.CTLA4 Ig诱导免疫耐受作用的研究进展 [J].国际内科学杂志,2007,34(7):427-431.
[13]Shojaa M,Aghaie M,Amoli M,et al.Association between 318C/T polymorphism of the CTLA-4 gene and systemic lupus erythematosus in Iranian patients[J].Int J Rheum Dis,2014,doi:10.1111/1756-185X.12275.
[14]Gu M,Kakoulidou M,Giscombe R,et al.Identification of CTLA-4 isoforms produced by alternative splicing and their association with myasthenia gravis[J].Clin Immunol,2013,128(3):374-381.
[15]Luszczek W,Majorczyk E,Nockowski P,et al.Distribution of the CTLA-4 single nucleotide polymorphisms CT60G>A and+49A>G in psoriasis vulgaris patients and control individuals from a Polish Caucasian population[J].Int J Immunogenet,2008,35(1):51-55.
[16]Zhu CL,Huang Q,Liu CH,et al.Polymorphisms in the cytotoxic T-lymphocyte antigen 4 gene and acute rejection risk in transplant recipients[J].Mol Biol Rep,2012,39(9):8701-8708.
[17]Pawlick R,Gala-Lopez B,Pepper AR,et al.The combination of anti-NKG2D and CTLA-4 Ig therapy prolongs islet allograft survival in a murine model[J].Am J Transplant,2014,14(10):2367-2374.
[18]Li J,Zhu H,Wang S,et al.Blockade of NKG2D synergized with CTLA4-Ig in promoting long-term graft survival in murine models of cardiac transplantation[J].Transplantation,2012,93(4):356-363.
[19]张颖新,刘雨生.CTLA4及其融合蛋白功能和应用的研究进展 [J].山东医药,2011,51(12):107-108.
(责任编辑:常海庆)
Effect of CTLA-4Ig on Renal Allograft Function in Rat's Kidney Allotransplantation
ZHOU Hao1,2,WANG Fang3,HUANG Jiangbo1,YANG Shaobo1,YU Miao1,ZENG Shun1,ZHU Wenhui1,PAN Ying1
(1Department of Urology Surgery,the Second Affiliated Hospital of Hu'nan University of Chinese Medicine,Changsha 410005,China;2Department of Urology Surgery,the Second Affiliated Hospital of University of South China,Hengyang 421001,China;3Department of Rehabilitation Medicine,Changsha Social Work College,Changsha 410004,China)
Objective To study the effect of CTLA-4Ig on the renal allograft function in rats'kidney allotransplantation,and to provide experimental evidence for the clinical application of CTLA-4Ig as a novel bioimmune inhibitor.MethodsRats'kidney allotransplantation model was established by using BN rats as donor and LEW rats as receptor.Receptor LEW rats were randomly divided into four groups,with 35 rats in each group.①The control group
equal volume of saline during surgery.②The CTLA-4Ig low concentration group received 1 mg/kg of CTLA-4Ig during surgery.③The CTLA-4Ig middle concentration group received 10 mg/kg of CTLA-4Ig.④CTLA-4Ig high concentration group received 20 mg/kg of CTLA-4Ig.All groups were given intraperitoneal injection.The blood samples were respectively collected before surgery,and 2 hours,4 hours,12 hours,24 hours,2 days and 3 days after surgery.The plasma CTLA-4Ig concentration and serum creatinine level were detected.Results No obvious plasma CTLA-4Ig was detected in rats of谈the control group.The plasma CTLA-4Ig concentration changed accordingly when the rats received different concentrations of CTLA-4Ig.1 mg/kg of CTLA-4Ig can effectively protect rats'renal allograft function,and the protective effect increased when the concentration increased. The protective effect was maximum with 10 mg/kg of CTLA-4Ig,then the increased drug concentration was meaningless to the protection of renal allograft function.Conclusions CTLA-4Ig can reduce the reject reaction and effectively protect the renal allograft function in rats' kidney allotransplantation.
CTLA-4Ig;Kidney transplantation;Immune tolerance
R392.4
:A
10.3969/j.issn.1674-4659.2017.09.1205
2017-03-12
2017-05-31
湖南省卫生计生委科研计划课题 (No.C2015-21)
周浩 (1980-),男,硕士学位,副主任医师,研究方向:肾移植。

