抗诺氟沙星单克隆抗体的制备及其性质的研究
徐田丽 苏国成 江晓颖 孙雪珂 江峰


摘要:为了监测诺氟沙星抗生素的滥用,我们开发了一种基于单克隆抗体的酶联免疫方法。将小分子抗原诺氟沙星NOR通过碳二亚胺法与载体蛋白BSA、OVA进行偶联。得到完全抗原NORBSA和NOROVA。用NORBSA对3只雌性小鼠进行免疫后,利用细胞融合技术制备杂交瘤细胞,用间接ELISA法和间接竞争ELISA法筛选阳性细胞进行克隆,得到3株稳定分泌抗体的单克隆细胞株,分别命名为7C4,8G3,11G7。检测细胞的上清液和纯化后的腹水效价,分别为1:512,1:1024,1:1024和1:128000,1:128000,1:128000。对三株细胞的亚型鉴定为IgG2b,IgG2b,IgG1。建立的标准竞争曲线计算得IC50值为31.225 ng,其检测线性范围为 5.011630.95 ng/mL,最低檢出量为2.75 ng。亲和力常数Kaff为4.6×108。诺氟沙星单克隆抗体与环丙沙星(27.22%)、恩诺沙星(11.29%)、奥比沙星(11.03%)、氧氟沙星(9.73%)、达氟沙星(7.38%)、沙拉沙星(2.57%)、二氟沙星(0.61%)几种抗菌药有较低的交叉反应率。
关键词:诺氟沙星;单克隆抗体;间接竞争酶联免疫吸附试验;性质
Abstract: To monitor the abuse of Norfloxacin (NOR), developing a monoclonal antibody (mAb) based enzyme linked immunosorbent assay (ELISA) is our future goal.The small molecule antigen NOR was conjugated with BSA and OVA proteins by EDC method.Then NORBSA conjugate and NOROVA can be obtained.Three female mice were immunized by NORBSA conjugate.And the hybridoma cell lines were obtained by cell fusing technology.Positive cells were screened by indirect ELISA and indirect competitive ELISA.Finally, three hybridoma cell lines named 7C4, 11G7 and 8G3 were screened out.The titer of cell culture supernatant and the ascites titer after purification of three hybridoma cell lines were 1:512, 1:1024, 1:1024 and 1:128000, 1:128000,1:128000 respectively.The subtypes of three cells were IgG2b, IgG2b, IgG1.The competition standard curve was developed by indirect ELISA, the half maximal inhibitory concentration(IC50) was 31.225 ng, the detection of linear range was 5.011 ng ~ 630.95 ng, and the detection limit was 2.75 ng.The affinity constant Kaff was 4.6×108.There have low crossreactivity between ciprofloxacin (27.22%), enrofloxacin (11.29%), orbifloxacin (11.03%), ofloxacin (9.73%), danofloxacin (7.38%), sarafloxacin (2.57%), difloxacin (0.61%) antimicrobial agents.
Key words:Norfloxacin;Monoclonal antibody;Indirect competitive ELISA;Characterization
随着经济的发展,人们生活水平提升了许多,对于肉、蛋、奶及相关副食品的数量和质量也提出了更高的要求。兽药在保障动物性食品供应上,发挥着不可替代的作用[1]。氟喹诺酮类原料药(FQs)是第三代合成抗生素,其具有光谱抗菌性,广泛用于在畜牧业和人类的各种疾病的预防和治疗[2]。由于他们可以进入食物链和导致细菌的耐药性,而对人类的健康存在潜在的危险。诺氟沙星(NOR)是一种合成氟喹诺酮类抗生素,通过破坏消化道内致病细菌的DNA螺旋酶,防止细菌DNA复制,因此达到抗菌性,针对许多致病性革兰氏阴性菌和革兰氏阳性菌,包括耐庆大霉素、绿脓假单胞菌和抗药性金黄色葡萄球菌[3]。NOR广泛用于治疗呼吸道和尿路感染、眼睛和皮肤感染、腹泻等[4]。尽管如此,NOR作为临床上重要的应用药物,它会导致一些副作用,例如头痛、头晕、恶心和呕吐[5]。鉴于他们的毒性和副作用,欧盟、美国、日本,和联合国粮农组织(FAO)和中国建立了FQs在不同动物食品中的最大残留量[6]。欧盟通过欧共体理事会条例,规定恩诺沙星(环丙沙星)的最大残留量100ug/kg,氟甲醛的最大残留量为50ug/kg,马波沙星为75ug/kg,達氟沙星为35ug/kg(03/2004)[7]。目前,氟喹诺酮类药物残留的主要检测方法有:微生物法[8],高效液相色谱法(HPLC)[9],免疫分析法[10],超高效液相色谱质谱连用法(LCMS)[11],高效毛细管电泳法(HPCE)[12],化学发光分析法(CL)[13],酶联免疫吸附测定法(ELISA)[14],免疫荧光测定法(IFA)[15],免疫亲和色谱法(IAC)[16],及胶体金免疫测定法(CGIA)[17]等。近年来,酶联免疫吸附试验已经广泛应用于环境和农业方面进行微量残留的筛选分析。相比其他方法,ELISA 需要更少的时间和样品准备,且适用于广大基层检测单位现场检测。ELISA试剂盒的研发也为喹诺酮类药物的残留监测提供了更大的方便。免疫学分析方法是基于抗原抗体特异性反应,具有操作简单、特异性强、灵敏度高的特点,并且可快速的检测多种样品。因此,本实验通过制备抗NOR单克隆抗体的免疫学分析方法,检测样品中的NOR的含量,具有重要的意义。通过抗原合成和动物免疫,细胞融合和筛选实验制备杂交瘤细胞株,并根据竞争抑制ELISA原理,以分泌的单克隆抗体建立了检测诺氟沙星残留的竞争抑制ELISA方法。
1 材料与方法
1.1 材料
1.1.1 主要试剂
诺氟沙星、环丙沙星、恩诺沙星、奥比沙星、氧氟沙星、达氟沙星、沙拉沙星、二氟沙星购于上海安谱实验科技股份有限公司。牛血清白蛋白(BSA)购于生工生物有限公司,鸡血清白蛋白(OVA)购于Sigma公司,诺氟沙星(NOR)标准品购于上海安谱实验科技股份公司。N,N-二甲基甲酰胺(DMF),乙基碳二亚胺(EDC),N羟基琥珀酰亚胺(NHS)。RPMI1640 基础培养基、HAT(50×)、HT(100×)以及抗生素(青霉素,链霉素)均购自Gibco公司,弗氏完全(不完全)佐剂购自Sigma公司,PAA优等级胎牛血清,羊抗鼠 IgGHRP 結合物(二抗)购自北京中杉公司。
1.1.2 主要仪器
生物安全柜,HH6数显恒水浴锅,酶标仪,恒温二氧化碳培养箱,TDL5低速台式离心机,紫外分光光度计,倒置显微镜
1.1.3 实验动物及骨髓瘤细胞
BALB/c雌性小鼠(8周龄)购于上海斯莱克动物中心。小鼠骨髓瘤细胞SP2/0来自厦门大学。
1.2 人工抗原制备与鉴定
方法参考文献[18],诺氟沙星分子中带有羧基,采用优化的碳二亚胺法制备人工抗原,利用EDC,将诺氟沙星与牛血清白蛋白BSA或鸡血清白蛋白OVA中的氨基偶联起来,制备人工抗原NORBSA和NOROVA。采用文献[19]中的方法,用1×TAE工作液配制凝胶糖凝胶。交联产物NORBSA和BSA载体蛋白各15 μL,与上样缓冲液等体积混匀上样。设置时间30 min,电压50 V跑胶。取出琼脂糖凝胶块,用考马斯亮蓝R250染色液染色5h。回收考马斯亮蓝R250染色液,并加入脱色液脱色,直到条带清晰为止。人工抗原通过紫外光谱扫描和红外光谱扫描鉴定。
1.3 小鼠免疫
取雌性BALB/c小鼠(8周龄)3只,首免将100ug免疫抗原NORBSA和弗式完全佐剂溶液等体积混合,用注射器进行乳化。乳化完全后,皮下多点进行注射免疫雌性BALB/c小鼠,每只200ul。每隔两周对小鼠再次免疫,用50ug免疫原和弗式不完全佐剂溶液混合。免疫4次后,进行尾部取血测效价,血清收集于250ul的离心管中,37℃水浴锅中孵育30min,按照间接ELISA的方法来测定小鼠的效价。血清的效价达到1:8000以上,腹腔注射100ugNORBSA加强免疫BALB/c小鼠,200ul/每只。3天后无菌取脾细胞进行细胞融合。
1.4 细胞融合与杂交瘤细胞的筛选
取一只效价在1:8000以上的并且加强免疫的BALB/c小鼠,摘眼球放血,无菌研磨脾脏制备脾细胞,与SP2/0骨髓瘤细胞用37℃预热的PEG1450进行融合,速度由慢到快,边滴加边摇晃离心管,使细胞充分融合,并在其中加入饲养细胞。混合细胞悬液加入96孔板中,每孔200 μL。将96孔板置于37℃、5%CO2培养箱中培养。在5~7天时,出现肉眼可见的克隆或在倒置显微镜下可观察到杂交瘤细胞布满孔底的1/5面积时就可检测抗体。标出只有单个克隆长出的孔,取上清用非竞争ELISA方法检测杂交瘤细胞的效价。挑选细胞集落较少,状态良好,细胞上清检测效价比较高的细胞培养孔,采用有限稀释法,进行亚克隆筛选。将检测为阳性孔的杂交瘤细胞进行扩大培养,分别用48孔板,24孔板,12孔板,6孔板培养。大约经过3~4次的亚克隆,就可以筛选到效价稳定的单克隆细胞株,将其冻存在液氮中。
1.5 腹水制备和抗体纯化
选择两只8周龄Balb/c雌性小鼠,体内注射0.5ml的液体石蜡油致敏,一周后将处于对数生长期的7C4杂交瘤细胞,约1×106个/mL细胞接种于致敏后的小鼠腹腔内。待第7天左右开始密切观察小鼠的腹水及存活情况,如果活力佳,有明显移动性腹水,可以放腹水2次左右;若发现小鼠活动受限,要立即处死放腹水。收集腹水用辛酸硫酸铵沉淀法纯化,SDSPAGE 凝胶电泳分析纯化结果。
1.6 抗诺氟沙星单克隆抗体特性的鉴定
1.6.1 单克隆抗体细胞亚类鉴定
利用抗体亚类鉴定试剂盒对抗诺氟沙星单克隆抗体进行亚型的鉴定,将试剂盒放在室温30 min,取出试剂盒中IgM,IgG2a,IgG2b,IgG1,IgG3,IgA6个试剂,并将它们各自按1:1000倍进行稀释,各孔加入上述的各类试剂(100 μL /孔)。37℃,1 h。洗板后,加入5%的PBSM封闭液200 uL,37℃封闭2 h。其余操作步骤同间接ELISA。
1.6.2 单克隆抗体效价的测定
间接ELISA法测定单抗体的细胞上清液效价。以NOROVA的最佳抗原稀释度包被,对待测的单克隆抗体细胞培养上清液进行倍比稀释,每孔100 μL加入酶标板中。阳性对照以空白小鼠的血清作对比,阴性对照以骨髓瘤细胞的上清液为对照。
1.6.3 单克隆抗体与载体蛋白的交叉反应性
用包被缓冲液将载体蛋白BSA、OVA和抗原NORBSA、NOROVA各自稀释到相同浓度进行包被。一抗加入稀释好的单克隆抗体,酶标仪测定450nm下的OD值。
1.6.4 单克隆抗体亲和力的测定
单克隆抗体亲和力常數Kaff,依据Batty饱和法测定[20]。按照iELISA测效价方法包被抗原NORBSA,包被浓度依次为0.25 μg/mL、0.5 μg/mL、1 μg/mL、2 μg/mL,包被过夜。一抗为倍比稀释的纯化抗体。亲和力的计算公式为:
1.7 标准竞争曲线的绘制
用方阵滴定法测定包被抗原(NOROVA) 和单克隆抗体的最佳工作浓度,选择是OD值为1.0左右的单抗浓度作为最佳工作浓度。通过加入不同浓度的NOR标准品,竞争一定浓度的抗原,建立 NOR 竞争标准曲线,计算IC50。具体方法为:竞争NOR浓度分别为 0、1.9531、3.9023、7.8125、15.625、31.25、62.5、125、250、500、1000 ng/ mL,横坐标代表NOR标准品竞争浓度的对数值,纵坐标代表诺氟沙星的抑制率(B/B0),绘制标准抑制曲线。根据 B/B0值和曲线方程计算NOR的浓度,算出的最低的NOR浓度就是最低检出限。抑制率达到90%时所对应的NOR的浓度就是最低检出限。抑制率为20%80%之间所对应的NOR浓度就是检测的线性范围。
1.8 NOR单抗与结构类似物的交叉反应性
用包被缓冲液以最佳抗原稀释度包被抗原NOROVA,分别设置不同浓度的诺氟沙星,氧氟沙星,奥比沙星,环丙沙星,恩诺沙星,沙拉沙星,二氟沙星,氧氟沙星共八种喹诺酮类药物作为竞争抗原,用间接竞争ELISA测不同药物对抗NOR单克隆抗体的抑制率。根据公式计算诺氟沙星与其它几种FQs结构类似物的交叉反应率:
交叉反应率(CR%)= IC50诺氟沙星/IC50反应物×100%
2 结果
2.1 完全抗原偶联物的鉴定
完全抗原在琼脂糖凝胶中电泳的结果如图1所示。当NOR与载体蛋白BSA交联后,其迁移速度比载体蛋白BSA快,表明BSANOR的分子量大于BSA,证明偶联成功。从电泳结果看,偶联产物的电泳迁移与载体蛋白存在明显的差异,且偶联产物的迁移速度比载体蛋白快。
2.2 小鼠免疫
小鼠经过5次免疫,采血后分析每只小鼠的血清效价。加强免疫后3只小鼠的血清效价都达到 1:64000 以上,其中1号和2号小鼠的效价在1:8000时可达到1.0 以上,3号小鼠的效价较低。因此选择的小鼠1进行细胞融合。经间接ELISA实验,结果证明人工抗原刺激小鼠产生的抗血清对诺氟沙星的具有良好的特异性反应。
2.3 杂交瘤细胞株的筛选
细胞融合一周后观察效果,用间接竞争ELISA 检测细胞上清,测得融合率阳性率高达90%。挑选细胞集落较少,状态良好,细胞上清检测效价OD值比较高的10孔细胞培养孔进行克隆,经过有限稀释法四次亚克隆后,筛选出3 株分泌稳定抗体的杂交瘤细胞株,分别命名为7C4、11G7和8G3。
2.4 单克隆抗体性质的研究
2.4.1 单克隆抗体亞型鉴定
利用抗体亚类试剂盒,对3个单抗细胞株的亚类进行鉴定,由实验结果得知:7C4、11G7、8G3细胞株的亚型,分别为:Ig2b,Ig2b,IgG1型。
2.4.2 单克隆抗体细胞效价的测定
利用间接ELISA的方法检测不同杂交瘤细胞细胞株分泌的单克隆的效价。由实验结果得知:细胞株7C4、11G7和8G3的效价分别为1:512,1:1024,1:1024。纯化之后的抗体效价达到1:128000,1:128000,1:128000。
2.4.3 单克隆抗体与载体蛋白的交叉反应性
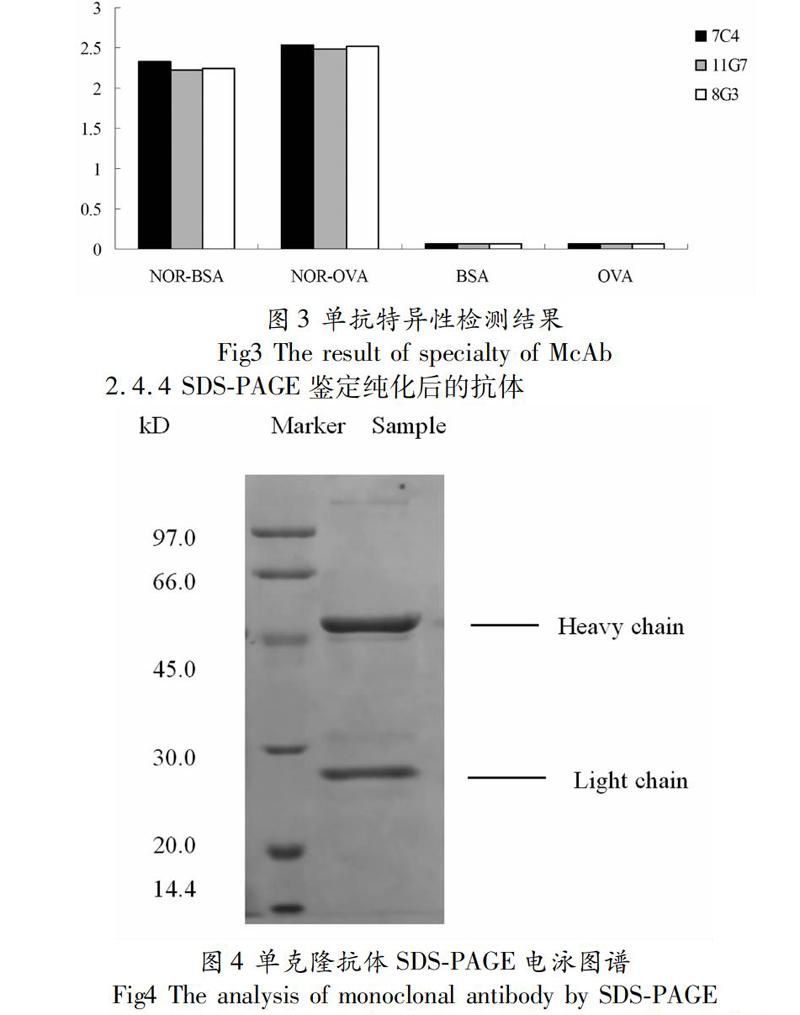
实验结果得知:用载体蛋白BSA以及OVA包被酶标孔,ELISA检测杂交瘤细胞上清效价接近于0,而用NORBSA、NOROVA包被酶标孔,ELISA检测2株单抗细胞株都显示出一定的效价。由此得知:筛选得到的单抗细胞株与载体蛋白无交叉反应,具有很高的特异性。
2.4.4 SDSPAGE鉴定纯化后的抗体
腹水经辛酸硫酸铵纯化后,用SDSPAGE检测显示纯化后的单抗有两条条带,一条条带的分子量约在25 kD为轻链,一条是分子量约为50 kD的重链,达到純化要求。腹水纯化后的蛋白质经BCA法测得含量为10.1mg/mL。
2.5 检测NOR的间接竞争ELISA 方法的建立
2.5.1 包被抗原与单克隆抗体最佳工作浓度的测定
依据抗原抗体用量最省的原则,选择OD值为1.0左右的值为抗原和抗体的最大稀释倍数。通过方阵滴定法,确定包被抗原NORBSA最佳工作浓度为0.22ug/ml,单克隆抗体的组价稀释倍数为1:64000。
2.5.2 单克隆抗体的标准竞争曲线的绘制
杂交瘤细胞株7C4的单抗竞争抑制曲线如图5。从Origin8.0软件分析的数据可以看到,NOR的标准曲线图上,曲线方程为y=0.29358x+1.0293,R2=0.99136,IC50值为31225ng,其检测线性范围为 5.011ng~630.95ng,最低检测线为2.75ng。 通过非竞争ELISA法测定细胞株的亲和力常数。测得杂交瘤细胞株7C4的亲和力KAff常数为4.6×108。
2.5.3 单克隆抗体特异性测定
将抗NOR抗体与几种其他药物进行交叉反应性检测,由下表结果表示,抗NOR 抗体与诺氟沙星(100%)、环丙沙星(42.82%)、恩诺沙星(17.74%)、奥比沙星(15.30%)、氧氟沙星(11.61%)、达氟沙星(17.35%)、沙拉沙星(4.378%)、二氟沙星(0.963%)几种抗菌药均有交叉反应率,这说明该免疫学方法可同时检测8种FQs兽药残留。
3 讨论
本实验通过抗原合成和动物免疫,细胞融合和筛选实验,获得了3株杂交瘤细胞株,并根据竞争抑制ELISA原理,以7C4分泌的单克隆抗体建立了检测诺氟沙星残留的竞争抑制ELISA方法。制备的单抗对喹诺酮类药物中的其他药物具有良好的识别性能,能够满足中国与欧盟等地区对氟喹诺酮类药物残留的检测要求。国内外已有制备喹诺酮类相关文献的报道,如刘庆堂等[21]通过碳二亚胺法制备的诺氟沙星单克隆抗体细胞株,其IC50为2.52 μg/L,而本文所得的单克隆抗体的IC50为31.225 ng/mL,最低检测限2.75 ng/mL,相对较高。本文筛选得到的诺氟沙星单克隆抗体可以与七种喹诺酮类药物,环丙沙星、恩诺沙星、奥比沙星、氧氟沙星、达氟沙星、沙拉沙星、二氟沙星交叉反应率较高。对诺氟沙星的分子结构分析,诺氟沙星(NOR)具备第三代喹诺酮类结构的共同特征:在萘啶环的6位C原子和7位C原子上分别引入一个氟原子和哌嗪环,这些基团的引入沙星类抗菌素的抗菌活性不断增强[22,23],并且抗菌谱也拓宽了。因此在保留NOR特征结构的原则下,选择诺氟沙星3位碳原子上的羧基与载体蛋白偶联,保留了抗菌活性。但是也由于诺氟沙星具有共同结构,所以由细胞融合实验制得的单克隆抗体与其他各类喹诺酮类药物有很大的交叉反应性,因此可同时检测其他八种兽药残留。Jiang等[8]制备的诺氟沙星抗体除了对培氟沙星(33.6%)和洛美沙星(21.8%)有略高的交叉反应率,除此之外对其他的类似物反应率较低。刘庆堂[24]等研究的NOR MAb 对二氟沙星和沙拉沙星有较小的交叉反应性,李超英[21]等研制的NOR抗体与环丙沙星、培氟沙星、依诺沙星、恩诺沙星和洛美沙星具有较高的交叉反应率。在另一篇报道中,NOR半抗原在哌嗪环上含有一个氨基,通过引入氨基和载体偶联在一起。因此产生的抗体可以识别13种喹诺酮药物[25]。在这种情况下,喹诺酮的共同的结构被导入到免疫系统,因此得到的抗体表现出广泛的特异性。
4 結論
本研究以细胞融合技术制备得到抗NOR的单克隆抗体,最后筛选出三株命名为7C4,11G7,8G3的杂交瘤细胞株,亚型鉴定分别为IgG2b,IgG2b,IgG1。在方阵滴定法的基础上,建立了间接竞争ELISA方法。建立的icELISA 标准曲线的线性检测范围为5.011~630.95ng,最低检测限和IC50值分别为2.75ng和31.225ng。单抗与其它八种结构类似物有交叉反应性。
参考文献:
[1]张家禾,孟婷,周作红,等.动物性食品中氟喹诺酮类药物残留检测方法的研究进展[J].中国畜牧兽医,2014,05:262-266.
[2]Meng Z, Shi Z, Liang S, et al. Residues investigation of fluoroquinolones and sulphonamides and their metabolites in bovine milk by quantification and confirmation using ultra-performance liquid chromatographytandem mass spectrometry[J].Food chemistry, 2015, 174: 597-605.
[3]Agrawal B, Chandra P, Goyal R N, et al. Detection of norfloxacin and monitoring its effect on caffeine catabolism in urine samples[J]. Biosensors and Bioelectronics, 2013, 47: 307-312.
[4]Chen Z, Zhang T, Han Y, et al. Resonance light scattering spectroscopy study of interaction between norfloxacin and calf thymus DNA and its analytical application[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2006, 65(3): 919-924.
[5]Liu Y Z, Zhao G X, Liu J, et al. Synthesis of novel haptens against ciprofloxacin and production of generic monoclonal antibodies for immunoscreening of fluoroquinolones in meat[J]. Journal of the Science of Food and Agriculture, 2013, 93(6): 1370-1377.
[6]Hu G, Sheng W, Zhang Y, et al. A novel and sensitive fluorescence immunoassay for the detection of fluoroquinolones in animal-derived foods using upconversion nanoparticles as labels[J].Analytical and bioanalytical chemistry,2015,407(28): 84878496.
[7]Jinqing J, Haitang Z, Yonghua Q, et al. Production and Characterization of Monoclonal Antibodies against Norfloxacin[J]. Procedia Environmental Sciences, 2011, 8: 529-535.
[8]Kim D P, Degand G, Douny C, et al. Preliminary Evaluation of Antimicrobial Residue Levels in Marketed Pork and Chicken Meat in the Red River Delta Region of Vietnam[J].Food and Public Health, 2013, 3(6): 267-276.
[9]Zhou M, Peng J, He R, et al. High performance liquid chromatography coupled with resonance Rayleigh scattering for the detection of three fluoroquinolones and mechanism study[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2015, 136: 1181-1187.
[10]Mi T, Wang Z, Eremin S A, et al. Simultaneous determination of multiple (fluoro) quinolone antibiotics in food samples by a one-step fluorescence polarization immunoassay[J]. Journal of agricultural and food chemistry, 2013, 61(39): 9347-9355.
[11]Meng Z, Shi Z, Liang S, et al. Residues investigation of fluoroquinolones and sulphonamides and their metabolites in bovine milk by quantification and confirmation using ultra-performance liquid chromatographytandem mass spectrometry[J].Food chemistry, 2015, 174: 597-605.
[12]周梅仙,周业飞,刘文琪,等.高效毛细管电泳法分离检测鸡蛋中3种喹诺酮类抗菌药[J].西北农业学报,2013,03:38-43.
[13]Schneider M J, Yun L, Lehotay S J. Terbium-Sensitised Luminescence Screening Method for Fluoroquinolones in Beef Serum[J].Food Additives & Contaminants:Part A,2013,30(4): 666-669.
[14]Tochi B N, Khaemba G, Isanga J, et al. Monoclonal Antibody for the Development of Specific Immunoassays to Detect Enrofloxacin in Foods of Animal Origin[J]. Food and Agricultural Immunology, 2016, 27(4): 435-448.
[15]Hu G, Sheng W, Zhang Y, et al. A novel and sensitive fluorescence immunoassay for the detection of fluoroquinolones in animal-derived foods using upconversion nanoparticles as labels[J].Analytical and bioanalytical chemistry, 2015, 407(28): 8487-8496.
[16]趙思俊,鄭增忍,曲志娜,等.免疫亲和色谱-HPLC-FLD法测定动物肝脏中10种喹诺酮类药物残留[J].分析化学,2009,03: 335-340.
[17]魏东,刘英.氟喹诺酮类药物残留多元快速检测试纸条的研制[J].核农学报,2012,09:1278-1283.
[18]李超英,姜金庆.诺氟沙星单克隆抗体的制备及初步应用[J].食品工业科技,2011,09:210-213.
[19]凌素美.抗伏马菌素B_1单克隆抗体的制备及其性质的鉴定[D].福建农林大学,2012.
[20]Wang Y,Guo Z,Li Y,et al.Production and Characterization of Anti-Estrone Monoclonal Antibody[J].Biomedical and Environmental Sciences,2002,15:103-112.
[21]刘庆堂,职爱民,李青梅,等.诺氟沙星单克隆抗体的制备及其特性鉴定[J].中国预防兽医学报,2010,9:716-720.
[22]胡瑞定.喹诺酮钯化合物合成、抗癌活性及邻菲咯啉金属配合物与DNA作用的光谱学研究[D].杭州:浙江大学,2007.
[23]叶发青,丁友梅,叶松,等.诺氟沙星衍生物的合成及其抗菌活性研究[J].中国药物化学杂志,2003,03:14-16+2.
[24]刘庆堂,职爱民,李青梅,柴书军,赵东,张磊,邓瑞广,张改平.诺氟沙星单克隆抗体的制备及其特性鉴定[J].中国预防兽医学报,2010,09:716-720.
[25]Li Y,Ji B,Chen W,et al.Production of New Class-Specific Polyclonal Antibody for Determination of Fluoroquinolones Antibiotics by Indirect Competitive ELISA[J].Food and Agricultural Immunology,2008,19(4):251-264.
基金项目:厦门市海洋经济创新发展区域示范项目(14CZP047HJ21)、(13PZP002SF24),教育部留学回国人员科研启动基金(201507030002),福建省教育厅中青年教师教育科研项目(JA15276)
作者简介:徐田丽(1992-),女,硕士研究生,研究方向:微生物。
通讯作者:苏国成(1962-),男,教授,研究方向:应用微生物、食品安全、食品生物技术。

