术前营养支持对腹腔镜结直肠癌根治术后免疫功能和并发症的影响
杜一鸿 刘云莉 李明杰
doi:10.3969/j.issn.1002-7386.2017.21.014
术前营养支持对腹腔镜结直肠癌根治术后免疫功能和并发症的影响
杜一鸿 刘云莉 李明杰

结直肠肿瘤;术前营养支持;免疫功能
结直肠癌是常见的消化系统恶性肿瘤之一,发病多在40岁以后,男女之比为2∶1,在所有恶性肿瘤中发病率位居第三,且随着我国老龄化的日趋严峻,其患病率、病死率均呈逐年上升趋势[1]。恶性肿瘤是一种消耗性疾病,大多患者均存在不同程度的营养不良和免疫力低下,而手术的创伤和应激以及术后短期饮食摄入受限往往会使其进一步加重[2]。而营养不良与术后切口感染、肺部感染等并发症发生密切相关,使患者术后康复受到严重的不良影响[3]。研究报道,约20%的肿瘤患者直接因营养不良致死[4]。因此,腹腔镜结直肠癌根治术前予以积极的营养支持改善患者营养状态和免疫功能对降低术后并发症发生率,促进患者康复显得尤为重要。本研究通过术前对患者进行营养支持,观察其对患者术后营养、免疫状况及胃肠功能恢复的影响,以期为临床合理开展营养支持治疗提供参考依据。
1 资料与方法
1.1 一般资料 选取2015年2月至2016年8月在我院肿瘤外科择期行腹腔镜结直肠癌根治术治疗的患者128例,根据患者术前有无行营养支持治疗分为干预组和对照组,每组64例。2组患者在性别、年龄、BMI、肿瘤位置、肿瘤分化程度、组织学类型和TNM分期等一般资料比较,差异均无统计学意义(P>0.05)。见表1。

表1 2组患者一般资料比较 n=64,例(%)
1.2 纳入与排除标准
1.2.1 纳入标准:①术前影像学检查未发现远处转移,具备择期腹腔镜结直肠癌根治术指征,术后经病理活检证实为结直肠癌;②TNM分期为Ⅱ~Ⅳ期;③术前或术后1周内未进行放疗、化疗;④年龄18~75岁,体重指数(body mass index,BMI)<35 kg/m2;⑤近两周内未使用清蛋白、免疫增强药物或激素替代治疗;⑥本研究经我院医学伦理委员会审核和批准实施,所有患者或其家属均经研究相关人员详细讲解本研究相关事项,自愿参加并签署书面知情同意书。
1.2.2 排除标准:①结直肠癌根治术后复发癌;②合并免疫系统、内分泌系统疾病或心、肝、肺、肾等重要脏器功能不全;③糖尿病或术前患有感染性疾病;④严重营养不良;⑤患者或其家属自行要求退出本试验。
1.3 方法 2组患者均择期行腹腔镜结直肠癌根治术,术前1 d改流质饮食。干预组患者自术前5 d起,在原有日常饮食的基础上,予以肠内营养剂瑞能(华瑞制药有限公司)口服,约100.00 kJ·kg-1·d-1,分多次口服。对照组患者不作干预,继续日常饮食。2组患者术后予以肠胃营养管灌注能全力[纽迪希亚制药(无锡)有限公司],手术后当天予以500 ml/d,以50 ml/h 的流速灌注;次日予以1 000 ml/d,以75 ml/h 的流速灌注;第3~7天予以1 500 ml/d,以100 ml/h 的流速灌注。
1.4 观察指标
1.4.1 营养状况:分别于术前、术后8 d采用营养风险筛查评分简表(Nutrition risk screening,NRS2002)[5]评估2组患者营养状况,该简表包括营养状况受损、疾病的严重程度、年龄等三个部分,总分为0~7分,分数越高,存在营养不良的风险越大。

1.4.3 术后恢复情况:记录2组患者术后肛门排气时间、下床活动时间、住院时间,并进行组间比较。
1.4.4 并发症发生情况:记录2组患者术后并发症发生情况,包括切口感染、尿路感染、腹腔感染、呼吸道感染、吻合口瘘等。

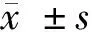
2 结果
2.1 2组患者术前、术后营养状态变化 术前,2组患者NRS2002简表评分比较,差异无统计学意义(P>0.05);术后8 d,2组患者NRS2002简表评分均较术前明显升高,但干预组患者NRS2002简表评分明显低于对照组,差异均有统计学意义(P<0.05)。见表2。
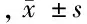
表2 2组患者术前、术后NRS2002简表评分比较 n=64,分
注:与术前比较,*P<0.05



组别IgA(g/L)IgG(g/L)IgM(g/L)CD+4/CD+8干预组 术前1.74±0.3511.35±2.280.96±0.221.64±0.34 术后8d1.90±0.54∗#11.47±2.34#0.96±0.21#1.65±0.35#对照组 术前1.78±0.3711.40±2.310.98±0.231.65±0.38 术后8d1.62±0.36∗9.82±1.69∗0.84±0.17∗1.48±0.33∗
注:与术前比较,*P<0.05;与对照组比较,#P<0.05
2.3 2组患者术后肛门排气时间、下床活动时间和术后住院时间比较 2组患者术后肛门排气时间、下床活动时间比较,差异均无统计学意义(P>0.05),但干预组患者术后住院时间明显短于对照组患者,差异有统计学意义(P<0.05)。见表4。


组别肛门排气时间(h)下床活动时间(h)术后住院时间(d)干预组62.40±9.6533.38±6.8212.15±2.26对照组65.13±10.1235.85±7.5415.39±2.47t值1.5601.9447.742P值0.0770.0620.001
2.4 2组患者术后并发症发生率比较 干预组患者术后并发症发生率为10.94%(7/64),对照组为25.00%(16/64),差异有统计学意义(χ2=4.393,P<0.05);2组患者各并发症发生率比较,差异均无统计学意义(P>0.05)。见表5。

表5 2组患者术后并发症发生率比较 n=64,例(%)
3 讨论
3.1 术前营养支持对腹腔镜结直肠癌根治术后营养状态的影响 已有较多的研究证实结直肠癌患者普遍存在营养风险[6,7]。黄彪等[8]采用NRS2002评估结直肠癌患者的术前营养状态,结果显示672例结直肠癌患者中营养风险的发生率为20.4%,且年龄超过65岁者营养风险的发生率显著升高。营养不良可加重病情,对预后及临床结局均有很大的不良影响[9]。因此,腹腔镜结直肠癌根治术前予以积极的营养支持可有效改善营养风险造成的不良结局。本研究结果显示,术后8 d,2组患者NRS2002简表评分均较术前明显升高,但干预组患者NRS2002简表评分明显低于对照组,差异均有统计学意义(P<0.05)。本研究结果证实手术创伤和应激可进一步加重患者营养风险,而术前营养支持有利于维持患者营养状态,降低其术后营养风险,对改善预后具有一定的意义。

3.3 术前营养支持对腹腔镜结直肠癌根治术后并发症发生的影响 研究表明,营养风险与恶性肿瘤术后并发症的发生密切相关[17,18]。陆莉等[19]研究报道,术前有营养风险的喉癌患者术后并发症发生率明显高于术前无营养风险者,可见术前予以营养支持纠正营养不良状态对减少术后并发症的发生具有一定的意义。本研究结果显示,干预组患者术后并发症发生率明显低于对照组患者,与Jie等[20]研究结果基本一致。分析其原因为术前营养支持可改善腹腔镜结肠癌根治术患者营养状态,可增强肌肉活力,有利于切口愈合,进而减少切口感染的发生;同时术前营养支持还可改善机体免疫功能,增强中性粒细胞、巨噬细胞和淋巴细胞的功能,减少尿路感染、呼吸道感染和腹腔感染等并发症的发生。此外,本研究结果显示干预组患者术后住院时间明显短于对照组患者,差异有统计学意义(P<0.05),表明术前营养支持有利于维持患者营养状态,减轻免疫抑制,进而促进患者的康复,缩短住院时间。本研究中,干预组和对照组间术后肛门排气时间、下床活动时间比较,差异无统计学意义(P>0.05),分析其原因可能与影响术后胃肠道功能恢复的因素较多和研究例数相对较少有关。
1 丘嘉煌,李燕,李科,等.广州市2004—2013年结直肠癌发病趋势分析.广东医学,2016,37:3334-3337.
2 傅平,周凯,徐连强,等.营养风险筛查在胃肠肿瘤患者围手术期中的应用.广东医学,2014,35:3681-3683.
3 陈晓秋,李柱,胡阳春,等.消化道恶性肿瘤患者营养风险、营养状况与炎症因子的相关性及其对临床结局的影响.广东医学,2015,36:1505-1508.
4 Ottery FD.Rethinking nutritional support of the cancer patient:the new field of nutritional oncology.Semin Oncol,1994,21:770-778.
5 Orell-Kotikangas H,Österlund P,Saarilahti K,et al.NRS-2002 for pre-treatment nutritional risk screening and nutritional status assessment in head and neck cancer patients.Support Care Cancer,2015,23:1495-1502.
6 郭添羽,黄昌浩,袁伟杰,等.术前营养风险筛查对胃癌和结肠癌患者围手术期营养支持的临床意义.中国现代医学杂志,2016,26:119-123.
7 梁涛,印义琼,钟静,等.胃肠道肿瘤病人营养风险的筛查.肠外与肠内营养,2012,19:218-219,222.
8 黄彪,王琦三.结直肠癌患者营养风险筛查和营养支持状况研究.中国全科医学,2014,17:656-658.
9 Kwag SJ,Kim JG,Kang WK,et al.The nutritional risk is a independent factor for postoperative morbidity in surgery for colorectal cancer.Ann Surg Treat Res,2014,86:206-211.
10 王婷婷,庄园,陈娜,等.肿瘤相关中性粒细胞在胃癌中的分布、表型及其免疫抑制功能研究.第三军医大学学报,2014,36:587-591.
11 Ding D,Feng Y,Song B,et al.Effects of preoperative and postoperative enteral nutrition on postoperative nutritional status and immune function of gastric cancer patients.Turk J Gastroenterol,2015,26:181-185.
12 Velásquez JF,Ramírez MF,Ai DI,et al.Impaired Immune Function in Patients Undergoing Surgery for Bone Cancer.Anticancer Res,2015,35:5461-5466.
13 李红.肿瘤患者血清免疫球蛋白检测结果的分析.中国医药指南,2016,14:92-93.
14 陈海,毛建平.肿瘤免疫逃逸与T淋巴细胞关系的研究进展.中国生物工程杂志,2012,32:86-92.

16 周志刚.早期肠内营养对患者免疫与营养状态及术后感染的影响观察.中华医院感染学杂志,2013,23:2638-2640.
17 Jia ZY,Yang J,Tong DN,et al.Screening of nutritional risk and nutritional support in general surgery patients:a survey from Shanghai,China.Int Surg,2015,100:841-848.
18 Ligthart-Melis GC,Weijs PJ,te Boveldt ND,et al.Dietician-delivered intensive nutritional support is associated with a decrease in severe postoperative complications after surgery in patients with esophageal cancer.Dis Esophagus,2013,26:587-593.
19 陆莉,顾敏静.营养风险对喉癌患者生活质量及术后并发症的影响.中国老年学杂志,2015,35:7142-7144.
20 Jie B,Jiang ZM,Nolan MT,et al.Impact of preoperative nutritional support on clinical outcome in abdominal surgical patients at nutritional risk.Nutrition,2012,28:1022-1027.
R 735.37
A
1002-7386(2017)21-3258-04
2017-04-07)
710016 西安市,西安长安医院普外科(杜一鸿、李明杰);陕西省扶风县中医医院(刘云莉)

