电转法介导沉默ABCE1基因对人胆囊癌细胞基因表达及增殖能力的抑制作用
段巨涛,张琦
电转法介导沉默ABCE1基因对人胆囊癌细胞基因表达及增殖能力的抑制作用
段巨涛1,张琦2
目的:研究电转法沉默ATP结合盒转运子E1(ABCE1)基因表达后对人胆囊癌GBC-SD细胞基因表达及增殖能力的抑制作用。方法:构建靶向ABCE1基因的载siRNA质粒(ABCE1-siRNA)以及阴性对照质粒(NC-siRNA),分别设置ABCE1-siRNA组、NC-siRNA组及空载组,于体外电转法转染至人胆囊癌GBC-SD细胞,形成ABCE1-GBC-SD、NC-siRNA-GBC-SD、Ctrl-GBC-SD细胞。分别采用实时荧光定量PCR(RT-PCR)、蛋白印迹(Western blotting)检测电转后细胞中ABCE1基因mRNA与蛋白的表达水平,流式细胞仪检测GBC-SD细胞周期及凋亡,CCK-8法测定GBC-SD细胞的增殖能力。结果:成功构建靶向ABCE1基因的载siRNA质粒。与对照组相比,电转后ABCE1-GBC-SD细胞中ABCE1基因mRNA(0. 45±0.06)和蛋白表达水平(0.65±0.10)显著降低(P<0.05);ABCE1-GBC-SD组细胞的生长速度减慢(P<0.05),细胞周期被阻滞于G0/G1期,S期的细胞数减少;与空载组相比,ABCE1-GBC-SD组细胞凋亡率(16.80±3.58)显著升高(P<0.01)。结论:体外电转沉默ABCE1基因的表达后能够抑制胆囊癌细胞的基因表达及增殖能力。
胆囊癌;ATP结合盒转运子E1;电转法;细胞增殖
胆囊癌是胆道系统中较为常见的恶性肿瘤,其地区分布不均,男女比例约为1∶2,女性明显多于男性[1],因早期症状不明显,大多数的患者于中晚期方能确诊,预后相对差。目前胆囊癌的综合治疗方案有多样,但由于胆囊癌易局部复发和远处转移,因此临床医生仍面临着巨大的挑战。有研究发现,ATP结合盒转运子E1(ATP-binding cassetteE1,ABCE1)与多数肿瘤细胞的增殖、迁移有密切关联[2]。目前国内外关于研究ABCE1基因抑制与胆囊癌细胞生物学特性的的文献较少见报道。本文研究将设计、合成靶向ABCE1的载siRNA基因(ABCE1-siRNA)电转法转染至人胆囊癌GBC-SD细胞,沉默胆囊癌GBC-SD细胞ABCE1基因后,分析胆囊癌GBC-SD细胞的生物学行为的特性。
1 材料与方法
1.1 细胞株及主要试剂人胆囊癌GBC-SD细胞购自大连宝生物公司,rAAV-hTERT及空载rAAV由本元正阳基因技术股份有限公司提供;L-DMEM培养基购自美国Hyclone公司;胎牛血清(FBS)购自美国Gibco公司。RT-PCR两步法试剂盒购自北京赛百盛基因技术有限公司,AMV逆转录试剂盒购自北京天根生化有限公司,耐热性TaqDNA聚合酶购自杭州博日。CCK-8试剂盒购自北京博奥森公司。细胞周期检测试剂盒购自美国Becon Dickinson公司。流式细胞仪(美国Bio-Rad公司);RNA提取试剂Trizol、L质粒提取试剂盒(GibcoBRL公司);脂质体转染试剂LipofectamineTM2000(北京赛百盛基因技术有限公司);CCK-8(美国Becon Dickinson公司产品);PCR引物序列(由上海闪晶生物公司设计并合成)。
1.2 靶向ABCE1的siRNA设计与合成根据参考文献[3]所设计的ABCEABCE1-siRNA序列,正义序列5'-ATCCGCTACAGCGAGTACGTTTACCTGTGAAGCCACAGATGGGGTAAACGTACTCGCTTAGCTTTTTTG-3',反义序列:5'-AATFCAAAAAAGCTACAGCGAGTACGTTTACCCCATCTGTGGCTTCACAGGTAAACGTACTCGCTGTAGCG-3';无同源性的阴性对照序列(negative control siRNA,NC-siRNA)正义序列:5'-GATCCGCGAGACCTCAGTATGTTACCTGTGAAGCCACAGATGGGGTAACATACTGAGGTCTCGCTTTTTTG-3',反义序列:5'-AATTCAAAAAAGCGAGACCTCAGTATGTTACCCATCTGTGGCTTCACAGGTAACATACTGAGGTCTCGCG-3'。
1.3 ABCE1-siRNA电转染GBC-SD细胞取对数生长期的GBC-SD细胞,制成单细胞的悬液,PBS洗涤、胰酶消化、离心后,加入电转液,重悬GBC-SD细胞,离心800 g,5 min,洗涤GBC-SD细胞3次,离心后重悬于电转液中,移入电击杯,加入10 μg ABCE1-siRNA质粒,混匀,放置于冰上0.5 h后,行电穿孔(电压450 V/cm,电容25 μF,时间0.9 ms),转染后的细胞命名为ABCE1-GBC-SD细胞(实验组),室温下放置0.5 h,将细胞移入加有DMEM培养基(含10%小牛血清,1%双抗)的培养皿中,置于37℃、5%CO2孵箱内培养,同时空载体电转染作为对照(细胞命名为Ctrl-GBC-SD细胞),同时NC-siRNA电转染作为阴性对照组,于转染48 h后进行RNA干扰效应的检测。
1.4 RT-PCR检测ABCE1 mRNA的表达分别收集ABCE1-GBC-SD、NC-siRNA-GBC-SD、Ctrl-GBC-SD组细胞1.5×107个,PBS冲洗3次,以TRIzol试剂提取各组细胞总RNA,逆转录为cDNA,进行PCR扩增。ABCE1上游引物:5'-TTGGTTGTGGGAAGTCGT-3',下游引物:5'-GCTTATGTAGTTAATGGGAGGT-3',扩增产物为415 bp。GAPDH引物序列:上游引物:5'-GAGTCAACGGATTGGTCGT-3',下游引物:5'-GACAAGCTTCCCGTTCTCAG-3',扩增产物为185 bp。RT-PCR反应条件:95℃预变性5 min,95℃变性30 s,60℃退火30 s,72℃延伸60 s,共35个循环。PCR的产物通过1.2%的琼脂糖凝胶电泳,用UVI凝胶成像系统摄像,Image-Pro Plus 7.0软件分析各条结果,用ABCE1/GAPDH的比值表示ABCE1 mRNA的相对表达量。
1.5 Westem blotting检测ABCE1蛋白的表达收集每组生长状态良好的目的细胞1×107个,细胞弃培养液后PBS冲洗3次,提取总蛋白,通过BCA法测定蛋白质浓度,吸取50 μg总蛋白,行10%SDS-PAGE电泳,通过电转移(40 V 150 min的转印条件)印迹到PVDF膜上,封闭5%脱脂奶粉FIBS液中,于37℃下孵育2 h。一抗孵育:加入1∶1000稀释的ABCE1多克隆一抗,4℃过夜,TBST洗膜5次,5 min/每次,二抗孵育:加入1∶5000 HRP标记的二抗,于37℃孵育2 h PBS洗涤,采用ECL法检测。通过GDSS000凝胶自动成像系统摄像。Image-Pro Plus 8.0软件分析条带灰度值,以ABCE1/GAPDH代表ABCE1的相对表达量。
1.6 流式细胞术检测GBC-SD细胞周期收集各组GBC-SD细胞,调整GBC-SD细胞密度至1×106个/L,经预冷的PBS洗涤2次,细胞沉淀用70%冰乙醇4℃混匀备用,洗涤细胞,PBS调整细胞密度至1× 106/mL,与含50 μg/mL RNA酶的Tris-HCl缓冲液(pH7.4)共同孵育30 min。1 μg/mL碘化丙啶进行GBC-SD细胞的DNA染色,室温避光保存30 min后,流式细胞仪检测细胞周期和凋亡,实验重复3次。
1.7 CCK8法检测GBC-SD细胞的增殖收集指数生长期细胞的3组细胞(实验组、空白对照组、阴性对照组),以l×103密度接种在96孔板中,用10%胎牛血清DMEM培养基200 μL,每组设6个复孔,于37℃,5%CO2,细胞培养箱中培养24 h后,每孔加入CCK-8)20 μL,于培养箱温育4 h后,以不加细胞空白孔为对照组。用CCK8法检测细胞增殖情况,酶联免疫检测仪测定各孔490 nm处的吸光值(A)。细胞吸光度A值平均值作为纵坐标,以时间为横坐标绘制生长曲线。
1.8 统计学处理数据用SPSS13.0软件包处理。计量资料以均数±标准差(±s)表示,两组间连续变量比较用t检验,多组间比较采用单因素方差分析及q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 ABCE1-siRNA转染抑制GBC-SD细胞中ABCE1 mRNA的表达RT-PCR检测结果(见图1)显示,与对照组相比较,实验组ABCE1 mRNA的表达为(0.45±0.06),明显少于空白对照组(0.69± 0.07)和阴性对照组(0.71±0.09)(P<0.05)。空白对照组和阴性对照组比较ABCE1 mRNA的表达无明显差异(P>0.05)。表明ABCE1-siRNA转染能够有效抑制GBC-SD细胞中ABCE1 mRNA的表达。2.2 siRNA抑制ABCE1蛋白的表达ABCE1蛋白检测结果见图2,与阴性对照组(0.97±0.12)和空白对照组(0.98±0.11)比较,实验组ABCE1蛋白表达(0.65±0.10)明显降低,差异均有统计学意义(P<0.05)。空白对照组和阴性对照组比较,ABCE1蛋白的表达无明显差异(P>0.05)。表明了ABCE1-siRNA转染能够有效抑制GBC-SD细胞中ABCE1蛋白的表达。
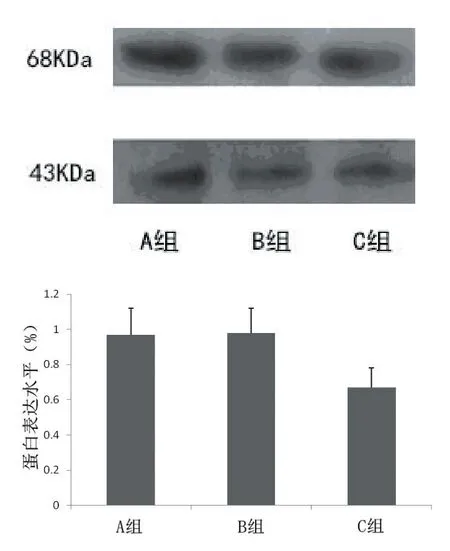
图2 ABCE1-siRNA转染抑制GBC-SD细胞后ABCE1蛋白的表达
2.3 流式细胞术检测ABCE1-GBC-SD细胞周期流式细胞仪分析结果示,与空白对照组和阴性对照组比较,实验组G0/G1期细胞与S期细胞分布差异均有统计学意义(P<0.05);空白对照组和阴性对照组间G0/G1期与S期细胞分布差异无统计学意义(P>0.05),表明了ABCE1-siRNA将细胞周期阻滞在G0/G1期,见表1。

表1 各组细胞周期分布及凋亡率(%)
2.4 流式细胞术检测ABCE1-GBC-SD细胞凋亡率
流式细胞仪分析显示,实验组细胞凋亡率明显高于对照组,差异有统计学意义(P<0.01);空白对照组和阴性对照组凋亡率无显著性差异(P>0.05),见表1。
2.5 CCK-8法检测ABCE1-GBC-SD细胞增殖降低
依CCK-8法检测结果绘制的生长曲线显示,实验组组较对照组曲线明显降低(见图3),差异有统计学意义(P<0.05),见表2。
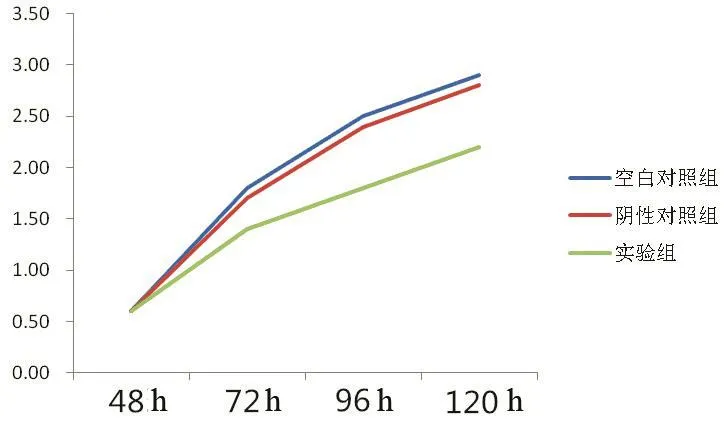
图3 CCK-8法检测ABCE1-GBC-SD细胞增殖率
表2 Absorbance at 490 nm(±s,n=6)
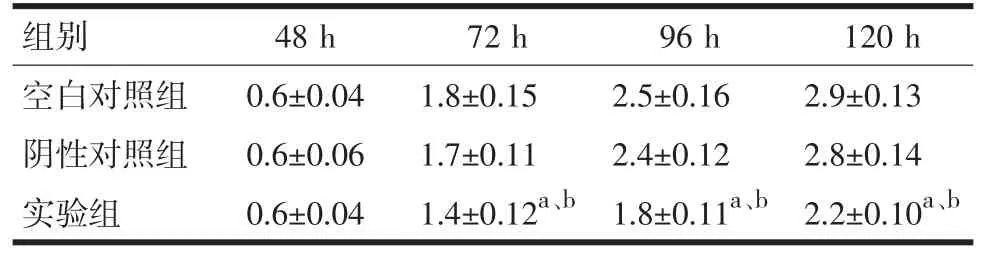
表2 Absorbance at 490 nm(±s,n=6)
注:与空白对照组比较,aP<0.05;与阴性对照组比较,bP<0.05
组别空白对照组阴性对照组实验组48 h 0.6±0.040.6±0.060.6±0.0472 h 1.8±0.151.7±0.111.4±0.12a、b 96 h 2.5±0.162.4±0.121.8±0.11a、b 120 h 2.9±0.132.8±0.142.2±0.10a、b
3 讨论
由于胆囊癌早期无特异性临床表现,患者确诊时多已至晚期,据统计,胆囊癌全国平均死亡率为0.45/(10万),位于全国恶性肿瘤的第19位,消化道肿瘤的第6位[4]。近年来,我国胆囊癌发病率有所上升[5]。目前治疗胆囊癌的综合治疗手段多种多样,但胆囊癌手术切除率低,仅有10%的患者有手术机会[6-7]。手术疗效也不甚理想,术后5年生存率不到5%[8]。对放化疗效果不明显,发生周围重要组织及脏器浸润与转移早,预后差,胆囊癌术后经综合治疗后的再次部复发及远处转移是临床医生面临的巨大难题。因此,寻找有效预防和治疗胆囊癌的方法具有极为重要临床意义及社会价值。
目前随着人类基因组计划圆满的完成以及不断的发展的功能基因科学研究表明[9],基因调控参与了多种肿瘤细胞(如肝癌、肺癌、前列腺癌等)的增殖、侵袭及迁移,因此在基因角度有效的抑制肿瘤发展的作用成为新的研究焦点,医学界研究人员非常重视此方面的研究[10]。目前研究表明抑制恶性肿瘤细胞凋亡是抑制肿瘤细胞的增殖、侵袭及迁移的关键[11]。位于常染色体4q31上的ATP结合盒转运子E1基因编码相对分子量约为68 kDa的蛋白质,属于ATP结合盒转运子基因亚家族的成员之一,于人体各组织器官中持续表达,全长cDN A序列的编码为599个氨基酸,参与肿瘤细胞的增殖分化、侵袭、迁移以及蛋白质的合成,主要通过抑制细胞内核糖核酸酶L(RNase-L)的活性来抑制细胞凋亡发挥作用[12]。相关研究表明,在正常细胞内RNase L由于2-5寡聚核苷酸含量(2-5A/RNase L)的增加而被激活,激活后的RNase L具有特异性抑制68kDa蛋白、抑制蛋白质合成、降解RNA、阻止细胞增生失控、诱导细胞凋亡的作用。理论上通过阻断肿瘤细胞中ABCE1的表达能有效抑制肿瘤细胞的发展,成为在基因治疗方面有效治疗恶性肿瘤的新方法[12-13]。研究表明[11-13]在结肠癌、前列腺癌、肺癌、直肠癌的细胞中存在ABCE1基因过度表达的情况。ABCE1基因沉默后影响肿瘤细胞增殖凋亡。但其对胆囊癌的生物学行为是否有影响国内外文献报道较少见。
近些年来相关实验研究中获得高效又较为理想的转染方法是外源DNA在高压电场电脉冲的作用下可由细胞膜瞬间出现的微小孔洞通过并进入细胞内[14-15]。本研究将设计及合成靶向ABCE1的siRNA序列(ABCE1-siRNA)以及阴性对照序列(NC-siRNA)电穿孔法转染至人胆囊癌GBC-SD细胞,分别形成ABCE1-GBC-SD、NC-siRNA-GBC-SD细胞通过RT-PCR、Western blotting发现检测电转后细胞中ABCE1 mRNA与蛋白的表达受到阻断,检验证实其靶向沉默ABCE1基因的效果,流式细胞术检测细胞周期及凋亡,CCK-8增殖实验测定人胆囊癌GBC-SD细胞增殖能力。结果显示ABCE1-GBC-SD细胞中ABCE1 mRNA和蛋白表达显著降低,ABCE1-GBC-SD细胞的生长速度明显减慢,细胞周期阻滞在G0/G1期,S期细胞数减少,ABCE1-GBC-SD细胞的增殖能力显著下降,凋亡率明显升高。
本研究结果表明在体外人胆囊癌组织中沉默ABCE1基因能抑制肿瘤细胞的基因表达及增殖能力,为下一步体内实验奠定基础。
[1]邹声泉,张林.全国胆囊癌临床流行病学调查报告[J].中国实用外科杂志,2000,20(1):43-46.
[2]Tian Y,Han X,Tian DL.The biological regulation of ABCE1[J]. IUBMB Life,2012,64(10):795-800.
[3]Bisbal C,Salehzada T,Silhol M,et al.The 2-5A/RNase L pathway and inhibition by RNase L inhibitor(RLI)[J].Methods Mol Biol, 2001,160(22):183-198.
[4]李连弟,张思维,鲁凤珠,等.中国恶性肿瘤死亡普及分类构成特征研究[J].中华肿瘤杂志,1997,19(9):323.
[5]张明迪,龚伟,郑莹,等.上海市胆囊癌流行状况和趋势分析[J].中国实用外科杂志,2013,33(8):691-694.
[6]Zhu AX,Hong TS,Hezel AF,et al.Current management of gall-bladder carcinoma[J].Oneologist,2010,15(2):168-181.
[7]马伟,李军,魏云巍.胆囊癌的治疗现状[J].医学研究杂志,2015,44 (9):175-177.
[8]Mastoraki A,Papanikolaou IS,Konstandiadou I,et al.Facing the challenge of treating gallbladder carcinoma[J].Hepalogastroenter⁃ology,2010,57(98):215-219.
[9]Shimizu M,Zaninotto G,Nagata K,et al.Esophageal squamous cell carcinoma with special reference to its early stage[J].Best Pract Res Clin Gastroenterol,2013,27(2):171-186.
[10]Terova G,Rimoldi S,Bernardini G,et al.Inhibition of myostatin gene expression in skeletal muscle of fish by in vivo electrically mediated dsRNA and shRNAi delivery[J].Mol Biotechnol,2013, 54(2):673-684.
[11]Chen SH,Li D,Xu C.Down regulation of Collal induces different tiation in mouse spermatogonia[J].Asian J Androl,2012,14(6): 842-849.
[12]Vander D,Elisabeth GE,Wim T,et al.ATP-binding cassette (ABC)transporters in normal and pathological lung[J].Respir Res, 2005,6(1):59-75.
[13]Hühmer AF,Paulus A,Martin LB,et al.The chromosome-centric human proteome project:a call to action[J].J Proteome Res,2013, 12(1):28-32.
[14]Barthelme D,Scheele U,Dinkelaker S,et al.Structural organiza⁃tion of essential iron-sulfur clusters in the evolutionarily highly conserved ATP-binding cassette protein ABCE1[J].J Biol Chem, 2007,282(19):14598-14607.
[15]Pisarev AV,Skabkin MA,Pisareva VP,et al.The role of ABCE1 ineukaryotic posttermination ribosomal recycling[J].Mol Cell,2010, 37(2):196-210.
Effect of ABCE1 Gene Silencing by Electroporation on Proliferation and Migration of Human Gallbladder Cancer Cells GBC-SD
DUAN Ju-tao,ZHANG Qi Nankai Clinical Medicine College of Tianjin Medical University,Tianjin(300100),China
ObjectiveTo study the effect of ATP-binding cassette E1(ABCE1)gene silencing by electro⁃poration on the survival and cell cycle of human gallbladder cancer cells GBC-SD.MethodsThe siRNA against ABCE1 was constructed and transfected into GBC-SD cells by electroporation in vitro.The expression of ABCE1 was detected by RT-PCR and Western blot.Flow cytometry was used to detect the cell cycle distribu⁃tion and apoptosis.The effects of ABCE1 gene silencing by electroporation on proliferation of GBC-SD cell line were evaluated by CCK-8 assay.ResultsCompared with the control group,the mRNA(0.45±0.06)and pro⁃tein levels(0.65±0.10)were significantly decreased in the experimental group when ABCE1 gene was silenced by electroporation.The cell cycle was arrested at Go/G1phase and cell number in S phase was decreased in GBC-SD cell line(P<0.05).The cell growth inhibition ratio in the experimental group was significantly higher than that in the control group and blank group(P<0.01).Compared with the control group and the blank group, CCK-8 proliferation experiment showed that GBC-SD cell proliferation was inhibited significantly in the experi⁃mental group(P<0.05).ConclusionABCE1 is involved in the progression of gallbladder cancer.Inhibiting the expression of ABCE1 by electroporation can decrease gene expression and proliferation ability of tumor cells in vitro.
Gallbladder cancer;ATP-binding cassette E1;electroporation;cell proliferation
R735.8
A
1007-6948(2017)05-0523-05
10.3969/j.issn.1007-6948.2017.05.016
1.天津医科大学南开临床医学院(天津300100) 2.天津市南开医院中西医结合急腹症研究所(天津300100)
张琦,E-mail:zhangqi8501@126.com
(收稿:2016-11-26 修回:2017-07-20)
(责任编辑 王丰)

