异硫氰酸酯类香料对两种革兰氏阳性致病菌的抑制作用
王 岩,周倩倩,万锈琳,王佳莹,侯红漫,张公亮*
(大连工业大学食品学院,辽宁 大连 116034)
异硫氰酸酯类香料对两种革兰氏阳性致病菌的抑制作用
王 岩,周倩倩,万锈琳,王佳莹,侯红漫,张公亮*
(大连工业大学食品学院,辽宁 大连 116034)
选取9 种异硫氰酸酯类香料,以金黄色葡萄球菌和单增李斯特菌作为供试菌,通过测量抑菌圈直径考察此类含硫香料的抑菌活性,并探讨其构效关系。筛选抑菌效果最好的含硫香料,利用反转录荧光定量聚合酶链式反应技术考察其对金黄色葡萄球菌耐热核酸酶nuc基因表达的影响。结果显示:4 种异硫氰酸酯类香料——异硫氰酸苄酯(benzyl isothiocyanate,BZITC)、异硫氰酸苯乙酯(phenethyl isothiocyanate,PEITC)、异硫氰酸3-甲硫基丙酯(3-methylthiopropyl isothiocyanate,MTPITC)和异硫氰酸异戊酯(isoamyl isothiocyanate,IAITC)对2 种革兰氏阳性菌的抑菌效果较好,且抑菌能力为BZITC≈PEITC>MTPITC>IAITC。对比9 种异硫氰酸酯类香料的抑菌活性,BZITC对金黄色葡萄球菌的抑菌活性最强,最低抑菌浓度为0.61 mmol/L,对单增李斯特菌的最低抑菌浓度为4.88 mmol/L。在亚抑菌浓度条件下,BZITC极显著地降低了金黄色葡萄球菌毒力基因nuc的表达(P<0.01)。以上结果说明,苯基的存在可能增强异硫氰酸酯类香料的抑菌活性,该结构对BZITC抑制金黄色葡萄球菌毒力基因nuc的表达具有重要作用。
异硫氰酸酯类香料;革兰氏阳性菌;抑菌活性;构效关系;毒力基因表达
在食用香料中,含硫香料占据十分重要的地位。GB 2760—2014《食品安全国家标准 食品添加剂使用标准》及美国食品香料与萃取物制造者协会(Flavor Extract Manufacturers’ Association,FEMA)公布的食品香料名单中,包含多种含硫香料[1]。近几年,FEMA新公布的一般认为安全的物质中,含硫香料的比例都超过31%[2-3]。目前,对含硫香料的研究报道主要集中在硫醚类化合物上,如大蒜的活性成分方面[4-5]。异硫氰酸酯类香料主要从十字花科植物提取,为R—N=C=S结构,具有抗炎、抗菌、抗氧化、抗癌和抗肿瘤等生物活性[6-8]。目前,对此种香料的抑菌构效研究比较少,主要集中在香料合成方面[9-10]。
金黄色葡萄球菌(Staphylococcus aureus)和单增李斯特菌(Listeria monocytogenes)是常见的革兰氏阳性致病菌。金黄色葡萄球菌是造成人类食物中毒的常见致病菌之一,由金黄色葡萄球菌产生的肠毒素可引起食物的污染,感染后可导致恶心、呕吐、腹泻等肠炎反应[11-12]。单增李斯特菌具有高致病率的特点,且对外界环境具有很强的适应性,在食品的贮藏、运输及加工过程中极易受到其污染[13-15],是对人类卫生健康具有重大影响的病原微生物之一[16]。因此,选取安全有效的食品级抑制剂来控制食品中的金黄色葡萄球菌和单增李斯特菌污染具有十分重要的研究意义。
金黄色葡萄球菌能产生多种与毒力强弱、致病力有关的毒素和细胞外酶,其中,由nuc基因编码的耐热核酸酶是产肠毒素金黄色葡萄球菌污染的一个典型特征,它不但是细菌成功侵入宿主的重要因子之一,而且是检测金黄色葡萄球菌污染食品和引起感染的特征标志[17-18]。目前研究含硫香料对金黄色葡萄球菌耐热核酸酶基因表达的影响情况很少,本实验选取了9 种异硫氰酸酯类香料,研究其对2 种革兰氏阳性致病菌——金黄色葡萄球菌和单增李斯特菌的抑制作用,并探讨其构效关系。同时利用异硫氰酸酯类香料,研究其对金黄色葡萄球菌耐热核酸酶nuc基因表达的调控情况,为含硫香料的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
本研究根据GB 2760—2014《食品安全国家标准 食品添加剂使用标准》[19]选取9 种异硫氰酸酯类香料,均购自美国Sigma公司。名称及结构式见表1。
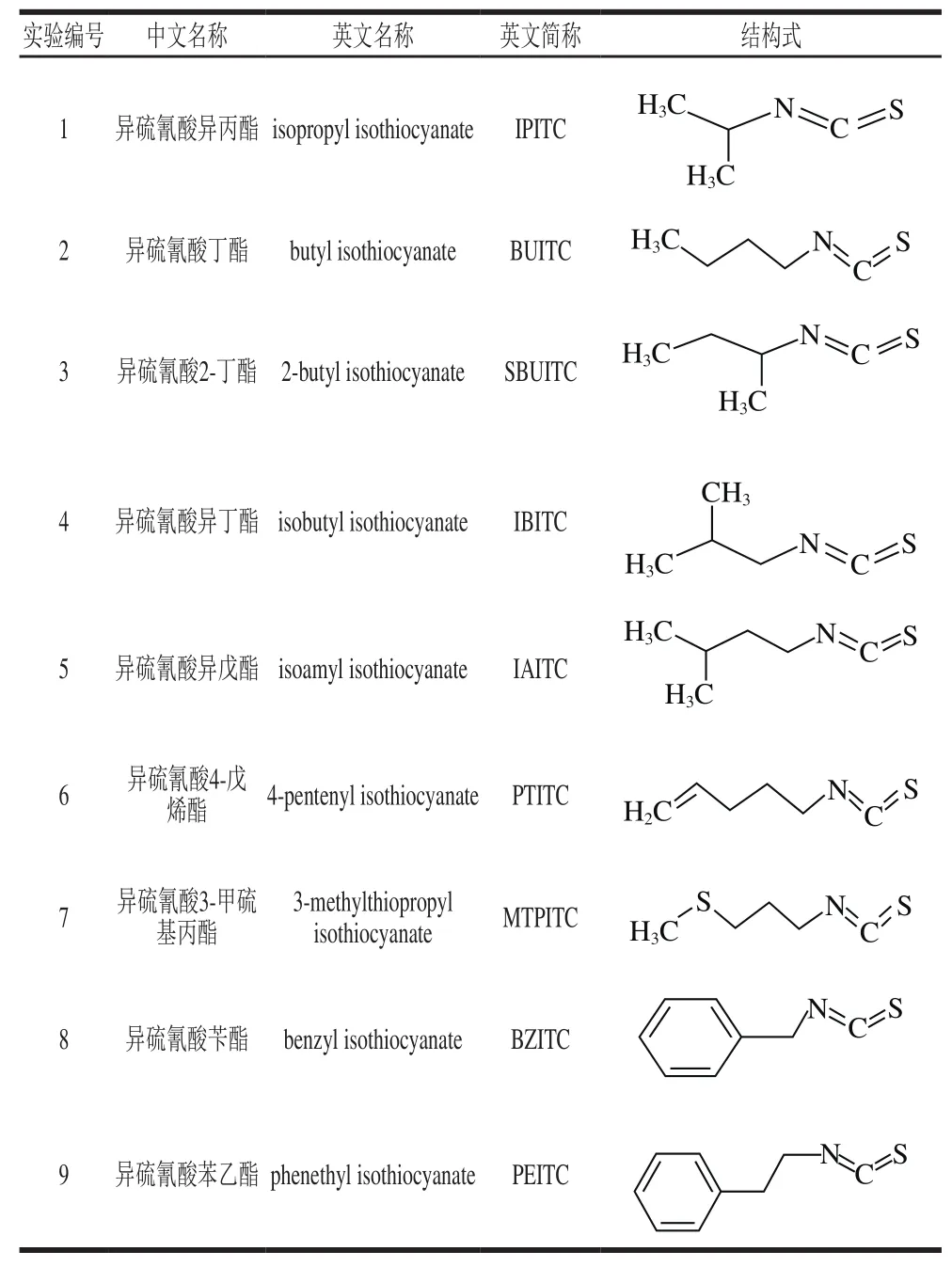
表1 9 种异硫氰酸酯类香料的名称及结构式Table 1 Names and structures of nine isothiocyanate flavors
金黄色葡萄球菌ATCC 6538、单增李斯特菌ATCC 19115由大连工业大学食品学院微生物实验室提供。
胰蛋白胨、酵母膏、氯化钠、琼脂粉、大豆蛋白胨、磷酸氢二钾、葡萄糖(分析纯) 大连博诺生物化学试剂公司;无水乙醇(分析纯) 沈阳力诚试剂厂;RNAprep pure培养细胞/细菌总RNA提取试剂盒 天根生化科技(北京)有限公司;SYBR®Premix Ex TaqTM、Random primers[pd(N)6]、5×M-MLV Buffer、dNTP Mixture、RNase Inhibitor、RTase M-MLV(RNase H)宝生物工程(大连)有限公司;RNase-free water、荧光定量聚合酶链式反应(polymerase chain reaction,PCR)用引物 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
FA(A)型电子天平 上海民桥精密科学仪器公司;01J2003-04型高压灭菌锅 上海博迅实业有限公司;ZHWY-100B型恒温培养振荡器、ZHWY-2102C型双层小容量全温度恒温摇床 上海智城分析仪器制造有限公司;DRP-9162型电热恒温培养箱 上海森信实验仪器有限公司;UV-1750型紫外-可见分光光度计 日本岛津仪器有限公司;MyiQTM2型荧光定量PCR仪 美国Bio-Rad公司。
1.3 方法
1.3.1 含硫香料的处理
按照下式求出所需原液和无水乙醇的体积后,将9 种异硫氰酸酯类香料稀释至适当浓度,密封备用。
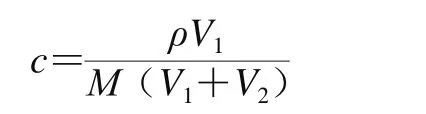
式中:c为稀释的异硫氰酸酯类香料的浓度/(mol/L);ρ为异硫氰酸酯类香料的密度/(g/L);V1为异硫氰酸酯类香料的体积/L;M为异硫氰酸酯类香料的摩尔质量/(g/mol);V2为无水乙醇的体积/L。
1.3.2 培养基的配制
溶菌肉汤(lysogeny broth,LB)培养基,用于金黄色葡萄球菌培养:胰蛋白胨1 g、酵母膏0.5 g、氯化钠1 g、琼脂1.5 g、去离子水100 mL,调节pH值至7.0,于121 ℃条件下灭菌20 min。
胰蛋白胨大豆肉汤培养基,用于单增李斯特菌培养:胰蛋白胨1.7 g、大豆蛋白胨0.3 g、氯化钠0.5 g、磷酸氢二钾0.25 g、葡萄糖0.25 g、琼脂1.5 g、去离子水100 mL,调节pH值至(7.3±0.2),于121 ℃条件下灭菌15 min。
1.3.3 菌种的活化与培养
取-80 ℃冻存的菌液,吸取适量于液体培养基中,振荡培养24 h进行初次活化;将上述菌液划平板过夜培养;挑取平板上的单菌落,转接至液体培养基中。用生理盐水将上述菌液配成含菌体为106~107CFU/mL的菌悬液,备用。
1.3.4 抑菌圈直径的测定
采用滤纸片法,测定抑菌圈直径的大小[20-21],并略有改进。取100 μL上述菌悬液均匀涂布于固体培养基上,平铺直径为1 cm的圆形滤纸片,添加6 μL的0.08 mol/L异硫氰酸酯类香料,置于37 ℃培养箱,培养18~24 h。每种香料做3 组平行,最终实验结果取平均值。
1.3.5 最低抑菌浓度的测定
根据1.3.4节的结果,选取抑菌效果最好的异硫氰酸酯类香料测定最低抑菌浓度(minimum inhibitory concentration,MIC)。采用60%乙醇溶液将5 mol/L异硫氰酸酯类香料稀释成17 个浓度,分别为2.50、1.25、0.63 mol/L等,直至76.28 μmol/L。取0.1 mL菌液添加至0.8 mL液体培养基中,分别添加0.1 mL不同浓度的异硫氰酸酯类香料,充分振荡均匀,于37 ℃条件下培养24 h。分别取培养液100 μL,涂布平板,37 ℃培养24 h[22]。观察有无细菌生长,以无细菌生长的异硫氰酸酯类香料的最低浓度记为MIC。每种香料3 组平行,实验结果取平均值。
1.3.6 异硫氰酸酯类香料作用下供试菌生长曲线的测定
将抑菌效果最好的异硫氰酸酯类香料浓度稀释成1/4 MIC、1/2 MIC(根据1.3.5节结果),取菌液1 mL添加至99 mL液体培养基中,分别添加0.1 mL异硫氰酸酯类香料,以添加0.1 mL无水乙醇为对照组,振荡培养24 h,每隔2 h,利用紫外分光光度计测定菌液OD600nm,以OD600nm为纵坐标,时间t为横坐标,绘制实验组和对照组生长曲线。
1.3.7 RNA的提取和反转录荧光定量PCR
在LB培养基中分别添加不同抑菌浓度(根据1.3.5节结果)的异硫氰酸酯类香料,以未添加异硫氰酸酯类香料作为对照组,培养12 h,取适量的菌液,按照细菌总RNA提取试剂盒说明书步骤进行RNA提取,反转录为cDNA[23-24]。反转录荧光定量PCR的25 μL反应体系:SYBR®Premix Ex TaqTM12.5 µL;浓度为10 µmol/L的引物对各0.5 µL;cDNA模板2 µL;RNase-free Water 9.5 µL。nuc基因引物:上游5’-GCG ATT GAT GGT GAT ACG GTT-3’、下游5’-AGC CAA GCC TTG ACG AAC TAA AGC-3’[25];16S rRNA内参基因引物:上游5’-GCT GCC CTT TGT ATT GTC-3’、下游5’-AGA TGT TGG GTT AAG TCC C-3’[26]。
反应参数:95 ℃ 1 min;95 ℃ 20 s,62 ℃ 20 s,于80 ℃停留15 s,收集荧光信号,反应40 个循环;并在60~95 ℃范围内建立熔解曲线。16S rRNA作为内参基因,利用方程2-ΔΔCt表示目的基因的相对表达量[27]。
1.4 统计分析
2 结果与分析
2.1 异硫氰酸酯类香料对2 种革兰氏阳性致病菌的抑菌效果
异硫氰酸酯类香料浓度稀释为0.08 mol/L,在此浓度条件下对2 种供试菌的抑制作用见表2。结果表明,4 种异硫氰酸酯类香料对金黄色葡萄球菌和单增李斯特菌有抑制作用,分别为BZITC、MTPITC、PEITC和IAITC。

表2 9 种异硫氰酸酯类香料对供试菌的抑制作用Table 2 Inhibitory effect of nine isothiocyanate flavors on the tested bacteria
2.2 异硫氰酸酯类香料的抑菌作用
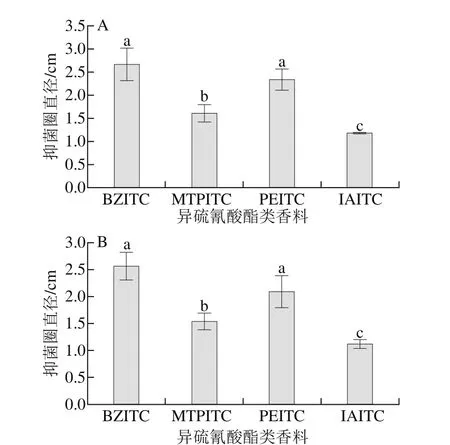
图1 异硫氰酸酯类香料对金黄色葡萄球菌(A)和单增李斯特菌(B)的抑制作用Fig. 1 Diameter of inhibition zone of isothiocyanate flavors against S. aureus (A) and L. monocytogenes (B)
以金黄色葡萄球菌和单增李斯特菌为供试菌,选取对其有抑菌作用的异硫氰酸酯类香料进行抑菌圈实验。如图1所示,4 种异硫氰酸酯类香料对金黄色葡萄球菌和单增李斯特菌的抑菌能力大小均为BZITC≈PEITC>MTPITC>IAITC,其中BZITC和PEITC的抑菌效果显著强于其他2 种香料(P<0.05)。BZITC和PEITC对金黄色葡萄球菌抑菌圈直径分别为(2.67±0.35)cm和(2.33±0.23)cm,对单增李斯特菌抑菌圈直径分别为(2.55±0.26)cm和(2.09±0.30)cm。
BZITC和PEITC侧链取代基中分别含有苯甲基和苯乙基,而其他2 种香料不含有,BZITC和PEITC的抑制作用较强,说明在本研究抑菌体系下,侧链取代基含有苯基的异硫氰酸酯类香料对金黄色葡萄球菌和单增李斯特菌的抑制作用更强,对于含有苯环的这2 种异硫氰酸酯类香料,亚甲基的个数对金黄色葡萄球菌和单增李斯特菌的抑菌效果无显著的影响(P>0.05)。
MTPITC和BUITC的分子式分别为C5H9NS2和C5H9NS,两者结构相似,前者连接的基团为甲硫基,后者为甲基。MTPITC对金黄色葡萄球菌和单增李斯特菌的抑制能力较强,而BUITC无抑制作用,说明结构中甲硫基的存在或硫原子数目的增多同样可能增强对金黄色葡萄球菌和单增李斯特菌的抑菌活性,这与前期的研究结果,即具有相同取代基团的硫醚类香料,硫原子的数量可能对其抑菌效果有重要影响[28-29]相似。
IPITC、IBITC和IAITC在结构上相似,IPITC侧链上无亚甲基、IBITC含有1 个亚甲基、IAITC含有2 个亚甲基。IAITC对金黄色葡萄球菌有微弱的抑制作用,而IPITC和IBITC无抑制作用,说明对于这3 种异硫氰酸酯类香料,结构相似,亚甲基的个数的增多可能对金黄色葡萄球菌的抑菌效果有一定的影响。
可见,不同的异硫氰酸酯类香料由于结构上的差异对同一种革兰氏阳性致病菌的抑菌活性是不同的;同一种异硫氰酸酯类香料对不同的2 种革兰氏阳性致病菌可能存在着菌间差异,但大体上趋势一致。这与前期研究的含氧硫醚类香料的抑菌作用的结论相似[30]。BZITC和PEITC比其他7 种不含有苯基的异硫氰酸酯类香料抑菌效果更明显,所以可能是侧链苯基的存在极大地加强了异硫氰酸酯类香料的抑菌活性。
2.3 BZITC对2 种革兰氏阳性致病菌的MIC
选取对这2 种供试菌均有最强抑制作用的BZITC,测定其MIC,结果见表3。当BZITC的浓度大于4.88 mmol/L时,对这2 种革兰氏阳性致病菌均表现出良好的抑菌效果。BZITC对金黄色葡萄球菌的抑制作用强于单增李斯特菌,其对金黄色葡萄球菌的MIC为0.61 mmol/L,对单增李斯特菌的MIC为4.88 mmol/L。
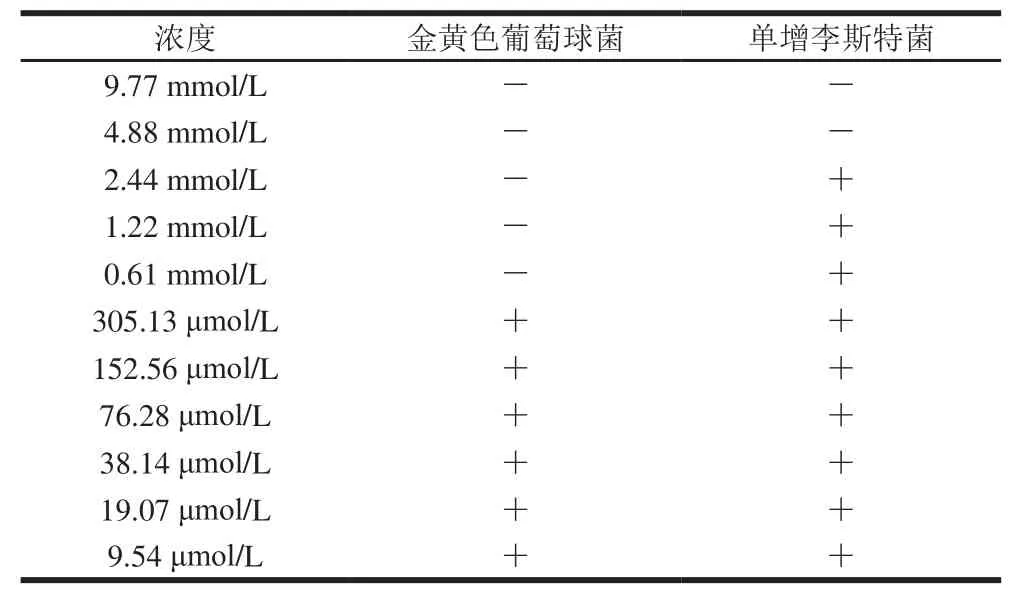
表3 BZITC对2 种革兰氏阳性致病菌的MICTable 3 MIC of BZITC for two Gram-positive pathogenic bacteria
2.4 BZITC对金黄色葡萄球菌生长曲线的影响
如图2所示,在0~14 h,金黄色葡萄球菌生长较快,14 h以后金黄色葡萄球菌的生长进入稳定期。BZITC对金黄色葡萄球菌的抑菌作用在1/4 MIC~MIC之间具有一定的浓度依赖性。经MIC和1/2 MIC的BZITC处理的金黄色葡萄球菌生长受到明显的抑制,特别是处于MIC的BZITC,金黄色葡萄球菌立即停止生长,1/2 MIC的BZITC大约抑制了金黄色葡萄球菌生长的1/8左右,浓度在1/4 MIC时,BZITC对金黄色葡萄球菌不再有抑制效果,与对照组相比的生长曲线几乎重合。
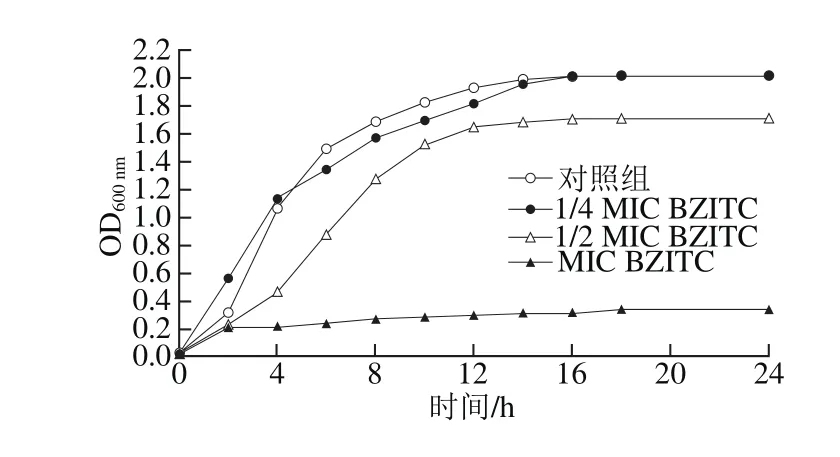
图2 BZITC对金黄色葡萄球菌生长曲线的影响Fig. 2 Effect of BZITC on the growth curve of S. aureus
2.5 BZITC对单增李斯特菌生长曲线的影响
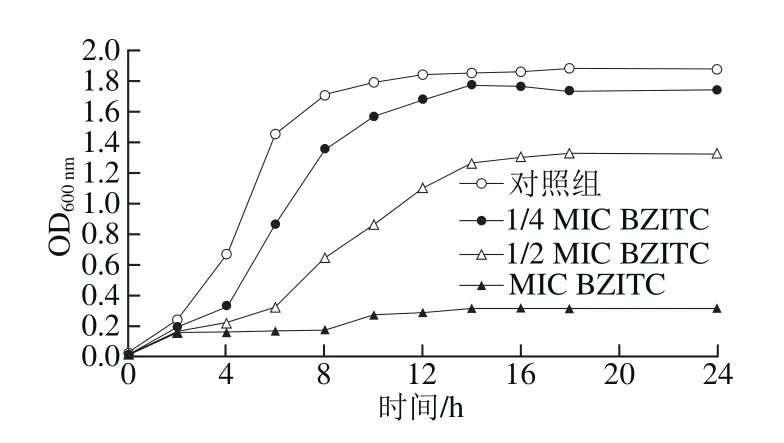
图3 BZITC对单增李斯特菌生长曲线的影响Fig. 3 Effect of BZITC on the growth curve of L. monocytogenes
由图3可知,添加MIC、1/2 MIC和1/4 MIC的BZITC,单增李斯特菌的生长受到了抑制,MIC的BZITC完全抑制了单增李斯特菌的生长,1/2 MIC的BZITC抑制单增李斯特菌生长量的1/3左右,1/4MIC的BZITC仍可以轻微抑制单增李斯特菌的生长,表明抑制作用具有一定的浓度依赖性。
2.6 BZITC对金黄色葡萄球菌毒力基因nuc表达的影响
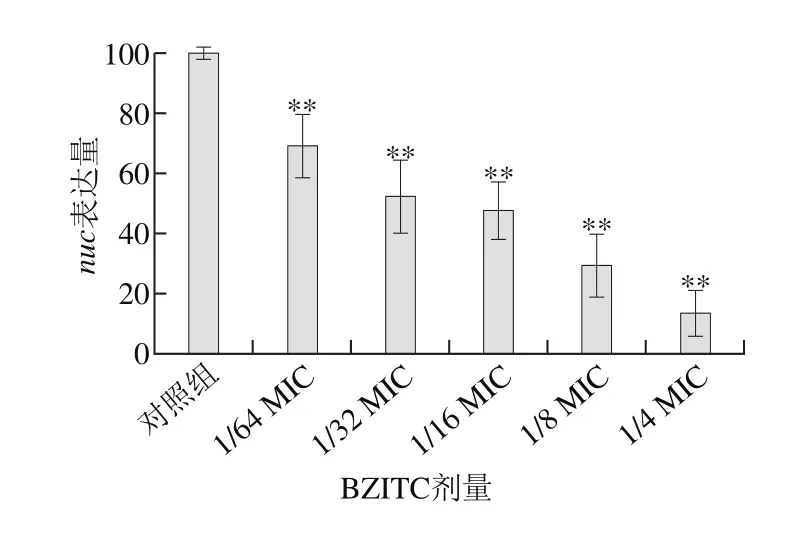
图4 BZITC对金黄色葡萄球菌nuc基因表达的影响Fig. 4 Effect of BZITC on the expression of nuc gene in S. aureus
如图4所示,与对照组相比,添加不同亚抑菌浓度的BZITC,金黄色葡萄球菌毒力基因nuc的表达量均极显著降低(P<0.01)。1/64 MIC的BZITC与对照组相比,nuc的表达量降低了30%左右,1/16 MIC的BZITC下降了55%左右,当BZITC的浓度为1/4 MIC,与对照组相比,nuc基因的表达量降低了约85%,只有对照组的15%左右,结果显示出一种浓度依赖性。这与大蒜素以一种剂量依赖性方式降低金黄色葡萄球菌hla基因表达的结论类似,大蒜素的主要成分为甲基烯丙基硫醚、二烯丙基硫醚等含硫香料[26]。
3 结 论
根据实验结果可知,9 种异硫氰酸酯类香料中,BZITC和PEITC对2 种革兰氏阳性致病菌均有较强的抑制作用,侧链苯基的存在很可能极大地加强了异硫氰酸酯类含硫香料的抑菌活性。BZITC对金黄色葡萄球菌的抑菌效果最强,MIC为0.61 mmol/L。BZITC对2 种革兰氏阳性致病菌生长曲线的抑制作用呈现浓度依赖性。在MIC条件下,能够完全抑制供试菌的生长,这与抑菌实验的结果相符。亚抑菌浓度条件下的BZITC以一种浓度依赖性的方式,极显著地降低了金黄色葡萄球菌耐热核酸酶nuc基因的表达(P<0.01)。
[1] 刘玉平, 孙宝国. 含硫食用香料的合成及应用[J]. 中国食品添加剂,2003(6): 69; 82-84. DOI:10.3969/j.issn.1006-2513.2003.06.019.
[2] SMITH R L, DOULL J, FERON V J, et al. GRAS flavoring substances 20[J]. Food Technology, 2001, 55(12): 34-55.
[3] SMITH R L, COHEN S M, DOULL J, et al. GRAS flavoring substances 21[J]. Food Technology, 2003, 57(5): 46-59.
[4] 彭光华. 三种大蒜有机硫化物抑菌性能的比较[J]. 西藏科技,2009(4): 10-12. DOI:10.3969/j.issn.1004-3403.2009.04.003.
[5] 杨转琴, 魏红, 曹雯, 等. 大蒜提取液及食醋抑菌作用的研究[J]. 食品科学, 2008, 29(1): 69-73. DOI:10.3321/j.issn:1002-6630.2008.01.009.
[6] TECHAPIESANCHAROENKIJ N, FIALA J L A, NAVASUMRIT P,et al. Sulforaphane, a cancer chemopreventive agent, induces pathways associated with membrane biosynthesis in response to tissue damage by aflatoxin B1[J]. Toxicology and Applied Pharmacology, 2015,282(1): 52-60. DOI:10.1016/j.taap.2014.11.004.
[7] 林海鸣, 郑晓鹤, 周军, 等. 硫代葡萄糖苷及异硫氰酸酯的抗癌和抗氧化作用进展[J]. 中国现代应用药学, 2015, 32(4): 513-520.DOI:10.13748/j.cnki.issn1007-7693.2015.04.032.
[8] 刘艳全, 刘鹏, 蒋珍菊, 等. 山葵生物活性成分及其保健作用的研究进展[J]. 中国食物与营养, 2017, 23(4): 59-62.
[9] JAYASHREEE N, LATONGLILA J, BHISMA K P. Improved procedure for the preparation of isothiocyanates via iodine-mediated desulfurization of dithiocarbamic acid salts[J]. Green Chemistry Letters and Reviews,2011, 4(1): 1-34. DOI:10.1080/17518253.2010.486773.
[10] RAMESH Y, HARISADHAN G, SIVA M, et al. Efficient preparation of isothiocyanates from dithiocarbamates using bromineless brominating reagent[J]. Synthetic Communications, 2010, 40(14):2083-2096. DOI:10.1080/00397910903219476.
[11] 何洋, 周黎黎, 刘红露, 等. 应用基因芯片技术检测食品中金黄色葡萄球菌[J]. 食品与发酵工业, 2007, 33(6): 108-110. DOI:10.3321/j.issn:0253-990X.2007.06.027.
[12] 张彦春, 杨杰, 荆红波. 北京市顺义区生牛奶中金黄色葡萄球菌污染情况及耐药性[J]. 首都公共卫生, 2009, 3(2): 84-85. DOI:10.3969/j.issn.1673-7830.2009.02.015.
[13] VÁZQUEZ-BOLAND J A, KUHN M, BERCHE P, et al. Listeria pathogenesis and molecular virulence determinants[J]. Clinical Microbiology Reviews, 2001, 14(3): 584-640. DOI:10.1128/CMR.14.3.584-640.2001.
[14] BELTON B, LITTLE D. The development of aquaculture in central Thailand: domestic demand versus export-led production[J]. Journal of Agrarian Change, 2008, 8(1): 123-143. DOI:10.1111/j.1471-0366.2007.00165.x.
[15] SHI H, TRINH Q, XU W T, et al. The transcriptional response of virulence genes in Listeria monocytogenes during inactivation by nisin[J]. Food Control, 2013, 31(2): 519-524. DOI:10.1016/j.foodcont.2012.11.008.
[16] MAKARITI I P, PRINTEZI A, KAPETANAKOU A E, et al.Investigating boundaries of survival, growth and expression of genes associated with stress and virulence of Listeria monocytogenes in response to acid and osmotic stress[J]. Food Microbiology, 2015, 45:231-244. DOI:10.1016/j.fm.2014.06.023.
[17] VANCRAEYNEST D, HAESEBROUCK F, HERMANS K. Multiplex PCR assay for the detection of high virulence rabbit Staphylococcus aureus strains[J]. Veterinary Microbiology, 2007, 121(3/4): 368-372.DOI:10.1016/j.vetmic.2006.12.011.
[18] 唐俊妮, 史贤明, 张荣, 等. 不同条件对金黄色葡萄球菌耐热核酸酶活性影响的研究[J]. 西南民族大学学报(自然科学版), 2010, 36(4):589-592. DOI:10.3969/j.issn.1003-2843.2010.04.021.
[19] 国家卫生和计划生育委员会. 食品添加剂使用标准: GB 2760—2014[S]. 北京: 中国标准出版社, 2014: 135-183 .
[20] 江洁芳. 花椒中抑菌活性成分提取工艺的研究[J]. 中国调味品,2011, 36(3): 30-32. DOI:10.3969/j.issn.1000-9973.2011.03.007.
[21] 贺菊萍, 赵勇, 孙晓红, 等. 牛蒡提取液对副溶血性弧菌的抑制作用[J]. 天然产物研究与开发, 2012, 24(3): 381-384. DOI:10.3969/j.issn.1001-6880.2012.03.024.
[22] LAMBERT R J W, SKANDAMIS P N, COOTE P J, et al. A study of the minimum inhibitory concentration and mode of action of oregano essential oil, thymol and carvacrol[J]. Journal of Applied Microbiology, 2001, 91(3): 453-462. DOI:10.1046/j.1365-2672.2001.01428.x.
[23] UPADHYAY A, JOHNY A K, AMALARADJOU M A, et al. Plantderived antimicrobials reduce Listeria monocytogenes virulence factors in vitro, and down-regulate expression of virulence genes[J].International Journal of Food Microbiology, 2012, 157(1): 88-94.DOI:10.1016/j.ijfoodmicro.2012.04.018.
[24] QIU J, LI H, MENG H, et al. Impact of luteolin on the production of alpha-toxin by Staphylococcus aureus[J]. Letters in Applied Microbiology, 2011, 53(2): 238-243. DOI:10.1111/j.1472-765X.2011.03098.x.
[25] 谢秀兰, 刘溪源, 王建东, 等. 奶牛乳房炎金黄色葡萄球菌8 种毒力基因的PCR检测[J]. 中国畜牧兽医, 2014, 41(10): 47-50.
[26] LENG B F, QIU J Z, DAI X H, et al. Allicin reduces the production of α-toxin by staphylococcus aureus[J]. Molecules, 2011, 16(9): 7958-7968. DOI:10.3390/molecules16097958.
[27] VIKRAM A, ANTE V M, BINA X R, et al. Cyclo (valine-valine)inhibits Vibrio cholerae virulence gene expression[J]. Microbiology,2014, 160(6): 1054-1062. DOI:10.1099/mic.0.077297-0.
[28] 张公亮, 丁佳琦, 董伟峰, 等. 几种硫醚类香料抑菌活性的研究[J]. 食品工业科技, 2012, 33(9): 127-130. DOI:10.13386/j.issn1002-0306.2012.09.086.
[29] AVATO P, TURSI F, VITALI C, et al. Allylsulfide constituents of garlic volatile oil as antimicrobial agents[J]. Phytomedicine, 2000,7(3): 239-243. DOI:10.1016/S0944-7113(00)80010-0.
[30] 梁颖, 朱俊雅, 张公亮, 等. 含氧硫醚类香料对常见致病菌的体外抑菌活性研究[J]. 食品工业科技, 2015, 36(18): 108-112.DOI:10.13386/j.issn1002-0306.2015.18.013.
Inhibitory Effect of Isothiocyanate Flavors on Two Gram-Positive Pathogenic Bacteria
WANG Yan, ZHOU Qianqian, WAN Xiulin, WANG Jiaying, HOU Hongman, ZHANG Gongliang*
(School of Food Science and Technology, Dalian Polytechnic University, Dalian 116034, China)
Nine isothiocyanate flavors were selected to evaluate their antibacterial activities against Staphylococcus aureus and Listeria monocytogenes by measuring the diameter of inhibition zone. Besides, the structure-activity relationship for these compounds was further investigated. The highest inhibitory effect of sulfur-containing flavors was screened to investigate its impact on the expression of the thermostable nuclease (nuc) gene of S. aureus as determined by real-time reverse transcription quantitative polymerase chain reaction (RT-qPCR). The results showed that benzyl isothiocyanate(BZITC), phenethyl isothiocyanate (PEITC), 3-methylthiopropyl isothiocyanate (MTPITC) and isoamyl isothiocyanate(IAITC) had better inhibitory effect against the two Gram-positive bacteria, and the inhibitory effect followed the descending order of BZITC ≈ PEITC 〉 MTPITC 〉 IAITC. Among the nine isothiocyanate flavors, BZITC showed the highest inhibitory effect against S. aureus with a minimal inhibitory concentration (MIC) of 0.61 mmol/L compared to 4.88 mmol/L for L. monocytogenes. At sub-inhibitory concentrations, BZITC markedly decreased the expression of the virulence factor nuc in S. aureus (P 〈 0.01). These results suggested that the presence of benzene ring may enhance the antibacterial activity of isothiocyanate flavors, and play an important role in the inhibitory effect of virulence factor gene nuc expression of BZITC in S. aureus.
isothiocyanate flavors; Gram-positive bacteria; antibacterial activity; structure-activity relationship; virulence factor expression
10.7506/spkx1002-6630-201721003
TS202.3
A
1002-6630(2017)21-0015-06
2016-09-13
国家自然科学基金面上项目(31571888);辽宁省高等学校优秀人才支持计划项目(LJQ2015010)
王岩(1991—),女,硕士研究生,研究方向为食品科学与工程。E-mail:18804208629@163.com
*通信作者:张公亮(1978—),男,副教授,博士,研究方向为食品色香味化学。E-mail:zhanggl1978@hotmail.com
王岩, 周倩倩, 万锈琳, 等. 异硫氰酸酯类香料对两种革兰氏阳性致病菌的抑制作用[J]. 食品科学, 2017, 38(21): 15-20.
10.7506/spkx1002-6630-201721003. http://www.spkx.net.cn
WANG Yan, ZHOU Qianqian, WAN Xiulin, et al. Inhibitory effect of isothiocyanate flavors on two Gram-positive pathogenic bacteria[J]. Food Science, 2017, 38(21): 15-20. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201721003. http://www.spkx.net.cn
——香草传

