空肠弯曲菌AhpC蛋白B细胞抗原表位预测及抗原性分析
陈浩浩,李旭升,郭方明,丁明星,胡 野,楼宏强
空肠弯曲菌AhpC蛋白B细胞抗原表位预测及抗原性分析
陈浩浩1,2,李旭升1,郭方明1,丁明星1,胡 野2,楼宏强2
目的利用生物信息学预测分析空肠弯曲菌AhpC的跨膜结构、信号肽及B细胞抗原表位,并分析空肠弯曲菌AhpC优势B细胞抗原表位的抗原性,为后续疫苗研究提供依据。方法使用TMHMM Server V2.0、SignalP 4.1、IEDB等生物信息学分析软件对空肠弯曲菌AhpC进行蛋白跨膜结构预测、信号肽及线性B细胞抗原表位进行预测分析。分别以原核表达的空肠弯曲菌AhpC蛋白和化学合成的表位肽为抗原,空肠弯曲菌AhpC抗体为一抗,通过ELISA及Dot blot对优势线性B细胞抗原表位的抗原性进行分析及筛选。结果生物信息学预测结果表明AhpC定位于空肠弯曲菌外膜,无跨膜结构,无信号肽,同时该蛋白中存在7个的B细胞线性表位。经Dot blot和ELISA检测发现其中AhpC4-16表位具有较强的抗原性,为优势表位。结论空肠弯曲菌AhpC保守存在于细菌表面,存在1个优势的B细胞线性抗原表位(AhpC4-16),可用于后续的疫苗开发研究。
空肠弯曲菌;表位;抗原;烷基过氧化氢还原酶
空肠弯曲菌(Campylobacterjejuni,C.jejuni)是革兰阴性、微需氧的人兽共患病病原菌,主要通过食物感染引起人类急性肠炎[1]。研究发现,空肠弯曲菌在肉猪和奶牛带菌率为10%~30%,肉鸡带菌率高达60%以上[2]。带菌动物的粪便污染水源和食物后感染人类,常可造成暴发流行[3]。空肠弯曲菌感染性腹泻发病率在一些国家和地区居细菌性腹泻的首位,部分国家也仅次于志贺菌或沙门菌[4-5]。表位疫苗是以抗原表位为基础制备的疫苗,是感染性疾病、恶性肿瘤以及自身免疫性疾病等疫苗研制的新方向。烷基过氧化氢还原酶(Alkyl hydroperoxide reductase, AhpC)属于空肠弯曲菌抗氧化酶家族,分子质量为22 kD,在空肠弯曲菌内普遍存在[6],具有高度保守性、稳定性和特异性[7],是理想的空肠弯曲菌疫苗候选抗原和单克隆抗体的筛选抗原。我们拟采用生物信息学技术进行空肠弯曲菌AhpC蛋白保守性分析及B细胞表位预测,利用Dot blot及ELISA,筛选空肠弯曲菌AhpC特异性B细胞抗原表位,为空肠弯曲菌疫苗的研制提供候选表位。
1 材料与方法
1.1材料 本研究表位多肽由苏州强耀生物科技有限公司合成,采用固相多肽合成技术,以N-α-Fmoc保护的氨基酸为原料,Fmoc-AA-Wang树脂为载体,HBTU方法偶联,经HPLC鉴定纯度在95%以上。大肠杆菌DH5α、表达载体pGEX-4T-1为本室保存,限制性核酸内切酶、异丙基硫代半乳糖苷(IPTG)均购自TaKaRa,胶回收试剂盒、质粒提取试剂盒、Marker购自AXYGEN公司,硝酸纤维素膜、ECL试剂盒购自Thermo Fisher公司,小鼠抗GST mAb、HRP标记羊抗兔IgG、HRP标记羊抗小鼠IgG购自北京中杉金桥,GST亲和层析预装柱及其他分析纯购自上海生工,引物合成、质粒测序由上海生工完成。清洁级成年雄性新西兰大白兔由浙江省金华市食品药品检测研究院动物中心提供,动物许可证号:SCXK(浙)2010-0046。
1.2表位预测、合成及KLH交联 空肠弯曲菌NCTC11168株ahpC基因序列(NC_002163.1)及蛋白质序列(CAL34485.1)均在美国国家生物技术信息中心获取。B细胞线性表位预测采用IEDB(http://tools.iedb.org/bcell/)在线预测软件,对线性B细胞表位进行计算和预测。蛋白分子信号肽序列采用CBS网站中SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)。跨膜区预测采用CBS网站中TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM/)。
1.3AphC原核表达、纯化和鉴定 将全基因的合成的aphc片段克隆至pGEX-4T-1载体,构建pGEX-4T-1/ahpc重组质粒。将重组质粒转化到E.coli BL21(DE3)感受态细菌,利用氨苄抗性筛选阳性克隆,PCR验证,提取阳性克隆菌株DNA后经酶切和测序鉴定。质粒的提取、酶切、酶连、转化等按照分子克隆技术常规方法进行。经优化诱导表达条件后,冰水浴超声破碎菌体,收集上清液。按照国家生化工程技术研究中心谷胱甘肽亲和介质纯化程序,纯化目的蛋白,利用SDS-PAGE 电泳及GST 标签抗体进行western blot分析。
1.4抗血清的制备及纯化 选取3只清洁级成年雄性新西兰大白兔,免疫前7 d耳静脉采血1~2 mL获取免疫前血清。取200 μg蛋白-KLH偶联物与等体积的完全弗氏佐剂充分混匀乳化后,背部皮下多点注射,其后每2周免疫1次(以不完全弗氏佐剂取代完全弗氏佐剂,其余同上)。免疫接种4次,末次免疫10 d后心脏采血,分离血清。之后采用饱和硫酸铵沉淀及DEAE-52柱层析法分离抗血清中的IgG,分别命名为纯化抗体1、2、3。
1.5Dot blot检测 将相同浓度待测表位滴加于硝酸纤维素膜上,干燥后,置于封闭液室温封闭1 h,加纯化后的抗体,室温震荡1 h,TBST洗膜3次,加二抗(HRP标记羊抗兔IgG,1∶4000),室温震荡1 h,TBST洗膜3次,ECL显色,拍照。
1.6ELISA检测优势表位 将各待测表位稀释至1 μg/mL,每个反应孔中加50 μL,4 ℃过夜,次日,弃去孔内溶液,TBST洗1次,1%BSA封闭,37 ℃孵育1 h,加纯化后的抗体(浓度为1∶200、1∶1000、1∶5000、1∶10000、1∶20000、1∶60000、1∶240000),室温震荡1 h,TBST洗3次,加二抗(HRP标记羊抗兔IgG,1∶10000),置37 ℃孵育45 min,TBST洗3次,加底物液显色,终止液终止反应,酶标仪读板。
2 结 果
2.1表位预测分析及合成 经SignalP 4.1软件预测分析空肠弯曲菌AhpC信号肽序列,AhpC为无信号肽的蛋白。经TMHMM 2.0分析AhpC跨膜序列显示AhpC无跨膜区,均为胞外序列。经IEDB预测发现AhpC中存在7个主要的线性B细胞抗原表位(图1),相关序列见表1。
2.2重组质粒构建 经过测序,峰型正常,目的基因合成正确,表明载体构建成功,重组蛋白表达纯化后经SDS-PAGE电泳及GST标签抗体western blot检测后,发现48 kD处有明显单一的条带,表明蛋白纯化正确且纯度较高(图2)。
表1 预测空肠弯曲菌AhpC线性B细胞抗原表位序列
Tab.1 Prediction of Campylobacter jejuni AhpC linear B-cell epitope sequence
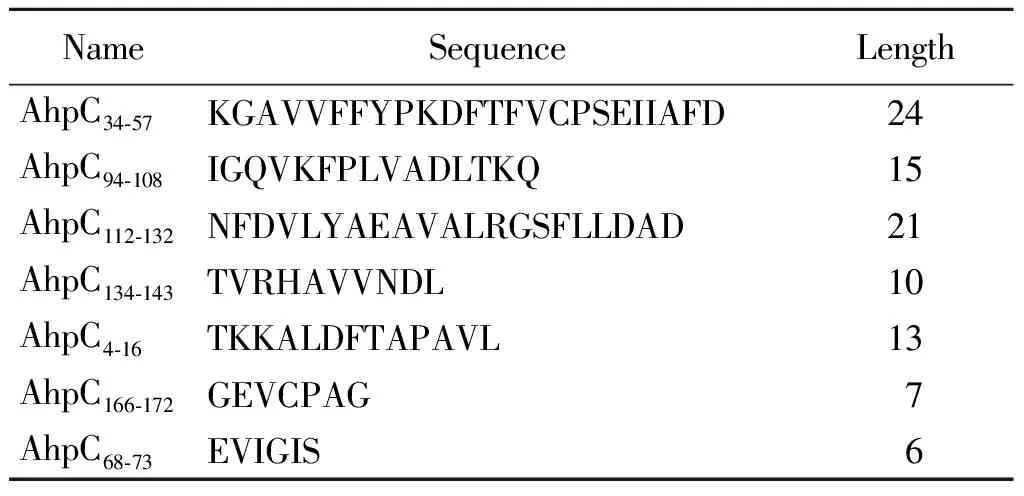
NameSequenceLengthAhpC34⁃57KGAVVFFYPKDFTFVCPSEIIAFD24AhpC94⁃108IGQVKFPLVADLTKQ15AhpC112⁃132NFDVLYAEAVALRGSFLLDAD21AhpC134⁃143TVRHAVVNDL10AhpC4⁃16TKKALDFTAPAVL13AhpC166⁃172GEVCPAG7AhpC68⁃73EVIGIS6
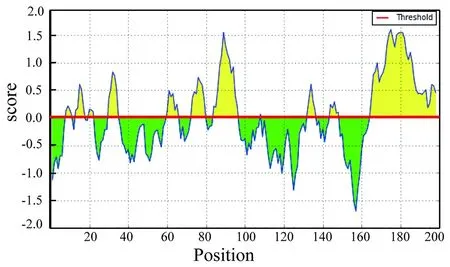
图1 IEDB预测AhpC线性B细胞抗原表位图Fig.1 Prediction of AhpC linear B cell antigen epitopes using IEDB
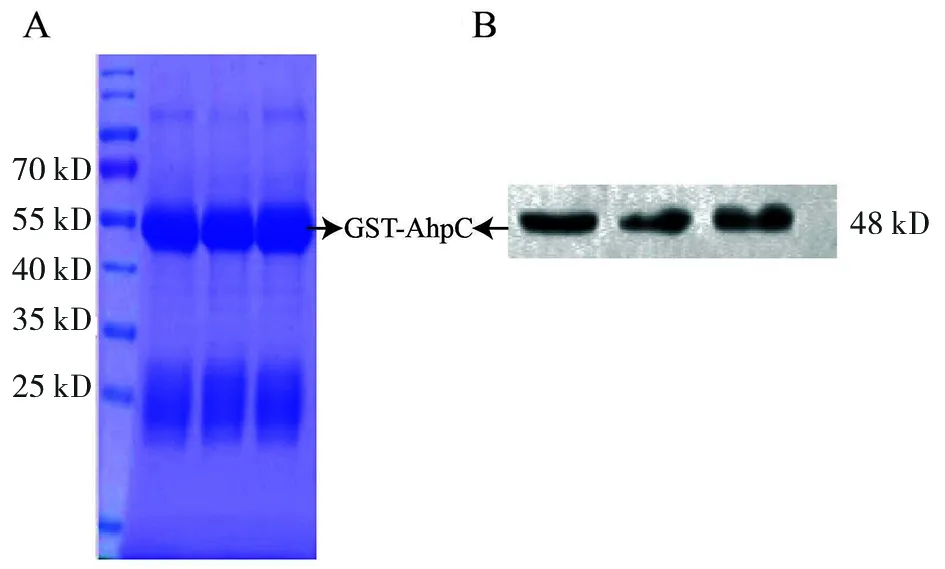
A:SDS-PAGE电泳图B:GST标签抗体western blot结果图A: SDS-PAGE; B: western blot by GST-tagged antibody图2 GST-AphC重组蛋白SDS-PAGE电泳及western blot图Fig.2 SDS-PAGE electrophoresis and western blot of GST-AphC protein
2.3Dot blot检测结果 运用dot blot方法使抗体分别与7条表位肽及AhpC蛋白杂交,结果如图3所示,纯化抗体1与AhpC4-16有阳性反应,纯化抗体2与AhpC4-16及AhpC112-132有明显阳性反应,纯化抗体3与AhpC4-16、AhpC112-132及AhpC166-172有阳性反应,其中以AhpC4-16最明显,综合上述结果判断,AhpC4-16为优势表位。

1为AhpC;2为AhpC34-57;3为AhpC94-108;4为AhpC112-132;5为AhpC134-143;6为AhpC4-16;7为AhpC166-172;8为AhpC68-73。1: AhpC; 2: AhpC34-57; 3: AhpC94-108; 4: AhpC112-132; 5: AhpC134-143; 6: AhpC4-16; 7: AhpC166-172; 8: AhpC68-73. 图3 各纯化抗体与AhpC蛋白及表位肽Dot Blot检测结果图Fig.3 Dot blot results of the purified antibody and AhpC protein, polypeptide
2.4ELISA检测结果 结果显示(图4),纯化抗体1稀释200及1 000倍后与AhpC4-16及AhpC34-57有明显阳性反应,抗体稀释5 000倍后,除AhpC蛋白外仅AhpC4-16有明显信号。纯化抗体2与抗体1类似,除AhpC蛋白外AhpC4-16的在不同的稀释比中吸光度最大。纯化抗体3稀释200及1 000倍后与AhpC4-16、AhpC34-57及AhpC112-132等肽段有明显阳性反应,抗体稀释5 000倍后与AhpC4-16反应后有最大吸光值(AhpC蛋白除外)。综合上述结果判断,AhpC4-16为优势表位。
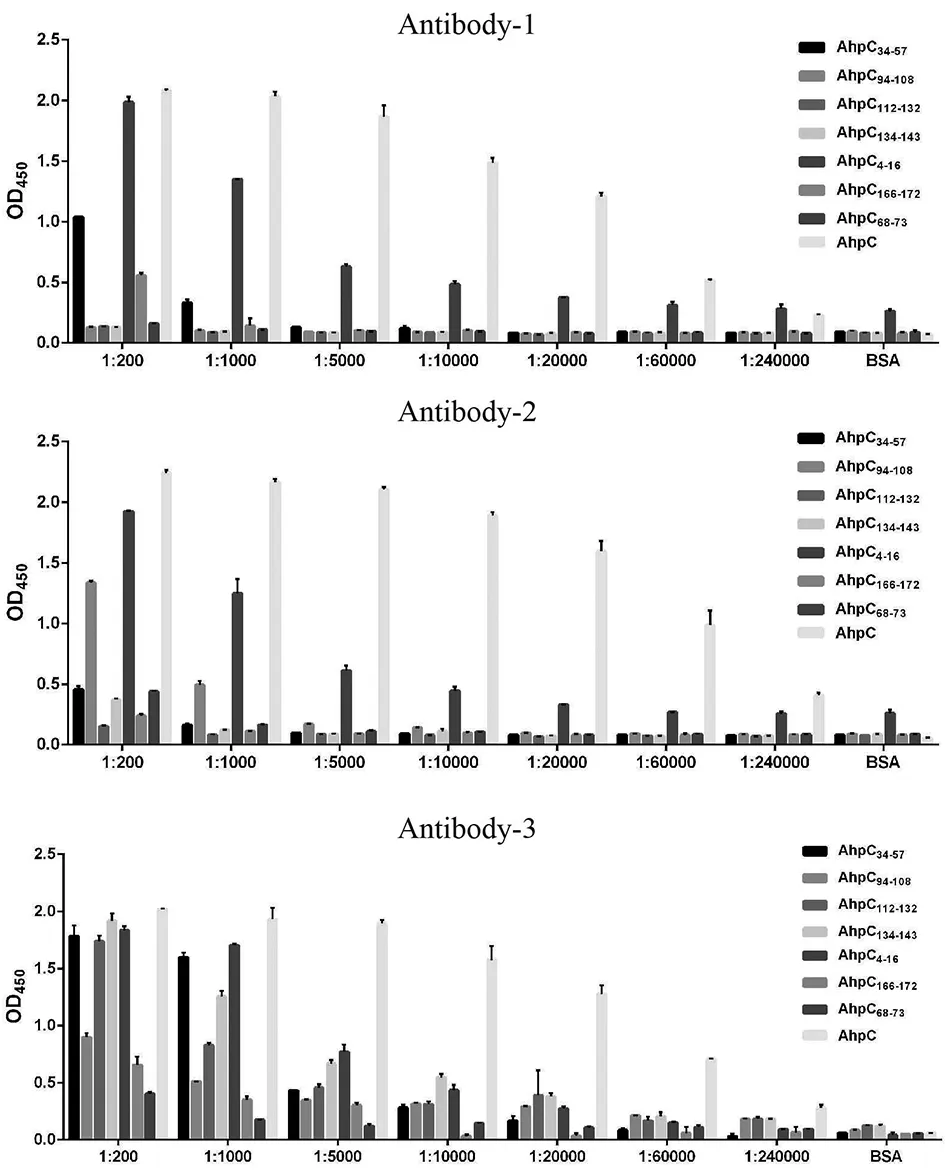
图4 ELISA检测各纯化抗体与表位肽及AhpC蛋白的反应Fig.4 Reaction of each purified antibody with the peptides and AhpC protein detected by ELISA
3 讨 论
空肠弯曲菌引起的食源性感染已成为重要的公共卫生问题,随着耐药菌株的不断增加[9-10],寻求一种新的、安全、有效的亚单位疫苗具有重要的现实意义。
众所周知,抗原通过抗原表位与相应的淋巴细胞表面的抗原受体结合,从而激活淋巴细胞,引起免疫应答,抗原也借表位与相应抗体或致敏淋巴细胞发生特异性结合而发挥免疫效应。因此,制备表位疫苗的关键是确定可被免疫细胞识别的特异性多肽。有研究人员利用毕赤酵母菌重组过表达生成幽门螺杆菌AhpC蛋白,预防性免疫接种小鼠后,55%~77.3%的小鼠不受幽门螺杆菌的感染[11]。国内有研究发现[12],空肠弯曲菌AhpC蛋白具有抗原性,可以作为空肠弯曲菌感染后血清抗体检测的特异抗原。在本研究中,预测并筛选空肠弯曲菌AhpC特异性B细胞抗原表位,并发现AhpC4-16为优势表位,为表位疫苗的制备提供了候选表位。
然而,在细菌感染过程中,由于宿主与致病菌之间的复杂作用机制,单一抗原组分的疫苗难以产生完全而有效的保护作用。因此在单一保护性抗原疫苗研究基础上,构建的多亚单位或包括多个抗原组分的疫苗,将能够激发机体产生比单一亚单位成分更强的免疫反应,并可减少机体变态反应的发生几率。由多种抗原表位组成的多抗原肽(multipleantigenic peptide, MAP)研究策略,为增强诱导免疫保护作用提供了一种新的方式和思维。在我们以前的研究中[13-14],已筛选了空肠弯曲菌OMP18的优势B细胞表位,所以在后续的研究中,我们将构建了多个串联多肽表位,通过动物保护实验中证实其免疫效果。
[1] DuPont HL. Clinical practice. Bacterial Diarrhea[J].N Engl J Med, 2009, 361: 1560-1569. DOI: 10.1056/NEJMcp0904162
[2] Jorgensen F, Bailey R, Williams S, et al. Prevalence and numbers ofSalmonellaandCampylobacterspp. on raw, whole chickens in relation to sampling methods[J]. Int J Food Microbiol, 2002, 76(1/2): 151-164. DOI:10.1016/S0168-1605(02)00027-2
[3] Aboutaleb N, Kuijper EJ, van Dissel JT. Emerging infectious colitis[J]. Curr Opin Gastroenterol, 2014, 30(1): 106-115. DOI: 10.1097/MOG.0000000000000030
[4] Fiedoruk K, Daniluk T, Rozkiewicz D. Conventional and molecular methods in the diagnosis of community-acquired diarrhoea in children under 5 years of age from the north-eastern region of Poland[J]. Int J Infect Dis, 2015, 37: 145-151. DOI: 10.1016/j.ijid.2015.06.028
[5] Ivanova K, Marina M, Petrov P, et al. Campylobacteriosis and other bacterial gastrointestinal diseases in Sofia, Bulgaria for the period 1987-2008[J]. Euro Surveill, 2010, 15(4): 19474.
[6] Oh E, Jeon B. Role of alkyl hydroperoxide reductase (AhpC) in the biofilm formation ofCampylobacterjejuni[J]. PLoS One, 2014, 9(1): e87312. DOI: 10.1371/journal.pone.0087312
[7] Perkins A, Poole LB, Karplus PA. Tuning of peroxiredoxin catalysis for various physiological roles[J]. Biochemistry, 2014, 53(49):7693-7705. DOI: 10.1021/bi5013222
[8] Maue AC, Poly F, Guerry P. A capsule conjugate vaccine approach to prevent diarrheal disease caused byCampylobacterjejuni[J].Hum Vaccin Immunother, 2014, 10(6):499-504. DOI: 10.4161/hv.27985
[9] Hu XJ, Han XF, Zhu DM, et al. Molecular characteristics of multidrug resistantCampylobacterjejuniandCampylobactercoliisolated from broilers[J].Chin J Zoonoses, 2015, 31(8): 694-699. DOI: 10.3969/j.issn.1002-2694.2015.08.002 (in Chinese)
胡欣洁,韩新锋,朱冬梅,等.肉鸡源多重耐药空肠、结肠弯曲菌的耐药分子特征[J].中国人兽共患病学报,2015,31(8): 694-699.
[10] Shin E, Hong H, Oh Y, et al. First report and molecular characterization of aCampylobacterjejuniisolate with extensive drug resistance from a travel-associated human case[J]. Antimicrobial Agents Chemother, 2015, 59(10): 6670-6672. DOI: 10.1128/AAC.01395-15
[11] O’Riordan AA, Morales VA, Mulligan L, et al. Alkyl hydroperoxide reductase: a candidateHelicobacterpylorivaccine[J].Vaccine, 2012, 30(26): 3876-3884. DOI: 10.1016/j.vaccine.2012.04.002
[12] Cao FF, Meng FL, Qiao B, et al. Cloning, expression, purification and antigenicity analysis of AhpC inCampylobacterjejuni[J].Chin J Zoonoses, 2011, 27(10): 909-913. (in Chinese)
曹芳芳,孟凡亮,乔博,等.空肠弯曲菌AhpC蛋白的克隆表达及抗原性分析[J].中国人兽共患病学报,2011,27(10): 909-913.
[13] Lou HQ, Hu Y, Wang L, et al. Analysis and identification of B cell epitopes of the OMP18 fromCampylobacterjejuni[J]. Chin J Zoonoses, 2014, 30(7): 739-742. DOI: 10.3969/cjz.j.issn.1002-2694.2014.07.015 (in Chinese)
楼宏强,胡野,王岚,等.空肠弯曲菌主要外膜蛋白 OMP18的B 细胞抗原表位分析及功能鉴定[J].中国人兽共患病学报,2014,30(7): 739-742.
[14] Lou HQ, Gao SH, Li XS, et al. Establishment of ELISA method for detectingCampylobacterjejunibased on the B-cell antigen epitope of OMP18[J]. Chin J Zoonoses, 2016, 32(10): 889-892. DOI: 10.3969/j.issn.1002-2694.2016.010.008(in Chinese)
楼宏强,高素华,李旭升,等.基于OMP18的B细胞抗原表位的空肠弯曲菌ELISA检测方法的建立[J].中国人兽共患病学报,2016,32(10): 889-892.
CampylobacterjejuniAhpCproteinBcellantigenepitopepredictionandantigenicanalysis
CHEN Hao-hao1,2, LI Xu-sheng1, GUO Fang-ming1,DING Ming-xing1, HU Ye2, LOU Hong-qiang1,2
(1.MedicalMolecularBiologyLaboratory,SchoolofMedicine,JinhuaPolytechnic,Jinhua321007,China;2.InstituteofZoonosis,JinhuaPolytechic,Jinhua321007,China)
To provide evidence forCampylobacterjejuni(C.jejuni) vaccine research, the B cell epitope of AhpC protein were predicted, and the antigenicity was analyzed. AhpC was found locating in outer membrane ofC.jejuniwithout transmembrane structure and no signal peptide by bioinformatics software TMHMM Server V2.0, SignalP 4.1. There were seven B-cell linear epitopes in AhpC predicted by IEDB. Then, the AhpC protein and chemically synthesized antigenic epitopes ofC.jejuniwere used as antigens, and the AhpC antibody ofC.jejuniwas used as the primary antibody, the antigens of predominant linear B cell epitopes were detected by ELISA and dot blot. Results showed that one epitope of B cell epitopes (AhpC4-16) was able to recognize the antibodies ofC.jejuniAhpC and had strong antigenicity, indicating that could be used in the follow-up vaccine research.
Campylobacterjejuni; epitope; antigen; alkyl hydroperoxide reductase
Lou Hong-qiang,Email:yxyjwk@163.com
10.3969/j.issn.1002-2694.2017.10.003
浙江省科技计划项目(No.2016C33229),浙江省科技计划项目(No.2016C37093)和金华市科技研究计划项目(No.2016-3-002)联合资助
楼宏强,Email:yxyjwk@163.com
1.金华职业技术学院医学院分子生物学实验室,金华 321007;2.金华职业技术学院人畜共患病研究所,金华 321007
378
A
1002-2694(2017)10-0868-04
Supported by grants from the Science and Technology Planning Project of Zhejiang Province (Nos.2016C33229, 2016C37093), the Science and Technology Planning Project of Jinhua City (No.2016-3-002).
2017-07-11编辑李友松

