葡萄CIPK基因家族的鉴定表达分析
路志浩,霍建强,马 钰,胡 炜,毛 娟
(甘肃农业大学 园艺学院,兰州 730070)
葡萄CIPK基因家族的鉴定表达分析
路志浩,霍建强,马 钰,胡 炜,毛 娟
(甘肃农业大学 园艺学院,兰州 730070)
以水稻、玉米、拟南芥中已知CIPK基因注册序列为基础,从葡萄基因组数据库中电子克隆出16条CIPK基因。对其理化性质分析表明,除 VvCIPK10编码的251个氨基酸数目外,其余氨基酸数目基本稳定为300~470。整个CIPK家族的理论等电点为6~9。基因结构分析表明, VvCIPK01、 VvCIPK03、 VvCIPK04、 VvCIPK08、 VvCIPK09、 VvCIPK13包含外显子数都大于10; VvCIPK02、 VvCIPK05、 VvCIPK06、 VvCIPK07、 VvCIPK10、 VvCIPK11、 VvCIPK12、 VvCIPK14、 VvCIPK15、 VvCIPK16包含外显子数都小于7。聚类分析表明,CIPK基因被分为4个亚族,且在每一个亚族中都包含葡萄和拟南芥的CIPK基因家族成员,说明它们具有很高的同源性。对CIPK蛋白质的二级结构分析表明,葡萄CIPK基因家族所编码的蛋白质均以α-螺旋和不规则卷曲为主,而β-转角最少。亚细胞定位后发现, VvCIPK基因在细胞质中表达最多。对葡萄CIPK基因家族上游2 kb区域顺式作用元件分析表明, VvCIPK13对于ABA和脱水胁迫的响应最为明显,葡萄CIPK基因家族对于MYB转录因子和WRKY转录因子均有响应。 荧光定量分析表明, VvCIPK15在根中表达量最多,在茎中表达量最少;在不同处理下该基因表达差异性显著。其中,受PEG、ABA、NaCl诱导后呈明显上调表达,其表达量依次为PEGgt;NaClgt;ABA。同时该基因在受到高、低温胁迫时表达量也有明显上调,9个处理中只有在山梨糖中呈下调表达。推测该基因能够参与调控干旱、盐碱、低温等逆境过程。
葡萄;CIPK家族;基因克隆;生物信息学分析;实时定量PCR
葡萄适应性很强,葡萄果实中含有白藜芦醇和多酚等重要营养或药用成分[1]。甘肃土壤的盐渍化与干旱以及冬季的绝对低温是制约葡萄面积扩展的主要因素之一。因此,有关葡萄抗逆性的研究对于扩大葡萄栽培面积以及提高葡萄品质具有重要的意义。
钙调磷酸酶B类似蛋白的互作蛋白激酶CIPK(CBL-interacting protein kinase)是作为下游蛋白与活化的钙调磷酸酶B类似蛋白CBL(Calcineurin B-like proteins)相互作用的一类蛋白[2]。二者的相互作用能将植物Ca2+信号传递下去,而Ca2+作为细胞内重要的第二信使,在植物对抗各种非生物胁迫的防御机制中起着重要的作用[3-4]。研究表明,CIPK基因家族编码蛋白广泛参与植物的逆境胁迫应答和生长发育调控。非生物胁迫因子,如干旱、高盐和低钾等都能引起植物CIPK基因的上调表达。目前,对CIPK基因功能的研究主要集中在拟南芥[5]、水稻[6]和玉米[7]中。研究表明,拟南芥CIPK23编码蛋白在钾离子代谢中有重要作用。当植物受到低钾胁迫时,CBL和 CIPK23相偶联,共同调控钾离子的运输。这个途径已经在拟南芥、水稻、白杨和葡萄中被确定[8-12]。另外,近几年中对于CBL-CIPK信号转导系统的研究也越发深入[13]。研究表明通过 AtCBL1、AtCBL9和 AtCIPK23共同作用后,钾离子运输通道将被激活,以此来调节植物对钾的吸收[9,14]。同时,也有研究提出,CBL可以和PP2C蛋白直接结合,从而去除CIPK的抑制[15]。最近几年,随着大规模植物基因组测序的完成,在杨树、豌豆和苜蓿等植物中对CIPK基因的研究也越来越深入。目前,葡萄基因组测序已完成(http://www.genoscope.cns.fr/externe/Genome Browser/Vitis/),但对葡萄中CIPK基因家族的研究还未见报道。
因此,本研究利用生物信息学技术,从葡萄基因组库中进行CIPK基因家族的电子克隆,将得到的 VvCIPK基因进行染色体定位、理化性质分析、二级结构预测、亚细胞定位、顺式作用元件分析、motif序列分析、同源序列分析以及聚类分析等,同时通过qRT-PCR实时荧光定量技术对逆境胁迫下该基因家族的功能进行鉴定,明确该基因家族在葡萄抗逆中的作用。
1 材料与方法
1.1 材 料
提取RNA所用材料为甘肃农业大学保存的葡萄试管苗‘宝石无核(Gem Seedless)’。
1.2 方 法
1.2.1 葡萄CIPK基因家族成员鉴定 从已知的文献中可以得到25个拟南芥(Arabidopsisthaliala)的CIPK基因ID;30个水稻(Oryzasativa)的CIPK基因ID;43个玉米(Zeamays)的CIPK基因ID。在NCBI中分别输入所有的基因号获得每一条基因对应的CDS与Full-length的序列(http://www.ncbi.nlm.nih.gov)。将获得的CDS输入到葡萄(Vitisvinifera)基因库中,将长度大于1 000 bp的序列保留下来。为了避免重复需要对获得的所有序列进行筛选(使用的工具:DNAMAN)。在葡萄基因库获取已知序列的基因号、CDS长度、氨基酸数目、等电点、分子量大小等理化性质数据(http://www.genoscope.cns.fr/cgi-bin/blast_server/projet_ML/blast.pl)。采用WoLF PSORT进行亚细胞定位(http://www.genscript.com/wolf-psort.html)。
1.2.2 葡萄CIPK基因家族进化及结构分析 利用MEGA 5.0软件和clustalx.exe分析蛋白系统进化关系,采用GSDS进行基因结构分析(http://gsds.cbi.pku.edu.cn/)[16],用http://meme-suite.org/tools/meme进行motif序列分析[17],并在http://meme-suite.org/tools/meme中进行蛋白质二级结构的预测。
1.2.3 葡萄CIPK基因家族表达及其启动子上游2 kb顺式元件分析 根据所得的基因序列提交至PLACE统计分析转录因子及逆境相关顺式作用元件数量(http://www.dna.affrc.go.jp/PLACE/signalscan.html),主要记录的对象有MYB转录因子、WRKY转录因子、ABA响应元件、脱水响应元件以及低温响应元件。
1.2.4 材料处理 将‘宝石无核’葡萄芽的茎段接于MS培养基上,分别置于LED白光(WLED424.724 nm,459 nm)下培养35 d后,选取长势一致的试管苗用于处理,胁迫处理组为:-4 ℃、4 ℃、25 ℃、40 ℃、400 mmol/L NaCl质量分数为10% PEG、400 mmol/L 甘露醇、400 mmol/L山梨糖、50 μmol/L ABA,每个处理设置3组重复,处理时长24 h;以25 ℃处理作为对照。同时以茎为对照,检测根、茎、叶中的表达情况。以上所有植物材料均被立即投入-80 ℃液氮中保存至RNA提取。
1.2.5 实时荧光定量PCR 参照申鹏等[18]方法提取试管苗茎叶混合RNA、试管苗根部RNA、试管苗茎部RNA、试管苗叶片RNA。由 VvCIPK基因家族的CDS序列在Primer Premier 5中设计引物(表1)。引物由上海生工生物工程技术服务有限公司合成。cDNA合成用Prime Script RT reagent Kit(Perfect Real Time) 试剂盒(TaKaRa)。反转录产物在-20 ℃下保存,备用。
实时荧光定量PCR(real-time fluorescent quantitative polymerase chain reaction,qRT-PCR),应用Bio-Rad iCycler iQ实时定量PCR仪,用设计的引物进行PCR 扩增,以葡萄UBQ 基因为内参[19],对 VvCIPK基因家族进行特异性表达分析。扩增体系含1 μL cDNA,上下游引物各 0.8 μL,10.4 μL 反应 MIX,7 μL ddH2O,总体系 20 μL。反应程序为 :95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s,共40个循环;反应结束后分析荧光值变化曲线。试验重复3 次,数据采用Excel 软件分析。
2 结果与分析
2.1 葡萄CIPK基因家族编码蛋白理化性质分析
在NCBI中分别输入水稻、玉米、拟南芥的基因号,获得每一条基因对应的CDS序列(http://www.ncbi.nlm.nih.gov)。将获得的水稻、玉米、拟南芥的CDS序列输入到葡萄基因库中,将长度大于1 000 bp的序列保留下来。为了避免重复,使用DNAMAN对获得的所有序列进行筛选,共得到16条 VvCIPK基因。与水稻、玉米、拟南芥相比,葡萄CIPK基因在数量上均少于上述3种模式作物。对电子克隆出的葡萄CIPK基因家族的16条基因分别命名为 VvCIPK01、 VvCIPK02、 VvCIPK03、 VvCIPK04、 VvCIPK05、 VvCIPK06、 VvCIPK07、 VvCIPK08、 VvCIPK09、 VvCIPK10、 VvCIPK11、 VvCIPK12、 VvCIPK13、 VvCIPK14、 VvCIPK15、 VvCIPK16。玉米中有43个CIPK基因,但只有26个含有FL-cDNA,而在 VvCIPK基因家族中均有FL-cDNA。 VvCIPK01与 VvCIPK07分布于5号染色体上, VvCIPK02与 VvCIPK03分布于6号染色体上, VvCIPK14与 VvCIPK15分布于8号染色体上, VvCIPK11与 VvCIPK16分布于9号染色体上, VvCIPK05与 VvCIPK12分布于10号染色体上, VvCIPK04、 VvCIPK06与 VvCIPK13分布于11号染色体上, VvCIPK08分布于18号染色体上, VvCIPK09分布于15号染色体上, VvCIPK10分布于13号染色体上(图1)。对蛋白质理化性质分析表明, VvCIPK10编码的氨基酸数目为251个,其余 VvCIPK基因家族成员编码的氨基酸数目为300~470,整体小于玉米中CIPK所编码的氨基酸数目。 VvCIPK家族的理论等电点均分布在6~9,酸性氨基酸有5个,分别是: VvCIPK01、 VvCIPK03、 VvCIPK08、 VvCIPK12、 VvCIPK13。 VvCIPK基因家族成员的序列长度各不相同, VvCIPK04序列最长且包含14个外显子, VvCIPK06的序列最短且仅包含3个外显子。 VvCIPK02、 VvCIPK06、 VvCIPK10和 VvCIPK16外显子数目最少,均含有3个; VvCIPK05、 VvCIPK07、 VvCIPK11、 VvCIPK14和 VvCIPK15均含有4个外显子,除 VvCIPK12有 7个外显子外,其余 VvCIPK基因上的外显子个数均大于10(表2)。

表1 VvCIPK基因家族表达分析的实时荧光定量引物Table 1 qRT-PCR primers for expression on analysis of VvCIPKs
2.2葡萄CIPK基因家族多序列比对及其进化分析
对 VvCIPK基因家族进行多序列比对分析发现: VvCIPK基因家族在C端和N端的均不保守。 VvCIPK10编码的氨基酸序列长度最小(图2)。为进一步了解葡萄CIPK蛋白的系谱发生及功能特征,本研究对葡萄CIPK基因家族编码的氨基酸序列与已经鉴定出的拟南芥、水稻、玉米的CIPK基因家族编码氨基酸序列进行了聚类分析。结果表明,所有的氨基酸序列被分成4个亚族。第一亚族(GroupⅠ)包含27个基因序列,其中6个基因来自葡萄,9个基因来自拟南芥,其余12个基因来自水稻和玉米,其中 VvCIPK03的亲缘关系和水稻CIPK基因亲缘关系相近,其余5个 VvCIPK基因均与拟南芥CIPK基因关系相近;第2亚族(GroupⅡ)包含19个基因序列,其中3个基因来自葡萄,8个基因来自拟南芥,其余8个基因来自水稻和玉米,其中 VvCIPK01与水稻CIPK亲缘关系相近,其余2个 VvCIPK基因与拟南芥CIPK关系相近;第3亚族(GroupⅢ)包含20个基因序列, 其中6个基因来自葡萄,6个基因来自拟南芥,其余8个基因来自水稻和玉米,该亚族中包含的所有 VvCIPK基因都和拟南芥CIPK基因亲缘关系相近;第4亚族(GroupⅣ)包含9个基因,1个基因来自葡萄,2个基因来自拟南芥,其余6个基因来自水稻和玉米,该亚族中的 VvCIPK基因和水稻CIPK亲缘关系相近(图3)。所以整体上 VvCIPK基因与AtCIPK基因同源性高,说明该基因在进化上比较保守。

图1 葡萄 CIPK基因在染色体上的分布Fig.1 The distribution of CIPK genes in grape chromosome
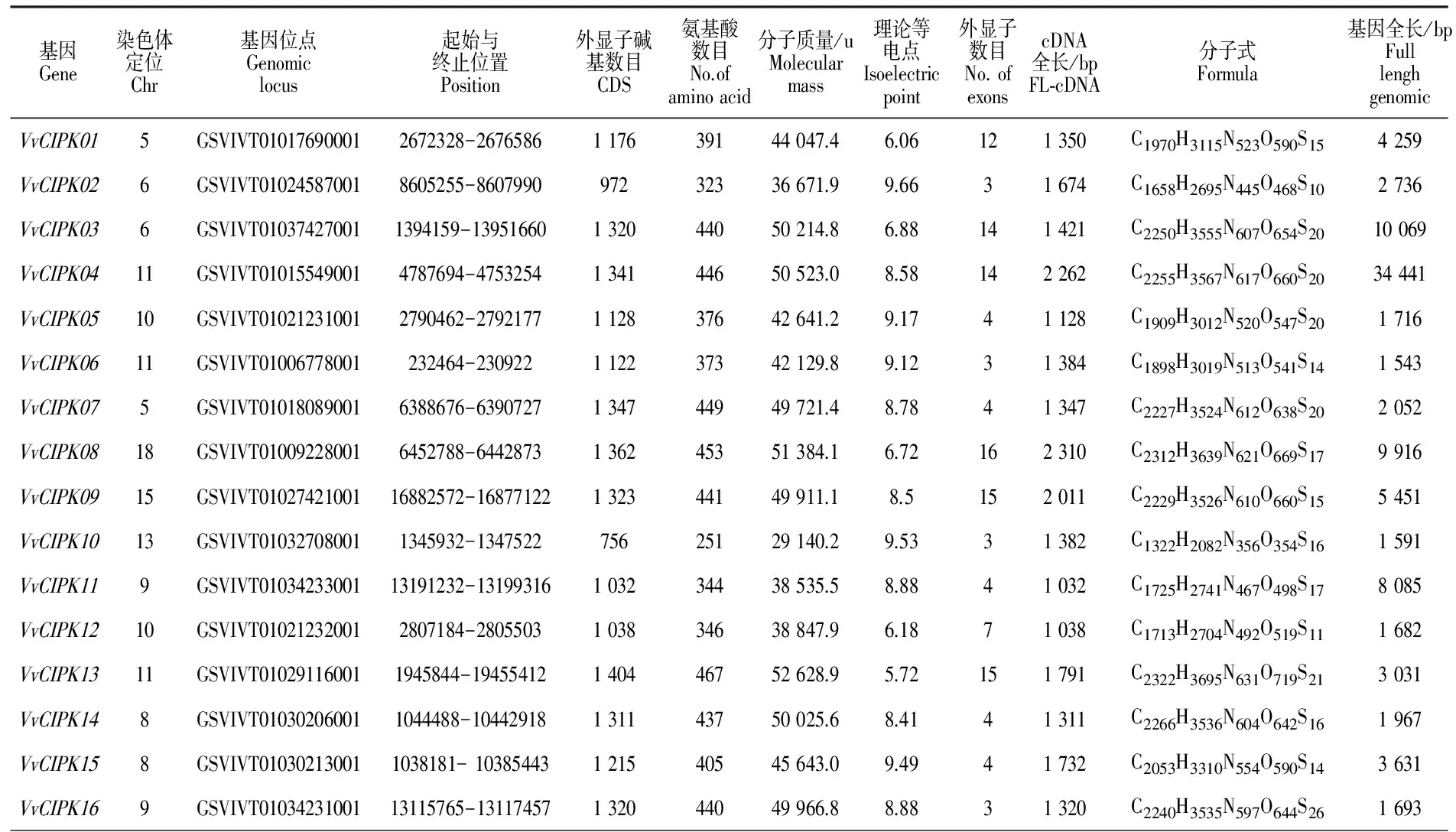
表2 葡萄 CIPK基因理化性质Table 2 The physical and chemical property of VvCIPK
2.3 葡萄CIPK基因家族基因结构分析
VvCIPK基因家族结构分析表明,该基因家族分为2组,一组包含外显子个数小于7,另一组包含外显子个数均大于10。外显子个数小于7的基因有: VvCIPK02、 VvCIPK05、 VvCIPK06、 VvCIPK07、 VvCIPK10、 VvCIPK11、 VvCIPK12、 VvCIPK14、 VvCIPK15和 VvCIPK16。外显子个数大于10的基因有: VvCIPK01、 VvCIPK03、 VvCIPK04、 VvCIPK08、 VvCIPK09和 VvCIPK13。 VvCIPK基因家族外显子长度保守性差,没有显著规律(图4)。
2.4 葡萄CIPK基因家族Motif序列分析
Motif分析表明:在 VvCIPK基因家族中共找到25个motif序列,结合聚类树分析和基因结构分析结果可以将 VvCIPK01、 VvCIPK03、 VvCIPK04、 VvCIPK08、 VvCIPK09、 VvCIPK16和 VvCIPK13分为一组,这些序列上共有的motif排列顺序为motif4、motif3、motif9、motif1、motif2、motif7、motif10和motif8,同时除 VvCIPK01以外,其余6条基因均聚到第1亚族内(GroupⅠ),但 VvCIPK01的外显子分类又和 VvCIPK03、 VvCIPK04、 VvCIPK08、 VvCIPK09和 VvCIPK13相似。故推测这7条基因执行的功能相近。motif16到motif25这10个motif序列都只分布在葡萄CIPK基因家族中的某2个成员上,motif16只存在于 VvCIPK05和 VvCIPK11中,motif20只存在于 VvCIPK10和 VvCIPK13中,motif18只存在于 VvCIPK02和 VvCIPK12中,motif19只存在于 VvCIPK04和 VvCIPK16。但是分布的位置却差异很大,故推测这些motif发挥功能的时间以及协作表达的蛋白上有可能存在差异(图5)。

图3 拟南芥、水稻、玉米和葡萄CIPK基因进化树Fig.3 The phylogenetic tree using the CIPK full length amino acid sequence from grape Arabidopsis, rice and maize
2.5葡萄CIPK基因家族亚细胞定位和蛋白质二级结构分析
亚细胞定位结果表明,除了 VvCIPK09外,葡萄CIPK基因家族在细胞质中均有表达;除了 VvCIPK06外,葡萄CIPK基因家族在叶绿体内均有表达。 VvCIPK01、 VvCIPK02分别只在过氧化物酶体和细胞骨架中表达。在高尔基体中表达的基因有 VvCIPK03和 VvCIPK09;在细胞基质中表达的基因有 VvCIPK10和 VvCIPK12(表3)。
葡萄CIPK基因家族编码蛋白质的二级结构主要有α-螺旋、β-转角与不规则卷曲。二级结构分析表明: VvCIPK基因家族编码的16条蛋白主要以α-螺旋和不规则卷曲为主(表4)。
2.6葡萄CIPK基因启动子上游2kb顺式作用元件分析
为了确定 VvCIPK基因家族启动子上游2 kb 区域的顺式作用元件,在该基因家族起始密码子上游2 kb碱基序列中进行搜索,结果表明: VvCIPK基因家族成员都含有MYB转录因子和WRKY转录因子,但是ABRE、DRE和LTRE则有很大不同。在 VvCIPK基因家族中,除 VvCIPK02、 VvCIPK10、 VvCIPK11、 VvCIPK12、 VvCIPK16其余均含有ABRE响应元件; VvCIPK06、 VvCIPK12、 VvCIPK13、 VvCIPK14、 VvCIPK15中含有DRE。 VvCIPK13在ABRE和DRE上的响应均最高。 VvCIPK11和 VvCIPK16只含有MYB与WRKY转录因子(表5)。

图4 葡萄CIPK基因家族的基因结构Fig.4 Gene structures of CIPK in grape

图5 葡萄CIPK 基因家族motif分析Fig.5 Grape CIPK gene family motif analysis
2.7 葡萄 CIPK15基因的实时定量分析
结果表明:除 VvCIPK15外,其余15个基因在根、叶、茎中的表达量基本一致,并且在不同胁迫处理下的表达量没有显著性差异。 VvCIPK15在根、叶、茎中的表达差异性显著。其中,茎中的表达量最少,根中的表达量最高,是对照的1.38倍(以茎为对照),并且在根和叶中均呈上调表达(图6)。 VvCIPK15在不同处理下,基因的表达情况:只有在400 mmol/L山梨糖处理24 h后呈下调表达,其余各个处理下, VvCIPK15呈上调表达。经过质量分数为10% PEG处理24 h后 VvCIPK15的相对表达量最高,是对照的5.24倍(以25 ℃为对照);经过400 mmol/L NaCl处理24 h后 VvCIPK15的相对表达量是对照的4.90倍;经过50 μmol/L ABA处理24 h后 VvCIPK15的相对表达量是对照的4.49倍。同时,在-4 ℃、4 ℃和40 ℃经24 h处理后,该基因均呈上调表达,说明 VvCIPK15也受高、低温胁迫诱导表达。故推测, VvCIPK15受高盐、干旱和温度胁迫的诱导,同时还受ABA的强烈诱导(图7)。

表3 葡萄 CIPK基因亚细胞定位预测Table 3 Subcellular location prediction of CIPK gene in grape

表4 葡萄CIPK蛋白二级结构分析Table 4 The secondary structure of CIPK protein sequence in grape %

表5 VvCIPK基因上游2 kb区域顺式作用元件的分布Table 5 Putative Cis-elements existed in the 2 kb upstream region of VvCIPK genes

图6 葡萄 CIPK15 基因在不同器官中的表达Fig.6 The relative expression of VvCIPK15 gene in different organs

1.-4 ℃;2.4 ℃;3.25 ℃;4.400 mmol/L NaCl;5.40 ℃;6.400 mmol/L甘露醇400 mmol/L mannitol;7.400 mmol/L山梨糖 400 mmol/L sorbose;8.10%PEG;9.50 μmol/L ABA
图7葡萄CIPK15基因在不同处理下的表达
Fig.7VvCIPK15geneexpressionunderdifferenttreatment
3 讨 论
植物在不断进化的过程中发展出一套应对各种非生物逆境的保护机制,这些逆境包括干旱、寒冷、高盐、高温和氧化等等。在这些不利因素下,植物可以通过启动相关基因及改变蛋白结构等来保护细胞内的各种新陈代谢反应,从而维持植物体结构与功能的完整性[20]。有研究表明CBL-CIPK信号系统在各种逆境响应中起到了重要的作用[21]。
本试验共得到16条葡萄CIPK基因,分别命名为 VvCIPK01~ VvCIPK16,其所处的位置、大小均有差异。与水稻、玉米、拟南芥CIPK基因家族包含基因个数相比,葡萄CIPK基因家族包含基因个数少于上述3种植物。本试验依据进化结果将葡萄CIPK基因家族分为4个亚族。进化分析结果显示: VvCIPK01、 VvCIPK03与水稻CIPK和玉米CIPK同源性高, VvCIPK07和水稻CIPK同源性高, VvCIPK基因家族的其他成员均与拟南芥CIPK基因家族同源性高。 ZmCIPK21基因组含有14个外显子和13个内含子,蛋白结构上具有CIPK所共有的C端NAF保守结构域[22], VvCIPK01中有12个外显子,故 VvCIPK01和 ZmCIPK21都属于多外显子的CIPK序列,并且 VvCIPK01的蛋白结构上C端具有NAF保守结构域。 ZmCIPK03与 VvCIPK03对比结果与 VvCIPK01和 ZmCIPK21对比结果相似,都属于CIPK基因中多外显子一类,并且均含有NAF保守结构域[23]。故推测聚类树中与葡萄CIPK同源性高的基因在内部结构上具有相似性。在外显子的分布上,葡萄、拟南芥、水稻、玉米、杨树CIPK基因的外显子都可以分为多外显子和少外显子2类。表明CIPK基因的进化比较早,这2个分支的祖先在单、双子叶分化之前就已经存在于植物的基因组中[24-26]。对 VvCIPK编码的蛋白质进行二级结构预测,发现他们以α-螺旋和不规则卷曲为主。这和甘蔗中CIPK编码蛋白的二级结构在组成上有相似之处,都是以α-螺旋和不规则卷曲为主[27]。在对 VvCIPK表达部位进行预测后发现,它们大多数在细胞质和叶绿体中表达。但是CIPK基因家族在野大麦中的表达部位则主要聚集在细胞膜和细胞核上[28]。本试验对启动子上游2 kb顺式作用元件分析发现: VvCIPK基因家族成员对于ABA、高盐、干旱均有响应,其中,ABA响应最为强烈,干旱响应最弱。故推测该基因家族在逆境诱导下会有响应。
已有研究表明,植物CIPK基因在逆境胁迫中有重要作用。同时,干旱或者高盐引起的胁迫信号至少通过ABA依赖和ABA不依赖的2条途经转导[29]。本试验荧光定量结果表明 VvCIPK15受ABA、PEG、NaCl以及低温胁迫的诱导较强,说明该基因可能与干旱或渗透胁迫有关并且依赖ABA途径。 ZmCIPK03、ZmCIPK42以及其他玉米CIPK基因家族成员对于PEG、NaCl以及低温胁迫均会有不同程度的上调表达,但不是所有玉米CIPK基因家族成员的表达都依赖ABA途径[7,22,30]。水稻CIPK基因家族也受ABA、高盐、干旱、低温等逆境诱导表达[6]。这一结果与本研究中葡萄 CIPK15的表达情况相似。说明 VvCIPK基因家族很可能在逆境响应中起到重要的作用。
Reference:
[1] 房经贵,章 镇,陶建敏,等.江苏发展葡萄的条件和策略[J].中外葡萄与葡萄酒,2001(3):7-8.
FANG J G,ZHANG ZH,TAO J M,etal.Conditions and strategy of development of grape in Jiangsu[J].GrapeandWineinChinaandForeignCountries,2001(3):7-8( in Chinese).
[2] 张俊文,魏建华,王宏芝,等.CBL-CIPK信号系统在植物应答逆境胁迫中的作用与机制[J].自然科学发展,2008,18(8):847-856.
ZHANG J W,WEI J H,WANG H ZH,etal.Functions and action mechanisms of CBL-CIPK signaling system in plants response treatment stress[J].DevelopmentofNaturalScience,2008,18(8):847-856( in Chinese).
[3] 赵晋锋,余爱丽,王高鸿,等.植物CBL/CIPK网络系统逆境应答研究进展[J].中国农业科技导报,2011,13(4):32-38.
ZHAO J F,YU A L,WANG G H,etal.Progress of CBL/CIPK signal system in response to stresses in plant[J].JournalofAgriculturalScienceandTechnology,2011,13(4):32-38(in Chinese with English abstract).
[4] 贾 如,雷梦琦,徐佳妮,等.植物细胞中钙通道的分布及其在植物抗逆机制中作用的研究进展[J].植物生理学报,2014,50(12):1791-1800
JIA R,LEI M Q,XU J N,etal.Research progress of Ca2+channel and the effect of Ca2+on plant resistancemechanism in plant cells[J].PlantPhysiologyJournal,2014,50(12):1791-1800(in Chinese with English abstract) .
[5] NER K,STEFAN W,DRAGICA B,etal.Calcium sensors and their interacting protein kinases:genomics of the arabidopsis and rice CBL-CIPK signaling networks[J].PlantPhysiology,2004,134(1):43-58.
[6] YONG X,YUE M H,XIONG L Z.Characterization of stress-responsiveCIPKgenes in rice for stress tolerance improvement[J].PlantPhysiology,2007,144(1):1416-1428.
[7] XI F C,GU Z M,XIN D D,etal.Identification and characterization of putativeCIPKGenes in maize[J].JournalofGeneticsandGenomics,2011,38(2):77-87.
[8] 王 毅,武维华.植物钾营养高效分子遗传机制[J].植物学报,2009,44(1):27-36.
WANG Y,WU W H.Molecular genetic mechanism of high efficient potassium up take in plants[J].ChineseBulletinofBotany,2009,44(1):27-36(in Chinese with English abstract).
[9] CHEONG Y H,PANDEY G K,GRANT J J,etal.Two calcineurin B-like calcium sensors,interacting with protein kinase CIPK23,regulate leaf transpiration and root potassium uptake inArabidopsis[J].PlantJournal,2007,52(2):223-239.
[10] CULIAR T,PASCAUD F,VERDEIL J L,etal.A grapevine Shaker inward K+channel activated by the calcineurin B-like calcium sensor 1-protein kinase CIPK23 network is expressed in grape berries under drought stress conditions[J].PlantJournal,2010,61(1):58-69.
[11] 张成伟,王天宇,黎 裕.植物中CBL-CIPK途径转导特异Ca2+信号的分子机制[J].植物遗传资源学报,2010,11(4):462-468,473.
ZHANG CH W,WANG T Y,LI Y.Molecular mechanisms of transducting specific calcium signal in CBL-CIPK pathway in plant[J].JournalofPlantGeneticResources,2010,11(4):462-468,473(in Chinese with English abstract).
[12] LI J,LONG Y,QI G N,etal.The Os-AKT1 channel is critical for K+uptake in rice roots and is modulated by the rice CBL1-CIPK23 complex[J].PlantCell,2014,26(8):3387-3402.
[13] 汤湖斌,闵康康,徐玲玲,等.CBL-CIPKs信号系统的研究进展[J].中国细胞生物学学报,2015,37(1):100-105.
TANG H B,MIN K K,XU L L,etal.Research progress in CBL-CIPKs signaling system [J].ChineseJournalofCellBiology,2015,37(1):100-105(in Chinese with English abstract).
[14] XU J,LI H,CHEN L,etal.A protein kinase,interacting with two calcineurin B-like proteins,regulates K+transporter AKT1 inArabidopsis[J].Cell,2006,125(7):1347-1360.
[15] LAN W,LEE S C,CHE Y,etal.Mechanistic analysis of AKT1 regulation by the CBL-CIPK-PP2CA interactions[J].MolecularPlant,2011,4(3):527-536.
[16] ZHANG Z B,ZHANG J W,CHEN Y J,etal.Genome-wide analysis and identification of HAK potassium transporter gene family in maize(ZeamaysL.)[J].MolecularBiologyReports,2012,39(8):8465-8473.
[17] BAILEY T L,BODEN M,BUSKE F A,etal.MEME SUITE:toolsfor motif discovery and searching[J].NucleicAcidsResearch,2009,37(8):202-208.
[18] 申 鹏,陈佰鸿.葡萄不同生育期总 RNA 提取及 SSH 建立[D].兰州:甘肃农业大学,2013.
SHEN P,CHEN B H.Extraction of total rna in different growth periods of grapevine and construction of suppression subtractive hybridization[D].Lanzhou:Gansu Agricultural University,2013( in Chinese with English abstract).
[19] 许 明, 伊恒杰, 赵 帅,等. 显齿蛇葡萄实时荧光定量PCR内参基因的筛选与验证[J].中草药,2017,48(6):1192-1198.
XU M,YI H J,ZHAO SH,etal.Screening and validation of reference genes for quantitative RT-PCR analysis in Ampelopsis grossedentata[J].ChineseTraditionalandHerbalDrugs,2017,48(6):1192-1198(in Chinese with English abstract).
[20] 李 琳,柳参奎.SnRK蛋白激酶家族及其成员SnRK2的功能[J].分子植物育种,2010,8(3):547-555.
LI L,LIU SH K.The SnRK protein kinase family and the function of SnRK2 protein kinase[J].MolecularPlantBreeding,2010,8(3):547-555(in Chinese with English abstract).
[21] 沈金秋,郑仲仲,潘伟槐,等.植物CBL-CIPK信号系统的功能及其作用机理[J].植物生理学报,2014,50(4):641-650.
SHEN J Q,ZHENG ZH ZH,PAN W H,etal.Functions and action mechanisms of CBL-CIPK signaling system in plants[J].PlantPhysiologyJournal,2014,50(4):641-650(in Chinese with English abstract).
[22] 陈勋基,李建平,郝晓燕,等.玉米 ZmCIPK21基因的克隆与分析[J].核农学报,2012,26(6):862-867.
CHEN X J,LI J P,HAO X Y,etal.Cloning and chara cterization of amaize ZmCIPK21 gene[J].JournalofNuclearAgriculturalSciences,2012,26(6):862-867(in Chinese with English abstract).
[23] 袁志恒,申腾飞,王 琦,等.玉米CIPK3 蛋白激酶的克隆及表达分析[J].河南农业大学学报,2012,46(4):359-369.
YUAN ZH H,SHEN T F,WANG Q,etal.Cloning and expression analysis of a CBL-interacting protein kinase of maize[J].JournalofHenanAgriculturalUniversity,2012,46(4):359-369(in Chinese with English abstract).
[24] 陈析丰,顾志敏,刘 峰,等.生物与非生物胁迫下水稻CIPK基因的鉴定分析[J].中国水稻科学,2010,24(6):567-574.
CHEN X F,GU ZH M,LIU F,etal.Molecular analysis of rice CIPKs involved in biotic and abiotic stress responses[J].ChinaJournalRiceScience,2010,24(6):567-574(in Chinese with English abstract).
[25] YU Y H,XIA X L,YIN W L,etal.Comparative genomic analysis ofCIPKGene family inArabidopsisand populus[J].PlantGrowthRegulation,2007,52(2):101-110.
[26] KOLUKISAOGLU U,WEINL S,BLAZEVIC D,etal.Calcium sensors and their interacting protein kinases:Genomics of theArabidopsisand rice CBL-CIPK signaling networks[J].PlantPhysiology,2004,134(1):43-58.
[27] 黄 珑,苏炜华,张玉叶,等.甘蔗CIPK基因的同源克隆与表达[J].作物学报2015,41(3):499-506.
HUANG L,SU W H,ZHANG Y Y,etal.Cloning and expression analysis ofCIPKgene in sugarcane[J].ActaAgronomicaSinica,2015,41(3):499-5061(in Chinese with English abstract).
[28] 李率帅,阚国仕,魏建华,等.野大麦CIPK基因的亚细胞定位[J].辽宁农业科学,2011(4):1-5.
LI SH SH,KAN G SH,WEI J H,etal.The subcellular localization of CIPK fromHordeumbrevisubulatum[J].LiaoningAgriculturalSciences,2011(4):1-5(in Chinese with English abstract).
[29] ANGELO D C,WEINl S,BATISTIC O,etal.Altrnative complex formation of the Ca+-regulated protein kinase CIPK1 controls abscisic acid dependent and independent stress responses inArabidopsis[J].PlantJournal,2006,48(6):857-872.
[30] 陈勋基,陈 果,邵 琳,等.玉米 ZmCIPK42克隆及逆境胁迫后表达特异性分析[J].分子植物育种,2013,11(3):326-331.
CHEN X J,CHEN G,SHAO L,etal. ZmCIPK42 cloning and its specific expression profiles under stress in maize[J].MolecularPlantBreeding,2013,11(3):326-331(in Chinese with English abstract).
CorrespondingauthorMAO Juan,female, Ph.D,associate professor. Research area:biotechnology of fruit trees.E-mail:maojuan@gsau.edu.cn
(责任编辑:潘学燕Responsibleeditor:PANXueyan)
Genome-wideIdentificationandExpressionAnalysisoftheCIPKGeneFamilyinGrape
LU Zhihao,HUO Jianqiang,MA Yu,HU Wei and MAO Juan
(College of Horticulture, Gansu Agricultural University, Lanzhou 730070,China)
This work was based on known genes of rice, maize and arabidopsis. A total of 16 members of this family were identified in grape genome. Analyzing their physical and chemical properties revealed all of the genes of amino acid number distribute on 300-470 but VvCIPK10 which has 251 amino acid. Theoretical isoelectric point of the whole genes distributed on 6-9.Analyzing structure of genes indicated that a part of exon of VvCIPK were more than 10( VvCIPK01, VvCIPK03, VvCIPK04, VvCIPK08, VvCIPK09 and VvCIPK13), the others were less than 7( VvCIPK02, VvCIPK05, VvCIPK06, VvCIPK07, VvCIPK10, VvCIPK11, VvCIPK12, VvCIPK14, VvCIPK15 and VvCIPK16).Phylogenetic analysis indicated that all the proteins fell into four major clusters, and every cluster contained a part of genes of grape and arabidopsis. It indicated high homology relationship of those genes.Analyzing the secondary structure of VvCIPK protein sequence indicated that most ratio were alpha helix and irregular curly, the ratio of beta angle was the least. The whole genes chief expressed in cytoplasm by using subcellular location prediction. Analysis Cis-elements in the 2 kb upstream region indicated that the response of ABA and drought stress in VvCIPK13 was the most. Meanwhile the response of MYB and WRKY in VvCIPK were existence. Real-time quantitative analysis revealed that the expression of VvCIPK15 was the most in root. Meanwhile the expression of VvCIPK15 existed large difference under the different treatment.The inducible expression level of VvCIPK15 was significantly up-regulated under the PEG, NaCl, ABA stress. The expression was the most under the treatment of PEG. Second was NaCl. Third was ABA. The inducible expression level of VvCIPK15 was also significantly up-regulated under high or low temperature stress. This gene was only down-regulated in sorbose. VvCIPK15 may play a significance role in the process of drought,salt,cold and so on.
Grape; CIPKs gene family; Gene clone; Bioinformatic analysis; Real-time PCR
2016-06-08
2016-10-15
Student Research Training Program of Nation in Gansu Agricultural University(No.201510733005);the National Natural Science Foundation of China(No.31460500).
LU Zhihao,male,bachelor student.Research area:biotechnology of fruit trees. E-mail:1790665627@qq.com
日期:2017-11-17
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20171117.1101.018.html
2016-06-08
2016-10-15
甘肃农业大学国家级大学生科技创新项目(201510733005);国家自然科学基金(31460500)。
路志浩,男,在读本科生,研究方向为果树生物技术。E-mail: 1790665627@qq.com
毛 娟,女,博士,副教授,研究方向为果树生物技术。E-mail: maojuan@gsau.edu.cn
S663.1
A
1004-1389(2017)11-1619-12

