酶解水溶剂法提取莜麦多酚的工艺研究
吕俊丽 游新勇 任志龙 刘中原
(内蒙古科技大学生命科学与技术学院1,包头 014010) (包头轻工职业技术学院食品药品工程学院2, 包头 014035)
酶解水溶剂法提取莜麦多酚的工艺研究
吕俊丽1游新勇1任志龙2刘中原1
(内蒙古科技大学生命科学与技术学院1,包头 014010) (包头轻工职业技术学院食品药品工程学院2, 包头 014035)
莜麦是内蒙地区特色作物之一,具有降血糖、降血脂等生理功能。为了研究莜麦中多酚的提取,以内蒙古莜麦为原料,以多酚得率为依据,在单因素试验的基础上,通过正交试验对酶解水溶剂法提取酚类物质的工艺进行优化,得出最佳提取工艺为:复合酶用量0.8%,酶解时间80 min,酶解温度55 ℃,pH值5.0,此时酚类物质的得率为:2.950 mg/g。在此基础上与微波辅助有机溶剂提取法比较,得出酶法提取多酚得率显著高于微波辅助提取法。表明:在提取莜麦多酚方面,酶解水溶剂提取法优于微波辅助有机溶剂提取法。
莜麦 酚类 酶解法
莜麦 (AvenasativaL.)属于禾本科植物,是内蒙古地区特色作物之一,其富含蛋白质、不饱和脂肪酸、膳食纤维、多酚等营养成分,具有降血糖、降血脂、清除自由基等多种生理功能[1-2]。目前关于莜麦的研究和利用多停留在蛋白质、油脂及膳食纤维方面,对多酚的研究还远远不够[3]。莜麦中的多酚类物质在降血脂、降血压、降低胆固醇、预防心脑血管疾病等方面有显著的效果,可以作为功能性成分进行提取。莜麦中游离态的酚类物质最少,绝大多数酚类化合物以不溶解的结合状态存在[4],这给莜麦多酚的提取带来了一定的困难。为了使莜麦中的结合态多酚释放出来,有研究者通过发芽处理来增加莜麦中多酚类物质的含量[5],同时使得发芽后谷物的功能活性有所提高[6-8]。
为了有效获取莜麦中的多酚,研究者们已通过多种途径提取。最常用的方法是溶剂提取法[9],此法操作简单,设备需求低,但同时也存在处理时间长、提取效率低等缺点。另有一些辅助提取法如微波辅助[10]、超声波辅助[11]等提取法试图提高莜麦多酚的得率[12-13],但始终无法避免大量有机试剂如乙醇的使用,造成了不可避免的环境污染和能源浪费。
近年来,有研究者将酶法引入植物组分有效成分的提取,并得到广泛的应用[14-16]。与其他方法相比,酶处理方法具有快速、高效、温和、专一性强等诸多优点,并且在成本和使用上更加简便,对设备和工艺的要求也较少[17]。然而,迄今为止,使用酶法提取莜麦多酚的研究还非常有限。
以内蒙古特产莜麦为原料,基于其多酚大多与多糖及细胞壁成分以结合态的方式存在,本试验拟利用复合酶(淀粉酶和纤维素酶),探究酶法提取多酚类物质的最佳工艺,旨在为多酚的研究和利用提供依据,进而为内蒙古地区莜麦资源优势得到充分发挥,带动地域经济发展提供参考。
1 材料与方法
1.1 原料
莜麦种子:呼和浩特市蒙田种苗有限公司。
没食子酸:上海金惠生物科技有限公司;福林酚:上海荔达生物科技有限公司;纤维素酶:江苏锐阳生物科技有限公司;α-淀粉酶:无锡市博立生物制品有限公司;无水乙醇、碳酸钠、磷酸氢二钠、磷酸二氢钠、氢氧化钠均为分析纯。
1.2 主要仪器设备
SQP型万分之一天平:赛多利斯科学仪器有限公司;3102型电子分析天平:上海跃平科学仪器有限公司;UV-7504TC紫外-可见分光光度计:上海欣茂仪器有限公司;R20BC台式高速冷冻离心机:湖南凯达实验有限公司。
1.3 试验方法
1.3.1 没食子酸标准曲线的绘制
分别精确吸取0.1 mg/mL的没食子酸标准溶液0.10、0.20、0.30、0.40、0.50 mL于10 mL 容量瓶中,然后加入1 mL Folin-Ciocalteau试剂,摇匀后依次加入2 mL 15%Na2CO3溶液,定容到10 mL,室温下避光反应2 h后于760 nm测定吸光度。以溶液浓度(mg/L)为横坐标,吸光度(A)为纵坐标绘制标准曲线。
1.3.2 酶解水溶剂提取莜麦中的酚类物质
精确称取粉碎后的莜麦粉5.00 g加入锥形瓶中,加入不同浓度复合酶(纤维素酶∶α-淀粉酶 = 1∶1),在一定pH、温度、时间条件下制得多酚提取液。
1.3.3 莜麦中酚类物质的测定
精确移取待测提取液1 mL于10 mL容量瓶中,依次加入1 mL Folin-Ciocalteu显色剂,摇匀后加入2 mL15% Na2CO3溶液定容到10 mL,室温下避光反应2 h后,于波长760 nm处测定吸光值,根据标准曲线计算总多酚的没食子酸当量,总酚含量以每克莜麦粉中的没食子酸当量(mg)表示[1]。
1.3.4 酶解水溶剂提取酚类物质单因素试验
以莜麦多酚得率为依据,分别对复合酶用量、酶解时间、酶解温度、pH值做单因素试验,以确定各因素的最佳水平。
1.3.5 酶解水溶剂法提取工艺优化
在单因素试验的基础上,选取A(复合酶用量)、B(酶解时间)、C(酶解温度)、D(pH值)4个因素,进行L9(34)正交试验设计,以酚类物质的得率为依据进行试验。正交试验的因素水平见表1。

表1 正交试验因素水平表
1.4 试验数据处理
数据采用Graphpad prism 软件处理并制图。
2 结果与分析
2.1 没食子酸标准曲线
没食子酸标准曲线如图1所示,回归方程为y=0.124 1x-0.000 6,R2=0.999 7。

图1 没食子酸标准曲线
2.2 酶解水溶剂提取酚类物质单因素试验
2.2.1 复合酶用量对莜麦多酚得率的影响
图2中,随着复合酶用量增加,多酚含量明显上升。这是因为淀粉酶在适宜的介质中可以水解莜麦粉中的淀粉,有助于与淀粉结合的部分多酚释放;纤维素酶在适宜介质中可作用于莜麦麸皮细胞,将其细胞壁中的纤维素水解为二聚糖、单糖等小分子,细胞壁的破裂,减少了莜麦酚类物质向溶剂中的扩散阻力,从而利于酚类物质的浸出。但当复合酶用量超过0.8%后,酚类物质得率变化不大。这是因为随着酶浓度的升高,底物浓度不能对酶达到饱和,导致酶的作用受到抑制[14]。

图2 复合酶用量、酶解时间、酶解温度、pH对莜麦多酚得率的影响
2.2.2 酶解时间对莜麦多酚得率的影响
图2中,随着酶解时间的增加,莜麦酚类物质得率升高,当酶解时间为90 min时,莜麦中多酚物质得率最高(2.417 mg/g);而当酶解时间超过90 min后,其酚类得率并没有明显提高。这是因为在酶解一定时间后,细胞壁与淀粉等形成的阻力被消除,细胞内外的多酚浓度达到动态平衡,继续延长提取时间对提高溶液中多酚浓度的作用有限[18]。故综合考虑生产效率及经济因素,选择酶解时间90 min为宜。付晓燕等[19]利用复合酶(淀粉酶和蛋白酶)辅助提取燕麦多酚时发现,酶解时间不应过长,以1.5 h左右为宜。这与本试验的结果相符。
2.2.3 酶解温度对莜麦多酚得率的影响
图2中,在一定温度范围内,温度升高,莜麦中酚类物质得率随之升高,在55 ℃时得率最高。这是因为:一方面淀粉酶和纤维素酶酶解活力随温度升高而增强,使反应速率加快,另一方面,在加热过程中,淀粉本身可发生膨胀并释放直链淀粉,随着加热的进行,淀粉颗粒破裂,使得多酚物质得以从笼形包含物中释放出来,因此,多酚得率随之增加。有研究表明,二者相比,酶解作用是促进燕麦粉中多酚释放的主要原因[20]。当温度继续升高时,多酚得率呈下降趋势。这是因为温度持续升高,导致酶活力减弱,稳定性降低,且高温还可能会破坏已提取出来的多酚结构[11],故选取55 ℃为最佳酶解温度。
2.2.4 pH值对莜麦多酚得率的影响
图2中,当pH值小于5.5时,莜麦中酚类物质得率随着介质pH值增大而显著提高,当酶解液pH达5.5时,莜麦中酚类物质得率最高,当pH值继续增大,莜麦多酚得率呈下降趋势,这是因为溶液pH不仅可以影响酶的活力和组织结构,还可能影响底物的解离状态[14]。所以,选取5.5为本试验最佳pH值。
2.3酶解水溶剂法提取莜麦酚类物质正交优化试验
从表2可以看出,影响莜麦中酚类物质得率的4个因素按影响主次顺序为:A>C>D>B,即复合酶用量>酶解温度>pH值>酶解时间;其中最优工艺条件的组合为A2B1C2D1,即复合酶用量0.8%,酶解时间80 min,酶解温度55 ℃,pH值5.0。该组合不在正交试验设计范围内,经验证:在此条件下得出莜麦中酚类物质得率为:2.950 mg/g,其得率大于正交试验中任一组合。付晓燕等[19]利用蛋白酶和淀粉酶提取莜麦多酚,提取含量为2.169 mg/g,低于本试验多酚得率。
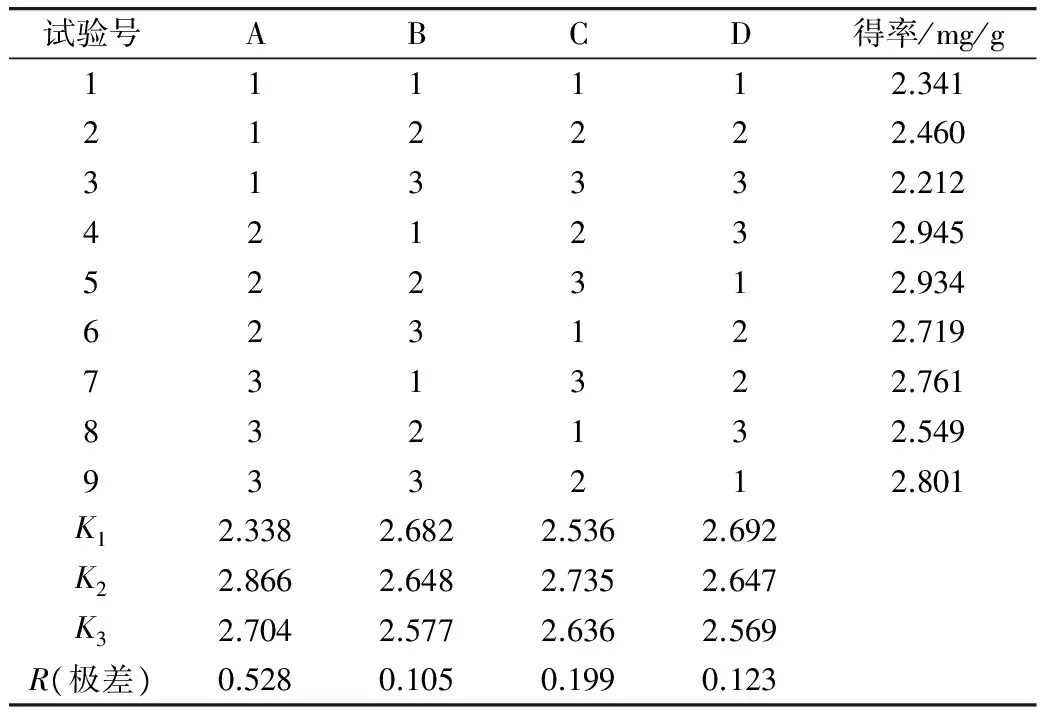
表2 L9(34) 正交试验设计及试验结果
2.4 酶法提取与微波辅助提取法比较
前期对微波辅助有机溶剂提取法进行了优化(微波功率700 W,乙醇浓度50%,提取时间60 min,提取温度60 ℃)。本试验比较了这2种方法在最优条件下酚类物质的得率,其结果如图3所示。由图3可知,酶法提取多酚得率显著高于微波辅助提取法,这可能由于莜麦麸皮中阿魏酸有98%都是以结合态形式存在[21]。使用纤维素酶酶解处理莜麦粉,能够有效酶解麸皮中的纤维素、半纤维素,释放出其中的结合态阿魏酸。同时,淀粉酶水解可以通过伸展淀粉链破坏其网状结构和水解糖苷键,使得被包裹在淀粉颗粒的网状结构中的单体酚如咖啡酸、香草醛得到有效释放[20]。结果表明:酶解水溶剂提取法优于微波辅助有机溶剂提取法。

图3 酶法提取与微波辅助提取法比较
3 结论
3.1 在单因素试验的基础上,经正交试验确定出影响酶解水溶剂提取法提取莜麦中酚类物质的各因素顺序为:复合酶用量>酶解温度>pH值>酶解时间,其最佳工艺条件为:复合酶用量0.8%,酶解时间80 min,酶解温度55 ℃,pH值5.0,以此条件组合得出莜麦中酚类物质的得率为:2.950 mg/g。
3.2 酶解水溶剂法提取莜麦中的酚类物质优于微波辅助有机溶剂提取法。
[1]Peterson D.M. Oat antioxidants [J]. Journal of Cereal Science, 2001, 33(2): 115-129
[2] Tapola N, Karvonen H, Niskanen L, et al. Glycemic responses of oat bran products in type 2 diabetic patients [J]. Nutrition, Metabolism & Cardiovascular Diseases, 2005, 15 (4): 255-261
[3] 陕方,田志芳,马晓凤,等.莜麦高纤食品基料加工技术及生理活性研究[J],食品科技,2004,(5):82-85
Shan F, Tian Z F, Ma X F, et al. Research of technology and biologic action of the dietary fiber material from oats [J],Food Science and Technology, 2004, (5):82-85
[4]Peterson D M, Emmons C L, Hibbs A H. Phenolic antioxidants and antioxidant activity in pearling fractions of oat groats [J]. Journal of Cereal Science, 2001, 33(1):97-103
[5]付晓燕,吴茜,李书艺,等.燕麦发芽前后酚类物质的组成变化及结构鉴定[J].中国农业科学, 2013,46(17):3669-3679
Fu X Y, Wu Q, Li S Y, et al. Composition change and structure identification of phenols in oat after germination [J]. Scientia Agricultura Sinica, 2013, 46(17):3669-3679
[6]付晓燕,隋勇,谢笔钧,等.燕麦多酚纯化、发芽燕麦不同组分的多酚分布及抗氧化活性[J].食品工业科技, 2014,35(8):83-87
Fu X Y, Sui Y, Xie B J, et al. Purification of oat phenols,distribution of phenolic compounds and antioxidant activity of different fractions separated from germinated oat [J]. Science and Technology of Food Industry, 2014, 35(8):83-87
[7] Xu J G, Tian C R, Hu Q P. Dynamic changes in phenolic compounds and antioxidant activity in oats (Avena nuda L.) during steeping and germination [J]. Journal of Agricultural & Food Chemistry, 2009, 57(21):10392-10398
[8]赵霞,张文斌 ,杨瑞金,等. 浸泡发芽处理对燕麦多酚组成及其抗氧化活性的影响[J]. 食品工业科技,2016,37(15):101-106
Zhao X, Zhang W B, Yang R J, et al. Polyphenol composition and antioxidant activity of oat as affected by soaking and germination [J]. Science and Technology of Food Industry, 2016, 37(15): 101-106
[9]付晓燕,李海龙,杨超,等. 发芽燕麦不同溶剂提取液抗氧化活性的比较[J].食品与发酵工业,2011, 37(4):68-72
Fu X Y, Li H L, Yang C, et al. Comparison of antioxidant activity for different solvents extracts from germinationed oat [J].Food and Fermentation Industries, 2011, 37(4):68-72
[10]刘仙俊,范向前,史起鹏,等.燕麦总多酚的微波辅助提取工艺研究[J].食品研究与开发,2016, 37(17):55-58
Liu X J, Fan X Q, Shi Q P, et al. Study on microwave-assisted extraction of total polyphenols from oat [J]. Food Research And Development, 2016,37(17):55-58
[11] Naczk M,Shahidi F. Extraction and analysis of phenolics in food [J]. Journal of Chromatography A, 2004, 1054(1-2):95-111
[12] 李巨秀,李利霞,曾王旻,等. 燕麦多酚化合物提取工艺及抗氧化活性的研究[J]. 中国食品学报,2010,10(5) :14-21
Li J X, Li L X, Zeng W M, et al. Studies on polyphenol extraction and antioxidant activities in oat [J]. Journal of Chinese Institute of Food Science and Technology, 2010, 10 (5):14-21
[13] 王燕,钟葵,林伟静,等. 响应面法优化微波辅助提取燕麦多酚[J]. 中国食品学报, 2012, 12(11):69-76
Wang Y, Zhong K, Lin J W, et al. Optimization of microwave-assisted extraction of oat polyphenols by response surface method [J]. Journal of Chinese Institute of Food Science and Technology, 2012, 12(11):69-76
[14] 王华斌,王珊, 傅力. 酶法提取石榴皮多酚工艺研究[J]. 中国食品学报, 2012, 12(6): 57-62
Wang H B, Wang S, Fu L. Study on technology of extracting polyphenol from pomegranate peel by enzymic treatment [J]. Journal of Chinese Institute of Food Science and Technology, 2012, 12(6): 57-62
[15] 李浡, 李双石, 兰蓉,等. 酶法提取葡萄藤茎中多酚物质的含量比较研究[J]. 酿酒科技, 2015,(7): 38-40
Li B, Li S S, Lan R, et al. Comparison of the content of polyphenols extracted from grape vine by different enzymic treatment [J]. Liquor-Making Science and Technology, 2015, (7): 38-40
[16]李存芝,欧仕益,周琪,等.薏米及发芽薏米酶解抗氧化活性变化[J].食品工业科技, 2011,32(1):100-103
Li C Z, Ou S Y, Zhou Q, et al. Study on change of antioxidant of adlay power before and after enzymolysis [J]. Science and Technology of Food Industry, 2011,32(1):100-103
[17] 杨云裳, 李帅斌, 李春雷,等. 酶法浸提酿酒葡萄果渣中多酚的最优工艺[J]. 兰州理工大学报, 2013,39(3): 61-64
Yang Y S, Li S B, Li C L, et al. Optimal process of polyphenol estraction from grape pomace of brewage with enzyme method [J]. Journal of Lanzhou University of Technology, 2013, 39(3): 61-64
[18] 徐婕,汤韧,吉树臣,等.酶法辅助提取茶多酚的工艺研究[J].食品研究与开发,2016,37(5):86-91
Xu J, Tang R, Ji S C, et al. Research of the extraction processing of tea polyphenols [J]. Food Research And Development,2016,37(5): 86-91
[19]付晓燕,吴茜,胡正浩,等.传统溶剂提取与酶辅助提取燕麦多酚工艺的优化与比较[J].食品工业科技,2012,33(24):277-281
Fu X Y, Wu Q, Hu Z H, et al. Optimization and comparison of the solvent extraction and enzyme assistant extraction of oat phenols [J]. Science and Technology of Food Industry, 2012,33(24):277-281
[20]陈东方. 酶解提高燕麦粉抗氧化活性的作用机制[D]. 杨凌:西北农林科技大学,2016
Chen D F. Mechanism of enhancement of antioxidant activity of oat flour after enzymatic hydrolysis [D]. Yangling: Northwest A&F University, 2016
[21] Adom K K, Liu R H. Antioxidant activity of grains [J]. Journal of Agricultural and Food Chemistry, 2002, 50(21): 6182-6187.
The Microwave-Assisted Organic Solvent Extraction of Poly-Phenols from Oat
Lü Junli1You Xinyong1Ren Zhilong2Liu Zhongyuan1
(School of Life Science and Technology, Inner Mogolia University of Science and Technology1,Baotou 014010) (School of Food and Drug, Baotou Light Industry Vocational Technical College2, Baotou 014035)
Naked oats is one of the characteristics crops in Inner Mongolia. It has many physiological functions in lowering blood sugar and blood lipid, et al. In order to study the extraction of polyphenols in oat, we used oat from Inner Mongolia as raw material. On the basis of polyphenols yields and single factor experiment, orthogonal experiments have been carried out to optimize the enzymatic extraction. The optimum extraction processes were as follows: 0.8% compound enzyme dosage, enzymolysis time 80 min, enzymolysis temperature 55 ℃, pH 5.0, phenolics extraction yield 2.950 mg/g. When compared with microwave-assisted organic solvent extraction, the extraction yield of polyphenol by enzymatic extraction was significantly higher than that of microwave-assisted extraction, which showed that enzymatic extraction process is better than microwave-assisted organic solvent extraction in terms of extraction of poly-phenols from naked oats.
naked oats, phenolics, enzymatic extraction
TS210.4
A
1003-0174(2017)11-0123-05
内蒙古自治区高等学校科学研究(NJZY14171),内蒙古自然科学基金( 2014BS0312),内蒙古科技大学创新基金(2014QDL005)
2016-10-25
吕俊丽,女,1982年出生,讲师,食品营养与化学

