圆锥角膜组织与正常角膜组织差异蛋白的表达
高娜 任丽
圆锥角膜组织与正常角膜组织差异蛋白的表达
高娜1任丽2
目的运用比较蛋白质组学技术,比较圆锥角膜组织和正常角膜组织的差异表达蛋白,筛选出圆锥角膜特异性分子标记物,探讨其与圆锥角膜发病机制的关系。方法收集12例圆锥角膜组织和4例正常人角膜组织,提取角膜组织总蛋白,行固相PH梯度双向凝胶电泳,分析凝胶电泳图谱,筛选差异表达蛋白,采用基质辅助激光解吸离子化一串联飞行时间质谱(MOLDI-TOF/TOF-MS)和数据库检索对差异蛋白质进行鉴定。结果圆锥角膜组织和正常角膜组织的双向电泳代表胶的蛋白点数分别为1035 和1070,匹配点数为869个,匹配率为84%。选取有明显表达差异的7个蛋白质点,其中6个蛋白质点在圆锥角膜组织中表达下调,1个蛋白质点表达上调。这7 个蛋白质点分别为转化生长因子B诱导的细胞外基质黏附蛋白(TGFBIp/βig-h3)、VI型胶原蛋白α1链前体(collagen alpha-1(VI)chain precursor)、αA-晶体蛋白(alpha-crystallin A)、βB-晶体蛋白(alpha-crystallin B)、βB2-晶体蛋白(beta-crystallin B2)、谷氨酰胺合成酶(glutamine synthetase)、碳酸酐酶(carbonic anhydrase),除VI型胶原蛋白α1链前体在圆锥角膜组织中表达上调外,其余6个蛋白成分在圆锥角膜组织中均表达下调。结论TGFBIp/βig-h3、alpha-crystallin A、alpha-crystallinB 、beta-crystallin B2、glutamine synthetase、collagen alpha-1(VI)chain precursor6种在圆锥角膜中差异表达的蛋白质成分可能与圆锥角膜发病相关。
圆锥角膜; 比较蛋白质组学; 基质辅助激光解吸离子化一串联飞行时间质谱(MOLDI-TOF/TOF-MS)
圆锥角膜(keratoconus)是一种以角膜扩张为特征,致角膜中央部向前呈圆 锥形凸起,及产生高度不规则近视散光和不同视力损害的原发性疾病。若病变持续发展,最终的结果是行角膜移植术。所以探明病因及发病机制,采取有效的控制手段,是防治圆锥角膜的根本。
圆锥角膜病因错综复杂,其发生是一个多因素、多基因及多途径改变的过程。目前难以用一种理论来解释所有的病例。以往的研究大多在基因水平或者是对某些特定的分子做相应分析,从而推测圆锥角膜可能的发病机理,其局限性在于DNA或RNA水平的改变并不能完全 反应蛋白质水平的变化(如信使RNA与蛋白质两者的相关系数大约在0.4~0.5之间)或者只能反应疾病的部分特征,若能从蛋白质整体水平直接入手来研究圆锥角膜,并与圆锥角膜基因组、转录组等方面的研究结果相互整合、互相验证,无疑将更加全面而真实地揭示圆锥角膜发病的本质,也将为圆锥角膜的病因发病学、诊断和防治开辟新的思路、提供新的线索。蛋白质组学为我们提供了新的方法和思路。蛋白质组学的研究主要包括以下三个方面:(1)蛋白质的大规模鉴定和转录后修饰的微特征研究;(2)比较蛋白质组学,比较疾病与正常状态下蛋白质表达的差异,为疾病的诊断寻找生物学标志;(3)通过各种技术,如质谱技术和酵母双杂交体系对蛋白质一蛋白质间相互作用的研究,并绘制蛋白质作用的图谱。在与临床的结合应用中最常用的是比较蛋白质组学,通过生理和病理条件下(如疾病状态或疾病的不同发展阶段)蛋白质组各成员表达水平、翻译后修饰等情况进行比较研究,发现和鉴定出有特征性的蛋白质,从而为疾病的发病机制,诊断及治疗的研究提供理论依据。
基于以上认识,为了阐明圆锥角膜的发病机制和建立有效的治疗和预防方法,本研究应用固相PH梯度双向凝胶电泳技术分离圆锥角膜病变组织及正常角膜组织的总蛋白质,建立双向电泳图谱,并用基质辅助激光解吸离子化一串联飞行时间质谱(MOLDI-TOF/TOF-MS)分析和数据库检索对差异蛋白质进行鉴定,以期筛选出圆锥角膜的特异分子标志物,为圆锥角膜发病机制的阐明提供新的方法和理论依据。
1 材料和方法
1.1 材料
12例圆锥角膜组织来源于行部分穿透性角膜移植手术的16~26岁圆锥角膜患者,患者术前完善辅助检查,排除全身结缔组织性疾病及其他全身性疾病,术中选用7.0~7.75mm大小环钻钻取病变角膜组织,术后均取部分病变组织经中山眼科中心病理室确诊。4例正常角膜组织由眼库提供。直径为10~12mm,尸眼均于死亡后4~16小时取材。将收集好的角膜组织置于 eppendorf tube中,-80°C冰箱深低温保存备用。
1.2 组织总蛋白提取-80℃
将收集的圆锥角膜组织随机分为4组,每组3例,分别编号为l、2、3、4组,正常角膜组织一例为一组,分别编号为5、6、7、8组。采用眼科显微角膜剪于冰上充分剪碎角膜组织,将各组角膜组织碎片分别收集于预冷的EP管中,按照l: 3体积比例加入裂解缓冲液充分混匀后,采用组织匀浆机冰上匀浆,匀浆强度选 用3.5级,每次匀浆8秒,间隔30秒后重复匀浆,共3次;匀浆结束后用封口胶将 EP管封口,置于液氮中2min,再于37°C水域中复温、解冻,反复3次。最后用低 温高速离心机4°C150009/min离心60min,小心吸取上清,即为组织总蛋白质,按照不同用量分装,置于一80°C冰箱中待用。
1.3 固相pH梯度双向凝胶电泳
2-DE方法主要参考文献和Bio-Rad仪器操作手册进行。
凝胶通过IIIlage Scanner II透射扫描仪及Labscan扫描软件进行扫描获取图像,利用ImageMaster 2D Elite 5.0分析软件对图像进行强度效正、点检测、背景消减及匹配等。比较对应蛋白点表达丰度,获得差异蛋白点的缺失、出现及表达量的变化等信息,选取有明显差异的蛋白点进行质谱分析。
1.4 质谱检查
沿边缘切取凝胶上的差异蛋白斑点,经水洗、脱色、胶内酶切等步骤后采用美国ABI公司的4700 TOF-TOT质谱仪进行质谱分析。
1.5 数据库检索
利用软件Mascot distiller过滤基线峰、识别信号峰。利用Matrixscience公司的Mascot软件搜索NCBInr数据库(http://www.matrixscience.com),寻找匹配的相关蛋白质,同时查询其功能,来明确鉴定的蛋白质为何种蛋白质。
2 结果
2.1 双向电泳图像的分析
利用ImageMaSter 2D Elite 5.0分析软件分析对圆锥角膜和正常角膜组织的两张代表胶图谱进行分析匹配,发现其蛋白点数分别为1035和1070,匹配点数为869个,匹配率为84%。通过对二者的凝胶图谱分析,根据以下几个条件筛选出7个明显的差异蛋白点进行质谱鉴定:1)在图像分析软件中蛋白点的灰度差异在两倍以上,并可人工识别;2)相同组织重复两次凝胶电泳,在两张图谱都出现相同差异的蛋白点;3)至少在50%的相同类型的角膜组织的凝胶图谱中出现;4)位于图谱下方的小分子量的蛋白点忽略不计,因为这些很可能为降解的蛋白片段。图1-1和图1-2分别是圆锥角膜组织和正常角膜组织的代表性双向凝胶电泳图谱,图中以“↖□”标记的为差异蛋白质。为了清晰显示蛋白质斑点的匹配和差异表达情况,我们以A3蛋白斑点为例,进行局部放大显示。图2为A3的局部放大图。
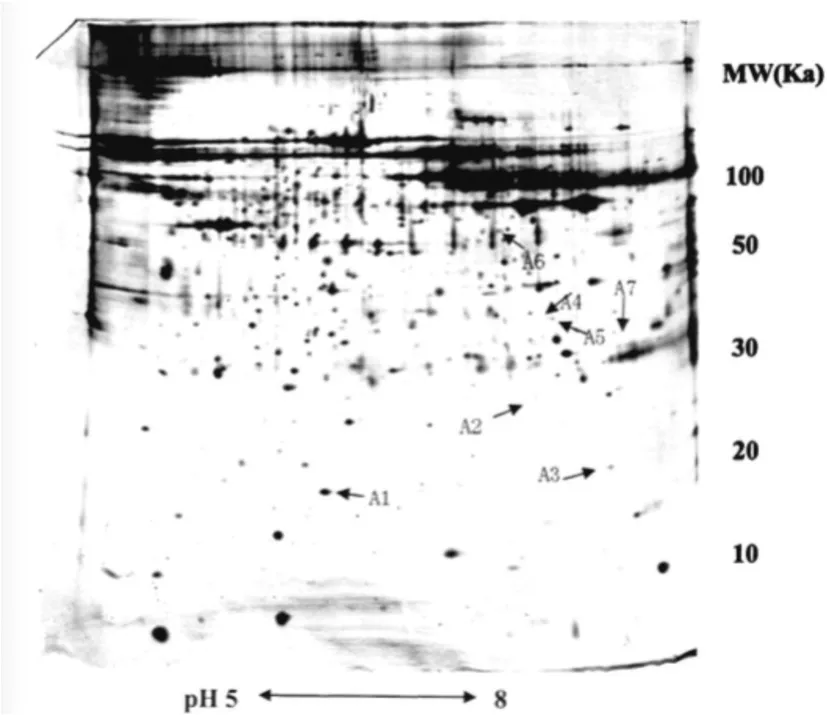
图1-1 圆锥角膜组织双向凝胶电泳图谱(pH 5~8,上样量230μg)
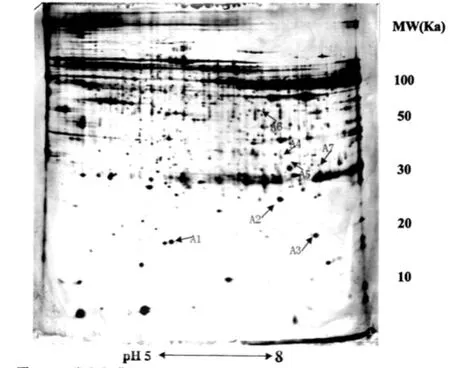
图1-2 正常人角膜组织双向凝胶电泳图谱(pH 5~8,上样量230μg)
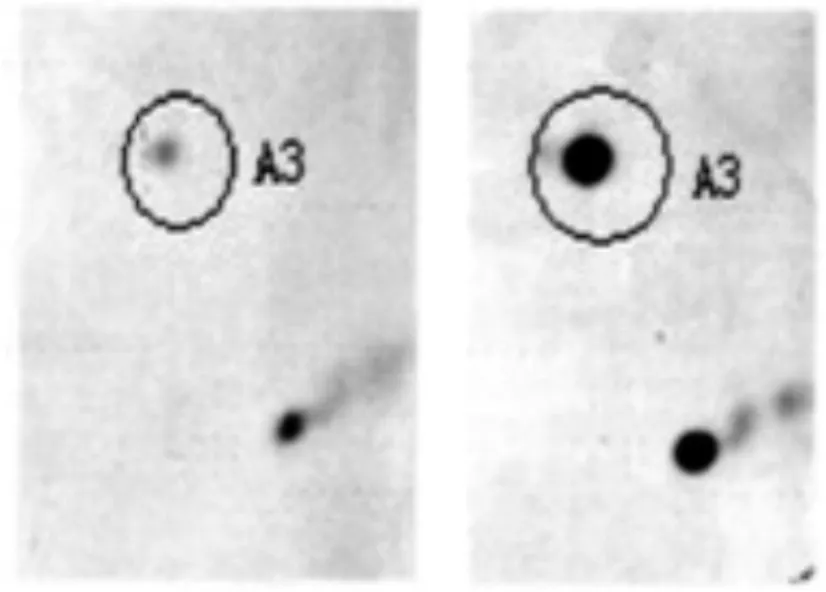
图2 左侧为圆锥角膜组织凝胶电泳蛋白质A3的局部放大图,右侧为正常角膜组织的A3放大图
2.2 质谱分析结果
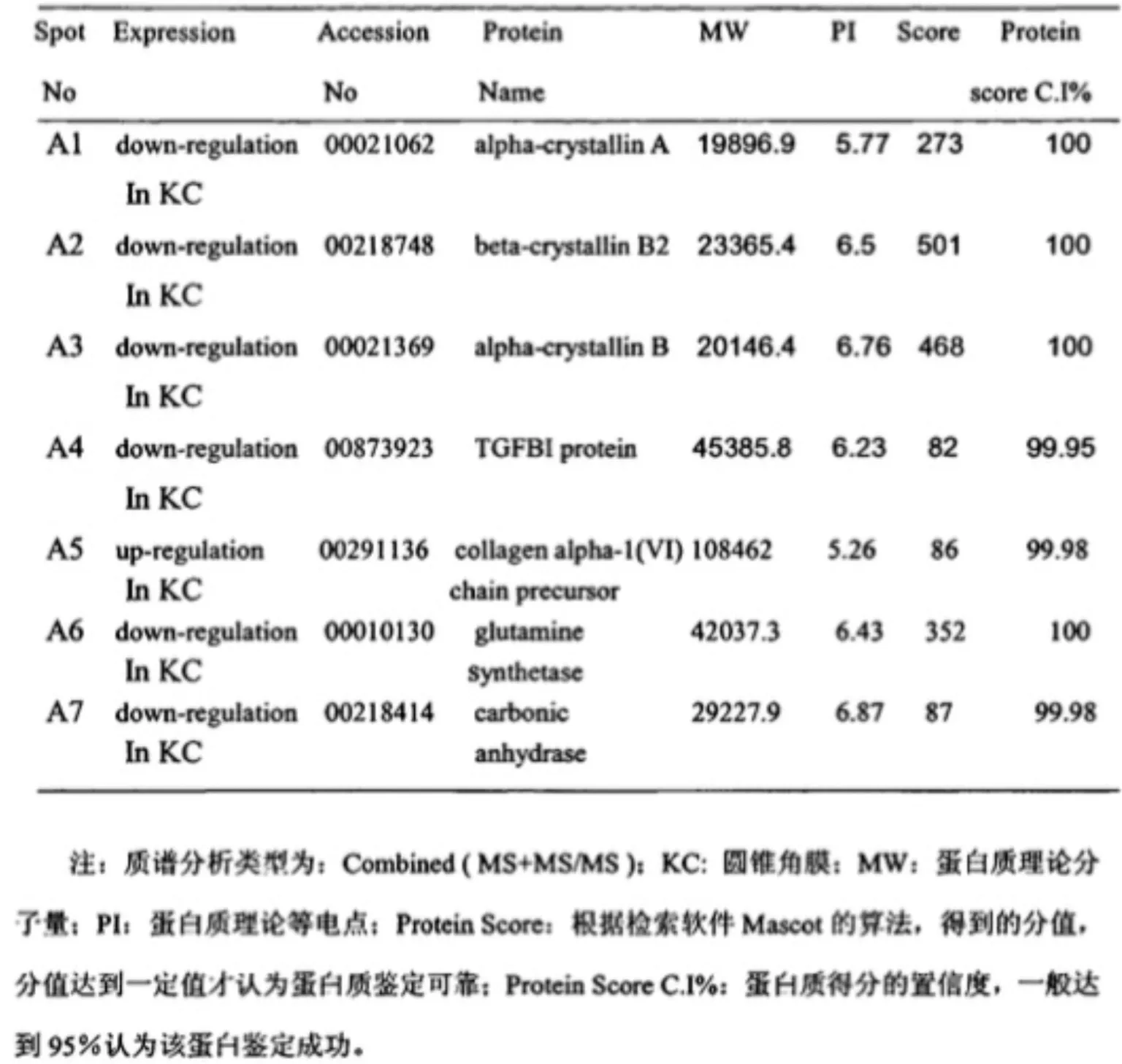
利用ImageMaster 2D Elite 5.0分析软件对圆锥角膜和正常角膜组织的凝胶电泳图谱进行分析匹配,筛选出7个明显的差异蛋白点,其中有6个蛋白成分在圆锥角膜组织中表达下调,1个蛋白成份表达上调,分别进行 MALDI-ToF/ToF-Ms质谱分析,获得蛋白质点的肽质量指纹图谱(PMF)及二级质谱图。最后利用Mascot软件搜索NcBInr数据库寻找匹配的相关蛋白质信息,7个蛋白质点均鉴定成功,其中6个在圆锥角膜中低表达的蛋白质成分包括TGFBIp/βig-h3、alpha-crystallin A、alpha-crystallinB 、beta-crystallin B2、glutamine synthetase、carbonic anhydrase,1个在圆锥角膜中高表达的蛋白质成分为collagen alpha-1(VI)chain precursor。各蛋白点的质谱分析见表1。
3 讨论
本实验将圆锥角膜组织和正常角膜组织的蛋白质表达进行对比分析研究,发现了TGFBIp等几种可能与圆锥角膜发病相关的差异蛋白质,研究所利用的是蛋白质组学技术中的比较蛋白质组学策略。比较蛋白质组学的技术路线首先用双向凝胶电泳技术分离复杂的蛋白质组分,并用专门的计算机软件对双向凝胶电泳结果进行数据采集和图像分析,然后采用氨基酸组成分析、微量蛋白质测序、质谱分析等技术将从凝胶上采集的蛋白质作进一步的鉴定,结合相关的数据库检索,获取有关蛋白质的性质、表达变化和翻译后的修饰加工等多方面的大量信息,建立蛋白质数据库,通过生理和病理条件下(如疾病状态或疾病不同发展阶段)蛋白质组各成员表达水平、翻译后的修饰加工以及亚细胞定位等情况的比较研究,发现和鉴定出有特征性的蛋白质(群),为疾病的发病机理研究、诊断和治疗提供线索。
对于圆锥角膜的蛋白质组学研究,目前国际国内上已经开展了部分工作。1989年Noorjuahan[1]及其同事利用双向电泳技术分析圆锥角膜与正常角膜差异表达蛋白,发现在圆锥角膜组织的凝胶电泳图谱中有两个异常蛋白成分表达(分子量分别为54KD、26KD),有三个正常的角膜蛋白成分(分子量分别为12KD、 14KD、39KD)出现高表达,同时还有三个正常角膜蛋白成分(分子量分别为 66KD、55l1、13KD)表达减少或者不表达。但是这部分研究结果没有做进一步的蛋白质谱分析,所以不能得出这些差异蛋白的确切成分。通过对比蛋白分子量及蛋白等电点,Noorjuahan等发现其中一个低表达的正常角膜蛋白成分与脯氨酰-4-羟化酶的亚基十分相似,而该酶正是胶原脯氨酸残基羟基化所必需的酶类;另外,Noorjuahan推测某些正常角膜蛋白成分由于异常的翻译后修饰作用如过度糖基化等,成为研究中所出现的异常表达蛋白质。后续的研究选择角膜的某些成分进行蛋白质组学研究。如Nielsen等[2]选择近视眼患者的角膜上皮细胞作为对照组寻找圆锥角膜上皮细胞中的差异蛋白,通过Melanie II分析软件及质谱分析发现,有十几个差异蛋白表达,包括cytokeratin 3,gelsolin,S100A4以及 enolase-1等。Nielsen认为这些蛋白可能参与了圆锥角膜的发病过程。Srivastava等[3]也对圆锥角膜的上皮细胞进行蛋白质组学分析,他们选用正常角膜组织上皮细胞为对照组,采用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)及免疫组织化学方法分析后发现α-enolase和β-actin两种蛋白在圆锥角膜组织的翼状细胞层及表面细胞层中呈低表达或不表达,Srivastava认为这与圆锥角膜中这两种蛋白的降解增强有关。
表1差异蛋白质点质谱检索结果
目前对圆锥角膜全层组织的总蛋白进行差异蛋白筛选和质谱分析的蛋白质 组学研究还未见报道。为了更加真实揭示圆锥角膜的蛋白表达状况、识别鉴定与其发病密切相关的差异蛋白质,本实验以正常角膜组织为对照组,提取角膜组织的总蛋白质,采用蛋白质组学图像分析软件分析圆锥角膜组织与对照组的双向电泳凝胶图谱,筛选出两者间的差异表达蛋白,利用MALDI/TOF-TOF/MS鉴定,共获得7张蛋白质点的肽质量指纹图谱(PMF),为进一步的研究提供条件。
在本研究中,对组织标本的收集、组织总蛋白质的提取以及双向凝胶电泳总蛋白质的上样量进行了最优条件的摸索,结果显示,选择PH值宽度为5-8的17cm非线性口G胶条,采用硝酸银染色方法,总蛋白上样量以230 u g为佳,从而建立了重复性较好的人角膜组织的双向凝胶电泳图谱。质谱技术作为蛋白质组学技术平台的支撑技术之一,因其可靠性直接影响到整个研究的可信性,所以质谱技术在蛋白质组学实验中具有非常重要的地位,故选择高效、可靠、稳定的质谱分析仪十分必要。
在圆锥角膜与正常角膜组织的比较分析中,我们发现6种可能与圆锥角膜发病相关的蛋白质,包括TGFBIp/βig-h3、collagen alpha-1(VI)chain precursor、alpha-crystallin A、beta-crystallin B2、alpha-crystallinB 、glutamine synthetase、这些蛋白成分有些参与细胞外基质的黏附,有些影响胶原的稳定性和成熟性,有些参与细胞的氧化应激等,为此还需进行更为详细的探讨。
[1] Noorjahan P,Jim D,Brian C,etal.Protein-related abnormalities in keratoconus.Invest Ophthalmol Vis Sci,1989,30:2481-2487.
[2] Nielsen K,Henrik V,Fagerholm P,etal.Proteome profiling of corneal epithelium and identification of marker protein for keratoconus,a pilot study.Exp Eye Res,2006,82(2):201-209.
[3] Srivastava OP,Chandrasekaran D,Pfister RR.Molecular changes in selected epithelial protein in human keratoconus comes compared to nornal corneas.Mol Vis,2006,12:1615-1625.
Initialstudyofproteinsdifferentiallyexpressedinhumankeratoconuscorneascomparedtonormalcorneas
GAONa1,RENLi2
(TeachingHospitalofChengduUniversityofTCM/ClinicalMedicalCollege,ChengduUniversityofTCM,Chengdu,Sichuan,610075;2.ChengduUniversityofTCM,Chengdu,Sichuan,610075)
ObjectiveThe proteins differentially expressed in keratoconus and normal corneas was analyzed by comparative proteomine technology,and then identify protein markers that may be specific to the disease.Methods12 human keratoconus buttons and 4 normal human central human corneas were collected.Cornea proteins were separeted on immobilized pH gradient-based two dimension electrophoresis SDS polyacrylamide gels and silver stained,spots were defined and quantified.Differentially expressend protein spots were then identified by matrix-assisted laser desorption ionization time of flight mass spectrometry(MALDI-TOF/TOF-MS)and databese searching.ResultsSeven differentially expressed proteins were identified by MALDI-TOF/TOF-MS,peptide mass fingerprint(PMF)and MS/MS maps were obtained.The proteins successfully identified were TGFBIp/βig-h3、collagen alpha-1(VI)chainprecursor、alpha-crystallin A、beta-crystallin B2、alpha-crystallinB 、glutamine synthetase、carbonic anhydrase.All of them were down-regulation in keratoconus except collagen alpha-1(VI)chain precursor.ConclusionTGFBIp/βig-h3、alpha-crystallin A、alpha-crystallinB 、beta-crystallin B2、glutamine synthetase、collagen alpha-1(VI)chain precursor were identified to be differentially expressed in keratoconus compared to normal corneas and thus may be involved in the pathogenesis.
Keratoconus; Comparativeproteomics; MALDI-TOF/TOF-MS
1.610075,四川成都,成都中医药大学/附属医院;2.610075,四川成都,成都中医药大学
任丽,E-mail:jnl.scrhi@163.com
10.3969/j.issn.1674-9006.2017.04.002
R77

