花椒麻味物质分子印迹固相萃取柱的制备及其应用
陈晓龙,李耀,陈光静,金新开,阚建全,2*
1(西南大学 食品科学学院,重庆,400715) 2(重庆市农产品加工及贮藏重点实验室,重庆,400715) 3(西南大学 园艺园林学院,重庆,400715)
花椒麻味物质分子印迹固相萃取柱的制备及其应用
陈晓龙1,李耀1,陈光静1,金新开3,阚建全1,2*
1(西南大学 食品科学学院,重庆,400715) 2(重庆市农产品加工及贮藏重点实验室,重庆,400715) 3(西南大学 园艺园林学院,重庆,400715)
以α-(羟基)-山椒素分子结构类似物为模板分子、2-乙烯基吡啶(2-vinylpyridine,2-Vpy)为功能单体、二甲基丙烯酸乙二醇酯(ethyleneglycol dimethacrylate,EDMA)为交联剂,按1∶4∶20的摩尔比合成了花椒麻味物质硅胶表面分子印迹聚合物,并以合成的硅胶表面分子印迹聚合物为固相萃取柱填料,制备了花椒麻味物质分子印迹固相萃取柱,确定了该固相萃取柱的最佳上样溶剂、淋洗溶剂及洗脱溶剂,用此固相萃取柱对花椒油树脂中的花椒麻味物质进行分离纯化。结果表明,该固相萃取柱对花椒麻味物质表现出优异的特异性吸附效果,可以分离纯化出相对纯度为93.66 %的花椒麻味物质。
花椒;分子印迹聚合物;分子印迹固相萃取柱;高效液相色谱;气相-质谱联用仪
花椒(ZanthoxylumL.)是芸香科花椒属植物,又称为大椒、秦椒、蜀椒、川椒或山椒。在我国分布广泛,北起东北南部,南至五岭北坡,东南至江浙沿海,西南至西藏东南部,从平原至海拔较高的山地均有栽种[1]。花椒是一种特色的,有2 000多年历史的香辛料和中药材,被誉为“八大调味品”之一,具有温中祛寒、杀虫止痛、健胃止泻、祛湿等功效[2]。花椒中含有多种化学成分,如挥发油、生物碱、酰胺、香豆素、甾醇和三萜类等[3],其中酰胺类物质是花椒中具有麻味作用的主要成分,具有镇痛[4]、麻醉[5]、杀虫抑菌[6]、抗肿瘤[7-8]等药理作用。目前对花椒麻味物质的分离提纯方法主要有水提法[9]、有机溶剂提取法[10-11]、超临界CO2萃取法[12-13]、逆流干柱层析法[14]、制备型液相色谱法[15]等,但这些分离提纯方法存在一定缺陷,如水提法、有机溶剂提取法提取效率低、杂质含量高,超临界CO2萃取法、逆流干柱层析法、制备型液相色谱法等提取步骤繁琐。
分子印迹固相萃取柱(molecularly imprinted solid-phase extraction,MISPE)是以具有高选择性的分子印迹聚合物为吸附剂,能选择性分离富集复杂样品中痕量分析物,有效去除杂质干扰,进而提高分析的准确度和灵敏度[16]。与传统的固相萃取柱相比,分子印迹固相萃取克服了试样体系复杂、预处理繁琐等不利因素,提高了分析准确性[17]。目前,分子印迹固相萃取柱在药物、食品、环境以及生物等领域已得到了广泛应用[18]。
本实验以α-(羟基)-山椒素分子结构类似物(分子结构式见图1)为模板分子、2-Vpy为功能单体、EDMA为交联剂合成了花椒麻味物质硅胶表面分子印迹聚合物,并以合成的硅胶表面分子印迹聚合物为固相萃取柱填料,制备了花椒麻味物质分子印迹固相萃取(HJMS-MISPE),为花椒中花椒麻味物质的分离、提纯提供了更加快速、经济、高效的方法。

图1 α-(羟基)-山椒素分子结构类似物Fig.1 Molecular structure of the α-(OH)-sanshool
1 材料与方法
1.1 材料与试剂
α-(羟基)-山椒素分子结构类似物:实验室自备,纯度(95%);硅胶(100目),青岛海洋化工有限公司;γ-氨丙基三乙氧基硅烷(APTS),阿拉丁试剂;丙烯酰氯,阿拉丁试剂;三乙胺,成都市科龙化工试剂厂;二甲基丙烯酸乙二醇酯(EDMA),上海国药集团;偶氮二异丁腈(AIBN),成都市科龙化工试剂厂;2-乙烯基吡啶(2-Vpy),上海国药集团;甲醇、乙腈、三氯甲烷、乙酸乙酯、丙酮、石油醚(沸程30~60 ℃)、二氯甲烷、甲苯均为分析纯,购自成都市科龙化工试剂厂。
1.2 仪器与设备
真空干燥箱(DZF-6020),上海齐欣科学仪器有限公司;旋转蒸发器(R-215),瑞士步琦公司;高效液相色谱(Aligent-1260),安捷伦公司;氮吹仪(UGC-12C),北京优晟联合科技有限公司;恒流泵(HL-1B),上海沪西分析仪器厂有限公司;气相-质谱联用仪(GC-MS),日本岛津。
1.3 实验方法
1.3.1 表面分子印迹聚合物的制备
硅胶的活化[19]:称取硅胶10 g,置于500 mL平底烧瓶中,加入6 mol/L的HCl溶液300 mL,常温磁力搅拌 24 h后过滤并用大量的去离子水洗涤硅胶直至中性,再用丙酮洗涤,洗涤后的硅胶于110 ℃烘干备用。
活化硅胶的酰化[20-23]:称取活化后的硅胶5 g,于500 mL的圆底三口烧瓶中,加入无水甲苯150 mL,常温磁力搅拌条件下缓慢加入30 mL的APTS,再缓慢加入10 mL的吡啶,氮气保护下95 ℃磁力搅拌反应24 h。将所得固体过滤,依次用甲苯、丙酮、乙醚、甲醇分别洗涤3次,110 ℃干燥12 h,得氨基化硅胶。称取氨基化硅胶4 g于250 mL圆底三口烧瓶中,加入无水甲苯100 mL,磁力搅拌15 min后,缓慢加入8 mL丙烯酰氯,磁力搅拌10 min后,再缓慢添加5 mL的三乙胺作为反应催化剂,滴加完毕后于氮气保护下室温磁力搅拌24 h,产物依次用50 mL甲苯、纯水、乙醇洗涤3次,于110 ℃干燥后备用。
称取271 mg(1 mmol)花椒麻味物质的替代模板分子于100 mL圆底烧瓶中,依次加入80 mL乙腈,4 mmol功能单体2-Vpy,800 mg酰基化硅胶,超声30 min,使其充分溶解分散后,加入20 mmol交联剂EDMA和40 mg引发剂AIBN,向混合液中通氮气20 min,并在氮气保护下用封口膜密封烧瓶;磁力搅拌下于50 ℃恒温水浴锅内热引发聚合4 h后再于60 ℃恒温水浴锅内热引发聚合20 h,所得固体以甲醇-乙酸(体积比9∶1)为溶剂进行索氏提取,直至索氏提取器内溶液不含类模板分子为止,再用甲醇反复洗涤聚合物以除去其中残留的乙酸,将处理好的分子印迹聚合物放置于真空干燥箱内,60 ℃干燥至恒重,待用,并记为SMIP。空白非印迹聚合物的制备及处理方法与表面分子印迹聚合物的制备步骤相同,只是在聚合物合成过程中不加入替代模板分子,记为SNIP。
1.3.2 分子印记聚合物的吸附性能研究
准确称取50.0 mg SMIP和SNIP,分别置于20 mL具塞锥形瓶中,分别加入8 mL质量浓度为250 μg/mL的HJMS氯仿溶液。混合溶液于25 ℃恒温水浴振荡器中,使聚合物与HJMS分子相互作用,每隔一段时间t(60、90、120、150、180、210、240、300 min)后,取出SMIP和SNIP上清液各1份,测定其中HJMS的含量,绘制HJMS吸附量Q(mg/g)与吸附时间t之间的变化曲线[24]。
1.3.3 分子印迹固相萃取柱的制备
取2只内径为12.7 mm,长为66 mm的聚丙烯空柱,先用玻璃棒把一层聚乙烯筛板推到柱体底部,将长颈漏斗置入柱体中,分别在漏斗中加入处理过的SMIP和SNIP填料,轻轻提起漏斗,柱床体积为6 mL,装填料后,缓慢注入5 mL甲醇通过固相萃取柱,再用玻璃棒把另一层聚乙烯筛板顶入柱体,使其在填料上表面固定,轻轻按压使其表面平齐。
1.3.4 分子印迹固相萃取柱的优化
1.3.4.1 上样原液的制备
取1.45 g花椒油树脂置于75 mL三氯甲烷中,于35 ℃下150 r/min振荡提取4 h,再将其转移到分液漏斗中,振摇2 min,静置分层后,收集三氯甲烷萃取液,定容于100 mL容量瓶中,将其作为固相萃取柱的上样原液于4 ℃下避光保存待用。
1.3.4.2 上样溶剂种类及上样量的选择[25]
实验选取相同体积的丙酮、乙酸乙酯、三氯甲烷、二氯甲烷和乙腈分别作为上样的溶剂[26]。取1 mL上样原液分别用上述上样溶剂稀释至25 mL作为上样液,相同操作下分别上样1.6倍柱床体积的上样液(经检测,其中花椒麻味物质浓度为0.35 mg/mL),高效液相色谱法分别检测上样液和流出液中花椒麻味物质的浓度,差减法计算出花椒麻味物质在固相萃取小柱中的保留率B[27],保留率最大的溶剂为最佳上样溶剂,见式(1):
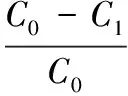
(1)
式中:C1为上样流出液中花椒麻味物质的质量,mg;C0为上样液中花椒麻味物质的质量,mg。
以保留效果最佳的溶剂为上样溶剂,分别上样4、5、6、7、8 mL,高效液相检测流出液中花椒麻味物质的浓度,流出液中检测不出花椒麻味物质的最大体积为最大上样量。
1.3.4.3 淋洗溶剂种类的选择[28]
参照王遵臣[29]等的方法选取相同体积的乙腈、三氯甲烷、甲苯、甲醇/水溶液(体积比5∶5)分别作为淋洗溶剂。MISPE柱中的吸附剂不仅吸附目标分子,还有些杂质会被同时吸附。因此,先用淋洗剂除去杂质,再洗脱目标物质,以减少杂质对目标物质的影响[30],先用1倍柱床体积的上样液上样,再分别用乙腈、三氯甲烷、甲苯、甲醇/水(体积比5∶5)各0.8倍柱床体积对其进行淋洗,收集淋洗液,高效液相色谱法测其中花椒麻味物质的浓度。计算淋洗后花椒麻味物质在固相萃取柱上的保留率,保留率见式(2):

(2)
式中:m1为淋洗流出液中花椒麻味物质的质量,mg;m0为上样液中花椒麻味物质的质量,mg。
1.3.4.4 洗脱液用量的确定[31]
固定制备好的MISPE柱,用1倍柱床体积的上样溶液上样, 0.8倍柱床体积的淋洗液淋洗后,再依次用6、8、10、12 mL的甲醇进行洗脱,收集洗出液,高效液相色谱法测其中花椒麻味物质的浓度,当花椒麻味物质的回收率接近100%的最小体积为洗脱液用量。根据上样液与洗脱液中花椒麻味物质量的变化计算花椒麻味物质的回收率[32],回收率定义为式(3):

(3)
式中:R为花椒麻味物质的回收率;NP为经过萃取柱后洗脱溶液中所含花椒麻味物质的质量,mg;NC表示初始上样液中含有花椒麻味物质的质量,mg。
1.3.5 分子印迹固相萃取柱的实际应用
在最佳的上样溶剂、淋洗溶剂、洗脱溶剂下进行过柱。用高效液相色谱分别测定上样液与固相萃取柱流出液中花椒麻味物质的纯度。其高效液相色谱条件为:色谱柱-Agilent EclipseXDB-C18(5 μm,4.6 mm×250 mm),流动相-甲醇∶水(体积比60∶40),流速1 mL/min,进样量10 μL,柱温40 ℃,紫外检测波长254 nm。GC-MS条件为:气相色谱条件:色谱柱为石英毛细管柱HP-1(30 m×0.25 mm),进样口温度 280 ℃,采用程序升温:起始温度50 ℃,保持1 min,以5 ℃/min升至140 ℃,接着以10 ℃/min升至180 ℃,再以15 ℃/min升至260 ℃,保持5 min。进样量1 μL,载气氦气流速1.0/min,分流比10∶1。质谱条件:EI离子源,连接质谱接口温度 280 ℃,电子能量70 eV,离子源温度250 ℃,倍增器电压1.8 kV;质量扫描范围为m/z:35~500,扫描间隔1 s。
1.3.6 试验数据处理方法
每个实验重复3次,用Origin8.0和Excel 2003处理实验数据并作图,结果以“平均值±标准差”表示。
2 结果与分析
2.1 表面分子印迹聚合物的吸附特性
如图2所示,在前180 min,吸附速率较快,在吸附210 min以后吸附量基本保持不变,达到吸附平衡。吸附动力学试验结果表明,SMIP对花椒麻味物质的饱和吸附时间为210 min,对花椒麻味物质的最大吸附容量为(24.92±0.81) mg,特异因子α=(2.91±0.09)。

图2 SMIP及SNIP对花椒麻味物质吸附动力学分析Fig.2 Binding dynamics of SMIP and SNIP to HJMS
2.2 上样溶剂种类及上样量的选择
由图3-A所示,当以丙酮作为上样溶剂时,HJMS的保留率最低(MISPE和NISPE分别为(40.05±4.39)%和(29.64±3.71)%,当以二氯甲烷作为上样溶剂时,HJMS的保留率最高(MISPE和NISPE分别为(78.72±5.36)%和(40.46±4.23)%,即MISPE对HJMS的保留能力随着上样溶剂极性增大而降低,这是因为溶剂极性太大则会破坏特异性印迹位点与花椒麻味物质之间的氢键结合[33]。故选二氯甲烷为上样溶剂。
为了确定MISPE的最大上样量,分别取4、5、6、7、8 mL的上样液(其中花椒麻味物质的质量浓度为0.35 mg/mL)上样,分别计算保留率。如图3-B所示,当上样量为 4、5、6 mL时花椒麻味物质在MISPE中的保留率均是100%,即这些过程中均没有花椒麻味物质穿漏,当上样量为7 mL时MISPE对HJMS的保留率为(88.71±3.36)%,即上样液中约12%的花椒麻味物质没有被MISPE吸附。因此,当固相萃取柱的柱床体积为6 mL时,选择1倍柱床体积的0.35 mg/mL的花椒麻味物质上样液作为最大上样量[34]。
2.3 淋洗溶剂种类的选择
在分子印迹固相萃取实验中,淋洗溶剂的选择应尽可能地消除分子印迹聚合物对模板分子非特异性相互作用而最大限度地保留住特异性相互作用[29]。为了最大限度地保留MISPE柱的特异性吸附性能,而且尽可能降低杂质等非特异性吸附的干扰,实验分别考察了以乙腈、三氯甲烷、甲苯、甲醇/水溶液(体积比5∶5)作为淋洗剂时,固相萃取柱对花椒麻味物质的保留率。由图3-C可知,当以甲醇/水(体积比5∶5)作为淋洗剂时,HJMS在MISPE上的保留率最低。当以三氯甲烷和甲苯作为淋洗剂时,MISPE对HJMS的保留率均为100%,即MISPE柱中没有HJMS被淋洗下来;但三氯甲烷和甲苯分别作为淋洗剂时,NISPE柱上非特异吸附的花椒麻味物质的保留率分别为(51.47±3.92)%和(85.04±6.09)%,说明三氯甲烷作为淋洗剂时能比甲苯更好的消除非特异性吸附力的影响。因此,淋洗溶剂选用氯仿溶液。
2.4 洗脱液种类及用量的选择
本实验选择甲醇作为洗脱溶剂,分别以6、8、10、12 mL的甲醇作为洗脱液计算回收率[35-36],结果如图3-D所示,甲醇用量为10 mL时,MISPE上的HJMS的回收率为(98.57±2.18)%,即HJMS几乎全部被洗脱下来。因此,当固相萃取柱的柱床体积为6 mL,取1倍柱床体积的上样液时,选用10 mL约1.7倍柱床体积的甲醇作为洗脱液[28]。

A-不同上样溶剂对MISPE和NISPE中花椒麻味物质保留率的影响;B-上样体积对MISPE和NISPE中花椒麻味物质保留率的影响;C-不同淋洗溶剂对MISPE和NISPE中花椒麻味物质保留率的影响;D-甲醇用量对MISPE中花椒麻味物质回收率的影响图3 固相萃取柱优化结果图Fig.3 Optimization diagram of solid phase extraction column
2.5 高效液相色谱检测花椒麻味物质的分离纯化结果
采用高效液相色谱法,在相同检测条件下对花椒麻味物质标准品和固相萃取柱分离纯化得到的产物进行定性确证,结果见表1。

表1 液相色谱图的分析结果Table 1 Analysis results of HPLC chromatogram
花椒麻味物质标准品的3个峰的平均保留时间分别是(13.961±0.237)、(14.538±0.221)、(14.908±0.256) min,固相萃取柱分离纯化得到的产物的3个峰的平均保留时间分别是(13.718±0.218)、(14.235±0.206)、(14.752±0.202) min,经均值差异性检验,花椒麻味物质标准品的3个峰的平均保留时间与固相萃取柱分离纯化得到的产物的平均保留时间相比,无显著性差异(p>0.05),可确证分离纯化出的物质的主要成分是花椒麻味物质;上样液中花椒麻味物质的峰面积占总峰面积的76.15%,固相萃取柱分离纯化得到的花椒麻味物质占总峰面积的94.10%,花椒麻味物质占总峰面积的比例提高了18%,从图4看出,固相萃取柱流出液的HPLC图主要有3个峰,中间峰最大[37-38]。

A-花椒麻味物质标准品的高相液相色谱图;B-上样液的HPLC图;C-固相萃取柱流出液的HPLC图图4 花椒麻味物质的高效液相色谱图Fig.4 Chromatogram of HPLC
2.6 气相色谱-质谱联用检测花椒麻味物质的分离纯化结果
GC-MS仪器检测花椒麻味物质标准品、上样液、固相萃取柱流出液的气相色谱-质谱总流图见图5。经NIST05.LIB谱库检索和峰面积归一化法计算[39],其分析结果分别见表2~表4。

A-花椒麻味物质标准品的气相色谱-质谱总离子流图;B-上样液的气相色谱-质谱总离子流图;C-固相萃取柱流出液的气相色谱-质谱总离子流图图5 花椒麻味物质的气相色谱-质谱总离子流图Fig.5 Total ion current chromatogram of the numb-taste component
由图5-A和表2可知,花椒麻味物质标准品主要成分为酰胺类物质,其中山椒素1含量为11.72%、山椒素2的含量为13.91%、长碳链不饱和酰胺类物质1的含量为19.42%、长碳链不饱和酰胺类物质2的含量为10.51%、长碳链不饱和酰胺类物质3的含量为17.08%;由图5-B和表3可知,气相色谱-质谱联用仪(GC-MS)检测出上样液中主要含50种成分,酰胺类物质即花椒麻味物质在上样液中的相对含量为30.81%;由图5-C和表4可知,经过分子印迹固相萃取柱分离纯化得到的产物中花椒麻味物质的相对含量为93.66%,说明上样液在经过分子印迹固相萃取柱分离后可得到纯度较高的花椒麻味物质,其中酰胺类物质4的含量最高,为28.71%,其次酰胺类物质3的含量为22.27%,酰胺类物质7的含量为11.16%、酰胺类物质8的含量为6.12%、酰胺类物质9的含量为8.22%,酰胺类物质10的含量为6.84%[40-41]。

表2 花椒麻味物质标准品的组分及其相对含量Table 2 The component and relative content component of the numb-taste component standards

表3 花椒油树脂的组分及其相对含量Table 3 The component and relative content component of Zanthoxylum oil resin ingredient
续表3

序号保留时间/min化合物名称(英文名称)质荷比(m/z)相对含量/%2919 581β⁃瑟林烯(β⁃selinene)2040 743019 796巴伦西亚橘烯(naphthalene)2041 783120 156榄香脑(elemenolic)2220 793221 056杜松醇(cadinol)2220 623321 358橙花叔醇(nerolidol)2226 383421 768氧化石竹烯(caryophylleneoxide)2200 473522 167斯巴醇(spathalenol)2220 533623 8512,3⁃二甲基⁃2,3⁃二苯基丁烷(2,3⁃dimethyl⁃2,3⁃diphenylbutane)2380 353725 791十七烷(heptadecane)2400 573826 5732⁃十六烯酸(hypogaeicacid)2540 143927 646棕榈酸(palmiticacid)2560 224031 269羟基⁃山椒素12451 514131 632羟基⁃山椒素22450 544234 261山椒素12633 624335 381山椒素22633 484435 765山椒素32631 234537 106山椒素52630 284640 453长碳链不饱和酰胺类物质12927 764740 935长碳链不饱和酰胺类物质22922 434841 373长碳链不饱和酰胺类物质32965 084941 572长碳链不饱和酰胺类物质42964 885044 362反⁃9⁃十八碳烯酸甲酯(methylelaidate)2980 11

表4 固相萃取柱流出液的组分及其相对含量Table 4 The component and relative content component of the sample liquid passing solid-phase extraction column
3 结论
用硅胶表面分子印迹聚合物制成固相萃取柱,确定了该固相萃取柱的最佳上样溶剂为二氯甲烷,最佳淋洗溶剂为三氯甲烷,最佳洗脱溶剂为甲醇,用此固相萃取柱对花椒油树脂中的花椒麻味物质进行分离纯化,结果表明,该固相萃取柱对花椒麻味物质表现出优异的特异性吸附效果,可以分离纯化出相对纯度为93.66 %的花椒麻味物质,与其它提取纯化花椒麻味物质的研究方法相比,该方法更加快速、经济、高效。
[1] 史劲松,顾龚平,吴素玲,等.花椒资源与开发利用现状调查[J].中国野生植物资源,2003,22(5):6-8.
[2] 王宇,巨勇,王钊.花椒属植物中生物活性成分研究近况[J].中草药,2002,33(7):93-97.
[3] 张敬文,赵镭,史波林,等.花椒果皮中化学成分的研究[J].华西药学杂志,2016,31(2):109-112.
[4] 莫丽春,卢馨,曾里,等.速煮紫薯中花青素的测定方法研究[J].粮食与饲料工业,2012,12(6):18-20.
[5] TANAKA O.Novel amide compound and produeton thereof[P].日本专利:JP1294657,1989-11.
[6] 徐文雯,马习东,王芳,等.富马酸生产菌少根根霉的诱变筛选[J].生物加工过程,2008,6(4):61-64.
[7] HASHIMOTO,SATOH K,KASE Y,et al.Modulatory effect of aliphatic acid amides fromZanthoxylumpiperitumon isolated gastrointestinal tract[J].PLANTA MEDICA,2001,67(2):179-181.
[8] 周敏,花椒麻素对肝癌细胞生理功效及机理研究[D].重庆: 西南大学,2014.
[9] 曹继全,徐伟昌,李春荣.高温高压水煮制取花椒麻味素的方法[P].中国专利:CN 1305742A.2001,8.
[10] IH-SHENG CHEN,TZU-LI CHEN,WEI Yu-lin,et al.Isobutyl amides from the fruit of Zanthoxylum integrifoliolum[J].Phytochemistry,1999,52:357-360.
[11] XIONG Quanbo,SHI Dawen,HIROFUMI,et al.Alkyl amides from Pericarps of Zanthoxylum[J].Phytochemistry,1997,46(6):1 123-1 126.
[12] 莫彬彬,连宾,万固,等.超临界CO2分步萃取花椒香气和麻味物质的初步研究[J].食品科学,2009,30(8):201-203.
[13] 杨潇,芮光伟,钟智超,等.9种花椒超临界CO2萃取物中化学成分的GC/MS/AMDI分析[J].食品与发酵工业,2011,37(3):158-162.
[14] 罗凯,胡江,黄秀芳,等.花椒麻味物质的提取分离及其组分分析[J].食品科学,2013,34(24):88-91.
[15] SUGAI E,MORIMITSU Y,KUBOTA K.Quantitative analysis of sanshool compounds in Japanese pepper (Xanthoxylum piperitum DC.) and their pungent characteristics[J].Bioscience Biotechnology & Biochemistry,2014,69(10):1 958-1 962.
[16] 薛敏,王安,王瑜,等.分子印迹固相萃取技术检测江水、尿液及牛奶中雌激素残留[J].分析化学,2011(6):793-798.
[17] 胡艳云,徐慧群,姚剑,等.分子印迹固相萃取-液相色谱-质谱法测定果蔬中20种三唑类农药残留[J].分析化学,2014(2):227-232.
[18] 韦寿莲,郭小君,汪洪武,等.咖啡因分子印迹固相萃取柱的制备及应用[J].分析化学,2012(7):1 071-1 075.
[19] GUTIÉRREZCLIMENTE R,GMEZCABALLERO A,HALHALLI M,et al.Iniferter-mediated grafting of molecularly imprinted polymers on porous silica beads for the enantiomeric resolution of drugs[J].Journal of Molecular Recognition,2016,29(3):106-114.
[20] 王明华,曲荣君,纪春暖,等.含酰胺结构的硅胶键载二乙烯三胺螯合微粒的合成及其吸附性能[J].离子交换与吸附,2008,24(5):408-417.
[21] 胡廷平,张宴铭,郑立辉,等.硅胶表面苯并噻吩分子印迹聚合物的分子识别与吸附性能[J].燃料化学学报,2010,38(6):722-729.
[22] GAO D,ZHANG Z,WU W,et al.A surface functional monomer-directing strategy for highly dense imprinting of TNT at surface of silica nanoparticles[J].Journal of the American Chemical Society,2007,129(25):7 859-7 866.
[23] LIAO S,ZHANG W,LONG W,et al.Adsorption characteristics,recognition properties,and preliminary application of nordihydroguaiaretic acid molecularly imprinted polymers prepared by sol-gel surface imprinting technology[J].Applied Surface Science,2016,364(4):579-588.
[24] KYZAS G Z,LAZARIDIS N K,BIKIARIS D N.Optimization of chitosan and β-cyclodextrin molecularly imprinted polymer synthesis for dye adsorption[J].Carbohydrate Polymers,2013,91(1):198-208.
[25] BITAR N,CAYOT P,BOUMAROUN E.Cayot and E.Boumaroun,Molecularly imprinted polymer solid phase extraction of fungicides from wine samples[J].Analytical Methods,2014,6(16):6 467-6 472.
[26] 吐尔洪·买买提,阿不都克热木·卡地尔,哈丽丹·买买提,等.替代模板法制备甲硝唑分子印迹聚合物及其在血清样品固相萃取中的应用[J].分析化学,2011,39(12):1 841-1 845.
[27] AZODI-DEILAMI,NAJAFABADI A H,ASADI E,et al.,Magnetic molecularly imprinted polymer nanoparticles for the solid-phase extraction of paracetamol from plasma samples,followed its determination by HPLC[J].Microchimica Acta,2014,181(15):1 823-1 832.
[28] 韩芳,胡艳云,张蕾,等.虚拟分子印迹固相萃取技术检测食品中10种三嗪类除草剂残留[J].分析化学,2012,40(11):1 648-1 653.
[29] 王遵臣,于海宁,沈生荣,等.辣椒素分子印迹聚合物的制备及其在固相萃取中的应用[J].食品科学,2013,34(12):45-50.
[30] 杜欣蔚,刘广洋,张艳欣,等.模板替代法制备三聚氰胺表面分子印迹聚合物及其在牛奶样品固相萃取中的应用[J].农产品质量与安全,2015(4):36-40.
[31] SHEYKHAGHAEI G,HOSSAINISADR M,KHANAHMADZADEH S,et al.Magnetic molecularly imprinted polymer nanoparticles for selective solid phase extraction and pre-concentration of Tizanidine in human urine[J].Journal of Chromatography B,2016,1011(7):1-5.
[32] 刘伯洋,李利军,程昊,等.分子印迹固相萃取技术对六堡茶中表儿茶素的分离特性[J].食品科学,2016,37(13):1-11.
[33] 张铁莉,赫彩霞,王磊.沉淀聚合法制备3-吲哚乙酸印迹聚合物微粒及其固相萃取应用[J].分析测试学报,2016,35(8):962-967.
[34] 杜丽丽,苏立强,高宝勋,等.加替沙星分子印迹聚合物的制备及其应用[J].化学研究与应用,2015,27(3):262-267.
[35] PARK H E,TIAN M,ROW K H.Molecularly imprinted polymer for solid-phase extraction of phenolic acids from salicornia herbacea L[J].Separation Science and Technology,2014,49(9):1 401-1 406.
[36] ZHANG Z,ZHENG S,YANG J,et al.Synthesis and solid phase extraction performance study of NNAL-specific molecularly imprinted polymers using dummy templates[J].Chinese Journal of Chemical Physics,2013,26(3):361-368.
[37] RAOR N,SRAVAN B,REDDY C K,et al.Molecularly imprinted polymer-based,solid-phase extraction followed by liquid chromatographic determination of lacosamide in rat plasma[J].Analytical Methods,2014,6(9):3 101-3 107.
[38] SANAGI M M,SALLEH S,WAN A W I,et al.Molecularly imprinted polymer solid-phase extraction for the analysis of organophosphorus pesticides in fruit samples[J].Journal of Food Composition and Analysis,2013,32(2):155-161.
[39] 房信胜,穆向山,李明会,等.莱芜花椒和川椒挥发油的GC-MS分析比较[J].中药材,2011,34(4):555-559.
[40] 莫彬彬,连宾,万固存,等.超临界CO2分步萃取花椒香气和麻味物质的初步研究[J].食品科学,2009,30(8):201-203.
[41] 杜文倩,史波林,欧克勤,等.基于麻味物质构成特征的红花椒高效液相色谱指纹图谱建立研究[J].食品安全质量检测学报,2016,7(3):1 138-1 144.
ThepreparationandapplicationoftheChinesepricklyash'smolecularlyimprintedsolid-phaseextraction
CHEN Xiao-long1,LI Yao1,CHEN Guang-jing1,JIN Xin-kai3,KAN Jian-quan1,2*
1(College of Food Science,Southwest University,Chongqing 400715 China) 2(Laboratory of Quality & Safety Risk Assessment for Agro-products on Storage and Preservation,Chongqing 400715,China) 3(College of Gardening,Southwest University,Chongqing 400715,China)
The molecularly imprinted polymers was synthesized by molecular structure analogues of α-(OH)-sanshool as the template molecule,2-Vpy as functional monomer,EDMA as the crosslinking agent and at the proportion of 1∶4∶20.The optimal sample solvent,drip washing solvent and elution solvent were selected out and the SMIP was used to separate and purify the numb taste components in Zanthoxylum oleoresin.The results show that the SMIP had specific adsorption to the numb taste components,and 93.66% of pure numb taste components can be separated.
Chinese prickly ash; molecularly imprinted polymer; molecularly imprinted solid-phase extraction (MISPE); high performance liquid chromatography (HPLC); gas chromatography mass spectrometry (GC-MS)
10.13995/j.cnki.11-1802/ts.014711
硕士研究生(阚建全教授为通讯作者,E-mail:kanjianquan@163.com)。
国家自然科学基金(31371834)
2017-05-06,改回日期:2017-06-01

