藻源性内毒素在铜绿微囊藻灭活过程中的释放
卜令君,周石庆,施 周,王 涛,衣启航,孙聚龙 (湖南大学土木工程学院,建筑安全与节能教育部重点实验室,湖南 长沙 410082)
农业化肥的流失、生活污水的过度排放等人类活动使得大量氮、磷流入湖泊、河流及海湾,在全球范围内造成了严重的水体富营养化,藻类爆发现象也随之频繁发生[1-2].藻类爆发及其衍生物的释放等问题给人类生产生活及自来水厂的正常运行带来了巨大影响[3],因此,如何有效抑制藻类爆发已成为世界性难题.化学修复方法由于见效快,目前被广泛应用于控制藻类爆发[4].但有学者研究发现,该类方法虽然能有效抑制藻类生长,但在灭活藻细胞的过程中会伴随有胞内有机物的释放,有可能对机体健康和生态平衡造成更大的危害,这类胞内有机物包括藻毒素、嗅味物质等受到了广泛关注[3,5-7].
在藻类释放的众多衍生物中,藻源性内毒素作为一种外源性致热源,未能引起国内外研究者足够的关注.藻源性内毒素是蓝藻细胞壁的脂多糖复合物,主要由藻类死亡后释放[8-10].内毒素一般由3部分组成:类脂A、核心寡糖以及O-特异多糖,其中类脂A可以通过一系列反应激活炎症信号,是其毒性中心[11].内毒素可通过血液、呼吸、胃肠等暴露途径使人体患上各种疾病[9],研究发现将 0.1~0.5ng/kg内毒素进行静脉注射即可引起人体发热反应[12];空气中内毒素浓度达到1000~2000ng/m3时则可能使人体患上有机粉尘毒性综合征[13].目前我国相关文件中规定的血液透析用水及制药用水对内毒素浓度的限制分别为1.0,0.25EU/mL[14].
调查发现芬兰某水源在藻类爆发时内毒素活性可达 20~38000EU/mL(1EU/mL = 0.1ng/mL),严重威胁着机体健康[15].除此之外,内毒素近年来在各地水源水、饮用水中被频繁检出[14,16],更是为水处理工作者敲响了警钟.目前已经有研究人员考察了常规水处理工艺、活性炭吸附、液氯、高锰酸钾、中压汞灯等对内毒素的去除效果[14,17-18],但其机理及动力学还有待进一步的研究.
由于藻细胞凋亡解体之后会释放大量内毒素,因此化学修复除藻的过程中必然会伴随有内毒素的释放.本文选用了 4种常见的化学除藻剂(次氯酸钠、双氧水、硫酸铜及敌草隆),对比了其对藻类的灭活效果及过程中内毒素的释放和降解,以期为高藻水源水的处理提供理论依据.
1 材料与方法
1.1 试验材料及器具
铜绿微囊藻藻种(FACHB-912)购自中科院武汉水生所,培养于 BG-11培养基中,培养箱温度设为25℃,光照周期为12h光照-12h黑暗.
BG-11培养基所需药剂均购自国药集团化学试剂有限公司.显色基质鲎试剂盒、无热原试管、无热源移液枪头、内毒素检查用水、内毒素标准品购自厦门鲎试剂生物科技股份有限公司.其他所用玻璃器皿清洗后于250℃干烤60min以上.
1.2 试验方法
本研究所采用藻细胞溶液浓度约为 1.5×106个/mL.取 100mL待处理藻溶液,分别投加 0.10,0.25,0.50mg/L次氯酸钠,0.10,0.25,0.50mmol/L双氧水,0.5,1.0,2.5μmol/L 硫酸铜,5,10,25μmol/L 敌草隆,充分混匀后,置于光照恒温培养箱中,分别于24,48,96,168h取样,测定其 OD680及内毒素含量,每个样品测试2次取平均值.
1.3 分析方法
藻细胞浓度由紫外-可见光分光光度计(U-3900, Hitachi)于波长680nm处测得.
内毒素含量利用显色基质鲎试剂盒进行定量测定.鲎试剂为鲎科动物东方鲎的血液変形细胞溶解物的冷冻干燥品,在温育(37℃)条件下,内毒素可与鲎试剂发生一系列酶促反应,激活凝固酶原形成凝固酶,凝固酶分解人工合成的显色基质,使其分解为多肽和黄色的对硝基苯胺(λmax=405nm),对硝基苯胺的生成量与内毒素浓度成正比,但为了避免待测样品本身的颜色对405nm处吸收峰的干扰,遂利用偶氮化试剂将对硝基苯胺染成玫瑰红色(λmax=545nm)再使用紫外-可见光分光光度计(U-3900, Hitachi)进行测定.采用内毒素标准样品作标准曲线(R2>0.98),并采用内毒素检查用水作阴性对照,该方法检测限可达0.01EU/mL.
2 结果与讨论
2.1 次氯酸钠对藻类活性及内毒素的影响
次氯酸钠由于其强氧化性是目前饮用水厂最常用的消毒剂,可有效杀灭水中的细菌,同样也常被用来灭活水中的藻类.一般饮用水中余氯含量不超过0.5mg/L即对人体没有危害,因此,本文分别选取0.10,0.25,0.50mg/L(以Cl2计)的次氯酸钠溶液对水中的铜绿微囊藻进行灭活.如图1(a)所示,在未加次氯酸钠的控制样中,藻细胞在168h内稳步繁殖生长,其OD680由0.0890逐步增至 0.2735;低浓度(0.10mg/L)的次氯酸钠虽未能完全去除溶液中的藻细胞,但有效抑制了藻细胞的生长,其OD680在168h后逐渐降至0.0444.0.25,0.50mg/L的次氯酸钠对铜绿微囊藻的去除效果显著,168h后其溶液吸光度分别降至 0.0046和0.0041,溶液几乎呈透明状.
其内毒素含量的变化情况如图1(b)所示.控制样中内毒素含量1周内均在80EU/mL上下波动,没有明显变化,这是因为所使用的藻溶液尚未进入衰亡期(图1(a)),而内毒素主要是由死亡的细胞释放.内毒素含量增长最明显的是经0.10mg/L次氯酸钠处理后的藻溶液,168h内其内毒素含量持续增长,且最终激增至 1564.78EU/mL;而经较高浓度(0.25,0.50mg/L)次氯酸钠处理后的藻溶液中虽然藻细胞死亡数目更多,但内毒素含量反而只有 872.14,852.03EU/mL,这可以归因为次氯酸钠的强氧化性,导致内毒素结构在处理过程中被破坏,这与Anderson等[17]的研究结果一致.

图1 次氯酸钠对藻类活性(a)和内毒素含量(b)的影响Fig.1 Effect of sodium hypochlorite on the activity of algae (a) and concentration of endotoxins (b)
2.2 双氧水对藻类活性及内毒素的影响
双氧水由于其氧化性较强且产物绿色环保,被越来越多的用于藻类爆发时藻细胞的灭活[19].有研究表明,在灭藻过程中,若双氧水投量小于19.7mg/L(约 0.58mmol/L),便不会对一般水生动物的健康造成危害[20],因此,本文分别选取 0.10,0.25,0.50mmol/L的双氧水溶液对水中的铜绿微囊藻进行灭活.如图2(a)所示,藻细胞活性在经不同浓度双氧水处理后受到了不同程度的破坏,其溶液吸光度均持续下降,经0.10,0.25,0.50mmol/L双氧水处理168h后的藻溶液在680nm处的吸光度由0.089分别降至0.0133、0.0027和0.0054.

图2 双氧水对藻类活性(a)和内毒素含量(b)的影响Fig.2 Effect of hydrogen peroxide on the activity of algae(a) and concentration of endotoxins (b)
双氧水处理过程中内毒素的含量变化如图2(b)所示.与次氯酸钠类似,内毒素释放最显著的是经0.25mmol/L双氧水处理后的藻溶液,其内毒素浓度由初始的 55.30EU/mL分别涨至 48h和96h的1038.26,1750.35EU/mL;168h时又稍微降至1706.22EU/mL.而经0.10mmol/L和0.50mmol/L双氧水处理的藻溶液在反应168h后内毒素浓度则分别只增至 732.23,944.84EU/mL,这一现象是因为当双氧水浓度较低时,部分藻细胞并未被完全破坏至释放内毒素;而当双氧水浓度较高时,多余的氧化剂则可以破坏部分内毒素的结构,因此内毒素浓度会相对减小.
2.3 硫酸铜对藻类活性及内毒素的影响
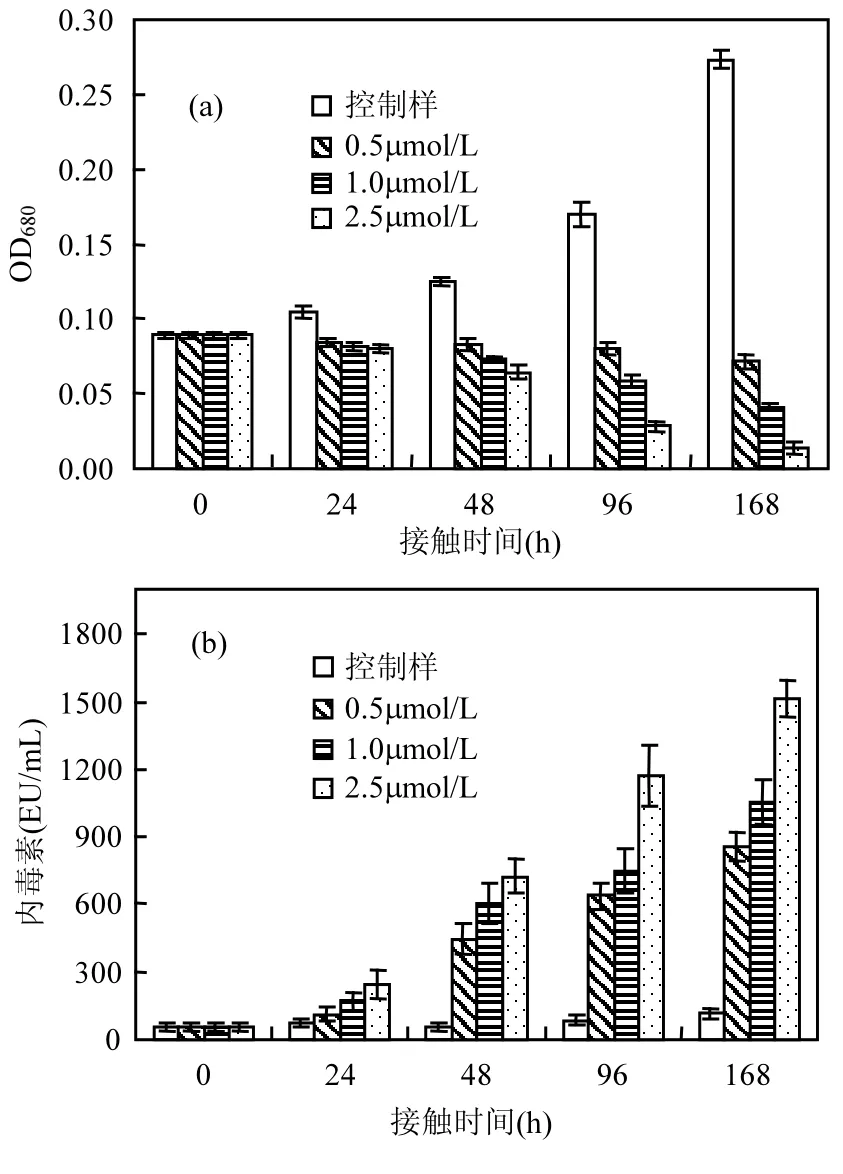
图3 硫酸铜对藻类活性(a)和内毒素含量(b)的影响Fig.3 Effect of copper sulfate on the activity of algae (a)and concentration of endotoxins (b)
验不同,经硫酸铜处理后的藻溶液中内毒素含量随着接触时间及硫酸铜浓度的增长而增长,在168h的反应时间结束后,3组样品中的内毒素含量由 55.30EU/mL分别增至 854.60,1055.45,1513.15EU/mL,该现象是由于硫酸铜本身并无氧化性,无法降解死亡藻细胞释放的内毒素,因此,随着硫酸铜浓度及细胞死亡数目的增加,溶液中的内毒素也会相应增加.
2.4 敌草隆对藻类活性及内毒素的影响

图4 敌草隆对藻类活性(a)和内毒素含量(b)的影响Fig.4 Effect of diuron on the activity of algae (a) and concentration of endotoxins (b)
硫酸铜在其常规用量(0.5~1.0mg/L,即3.125~6.25μmol/L)的情况下对人体健康无害,且可导致藻细胞中类囊体破裂、DNA原纤维聚集,从而使藻细胞死亡[21].硫酸铜因其除藻效果好且价格便宜,是目前室外游泳池最常用的除藻剂.因此,本文选用 0.5,1.0,2.5μmol/L硫酸铜对水中的铜绿微囊藻进行灭活,结果如图4所示.相较于次氯酸钠和双氧水,硫酸铜的除藻效果稍差,但可以看出其仍可以有效抑制藻类的生长,经 0.5,1.0,2.5μmol/L硫酸铜处理168h后的藻溶液在680nm处的吸光度由0.089分别降至0.0713、0.0411及0.0135(图3(a)).另一方面(图3(b)),与以上2组实
敌草隆又名二氯苯基二甲脲,是一种光合作用抑制剂,其可以阻止叶绿素的合成和阻断电子传递,从而破坏植物的光合系统II导致细胞死亡,但由于敌草隆属于难降解有机物,且其部分中间产物具有极强的基因毒性,因此在其应用过程中应酌情使用[22].本文选用了 5,10,25μmol/L敌草隆进行了藻类灭活实验.如图4(a)所示,5 μmol/L的敌草隆在前 96h内对藻细胞的生长并无明显抑制作用,而 10μmol/L和 25μmol/L的敌草隆在96h内虽能抑制藻细胞的生长,仍无法有效去除藻细胞,但3组溶液在观察过程中均已明显变黄,说明了其光合系统已遭破坏,细胞中叶绿素含量减少,且3组溶液在168h反应时间结束后OD680分别骤降至0.0279、0.0223和0.0179.同样,与硫酸铜相似,由于敌草隆本身不具有氧化性,所以溶液中的内毒素含量与死亡细胞数目基本成正比,因此,经敌草隆处理后的藻溶液中内毒素含量也随着反应时间及敌草隆浓度的升高而升高,由图4(b)可知,3组溶液内毒素浓度在前96h增幅不大,由 55.30EU/mL分别增至 476.94,632.32,942.43EU/mL,然后随着细胞死亡数据激增,168h时内毒素浓度分别增至 1802.23,1788.11,1886.14EU/mL.
2.5 4种除藻剂的对比
现将次氯酸钠、双氧水、硫酸铜和敌草隆4种除藻剂在 168h(7d)时对铜绿微囊藻的抑制率及内毒素的释放进行分析如表1所示.由表1可知,本实验所采用的4种除藻剂在1周内均能高效的灭活水中的铜绿微囊藻,且当采用较高浓度时对藻类的抑制率均可达到 90%以上.这与其他参考文献中的实验结果一致[4,6],除藻剂能够有效拟制藻细胞的光量子产率,进而降低光捕获能力并阻断电子传递,最终造成藻细胞完全丧失光合作用能力,因此本研究中藻细胞与除藻剂接触一段时间后逐渐死亡,OD680值降至0.02以下.
与此同时,本研究所进行的12组不同浓度除藻剂实验中,藻类被灭活的过程均伴随有不同浓度内毒素的释放,且随着接触时间的延长,内毒素释放的浓度越来越大.7d除藻实验中4种除藻剂造成内毒素释放的浓度在 732.30~1886.14EU/mL之间,均远远大于控制样在7d时释放的内毒素浓度(113.86EU/mL).这一结果可以归结于2个原因:一是藻细胞在正常生长过程中会向周围水体释放内毒素,如控制样水中内毒素浓度随着时间延长逐渐升高;二是除藻剂与藻细胞作用后,细胞壁破裂或细胞死亡裂解,从而不断释放内毒素至周围水体中,且随着除藻剂投加量增加,内毒素释放有上升趋势.本研究中内毒素的释放规律与其他文献氧化剂除藻过程中藻毒素的释放过程类似[4,23],均是由于藻细胞破裂或裂解所致.
以上实验结果表明在使用化学除藻剂灭藻过程中,即使水源水中藻类已被除藻剂有效去除,因其除藻过程中释放了大量的内毒素,人们仍不能直接与含藻水源接触,以避免因暴露于过量内毒素之下而引发病症.

表1 168h时各除藻剂对铜绿微囊藻的抑制率和内毒素的释放情况Table 1 Inhibition rate of different algaecides on Microcystis aeruginosa and the release of endotoxin
3 结论
3.1 次氯酸钠、双氧水、硫酸铜及敌草隆等化学除藻剂在灭活藻类的同时会伴随有大量内毒素的释放(732.30~1886.14EU/mL),远大于藻类自然代谢产生的内毒素(113.86EU/mL),严重危害着机体健康.
3.2 次氯酸钠、双氧水等具有氧化性的除藻剂在用量较大时能一定程度上降解部分内毒素(7d时间分别释放内毒素852.03,944.84EU/mL),而硫酸铜、敌草隆等非氧化性的除藻剂则无法降解释放的内毒素(7d时间分别释放内毒素 1513.15,1886.14EU/mL).
3.3 人们应避免与化学修复法处理的高藻水直接接触,以减少内毒素暴露风险.
[1] Burford M A, Johnson S A, Cook A J, et al. Correlations between watershed and reservoir characteristics, and algal blooms insubtropical reservoirs [J]. Water Research, 2007,41(18):4105-4114.
[2] 王 林,吴纯德,倪木子,等.硅藻土强化混凝去除铜绿微囊藻的影响因素研究 [J]. 中国环境科学, 2014,34(1):156-160.
[3] Li L, Gao N, Deng Y, et al. Characterization of intracellular &extracellular algae organic matters (AOM) of Microcystic aeruginosa and formation of AOM-associated disinfection byproducts and odor & taste compounds [J]. Water Research,2012,46(4):1233-1240.
[4] Zhou S, Shao Y, Gao N, et al. Effects of different algaecides on the photosynthetic capacity, cell integrity and microcystin-LR release of Microcystis aeruginosa [J]. Science of the Total Environment, 2013,463:111-119.
[5] Jančula D, Maršálek B. Critical review of actually available chemical compounds for prevention and management of cyanobacterial blooms [J]. Chemosphere, 2011,85(9):1415-1422.
[6] 汪小雄,姜成春,朱 佳,等.臭氧灭活水中铜绿微囊藻影响因素研究 [J]. 中国环境科学, 2012,32(4):653-658.
[7] He X, Zhang G, de la Cruz A A, et al. Degradation mechanism of cyanobacterial toxin cylindrospermopsin by hydroxyl radicals in homogeneous UV/H2O2process [J]. Environmental Science &Technology, 2014,48(8):4495-4504.
[8] Anderson W B, Slawson R M, Mayfield C I. Review/Synthèse A review of drinking-water-associated endotoxin, including potential routes of human exposure [J]. Canadian Journal of Microbiology, 2002,48(7):567-587.
[9] 张 灿,刘文君,张明露,等.水中细菌内毒素污染特性及检测方法研究进展 [J]. 环境科学, 2014,35(4):1597-1601.
[10] Parikh S J, Chorover J. Infrared spectroscopy studies of cation effects on lipopolysaccharides in aqueous solution [J]. Colloids &Surfaces B Biointerfaces, 2007,55(2):241-250.
[11] 邵英光,李京华,魏桂林,等.内毒素的去除策略 [J]. 广州化学,2003,28(2):38-45.
[12] Elin R J, Wolff S M, McAdam K, et al. Properties of reference Escherichia coli endotoxin and its phthalylated derivative in humans [J]. Journal of Infectious Diseases, 1981,144(4):329-336.
[13] Xue J, Zhang J, Xu B, et al. Endotoxins: The critical risk factor in reclaimed water via inhalation exposure [J]. Environmental Science & Technology, 2016,50(21):11957-11964.
[14] 张 灿,刘文君,张明露,等.生活饮用水和瓶装饮用水的细菌内毒素活性调查 [J]. 中国给水排水, 2013,29(13):47-52.
[15] Rapala J, Lahti K, Räsänen L A, et al. Endotoxins associated with cyanobacteria and their removal during drinking water treatment[J]. Water Research, 2002,36(10):2627-2635.
[16] Zhang C, Liu W, Wen S, et al. Endotoxin contamination and control in surface water sources and a drinking water treatment plant in Beijing, China [J]. Water Research, 2013,47(11):3591-3599.
[17] Anderson W B, Mayfield C I, Dixon D G, et al. Endotoxin inactivation by selected drinking water treatment oxidants [J].Water Research, 2003,37(19):4553.
[18] Anderson W B, Huck P M, Dixon D G, et al. Endotoxin Inactivation in Water by Using Medium-Pressure UV Lamps [J].Applied & Environmental Microbiology, 2003,69(5):3002-3004.
[19] Qian H, Yu S, Sun Z, et al. Effects of copper sulfate, hydrogen peroxide and N-phenyl-2-naphthylamine on oxidative stress and the expression of genes involved photosynthesis and microcystin disposition in Microcystis aeruginosa [J]. Aquatic Toxicology,2010,99(3):405-412.
[20] Gaikowski M P, Rach J J, Ramsay R T. Acute toxicity of hydrogen peroxide treatments to selected lifestages of cold-,cool-, and warmwater fish [J]. Aquaculture, 1999,178(3):191-207.
[21] Verhoeven R L, Eloff J N. Effect of lethal concentrations of copper on the ultrastructure and growth of Microcystis [J].Proceedings-Southern African Electron Microscopy Society,1979,9:161-162.
[22] Giacomazzi S, Cochet N. Environmental impact of diuron transformation: a review [J]. Chemosphere, 2004,56(11):1021-1032.
[23] Daly R I, Ho L, Brookes J D. Effect of chlorination on Microcystis aeruginosa cell integrity and subsequent microcystin release and degradation [J]. Environmental Science & Technology,2007,41: 4447-4453.

