解脂耶氏酵母利用甘蔗渣发酵产赤藓醇
刘晓燕, 张 瑾, 王媛媛, 蔡顺晨, 张 晴, 孙 静, 徐继明
(淮阴师范学院, 化学化工学院, 江苏 淮安 223300)
0 引言
赤藓醇(Erythritol,1,2,3,4-丁四醇),作为一种代谢产物及贮存化合物,在许多天然产品如地衣,大麻叶、蘑菇、西瓜及葡萄中广泛存在,很多发酵食品如酱油、啤酒中也含有丰富的赤藓醇.赤藓醇热量极低(0.3 kcal/g),甜度却为蔗糖的70%~80%.由于人体缺乏代谢赤藓醇的酶系,人体摄入的90%的赤藓醇不能被人体代谢,很快随尿液直接排出体外而不改变血糖指数,因此赤藓醇被认为是理想的低热量无糖食品配料.同时动物毒理学与临床研究已表明赤藓醇是安全的甜味剂,且人体对其具有高耐受性.基于以上的属性,赤藓醇已被广泛应用于特殊功能食品加工,成为糖尿病人、心血管病人和肥胖病人饮食中理想的甜味剂[1].此外,赤藓醇能抑制口腔细菌增长,对龋齿具有明显的抑制作用,因而在日化领域亦广受青睐[2-3].近年来,赤藓醇在食品与卫生保健、化工等领域的应用前景十分广阔,需求量日益增加.
赤藓醇在自然界中含量极低,目前大规模生产赤藓醇的主要方法是微生物发酵法[4].赤藓醇商业化生产主要依赖于短梗霉属(Aureobasidiumsp.)以及链霉属(Pseudozymatsukubaensis)以葡萄糖为原料发酵合成赤藓醇[5],因而发酵成本较高.近年来,解脂耶氏酵母(Yarrowialipolytica)因其广泛的底物范围及高赤藓醇产量获得了众多关注[6-8].解脂耶氏酵母大多从食品中分离而来,被FDA(美国食品药物管理局)认定为对人类健康无害的安全发酵菌株[9],且该菌对低溶氧及重金属环境耐受力强,使得粗原料可以作为其发酵碳源而降低发酵成本.以上特点使得解脂耶氏酵母在赤藓醇发酵领域中具有显著优势.
甘蔗渣(Bagasse)是制糖加工过程中的副产品,甘蔗榨汁过程中大量可溶性糖含量残留在甘蔗渣中,因此甘蔗渣是良好的微生物发酵碳源[10].甘蔗渣产量巨大,然而目前尚无有效地处理方法.在实验中,选择甘蔗渣作为唯一碳源、以解脂耶氏酵母为发酵菌株进行赤藓醇发酵,探索一条甘蔗渣利用新工艺,同时为降低赤藓醇发酵成本提供技术指导.并通过发酵条件优化,构建了甘蔗渣生产赤藓醇的高效发酵体系.
1 材料和方法
1.1 菌种与原料
实验所用的菌株为解脂耶氏酵母 SWJ-1b,该菌分离自渤海海洋鱼类消化道,纯化后接在固体YPD斜面上,置入4℃冰箱中保存.为保证菌株活力,每个月转接一次斜面.
实验所用原料来自淮安本地水果店鲜榨甘蔗汁后弃置的甘蔗渣,经烘干与粉碎后使用.
1.2 培养基
YPD固体培养基(g/L): 葡萄糖20.0,琼脂20.0,酵母粉10.0,蛋白胨20.0.
YPD液体培养基(g/L): 葡萄糖20.0,酵母粉10.0,蛋白胨20.0.
初始发酵培养基(g/L): (NH4)2SO42.50,MgSO4·7H2O 1.00,KH2PO41.00,酵母粉 0.75及NaCl 20.0,底物20.0.
以上培养基均以蒸馏水配置,并在配置好后于115℃下灭菌30 min后待用.
1.3 试剂
赤藓醇测定试剂: 国药集团化学试剂有限公司.
高碘酸钠试剂: 准确称取高碘酸钠溶于0.25 mol/L硫酸,终浓度为0.03 mol/L.
SnCl2试剂: 准确称取SnCl2溶于0.3 mol/L盐酸,终浓度为0.125 mol/L (注:现配现用).
变色酸试剂: 准确称取0.2 g变色酸溶于10 mL水,再加入40 mL浓硫酸.
其他所需试剂: NH4Cl,NH4HCO3,过硫酸铵,尿素及玉米浆.
实验中所用试剂均为分析纯.
1.4 种子液培养及发酵培养
从YPD斜面培养基上挑取菌体接种于YPD液体培养基中,在摇床内于30℃和200 rpm下恒温振荡培养24 h.取1 mL(OD600nm=30)培养好的种子液接种至50 mL发酵培养基中,在摇床内于30℃和200 rpm下恒温振荡120 h.
1.5 发酵优化
在碳源优化实验中,分别添加10.0,20.0,30.0,40.0,50.0和60.0 g/L甘蔗渣进行发酵培养.在氮源优化培养基中,分别添加(NH4)2SO4,NH4Cl,NH4HCO3,过硫酸铵,尿素及玉米浆作为氮源进行发酵培养.在氮源浓度优化实验中,分别添加0,1.0,2.0,3.0和4.0g/L的氮源进行发酵培养.在NaCl优化实验中分别添加0,20.0,40.0,60.0,80.0及100.0 g/L的NaCl于发酵培养基中进行发酵.在矿物元素添加优化试验中,分别添加0,2.0,4.0,6.0及8.0 mg/L的Cu2+和0,5.0,10.0,15.0和20.0 mg/L的Mn2+至发酵培养基中进行培养.以优化后的条件发酵并测定发酵曲线,培养时间为一周共168 h,每24 h取样测定.
1.6 赤藓醇产量的测定
发酵培养基经离心后,取上层清液稀释50倍,取0.5 mL于大试管内,对照加0.5 mL蒸馏水.首先向各试管中加入0.5 mL高碘酸钠试剂,室温下放置8~10 min.随后加入0.5 mL SnCl2,摇匀.接着加2 mL变色酸,用力摇匀后置于沸水浴30 min,待冷却后转移至比色管中定容至25 mL,于570 nm处测吸光度,并通过标准曲线计算出产量.
2 实验结果与讨论
2.1 原料的预处理
将新鲜的甘蔗渣经粉碎、烘干、再粉碎后,于干燥处保存,如图1所示.甘蔗渣烘干可以降低水活度,防止微生物滋生导致的组分变化.甘蔗渣粉碎后质地更加均匀,在发酵培养基中与微生物细胞更容易接触,对发酵更为有利.
2.2 不同碳源发酵赤藓醇比较
为了探究甘蔗渣作为发酵底物的可行性,分别以20.0 g/L的甘油、葡萄糖、豆渣,菠萝皮,甘蔗渣及玉米芯作为底物进行发酵培养.发酵结束后,测定不用底物培养基中赤藓醇产量,结果如图2所示.结果表明,不同底物对发酵过程的菌体生物量和赤藓醇产量影响明显.甘蔗渣的赤藓醇产量(9.7 g/L)虽略低于理想原料甘油(10.9 g/L)及葡萄糖(11.7 g/L),但相对于其他粗原料如苹果皮(6.9 g/L)及玉米芯(7.6 g/L)有较大优势,在所有粗原料中发酵效果最好.因此选择甘蔗渣作为发酵底物是可行的.

图1 烘干粉碎后的甘蔗渣

图2 不同碳源发酵赤藓醇比较
2.3 甘蔗渣浓度对解脂耶氏酵母赤藓醇发酵的影响
解脂耶氏酵母分别在含有6种不同浓度甘蔗渣(10.0,20.0,30.0,40.0,50.0和60.0 g/L)的发酵培养基中进行培养,其发酵结果如图3所示.从图3可以看出,在低底物浓度(10.0 g/L)培养基中,赤藓醇产量较低,产率也不高.当培养基中的甘蔗渣浓度提升至30.0 g/L,赤藓醇的产量最高,达到13.7 g/L,同时产率也达到最大的45.7 %.但随着甘蔗渣浓度的进一步增加,赤藓醇产量与产率均有所下降.
结果表明甘蔗渣浓度在赤藓醇发酵中起关键作用.过低浓度的甘蔗渣使得发酵产量低,不利于工业化生产.然而碳源浓度过高同样不利于赤藓醇生产,推测其中的原因可能是过多的甘蔗渣导致培养基传质及溶氧量下降,从而使发酵产量下降.这从侧面反映了培养基溶氧量及传质对发酵的重要影响.值得一提的是,王凤伟等人在研究耐高渗赤藓糖醇生产菌的筛选与发酵条件优化时所选用葡萄糖的最佳浓度达到200g/L[11],原因可能是碳源的溶解性不同所导致.可溶性碳源不会影响培养基溶氧,因而较高的添加量也不会导致溶氧量的下降;而不溶性碳源则受到培养基溶氧的限制,培养基对其接纳力下降.甘蔗渣作为一种不溶性碳源,其适于发酵的浓度偏低,故实验中测定到其最佳发酵浓度为30.0 g/L.
2.4 NaCl浓度对甘蔗渣发酵赤藓醇的影响
渗透压对细胞生长及代谢影响较大,而对于赤藓醇生成来说,渗透压的选择显得尤为关键[12].一般情况下,赤藓醇是由耐高渗的菌株在较高的渗透压下生成,作为对抗高渗环境的一种反应.发酵培养基的碳源及NaCl是提供渗透压的主要来源,然而实验中所用碳源甘蔗渣不能溶于水,因此碳源本身不能提供渗透压.在此通过添加NaCl提高发酵培养基渗透压来调控赤藓醇产量.Yang等也认为较高的NaCl初始浓度在调节渗透压中比发酵碳源有更为重要的作用[7].因此实验中,把NaCl作为渗透压调节剂,并对其浓度进行优化.在赤藓醇发酵培养基中分别添加不同浓度的NaCl(浓度范围为0~100.0 g/L),发酵结果如图4所示.
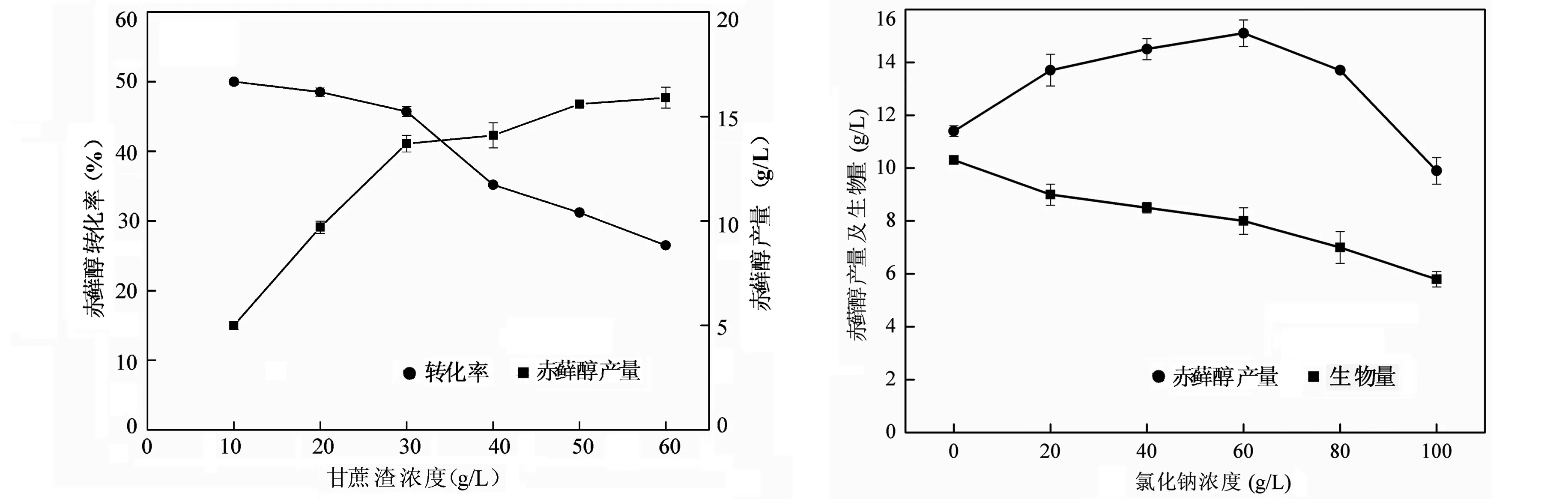
图3 甘蔗渣浓度对赤藓醇发酵的影响 图4 NaCl浓度对甘蔗渣发酵赤藓醇的影响
在图4中,最大赤藓醇产量发生在NaCl初始浓度为60 g/L时,为15.1 g/L.这表明在解脂耶氏酵母以甘蔗渣为原料发酵赤藓醇时,同样需要较高的渗透压促进赤藓醇的生成.然而,过高的渗透压对赤藓醇的生成也存在相反的作用,其原因在于过高的渗透压会抑制细胞生长,从而使得赤藓醇分泌下降.
2.5 不同氮源对解脂耶氏酵母赤藓醇发酵的影响
分别添加相同浓度的(NH4)2SO4,NH4Cl,NH4HCO3,(NH4)2S2O8,尿素及玉米浆于发酵培养基中作为氮源进行发酵培养,其发酵结果如图5所示.从图5数据中可以看出,当氮源为有机氮源(尿素和玉米浆时),发酵体系生物量较高,但赤藓醇产量较低;当氮源为(NH4)2S2O8时,发酵体系生物量较低,但赤藓醇的产量高于其他几种氮源,达到15.9 g/L.由此可见,氮源种类对解脂耶氏酵母产赤藓醇发酵过程的菌体生长及赤藓醇合成存在显著影响,有的氮源能够引起菌体的过量生长,但往往不利于赤藓醇的合成.因此在实验中,(NH4)2S2O8可以认定为甘蔗渣发酵赤藓醇的最佳氮源.
王凤伟等在以葡萄糖为底物发酵产赤藓醇时,所选用的最佳氮源为酵母膏与尿素的复合氮源,他们认为有机氮源更有利于赤藓醇的合成[11].这与实验结果有所不同.实验选择的测定氮源中,无机氮源的发酵效果显著优于有机氮源,推测其原因可能在于,实验所用的碳源甘蔗渣成分较为复杂,本身含有部分有机氮源,无机氮源的添加构成了无机有机混合氮源,更加有利于赤藓醇发酵.
2.6 氮源浓度对解脂耶氏酵母赤藓醇发酵的影响
为了确定甘蔗渣发酵赤藓醇的最佳氮源,分别向培养基中添加不同浓度(0,1.0,2.0,3.0和4.0g/L)的(NH4)2S2O8进行发酵培养,其结果如图6所示.从图6数据可以看出,当培养基中(NH4)2S2O8浓度为0时,赤藓醇产量较低(9.2 g/L).随着氮源浓度的逐渐增加,生物量随之提高,赤藓醇产量也在逐渐增加.当氮源浓度为3.0 g/L时,赤藓醇产量达到最大,为16.6 g/L,而此时生物量并非最高.当氮源浓度进一步增加时,赤藓醇产量开始降低.这些结果表明,氮源的添加是赤藓醇的合成的必需条件,然而其添加量对赤藓醇产量有着显著影响.过高的氮源导致细胞的大量生长,使过多的碳源被细胞呼吸所消耗,转化为赤藓醇的碳源减少,从而使得赤藓醇产量下降.因此,在实验中,解脂耶氏酵母发酵甘蔗渣产赤藓醇(NH4)2S2O8的最佳浓度约为3.0 g/L.
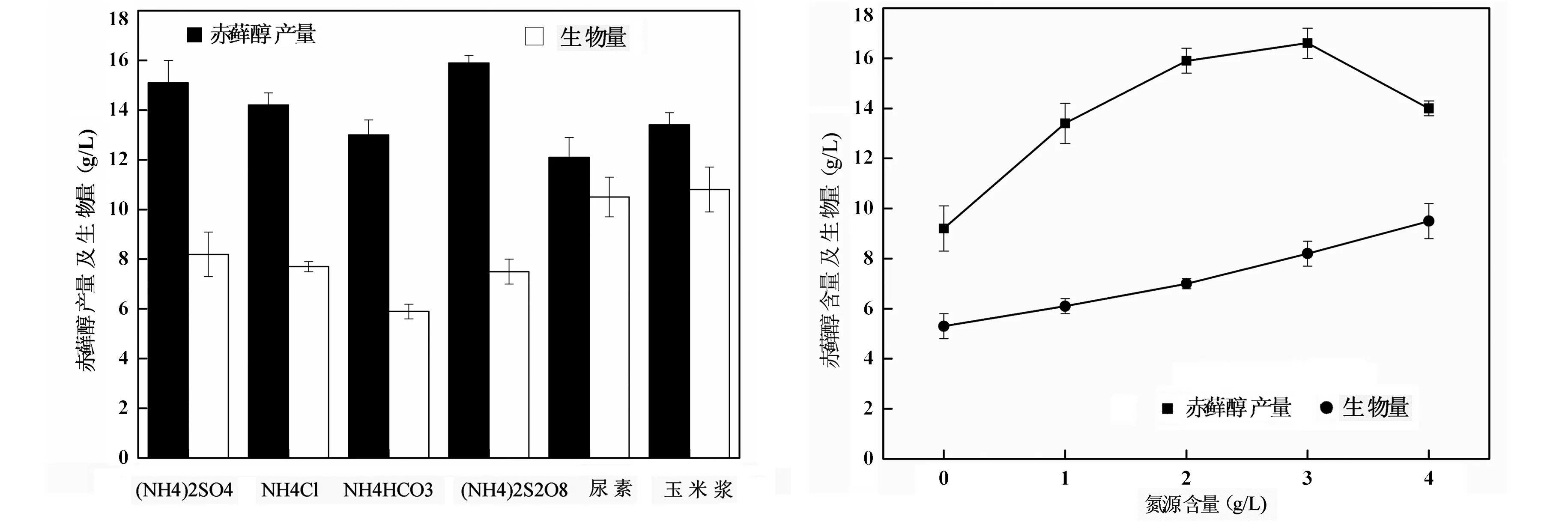
图5 不同氮源对甘蔗渣发酵赤藓醇的影响 图6 氮源浓度对赤藓醇产量的影响
2.7 添加Cu2+和Mn2+对赤藓醇发酵的影响
研究表明,很多矿物质例如Cu2+,Fe3+,Mn2+及Zn2+等会通过影响细胞内的酶活性来影响赤藓醇产量.在众多矿物元素中,Cu2+和Mn2+被认为对赤藓醇合成存在最为显著的影响[13].为了研究这两种金属离子对甘蔗渣发酵合成赤藓醇的影响,在实验中,通过添加不同浓度的Cu2+和Mn2+,探究发酵过程中赤藓醇浓度的变化.分别将0~8 mg/L的Cu2+及0~20 mg/L的Mn2+添加至发酵培养基,测定不同培养基中赤藓醇产量变化,结果如图7所示.在图7a中,发现细胞生长及赤藓醇产量受Cu2+添加量的显著影响,随着Cu2+含量的增加,生物量逐渐降低.而当Cu2+含量为4 mg/L,赤藓醇产量最高(17.9 g/L);Mn2+同样对细胞生长及赤藓醇合成存在类似影响.从图7b中可以看出,随着Mn2+添加量的提高,生物量下降,而赤藓醇产量提高.当Mn2+为10 mg/L时,赤藓醇产量达到最高(18.6 g/L).而当Mn2+浓度高于10 mg/L时,赤藓醇产量迅速下降.

图7 Cu2+(a)和Mn2+(b)对甘蔗渣发酵赤藓醇的影响
在Lee等的报道中[13],在培养基中添加Mn2+和Cu2+Torula sp.发酵赤藓醇产量提高,进一步研究发现,赤藓醇产量提高的原因在于,Cu2+的添加会导致赤藓醇合成的关键酶赤藓糖还原酶活力的提高,因为Cu2+会降低赤藓糖还原酶的抑制剂延胡索酸的生成[14].Mn2+与Cu2+对赤藓醇的促进作用则表现在不同的方面.Mn2+能够改变细胞渗透性,使得生成的赤藓醇更快地运出细胞,从而减少产物的反馈抑制,促进赤藓醇生成[15].然而,过多的Mn2+会破坏胞内平衡,使得赤藓醇产量下降.因此,当培养基中添加10 mg/L的Mn2+同时添加4 mg/L的Cu2+,会使得赤藓醇产量大幅度提高,结果与Lee等的报道是一致的[13-14].
2.8 解脂耶氏酵母以甘蔗渣为原料的赤藓醇发酵曲线
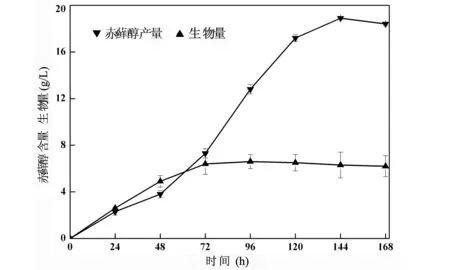
图8 甘蔗渣产赤藓醇的发酵曲线
为了更好地把握解脂耶氏酵母利用甘蔗渣发酵赤藓醇的情况,对该发酵过程进行了全程跟踪测试.以条件优化后培养基进行发酵培养,每隔24 h取样测定,发酵结果如图8所示.从图8中可以看出,在发酵开始的前48个 h内,发酵液中的赤藓醇产量几乎没什么变化,可能的原因是前48 h是解脂耶氏酵母接入发酵培养基的适应期.从发酵72 h起,随着发酵天数的增长,赤藓醇的产量逐渐增加,并在发酵144 h达到最大值,进一步发酵赤藓醇已无明显增长.由此可知,在解脂耶氏酵母以甘蔗渣为唯一碳源的发酵赤藓醇的周期大约为144 h,赤藓醇最高产量达到了18.9 g/L.这些结果表明,以甘蔗渣作为碳源进行赤藓醇发酵具有极高的可行性,可将其用于赤藓醇的工业生产,为赤藓醇生产提供了一条经济可行的新工艺.
3 结束语
为了研究解脂耶氏酵母以甘蔗渣为唯一碳源进行发酵产赤藓醇的可行性,进行了本次实验.以甘蔗渣为唯一碳源进行发酵产赤藓醇的研究,初步探索了适合甘蔗渣发酵赤藓醇的最佳培养基.结果证明,以甘蔗渣为唯一碳源发酵产赤藓醇是可行的,赤藓醇产率可达到63%.为实现甘蔗渣的再利用,降低赤藓醇发酵成本提供了可靠的技术支撑.
[1] Roper H, Goossens J. Erythritol a new material for food and non-food application[J]. Starch/Stärke,1993, 45: 400-405.
[2] 郭传琦, 葛兆强, 李兆河, 等. 赤藓糖醇在日化领域中的应用研究[J]. 精细与专用化学品, 2014(2): 25-28.
[3] 薛雅莺, 贾慧慧, 杨海军. 赤藓糖醇在非食品领域的应用与研究现状[J]. 精细与专用化学品, 2012(7): 9-11.
[4] Park J B, Seo B C, Kim J R, et al. Production of erythritol in fed-batch cultures of Trichosporon sp[J]. J Ferment Bioeng, 1998, 86: 577-580.
[5] Ishizuka H, Wako H, Kasumi T, et al. Breeding of a mutant of Aureobasidium sp. with high erythritol production[J]. J Ferment Bioeng, 1989, 68: 310-314.
[6] Tomaszewska L, Rywinska A, Rymowicz W. High selectivity of erythritol production from glycerol by Yarrowia lipolytica[J]. Biomass Bioener, 2014, 64: 309-320.
[7] Yang L B, Zhan X B, Zheng Z Y, et al. A novel osmotic pressure control fed-batch fermentation strategy for improvement of erythritol production by Yarrowia lipolytica from glycerol[J]. Bioresource Technol, 2014, 151: 120-127.
[8] Rywinska A, Bak M, Rakicka M, et al. Selection of the UV mutants of Yarrowia lipolytica yeast for erythritol biosynthesis from glycerol[J]. Acta Sci Pol Biotechnol, 2012, 11: 23-28.
[9] Moeller L, Zehnsdorf A, Aurich A, et al. Substrate utilization by recombinant Yarrowia lipolytica growing on sucrose[J]. Appl Microbiol Biotechnol, 2012, 93: 1695-1702.
[10] 王允圃,李积华,刘玉环,等.甘蔗渣综合利用技术的最新进展[J]. 中国农学通报, 2010, 26(16): 370-375.
[11] 王凤伟. 耐高渗赤藓糖醇生产菌的筛选与发酵条件优化[D]. 无锡:江南大学硕士研究生论文, 2012.
[12] Tomaszewska L, Rakicka M, Rymowicz W, et al. A comparative study on glycerol metabolism to erythritol and citric acid in Yarrowia lipolytica yeast cells[J]. FEMS Yeast Res, 2014,14: 966-976.
[13] Lee J K, Ha S J, Kim SY, et al. Increased erythritol production in Torula sp. by Mn2+and Cu2+[J]. Biotechnol Lett, 2000, 22: 983-986.
[14] Lee J K, Koo B S, Kim S Y. Fumarate-Mediated inhibition of erythrose reductase, a key enzyme for erythritol production by Torula coralline[J]. Appl Environ Microb, 2002, 68: 4534-4538.
[15] Mironczuk A M, Dobrowolski A, Rakicka M, et al. Newly isolated mutant of Yarrowia lipolytica MK1 as a proper host for efficient erythritol biosynthesis from glycerol[J]. Process Biochem, 2015,50: 61-68.

