灵芝酸A对人炎性乳腺癌细胞体外增殖和凋亡的影响
林晓萌,丁琪琼,陈鹊汀,张 磊,郝 鑫,,李 中
(1.河北大学附属医院乳腺外科,河北 保定071000;2. 北京协和医院临床与药理中心,北京100032;3.河北大学附属医院肿瘤内科 河北省肿瘤放化疗机制与规程研究重点实验室,河北 保定071000)
炎性乳腺癌是一种恶性程度极高的局部晚期特殊类型的恶性肿瘤之一,约占所有乳腺癌的6%,发病率逐年上升。由于病因不清及病情迅猛,临床治疗方式主要采用手术切除辅助化疗,但术后及预后效果仍较差,患者的平均生存期低于2.5年[1]。化疗药物不良反应较重,而且容易产生耐药性,从而降低药效,降低患者的生存期,甚至导致治疗失败。因此,寻找有效抑制炎性乳腺癌细胞增殖、生长的药物成为治疗的关键。灵芝酸A是从灵芝孢子粉中提取的主要成分,属于灵芝三萜类化合物中的一种[2-3]。近年来研究[4-6]显示:灵芝酸A具有抗肿瘤细胞增殖、抑制肿瘤细胞侵袭能力以及诱导人乳腺癌、肝癌、肺癌细胞凋亡的作用。体内外研究[7-8]表明:灵芝酸A可控制淋巴瘤生长,增强HepG2细胞对顺铂的化学敏感性,抑制癌细胞的生长和侵袭。迄今为止,国内外关于灵芝酸A对人炎性乳腺癌SUM149细胞的体外抑瘤作用鲜有报道。本文作者采用MTT法和流式细胞术等方法,研究灵芝酸A对体外人炎性乳腺癌SUM149细胞增殖和凋亡的影响,并探讨其可能的作用机制。
1 材料与方法
1.1 细胞和主要试剂人炎性乳腺癌SUM149细胞由北京大学医学部病理教研室提供。灵芝酸A购于大连美仑生物技术有限公司。胰蛋白酶购自北京鼎国生物技术有限公司,胎牛血清购自杭州四季青生物工程材料有限公司,DMED培养基和二甲亚砜购自美国Sigma 公司,2,5-二苯基四氮唑溴盐(MTT)购自北京百奥生物公司
1.2 细胞培养人炎性乳腺癌SUM149细胞37℃水浴复苏,置于含10%胎牛血清、100 U·mL-1链霉素和100 U·mL-1青霉素的DMEM F12培养液中,于37℃、5%CO2的饱和湿度恒温培养箱中培养,定期观察细胞形态,细胞融合度达80%~90%时,加入0.25%胰蛋白酶对贴壁的SUM149细胞进行消化,取对数生长期细胞用于实验。
1.3 MTT法检测细胞增殖抑制率取对数生长期SUM149细胞消化后制成单细胞悬液,稀释成1×104mL-1,每孔200 μL加入96孔板中。当细胞贴壁生长24 h后,加入含不同浓度灵芝酸A [0(对照组)、0.1、0.5、1.0、5.0和10.0 μmol·L-1]的培养基(每样设 4 个复孔),置于恒温培养箱中培养24、48和72 h后,再加入MTT溶液,20 μL/孔,37℃再培养4 h。弃去培养上清液,每孔再加入150 μL二甲基亚砜,振荡10 min,溶解混匀。利用酶联免疫检测仪,于490 nm波长处测定吸光度(A)值,取平均值,计算细胞增殖抑制率。细胞增殖抑制率=(对照组A值-实验组A值)/ 对照组A值×100%。
1.4 流式细胞术检测细胞凋亡率和细胞周期百分率取对数生长期SUM149细胞制成单细胞悬液,稀释成1×105mL-1接种于培养瓶内,置于培养箱中培养,生长24 h后加入含不同浓度灵芝酸A[0(对照组)、0.1、0.5、1.0、5.0和10.0 μmol·L-1]的培养基,培养24、48和72 h后,加入0.25%胰蛋白酶消化,1 500 r·min-1离心5 min,弃上清液,用PBS冲洗2次,加入1 mL预冷70%乙醇中,-20℃保存固定24 h。PBS冲洗2次,1 000 r·min-1离心5 min,弃上清液,加入的PBS重悬细胞。样品上机染色,分别加入0.5 mL碘化丙啶染色液,细胞充分重悬,避光4℃染色30 min。利用流式细胞仪,于波长488 nm处测定红色荧光。利用以下公式计算分析各组细胞凋亡率。利用ModFit分析软件分析细胞DNA含量,检测对照组和5、10.0 μmol·L-1灵芝酸A组不同周期细胞百分率。细胞凋亡率=凋亡细胞数/(凋亡细胞数+正常细胞数)×100%。
1.5 免疫细胞化学染色法检测各组细胞中Ki67和Livin蛋白表达水平取对数生长期SUM149细胞消化后制成单细胞悬液,稀释成1×105mL-1,取6孔板,每孔加入1.8 mL细胞悬液,置于恒温培养箱中培养12 h,加入含不同浓度的灵芝酸A [0(对照组)、0.1、0.5、1.0、5.0和10.0 μmol·L-1]的培养基,置于恒温培养箱中培养24、48和72 h后,弃去上层培养基,PBS冲洗,加入4%多聚甲醛固定30 min,PBS冲洗,加入1 mL 0.1%Trionx-100室温反应30 min,PBS冲洗,加入3%过氧化氢孵育10 min,PBS冲洗,加入一抗(1∶50兔抗 Livin 单克隆抗体,1∶100兔抗 Ki67 单克隆抗体),4℃孵育12 h,加入二抗生物素化羊抗,37℃孵育 1 h,DAB 显色,苏木精溶液中复染1 min,酒精脱水,二甲苯Ⅰ和二甲苯Ⅱ中透明,封片,显微镜下观察,利用Image Pro Plus 6.0 软件分析 Ki67和Livin蛋白阳性表达的累积吸光度(A)值,代表蛋白表达水平。

2 结 果
2.1 各组SUM149细胞增殖抑制率随着灵芝酸A浓度的增加和作用时间的延长,SUM149细胞增殖抑制率呈明显上升趋势。作用24、48和72 h时,与0.1 μmol·L-1灵芝酸A组比较,0.5、1.0、5.0和10.0 μmol·L-1灵芝酸A组SUM149细胞增殖抑制率明显升高,差异有统计学意义(P<0.05或P<0.01)。相同灵芝酸A浓度,随着干预时间(24、48和72 h)的延长,SUM149细胞的增殖抑制率逐渐升高,72 h与24 h时组间比较差异有统计学意义(P<0.05)。见表1。
2.2 各组SUM149细胞凋亡率相同作用时间,与对照组比较,不同浓度灵芝酸A组细胞凋亡率明显升高(P<0.05或P<0.01)。相同灵芝酸A浓度,不同作用时间(24、48和72 h)组间比较差异有统计学意义(P<0.05)。随着灵芝酸A作用浓度的升高和作用时间的延长,SUM149细胞凋亡率逐渐升高,呈浓度和时间依赖性。见表2。
表1 各组SUM149细胞增殖抑制率
Tab.1 Inhibitory rates of proliferation of SUM149 cells in various groups

表1 各组SUM149细胞增殖抑制率
GroupInhibitoryrate(t/h) 244872Control000GanodermalucidumA(μmol·L-1) 0.112.09±2.1129.57±5.5835.58±6.28△ 0.521.33±5.27∗35.49±8.51∗41.28±7.73∗△ 1.030.67±6.18∗45.25±9.04∗49.19±9.94∗△ 5.039.78±7.11∗49.77±8.76∗55.10±11.90∗△ 10.050.48±9.64∗∗58.03±10.29∗∗61.54±13.02∗∗△
*P<0.05,**P<0.01 compared with 0.1 μmol·L-1ganoderma lucidum A group;△P<0.05 compared with 24 h.
表2 各组SUM149细胞凋亡率
Tab.2 Apoptotic rates of SUM149 cells in various groups

表2 各组SUM149细胞凋亡率
GroupInhibitoryrate(t/h) 244872Control0.71±0.170.84±0.191.16±0.15GanodermalucidumA(μmol·L-1) 0.11.15±0.262.12±0.33∗7.95±1.10∗△ 0.51.81±0.523.17±0.48∗∗12.74±2.81∗∗△ 1.02.20±0.66∗5.23±0.52∗∗19.47±3.30∗∗△ 5.02.71±0.84∗9.40±1.38∗∗22.47±5.71∗∗△ 10.04.92±0.89∗∗11.66±2.21∗∗28.17±5.89∗∗△
*P<0.05 ,**P<0.01 compared with control group;△P<0.05 compared with 24 h.
2.3 各组SUM149细胞不同周期细胞百分率与对照组比较,不同浓度灵芝酸A组SUM149细胞中G1期细胞百分率明显增加(P<0.05),且随着灵芝酸A 作用时间的延长G1期细胞百分率也明显增加。与对照组比较,不同浓度灵芝酸A组SUM149细胞中S期细胞百分率明显减少(P<0.05或P<0.01),且随着灵芝酸A作用时间的延长S期细胞百分率也明显减少。与对照组比较,不同浓度灵芝酸A组SUM149细胞中G2期细胞百分率差异无统计学意义(P>0.05)。见表3。
表3 各组SUM149细胞不同周期细胞百分率
Tab.3 Percentages of SUM149 cells at different phases in various groups
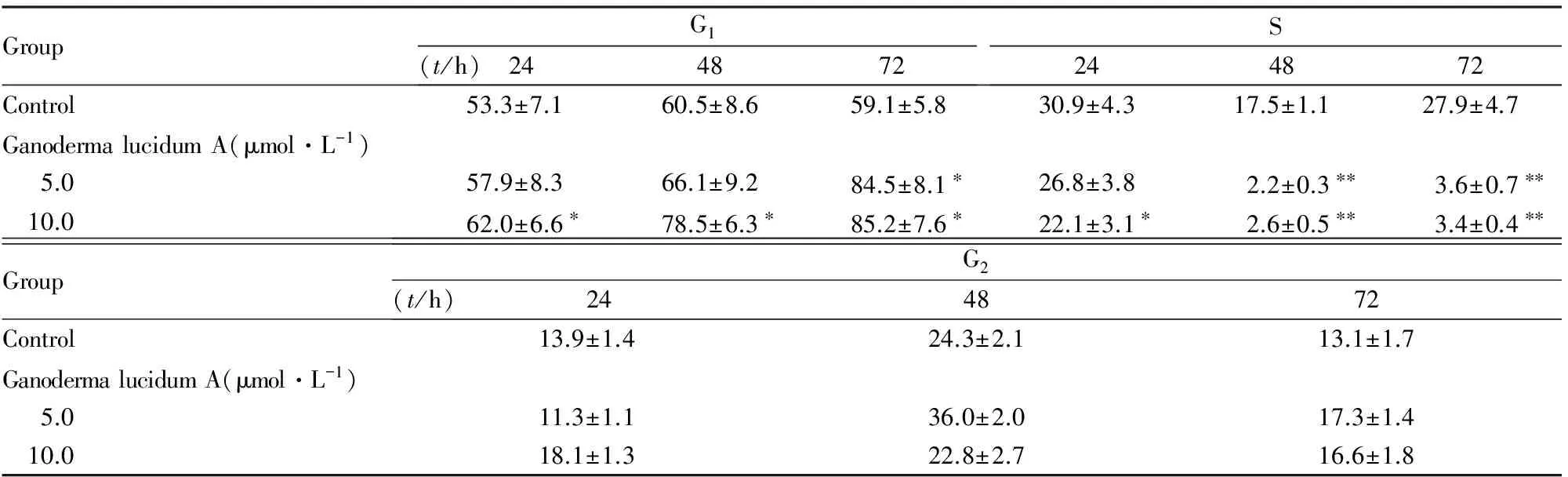
表3 各组SUM149细胞不同周期细胞百分率
GroupG1(t/h) 244872S244872Control53.3±7.160.5±8.659.1±5.830.9±4.317.5±1.127.9±4.7GanodermalucidumA(μmol·L-1) 5.057.9±8.366.1±9.284.5±8.1∗26.8±3.82.2±0.3∗∗3.6±0.7∗∗ 10.062.0±6.6∗78.5±6.3∗85.2±7.6∗22.1±3.1∗2.6±0.5∗∗3.4±0.4∗∗GroupG2(t/h) 244872Control13.9±1.424.3±2.113.1±1.7GanodermalucidumA(μmol·L-1) 5.011.3±1.136.0±2.017.3±1.4 10.018.1±1.322.8±2.716.6±1.8
*P<0.05 ,**P<0.01 compared with control group.
2.4 各组SUM149细胞中Ki67和Livin蛋白表达水平Ki67蛋白阳性表达位于细胞核,Livin蛋白阳性表达位于细胞浆。相同灵芝酸A浓度,随着作用时间的延长,Ki67和Livin蛋白表达水平明显降低;相同作用时间,随着灵芝酸A浓度的增加,Ki67和Livin蛋白表达水平也明显降低。与对照组比较,作用24、48和72 h,0.5、1.0、5.0和10.0 μmol·L-1灵芝酸A组SUM149细胞Ki67蛋白表达水平明显降低(P<0.05或P<0.01),5.0和10.0 μmol·L-1灵芝酸A组24 h及1.0、5.0和10.0 μmol·L-1灵芝酸A组48和72 h Livin蛋白表达水平明显降低(P<0.05或P<0.01)。见表4。
表4 各组SUM149细胞中Ki67和Livin蛋白表达水平
Tab.4 Expression levels of Ki67 and Livin proteins in SUM149 cells in various groups
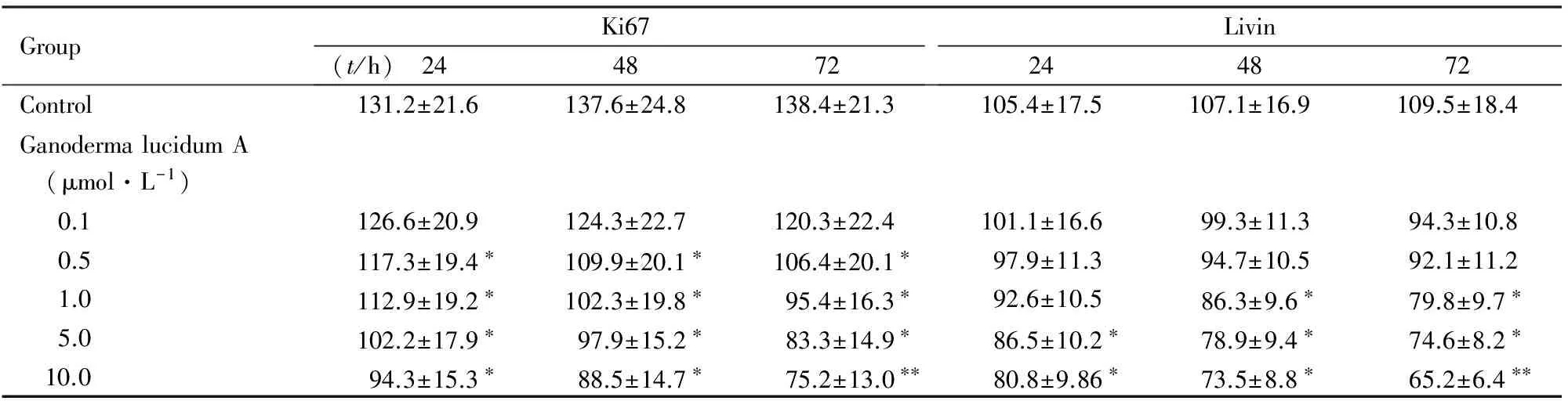
表4 各组SUM149细胞中Ki67和Livin蛋白表达水平
GroupKi67(t/h) 244872Livin244872Control131.2±21.6137.6±24.8138.4±21.3105.4±17.5107.1±16.9109.5±18.4GanodermalucidumA (μmol·L-1) 0.1126.6±20.9124.3±22.7120.3±22.4101.1±16.699.3±11.394.3±10.8 0.5117.3±19.4∗109.9±20.1∗106.4±20.1∗97.9±11.394.7±10.592.1±11.2 1.0112.9±19.2∗102.3±19.8∗95.4±16.3∗92.6±10.586.3±9.6∗79.8±9.7∗ 5.0102.2±17.9∗97.9±15.2∗83.3±14.9∗86.5±10.2∗78.9±9.4∗74.6±8.2∗ 10.094.3±15.3∗88.5±14.7∗75.2±13.0∗∗80.8±9.86∗73.5±8.8∗65.2±6.4∗∗
*P<0.05 ,**P<0.01 compared with control group.
3 讨 论
选择安全性高、疗效好和不良反应少的治疗药物,在炎性乳腺癌治疗中具有极其重要的意义,因此也成为目前临床研究者治疗乳腺癌有待攻克的难题。灵芝具有提高机体免疫力、抗肿瘤等多种药用价值,尤其在抗肿瘤方面的确切机制已引起了医学研究者的广泛兴趣。研究[9-10]证实:灵芝酸可以激活破坏肿瘤细胞核形成的蛋白酶。作为一种天然的化合物,灵芝酸A已被证实具有抗肿瘤生物活性,对癌细胞具有细胞抑制作用[11]。然而,灵芝酸A抗肿瘤作用机制复杂,目前尚不明确,因此探讨灵芝酸A对炎性乳腺癌的作用机制,可为炎性乳腺癌的治疗提供新方向,也为临床上个体化治疗提供新方案,具有极其重要的理论和临床应用价值。
肿瘤的发生是多因素、多基因相互作用的结果,细胞增殖-凋亡的平衡失调是影响其发生发展的重要因素。研究[12-13]表明:凋亡抑制因子的过度表达与肿瘤的发生发展有密切关联。
Livin属于凋亡抑制蛋白家族,在多数肿瘤组织中特异性高表达。近年研究[14-15]表明:Livin主要是抑制肿瘤细胞的凋亡,在正常细胞中不表达,而在乳腺癌组织中高表达,且与临床分期及淋巴转移有关。本研究结果显示:Livin在人炎性乳腺癌SUM149细胞质中高表达,表达率随着灵芝酸A作用浓度增加和作用时间延长而下降,提示灵芝酸A可抑制人炎性乳腺癌SUM149细胞中Livin的表达,推测灵芝酸A下调人炎性乳腺癌SUM149细胞株中Livin的表达是灵芝酸A诱导其凋亡的机制之一。
Ki67是分布于细胞核内的一种非组蛋白性核蛋白,与细胞增殖有密切关联,表达于G1、S和G2期细胞,被认为是反映肿瘤细胞增殖活性最可靠指标之一[16]。同样,Ki67在正常细胞中不表达,而在乳腺癌组织中呈特异性高表达,可以反映乳腺癌的生物学行为[17]。本实验通过细胞免疫组织化学检测表明:Ki67在人炎性乳腺癌SUM149细胞质中高表达,灵芝酸A可以抑制人炎性乳腺癌SUM149细胞中Ki67的表达,推测灵芝酸A可能是通过下调人炎性乳腺癌SUM149细胞株中Ki67的表达,抑制其增殖。
本研究结果显示:灵芝酸A能抑制人炎性乳腺癌SUM149细胞的增殖,诱导其发生凋亡,同时还可下调SUM149细胞中Livin和Ki67的表达,表明灵芝酸A下调Livin和Ki67的表达可能是其抑制人炎性乳腺癌SUM149细胞增殖并促进其凋亡的机制之一。
[1] Al-Khanbashi M,Caramuta S,Alajmi AM,et al. Tissue and serum miRNA profile in Locally Advanced Breast cancer (LABC) in response to Neo-Adjuvant Chemotherapy (NAC) treatment [J].PLoS One,2016,11(4):e0152032.
[2] Meng Y,Lin ZM,Ge N,et al.Ursolic acid induces apoptosis of prostate cancer cells via the PI3K/Akt/mTOR pathway[J].Am J Chin Med,2015,43(7):1471-1486.
[3] Sakamoto S,Kohno T,Shimizu K,et al.Detection of ganoderic gcid a in ganodema lingzhi by an indirect competitive enzyme-linked immunosorbent assay [J].Planta Med,2016,82 (8):747-751.
[4] 石 玮,董 莉,包军胜.前列腺癌相关分子研究进展[J].中华男科学杂志,2015,21(4):357-362.
[5] Gill BS,Kumar S,Navgeet.evaluating anti-oxidant potential of ganoderic acid a in STAT 3 pathway in prostate cancer [J].Mol Biol Rep,2016,43(12):1411-1422.
[6] Pintha K,Yodkeeree S,Limtrakul P.Proanthocyanidin in red rice inhibits MDA-MB-231 breast cancer cell invasion via the expression control of invasive proteins [J].Biol Pharm Bull,2015,38(4):571-581.
[7] Radwan FF,Hossain A,God JM,et al.Reduction of myeloid-derived suppressor cells and lymphoma growth by a natural triterpenoid [J].J Cell Biochem,2015,116(1):102-114.
[8] Wu M,Wu Y,Lan T,et al.Type Ⅱ cGMP-dependent protein kinase inhibits EGF-induced JAK/ STAT signaling in gastric cancer cells [J].Mol Med Rep,2016,14(2):1849-1856.
[9] 刘 乔.灵芝酸组分提取分离及其体内抗氧化、免疫活性活性作用研究 [D].长春:吉林农业大学,2016.
[10]唐 文.灵芝酸T提高多药耐药性肿瘤细胞对阿霉素敏感性的初步研究 [J].天然产物研究与开发,2013,25(8):1052-1055.
[11]周昌艳,唐庆九,杨 焱,等.灵芝中有效成分灵芝酸的抑制肿瘤作用研究 [J].菌物学报,2004,23(2):275-279.
[12]Wang Z,Liu S,Ding K,et al.Silencing livin induces apoptotic and autophagic cell death,increasing chemotherapeutic sensitivity to cisplatin of renal carcinoma cells [J].Tumour Biol,2016,37(11):15133-15143.
[13]Liu AH,He AB,Tong WX,et al.Prognostic significance of livin expression in nasopharyngeal carcinoma after radiotherapy [J].Cancer Radiother,2016,20(5):384-390.
[14]Broodman I,VanDuijn MM,Stingl C,et al.Survivin autoantibodies are not elevated in lung cancer when assayed controlling for specificity and smoking status [J].Cancer Immunol Res,2016,4(2):165-172.
[15]陈建华,范钦和,陈 淼.Livin在乳腺癌中的表达及与c-erbB-2和激素受体的关系 [J].诊断病理学杂志,2008,15(4):320-323.
[16]Huang MH,Poh KK,Tan HC,et al.Therapeutic synergy and complementarity for ischemia/reperfusion injury:β1-adrenergic blockade and phosphodiesterase-3 inhibition [J].Int J Cardiol,2016,214:374-380.
[17]Zhong F,Bi R,Yu B,et al.A comparison of visual assessment and automated digital image analysis of Ki67 labeling index in breast cancer [J].PLoS One,2016,11(2):e0150505.

