正交设计法优化提取田菁叶片蛋白工艺研究
周梦婷,陈子云,杜照奎,3,*,周斌,余敏
(1.台州学院生命科学学院,浙江台州318000;2.浙江省镇海中学,浙江宁波315200;3.浙江省植物进化生态学与保护重点实验室,浙江台州318000;4.浙江百花园林集团有限公司,浙江台州318050)
田菁Sesbania cannabina(Retz.)Poir为豆科田菁属一年生草本植物,又名碱菁、涝豆,喜温暖的气候,常见于我国南方省市[1]。田菁有较强的抗旱能力[2],同时也耐盐[3-4]、耐碱[5]、耐涝[6-7]、耐瘠薄[8-9]、耐重金属[10],适应性广。长期以来,田菁一直作为改良盐碱土和培肥土壤的先锋绿肥作物[11]。
田菁生长迅速、生物量大,蛋白质含量十分丰富,可作牧草配合饲料饲养动物[12]。此外,一般的豆类蛋白质和谷类蛋白质相比较,更易消化吸收,更加健康符合人类需求[13],且含多种维生素及矿物质[14],也可作为人类饮食的蛋白质补充,可改善膳食结构。目前,对于田菁蛋白质分离提取的研究鲜有报道,因而其蕴含的丰富蛋白质并未得到充分利用。本研究以田菁叶片为原料,采用单因素试验和正交试验研究其蛋白质提取的最佳工艺条件,旨在提高田菁的资源利用率,为进一步开发利用田菁资源提供科学依据。
1 材料与方法
1.1 田菁叶片粉末的制备
田菁叶片采自台州学院椒江校区校园内,80℃干燥8 h后用粉碎机粉碎成粉末,所得粉末用广口瓶收集,密封置于阴凉处备用。
1.2 标准曲线的测定
称取10 mg的牛血清白蛋白固体(BSA)加蒸馏水定容至100 mL,此溶液即为试验所用的0.1 mg/mL标准溶液。在6支试管中加入0.1 mg/mL的标准溶液各0、0.2、0.4、0.6、0.8、1 mL,再依次加入蒸馏水 1、0.8、0.6、0.4、0.2、0 mL。再分别加入3 mL考马斯亮蓝G-250试剂并盖塞混匀。放置2 min后,在595 nm下比色,绘制标准曲线[15]。以蛋白质浓度(x)对吸光度(y)作出相应的标准曲线,得到线性回归方程:y=8.533 1x-0.008 0(R2=0.991 4),结果表明总蛋白浓度在0.01 mg/mL~0.1 mg/mL范围内与吸光度有良好的线性关系。
1.3 单因素试验对田菁叶片蛋白提取条件的优化
1.3.1 提取时间对田菁叶片蛋白质提取率的影响
准确称取1 g田菁叶片粉末,置于洁净烧杯中,按1:30(g/mL)的料液比加水(pH 值为 6),再加入 NaCl粉末,使其浓度为4%,于50℃水浴锅中分别提取30、60、90、120、150、180 min。提取液于 6 000 r/min 转速下离心10 min,取上清液1mL置具塞玻璃试管中,加入考马斯亮蓝试剂3 mL,并盖上塞子,混匀,于波长595 nm处测定吸光度,根据标准曲线计算1 mL提取液和总体积提取液中蛋白质含量。
1.3.2 pH值对田菁叶片蛋白质提取率的影响
准确称取1 g田菁叶片粉末,置于洁净烧杯中,按料液比 1 ∶30(g/mL)分别加水,pH 值分别为 2、4、6、8、10、12,再加入NaCl粉末,使其浓度为4%,于50℃水浴锅中提取90 min。提取液于6 000 r/min转速下离心10 min,取上清液1 mL置具塞玻璃试管中,其余操作同上。
1.3.3 料液比对田菁叶片蛋白质提取率的影响
准确称取1 g田菁叶片粉末,置于洁净烧杯中,分别按料液比 1 ∶10、1 ∶20、1 ∶30、1 ∶40、1 ∶50(g/mL)比例加水(pH值为6),再加入NaCl粉末,使其浓度为4%,于50℃水浴锅中提取90 min。提取液于6000r/min转速下离心10 min,取上清液1 mL置具塞玻璃试管中,其余操作同上。
1.3.4 提取温度对田菁叶片蛋白质提取率的影响
准确称取1 g田菁叶片粉末,置于洁净烧杯中,按1∶30(g/mL)的料液比加水(pH 值为 6),再加入 NaCl粉末,使其浓度为 4%,分别于 30、40、50、60、70、80 ℃水浴锅中提取90 min。提取液于6 000 r/min转速下离心10 min,取上清液1 mL置具塞玻璃试管中,其余操作同上。
1.3.5 盐浓度对田菁叶片蛋白质提取率的影响
准确称取1g田菁叶片粉末,置于洁净烧杯中,按料液比 1∶30(g/mL)比例加水(pH 值为 6),再加入 NaCl粉末,使其浓度分别为1%、2%、3%、4%、5%、6%,于50℃水浴锅中提取90 min。提取液于6 000 r/min转速下离心10 min,取上清液1 mL置具塞玻璃试管中,其余操作同上。
1.3.6 正交设计法优化田菁叶片蛋白的提取条件
在提取时间、pH值、液料比、温度和盐浓度5个单因素试验的基础上,采用五因素四水平进行L16(45)正交试验,每个试验重复6次,以确定田菁总蛋白提取的最佳方案,因素水平如表1所示。
1.3.7 数据处理
运用SPSS 13.0对蛋白提取量进行数据分析,并采用Duncan新复极差检验法对提取量进行多重比较(P<0.05)。
2 结果与分析
2.1 单因素试验结果分析
2.1.1 提取时间对田菁叶片蛋白质含量的影响
提取时间对田菁叶片蛋白质含量的影响见图1所示。
由图1可知,蛋白质含量随着提取时间的增加先增加后降低,当提取时间为90 min时,蛋白质含量达到最高,蛋白质含量为28.98 mg/g,之后含量缓慢下降。可能的原因是提取时间过短,蛋白质还没有完全从原料中溶解出来;时间过长,高温和强碱作用会使蛋白质氢键断裂,空间结构遭到破坏,疏水基团暴露、溶解度降低[16]。综合产量和能耗两方面原因考虑,初步确定提取时间90 min~180 min。
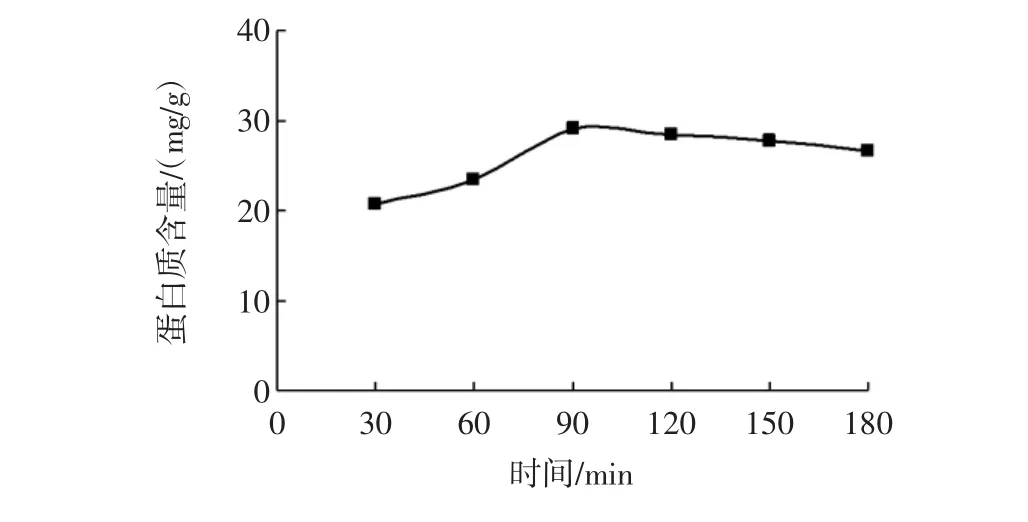
图1 提取时间对田菁叶片蛋白质含量的影响Fig.1 Effects of extraction time on extraction yield of Sesbania leaf proteins
2.1.2 pH值对田菁叶片蛋白质含量的影响
pH值对田菁叶片蛋白质含量的影响见图2所示。
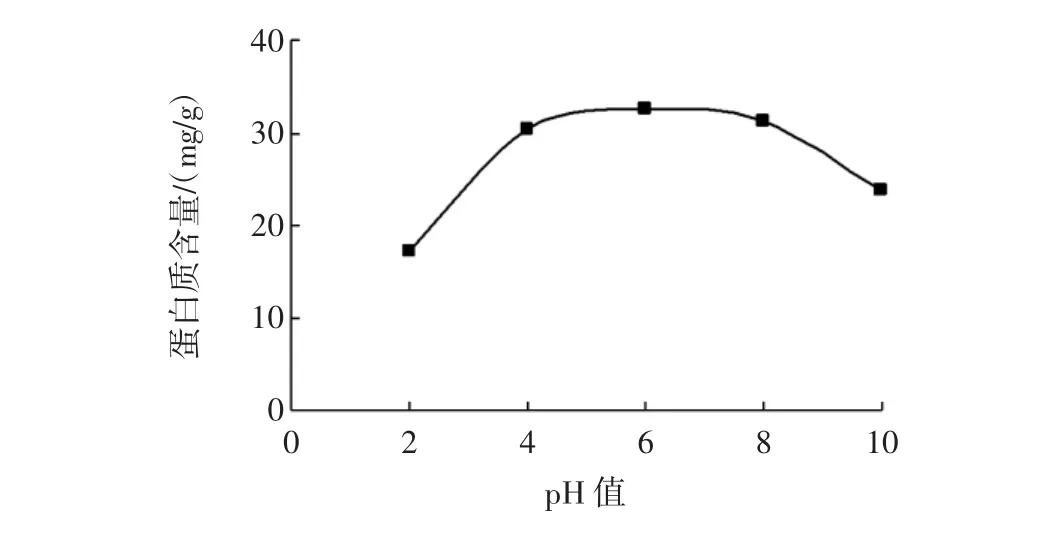
图2 pH值对田菁叶片蛋白质含量的影响Fig.2 Effects of pH on extraction yield of Sesbania leaf proteins
由图2可知,蛋白质含量随着pH值的增加先显著增加,到pH=6时,含量最大,值为32.51 mg/g;随后,蛋白质含量随pH值的升高而显著降低。这是因为蛋白质为两性电解质,在某一pH值的溶液中它所带的正电荷数与负电荷数恰好相等,即净电荷数为零(此时pH值称为等电点),等电点时蛋白质间静电斥力最低,蛋白质溶解度最低,容易聚集、沉淀,从溶液中析出[17];而较强的酸或碱会使蛋白质脱氨、脱羧或水解,使得含量降低[18]。据此,初步确定提取pH值范围为4~10。
2.1.3 料液比对田菁叶片蛋白含量的影响
料液比对田菁叶片蛋白含量的影响见图3所示。
由图3可知,当料液比较大时,蛋白质含量随料液比增大而显著增加,料液比达到1∶30(g/mL)时,产量达到峰值,蛋白质含量为35.12 mg/g,之后又显著下降。可能因为当溶剂量太小时,田菁叶片蛋白不能完全充分溶解,溶液中的蛋白质少,所以含量过小,但是加溶剂量过大,则又会破坏提取效果[19],而且使试验设备体积增大,大大降低了生产效率。因此,初步确定提取的料液比为 1∶20(g/mL)~1∶50(g/mL)。
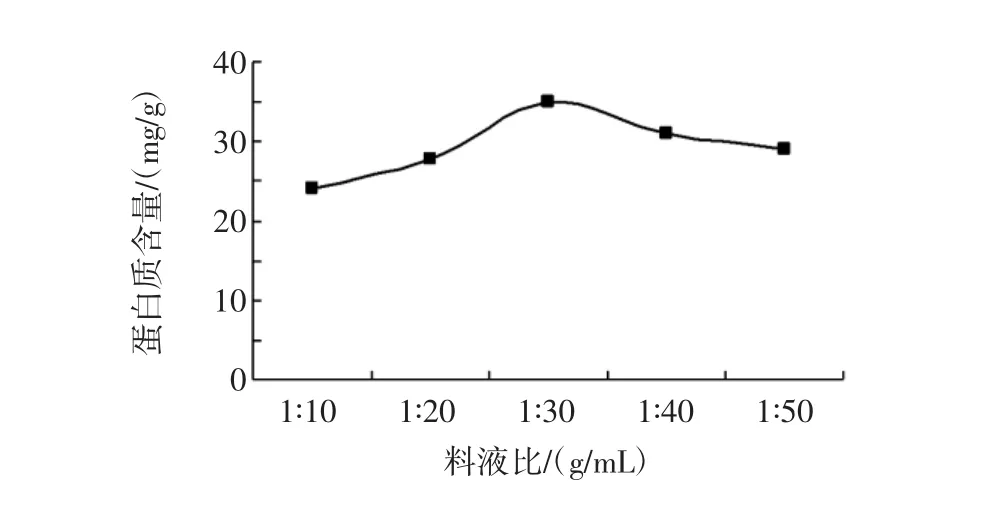
图3 料液比对田菁叶片蛋白质含量的影响Fig.3 Effects of material-to-liquid on extraction yield of Sesbania leaf proteins
2.1.4 提取温度对田菁叶片蛋白质含量的影响
提取温度对田菁叶片蛋白质含量的影响见图4所示。
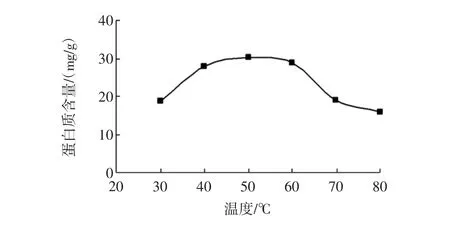
图4 提取温度对田菁叶片蛋白质含量的影响Fig.4 Effects of extraction temperature on extraction yield of Sesbania leaf proteins
由图4可知,叶片蛋白含量随提取温度的升高而显著增加,当提取温度达到50℃时,蛋白质产量达到最高值30.35 mg/g。这是因为温度升高,分子运动速度加快,蛋白质较容易从原料中溶解出来,但温度不是越高越好,高温会使蛋白质变性或裂解[20],从而影响蛋白质的含量和质量。综合能耗和产量考虑,初步确定提取温度为30℃~60℃。
2.1.5 盐浓度对田菁叶片蛋白质含量的影响
盐浓度对田菁叶片蛋白质含量的影响见图5所示。
由图5可知,当盐浓度为1%~5%时,叶片蛋白质含量基本符合逐步上升的趋势,当盐浓度为5%时,叶片蛋白值含量达到最高34.68 mg/g,超过5%后,提取含量有所下降。这可能是因为溶液中的钠离子和氯离子可与带负电荷和正电荷的蛋白质基团结合,屏蔽了蛋白质分子之间的静电排斥力,蛋白质分子在运动时更容易交联、聚焦而产生沉淀析出[21]。综合含量和成本因素,初步确定盐浓度为2%~5%。
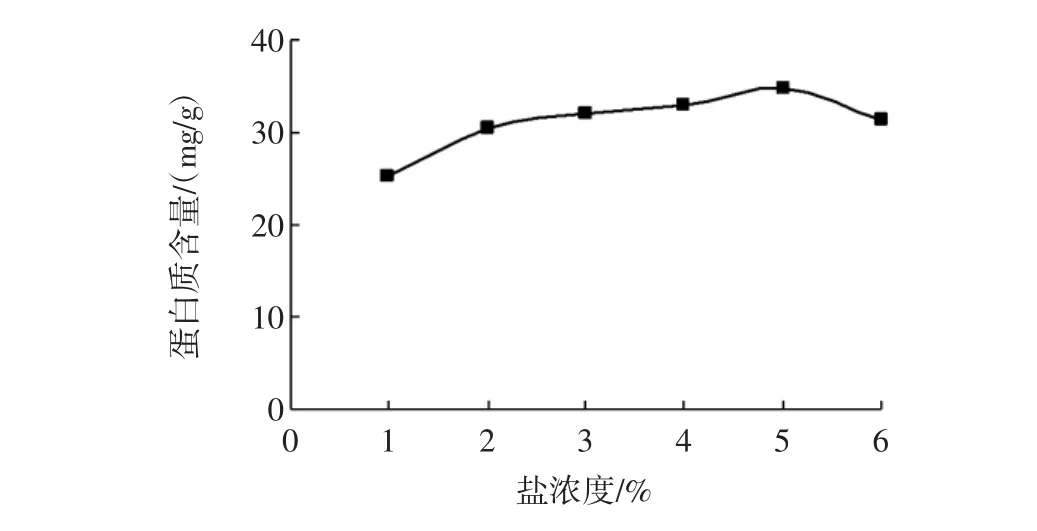
图5 盐浓度对田菁叶片蛋白质含量的影响Fig.5 Effects of the concentration of NaCl on extraction yield of Sesbania leaf proteins
2.2 正交设计法优化提取工艺
2.2.1 正交试验结果
根据单因素的结果,设计L16(45)五因素四水平正交优化试验,每个试验重复6次,结果见表2。
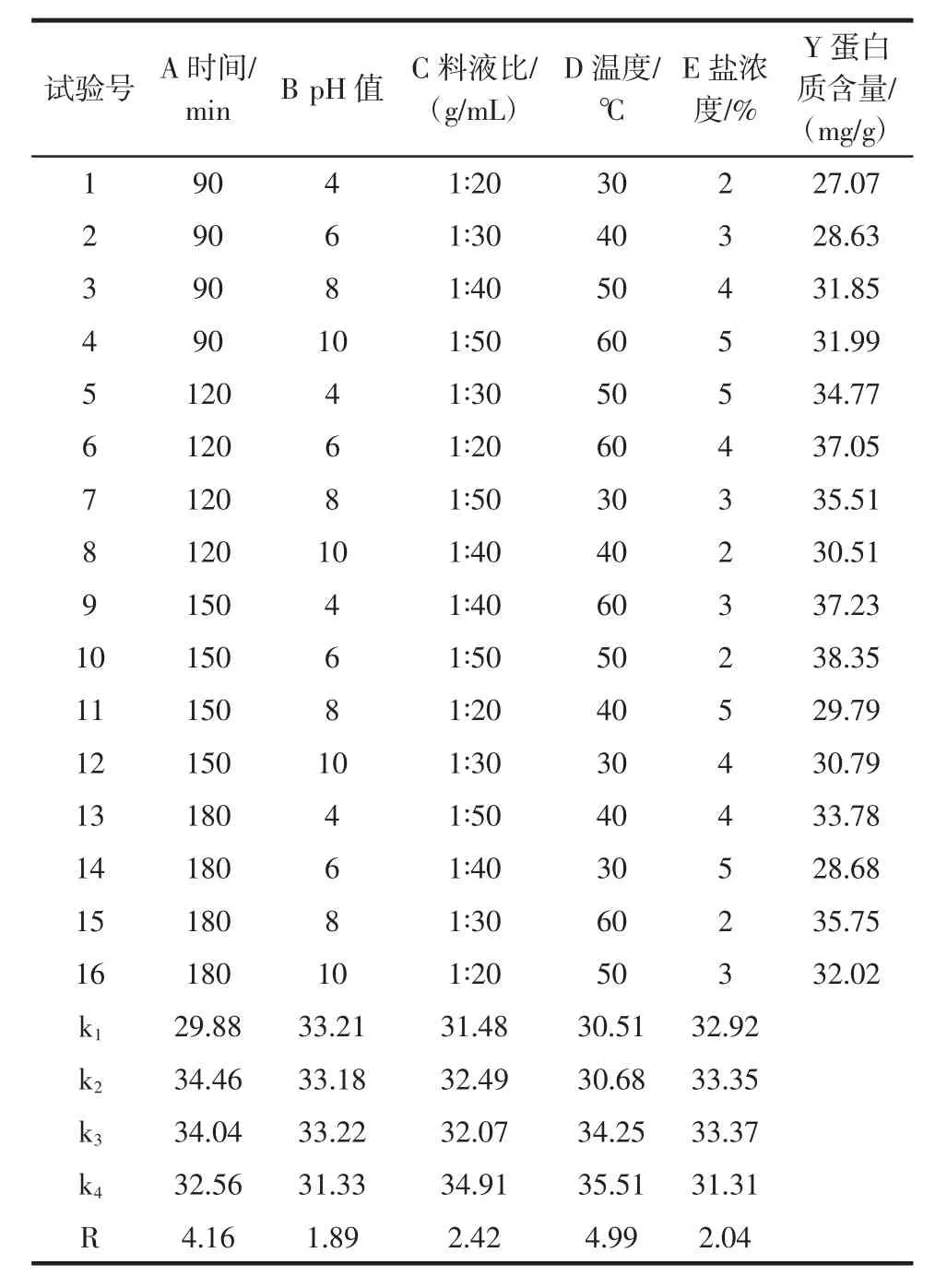
表2正交设计及结果L16(45)Table 2L16(45)orthogonal design arrangement and experimental results
从表2可以看出,根据极差R的大小判断得:田菁叶片蛋白质提取含量影响因素的主次顺序为D>A>C>E>B,即提取温度>提取时间>料液比>盐浓度>pH值。分析蛋白质提取的含量和各因素的k值,A2B3C4D4E3组合为田菁叶片蛋白质提取的最佳方案。
2.2.2 正交试验方差分析和多重比较结果
为考察5种因素对蛋白质提取含量的差异,采用One-Way ANOVA进行单因素方差分析,结果见表3。
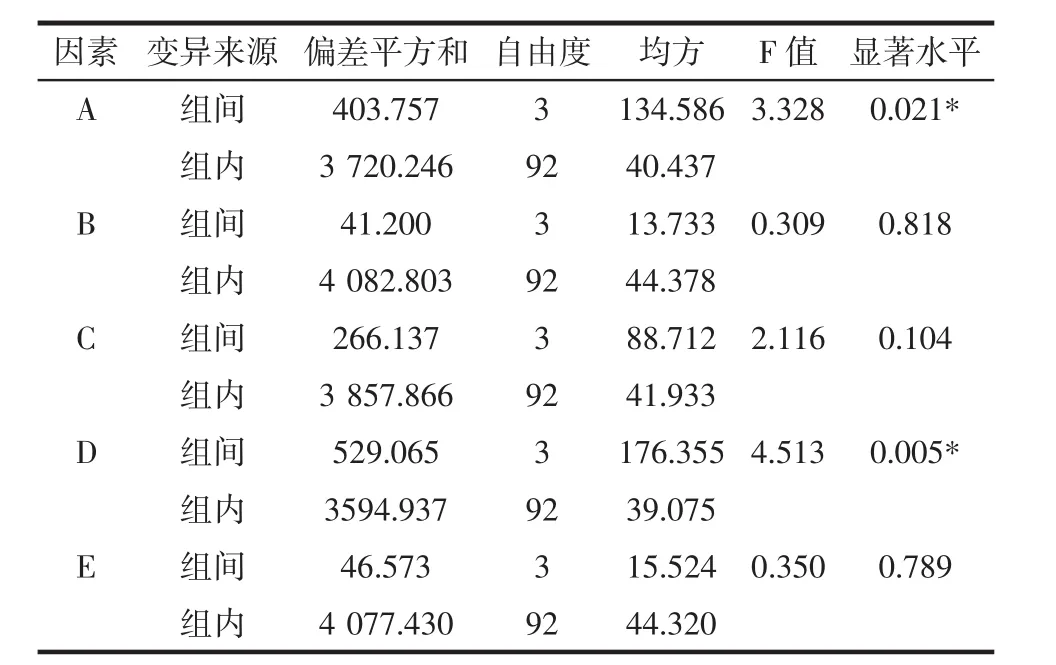
表3 正交试验方差分析结果Table 3 Variance analysis of orthogonal experiments
由表3可知,因素A和D不同水平之间有显著性差异,说明提取温度和提取时间对田菁叶片蛋白质的提取率有显著影响;因素B、C和E均无显著性差异,说明pH值、料液比和盐浓度在正交设计的4个水平对蛋白质的提取率无显著影响。
为了进一步考察显著因素不同水平间的差异,采用Duncan新复极差法分别对因素A和D进行多重比较,结果见表4。
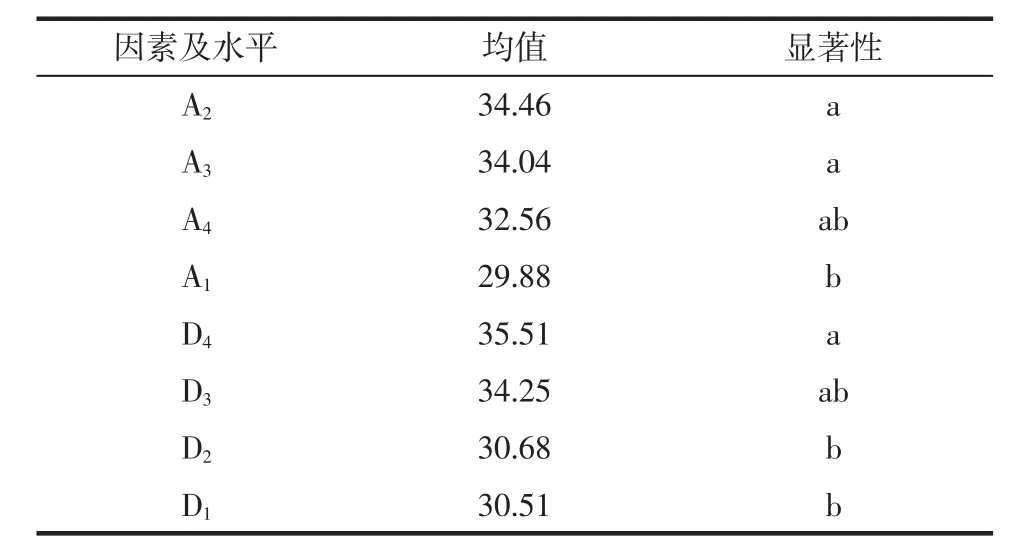
表4 A和D两因素四水平蛋白提取量均值的多重比较Table 4 Multiple comparisons of proteins extraction yield at different levels of factor A and D
由表4可知,A2和A3水平对蛋白质含量的影响显著高于A1水平,但A2和A3之间差异不显著,而选择A2水平成本更低;D4水平显著高于D2和D1水平,故选择D4作为D因素的最适水平。
因素B、C和E因无显著性差异,其水平可根据实际情况进行选择。从经济角度考虑,三者分别B3、C1和E1均较为合适。因此,最后确定提取田菁叶片蛋白质的最佳工艺参数为A2B3C1D4E1,即采用料液比1∶20(g/mL)、pH 8、NaCl 2%、60℃条件下提取120 min,即可达到最佳提取效果,在此条件下重复提取田菁叶片蛋白质6次,测得平均提取率为40.02 mg/g。
3 结论
以水为溶剂,从田菁叶中提取蛋白质,得到影响蛋白质提取率的各个因素主次为提取温度、提取时间、料液比、盐浓度和pH值。从田菁叶中提取蛋白质的最佳工艺条件为:料液比 1 ∶20(g/mL)、pH 8、NaCl 2%、提取温度60℃,提取时间120 min。按该工艺参数组合提取田菁叶片蛋白质的提取率可达40.02 mg/g。
[1]张晓红,邹长明,王允青,等.适宜在安徽推广种植的田菁品种的筛选与评价[J].湖南农业大学学报(自科版),2015,41(2):190-195
[2]Srivastava N,Kumar G.Influence of drought stress on cytological behavior of green manure crop Sesbania cannabina Poir[J].Cytologia,2014,79(3):325-329
[3]Ren C G,Bai Y J,Kong C C,et al.Synergistic interactions between salt-tolerant rhizobia and arbuscular mycorrhizal fungi on salinity tolerance of Sesbania cannabina Plants[J].Journal of Plant Growth Regulation,2016,35(4):1098-1107
[4]张立宾,郭新霞,常尚连.田菁的耐盐能力及其对滨海盐渍土的改良效果[J].江苏农业科学,2012,40(2):310-312
[5]Rao D L N,Gill H S.Biomass and biofertilizer production by Sesbania cannabina in alkaline soil[J].Bioresource technology,1995,53(2):169-172
[6]Li Y,Li X,Liu Y,et al.Genetic diversity and community structure of rhizobia nodulating Sesbania cannabina in saline-alkaline soils[J].Systematic and applied microbiology,2016,39(3):195-202
[7]谢文军,王济世,靳祥旭,等.田菁改良重度盐渍化土壤的效果分析[J].中国农学通报,2016,32(6):119-123
[8]张俊彪,谢秒秒,张磊,等.田菁茎瘤固氮根瘤菌ORS571类T3SS效应蛋白的预测、原核表达及相关功能分析[J].农业生物技术学报,2017,25(3):461-469
[9]姜南,刘卫,李岩,等.茎瘤固氮根瘤菌趋化系统基因的比较基因组学分析及相关蛋白序列分析[J].微生物学报,2016,56(8):1256-1265
[10]Sinha S,Gupta A K.Translocation of metals from fly ash amended soil in the plant of Sesbania cannabina L.Ritz:effect on antioxidants[J].Chemosphere,2005,61(8):1204-1214
[11]秦俊豪,温莹,李君菲,等.绿肥植物田菁的化感效应及对土壤肥力的影响[J].土壤,2015,47(3):524-529
[12]李福岭.田菁的饲料利用价值及饲喂试验[J].饲料研究,1993(5):30-31
[13]张艳,朱珠,张传智,等.黑豆饼粕蛋白的超声波提取及其性质的研究[J].食品研究与开发,2014,35(24):49-53
[14]张亚格,李茂,周汉林,等.豆科牧草在肉羊生产中的应用[J].家畜生态学报,2016,37(5):73-77
[15]叶婧,曾育蒙,王秀丽,等.腰果蛋白的提取及功能特性研究[J].食品研究与开发,2016,37(6):43-49
[16]杨芙莲,赵丽娜.甜荞麦麸皮蛋白质提取工艺研究[J].陕西科技大学学报(自然科学版),2015,35(1):126-130
[17]刘宇,刘畅,杨杰,等.橡胶籽分离蛋白的组成及功能性质[J].中国粮油学报,2016,31(5):61-65
[18]孔维宝,侯明杰,李万武,等.文冠果油渣中蛋白质的提取工艺研究[J].中国油脂,2014,39(7):42-45
[19]杨晓明,安峰峰,张雅倩.三叶草可溶性蛋白提取工艺研究[J].甘肃科技,2014,30(23):146-148
[20]赵晨霞,祝海娟,张翌楠.正交试验优化大麦虫蛋白质提取工艺[J].食品科学,2013,34(16):42-45
[21]邵瑶瑶,赵燕,徐明生,等.金属离子对蛋白质凝胶化行为的影响研究进展[J].食品科学,2017,38(5):299-304


