椰蓉膳食纤维的酶法提取与理化性质分析
张玉锋,宋彦博,,王志煌,,陈卫军,赵松林
(1.中国热带农业科学院椰子研究所,国家重要热带作物工程技术研究中心,海南省椰子深加工工程技术研究中心,海南文昌571339;2.海南大学食品学院,海南海口570228)
膳食纤维(Dietary Fiber,DF)是不能被人体小肠中内源性的酶水解、由10个或以上单体组成的碳水化合物聚合物的总称,主要包括存在于日常食物中经物理、化学、酶法从食品原料中提取或人工合成的,并被官方证实的具有特定生理作用的碳水化合物聚合物[1]。根据溶解性的不同可将膳食纤维分为可溶性(Soluble Dietary Fiber,SDF)和不溶性膳食纤维(Insoluble Dietary Fiber,IDF)两大类[2]。现代研究表明膳食纤维具有降低血清胆固醇、降低餐后血糖和胰岛素水平、增加饱腹感、减轻慢性便秘和肠憩室等功效,被誉为“第七大营养素”[3]。近年来随着饮食结构的改变,我国人民罹患肥胖、糖尿病、动脉硬化、肠癌等疾病的风险呈逐年增加的趋势,这与膳食纤维的摄入不足有很大的关系[4]。如我国成年人平均每人每天摄入的膳食纤维仅为13.3 g左右,尚不到推荐摄入量的一半(30.2 g)。因此,寻求新的膳食纤维资源并进行日常膳食的纤维强化成为了国内外学者的重要研究课题。
椰蓉是新鲜椰肉粉碎并榨取椰奶后的副产物,经干燥脱水(水分至2.5%)后,其脂肪含量为42.6%,蛋白质4.2%,碳水化合物19.2%,粗纤维23.2%,是一种优良的膳食纤维资源,将其添加到食品中后会产生大量的短链脂肪酸(丁酸),可有效降低血糖水平,防止体重增加[5]。而目前国内外学者在椰蓉粉末的动力学特征、不同颗粒大小对椰蓉的水合性质、脂肪吸收能力和微观结构的影响以及将椰蓉粗纤维添加到面条和饼干制品中研究其对食品感官和品质的影响等方面均有所报道[6-8]。但在椰蓉纤维的分类制备(SDF和IDF)及各组分的理化特性方面的研究报道尚未见到,因此本文拟在前期工作的基础上研究椰蓉中膳食纤维的酶法制备工艺,分类制备SDF和IDF,并研究其理化特性,为提高椰蓉的附加值和后续开发利用提供理论指导和技术支持。
1 材料与方法
1.1 材料及试剂
新鲜椰蓉由海南文昌南椰实业有限公司提供;耐高温α-淀粉酶(30 000 U/g):湖南新鸿鹰生物工程有限公司;木瓜蛋白酶(≥3000U/g)、糖化酶(10万U/mL):阿拉丁试剂有限公司;氢氧化钠、盐酸、磷酸氢二钠、磷酸二氢钠:均为分析纯。
1.2 试验方法
1.2.1 材料的预处理
新鲜椰蓉→60℃鼓风干燥箱(7 h)→粉碎→过筛(60目)→脱脂(椰蓉、石油醚质量体积比1∶4,浸泡过夜,脱脂3次)→60℃鼓风干燥箱(7 h)→密封保存
1.2.2 膳食纤维提取工艺流程


1.2.3 试验设计与优化
在3种酶的最适水解温度和pH值的基础上进一步考察酶用量及水解时间对膳食纤维提取得率的影响。以提取率为考核指标,具体单因素试验设计如表1所示,然后根据单因素试验结果进行正交优化以确定最佳提取参数,并加以验证。
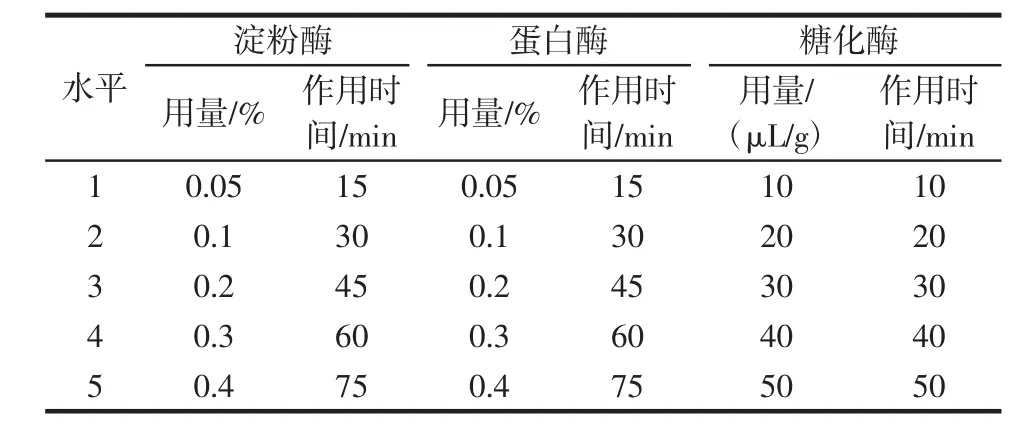
表1 酶法提取试验的因素水平表Table 1 Factors and levels of enzymatic extraction experiment
1.2.4 理化性质测定
溶胀力(Swelling Capacity,SC)的测定简要过程:称取干样1.00 g,置入到50 mL量筒中,读取样品干样体积,取30 mL去离子水加入到量筒中,于37℃下振荡12 h,静置12 h,读取量筒中膨胀后的体积。
持油力(Oil Holding Capacity,OHC)的测定:称取干样1.00 g置于50 mL离心管中,加入25 mL花生油于离心管中,37℃振荡1 h,3 000 r/min,离心20 min。去掉上层未被吸附的液体,用滤纸吸干残液,称重。

持水力(Water Holding Capacity,WHC)的测定:称量干样1.00 g置于50 mL离心管中,加入25 mL的去离子水,37℃振荡1 h,在4 000 r/min条件下离心20 min,弃去上清液,用滤纸吸干残液,称重。
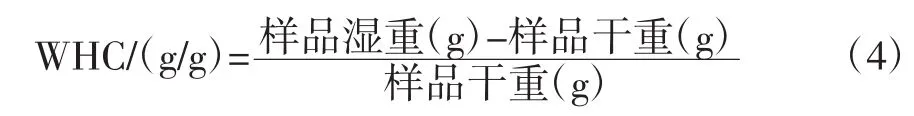
2 结果与分析
2.1 α-淀粉酶对椰蓉DF提取率的影响
α-淀粉酶的用量和水解时间对椰蓉DF提取率的影响结果见图1和图2。
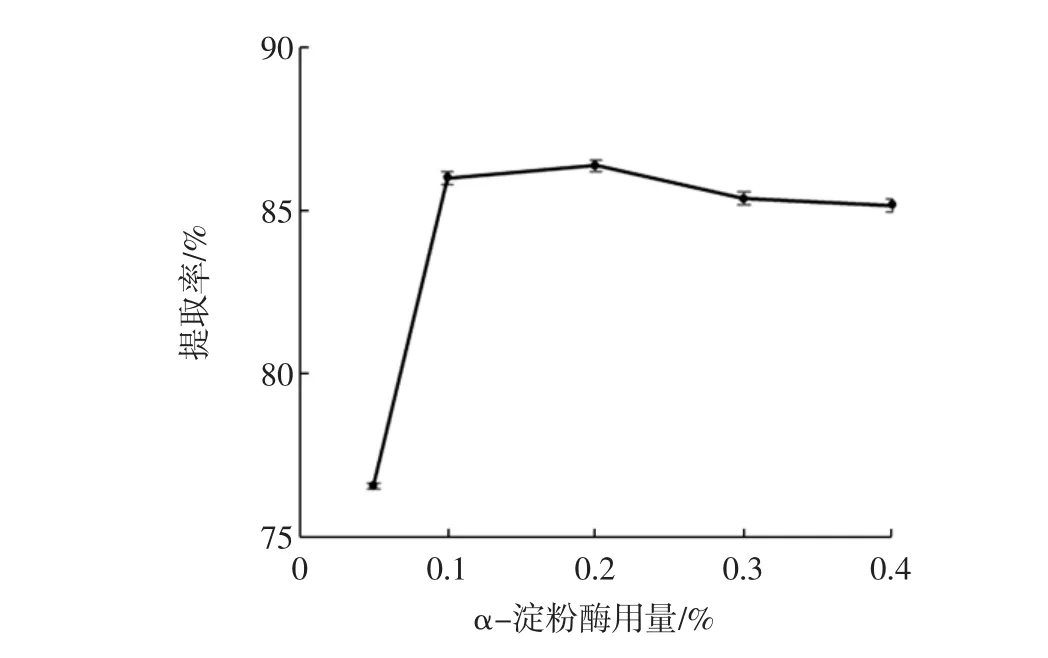
图1 α-淀粉酶用量对DF提取率的影响Fig.1 Effect of α-amylase dosage on DF extraction rate
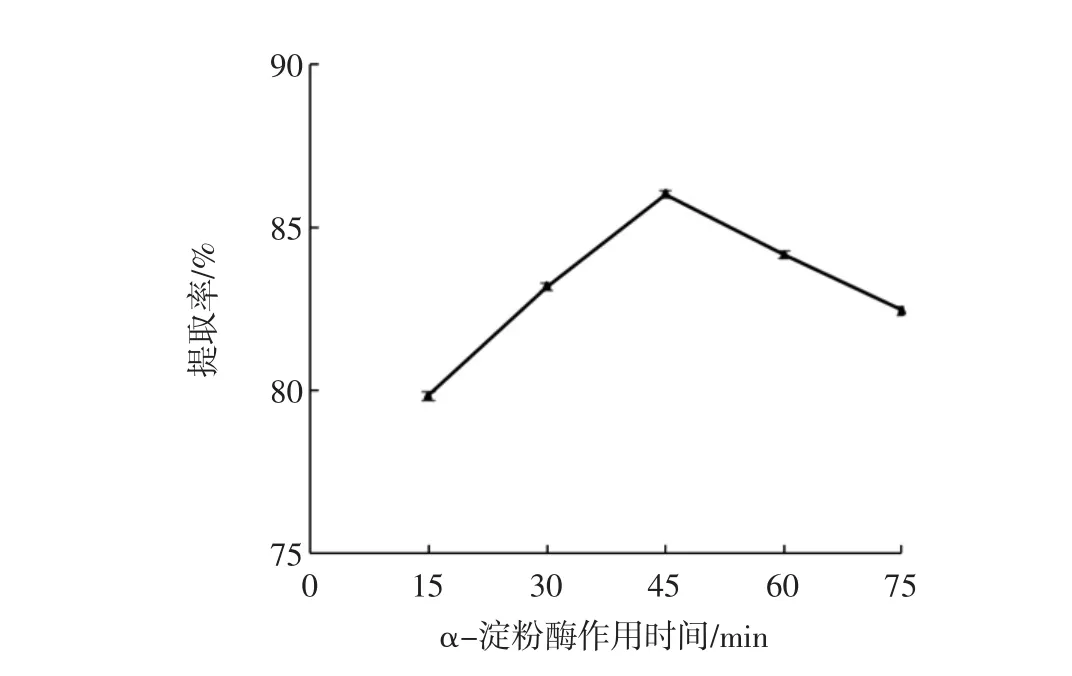
图2 α-淀粉酶作用时间对DF提取率的影响Fig.2 Effect of hydrolysis time on DF extraction rate
图1、图2可以看出:在α-淀粉酶用量低于0.2%时,DF提取率呈显著增大趋势;酶用量为0.2%时提取率最高,达86.39%;再增加酶用量,DF提取率基本不变且略有降低;而对α-淀粉酶的作用时间而言,在作用时间为45 min时,DF的提取率最高,可达86.02%;增加或缩短水解时间均会导致提取率的降低;因此选择α-淀粉酶的用量0.1%~0.3%、作用时间30 min~60 min为正交试验的水平范围。
2.2 蛋白酶对椰蓉DF提取率的影响
蛋白酶对椰蓉DF提取率的影响见图3、图4。
由图3可知,蛋白酶是DF酶法提取的关键用酶,随着蛋白酶用量的增加,DF的提取率呈先增加再降低的趋势,且在用量为0.2%时提取率达到最高为87.63%。由图4可知,对蛋白酶作用时间来说,随着时间的延长,DF的提取率迅速增加,而45 min以后,DF提取率基本不再变化(图4)。这可能是因为在反应开始时,椰蓉浓度较高,DF浓度较低,反馈抑制效应小,酶促反应速率和DF的提取率较高;但随着时间的增长,椰蓉浓度不断减小、DF不断积累,产物的负反馈抑制效应明显增加,酶促反应速率和DF提取率则不再增加[9]。因此蛋白酶用量和作用时间分别选择0.1%~0.3%和30 min~60 min作为后续正交试验的水平范围。
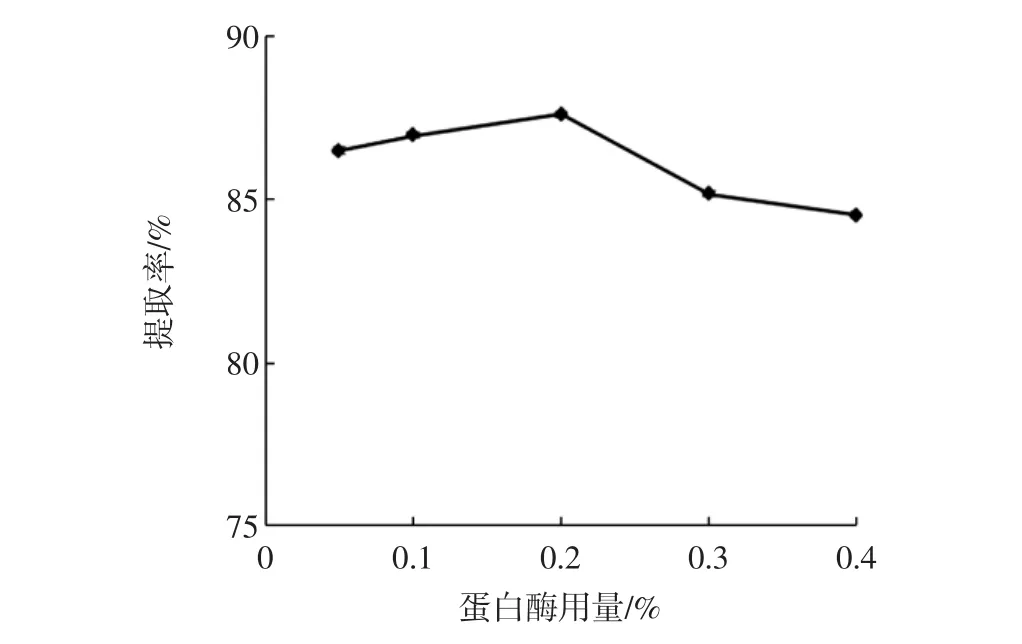
图3 蛋白酶用量对DF提取率的影响Fig.3 Effect of protease dosage on DF extraction rate
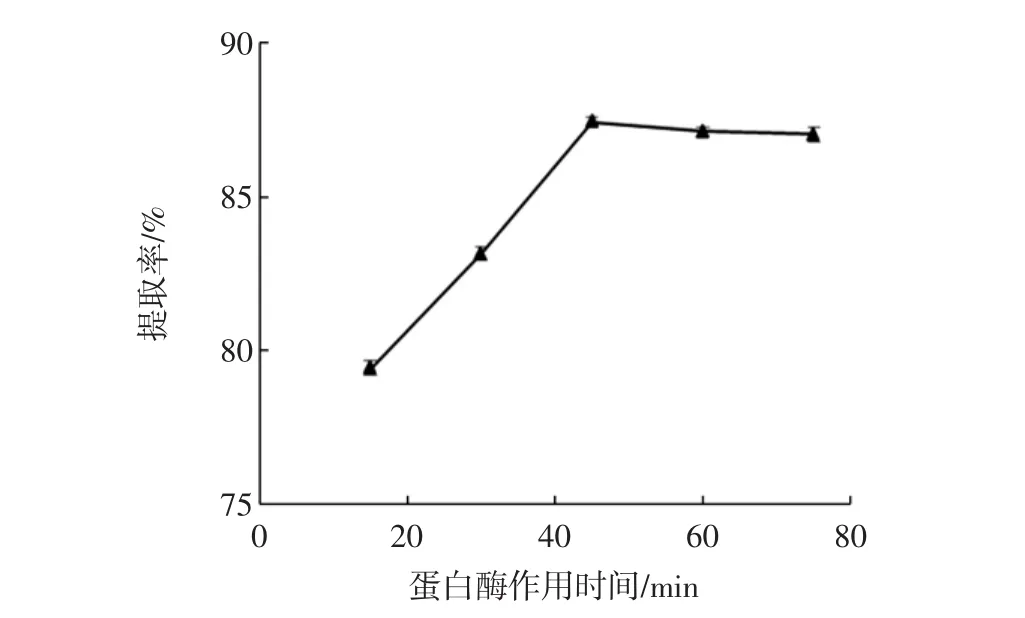
图4 蛋白酶作用时间对DF提取率的影响Fig.4 Effect of hydrolysis time on DF extraction rate
2.3 糖化酶对椰蓉DF提取率的影响
糖化酶对椰蓉DF提取率的影响结果见图5、图6。
可知:在糖化酶添加量小于30 μL/g时,DF的提取率随着酶用量的增加而显著提高。但当糖化酶用量大于30 μL/g时,DF得率逐渐降低(图5)。糖化酶作用时间对DF提取率的影响与酶用量的作用结果类似,在作用时间为30 min时,DF提取率最高,而后提取率逐渐降低(图6)。其原因可能是随着酶用量的增加和作用时间的延长,膳食纤维(主要为IDF)中的纤维素和半纤维素等成分会因糖苷键和氢键等化学键的断裂而降解成低聚糖或单糖等小分子产物,不易被乙醇沉淀,从而导致DF的提取率逐渐降低[10-11]。因此糖化酶的用量和作用时间分别以 20 μL/g~40 μL/g 和20 min~40 min为宜。
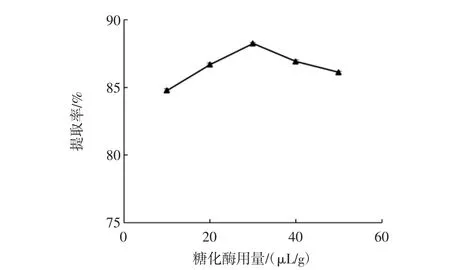
图5 糖化酶用量对DF提取率的影响Fig.5 Effect of glucoamylase dosage on DF extraction rate
2.4 3种酶提取的正交优化
在上述单因素试验的基础上,选取α-淀粉酶的用量(A)和作用时间(B)、蛋白酶的用量(C)和作用时间(D)以及糖化酶的用量(E)和作用时间(F)6个因素,进行3水平正交试验L18(37)优化,以确定椰蓉DF的酶法提取工艺,结果见表2。
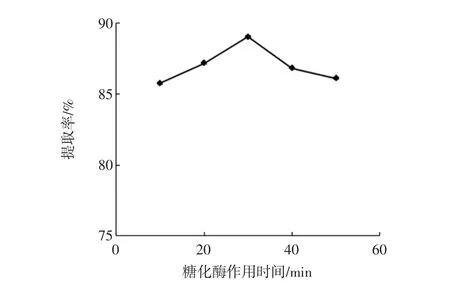
图6 糖化酶作用时间对DF得率的影响Fig.6 Effect of hydrolysis time on DF extraction rate

表2 酶法提取膳食纤维的正交试验结果Table 2 Orthogonal test results of dietary fiber extracted by enzymatic extraction
根据R值的大小可知:3种酶对椰蓉DF提取率的影响大小顺序分别为B>A、D>C、E>F,即对于 α-淀粉酶和蛋白酶来说,酶解时间对椰蓉DF的影响大于酶用量,而对糖化酶来说,酶用量对DF提取率的影响大于酶解时间,这可能是不同酶的活力大小或者其自身特性不同的缘故。由K值可以看出酶法提取的最佳组合应为B2A3D2C2E1F2,即α-淀粉酶作用时间和用量分别为45 min和0.3%、蛋白酶作用时间和用量分别为45 min和0.2%、糖化酶用量和作用时间分别为20 μL/g和30 min。经3次重复验证后得知:此工艺下椰蓉DF的提取率为89.68%。而第2组试验(B2A1D2C2E2F2)的DF提取率也高达89.37%,只是α-淀粉酶和糖化酶的用量(0.1%和30 μL/g)与优化组略有差异。但从生产成本方面考虑,处理等量物料时,0.2%淀粉酶的价格要远低于 10 μL/g糖化酶的价格,因此优化组(B2A3D2C2E1F2)更适合作为大批量原料处理和规模化生产的首选。
2.5 椰蓉膳食纤维的理化性质分析
在最佳酶法提取工艺的基础上,按照1.2.2的操作分别制备了椰蓉SDF和IDF,进而对其理化性质(持水力、持油力和溶胀性)进行分析结果见表3。
结果表明:SDF因其较好的溶解性能,不再表现出吸水膨胀性;而IDF的的SC值约为椰蓉原料的1.5倍,均优于大豆副产品的溶胀性(9.09 mL/g)[12],说明椰蓉IDF可作为一种保水组分应用到不同食品中,增加人们的饱腹感,减少其他食物的摄入量,进而起到一定的体重控制目的。
就OHC而言,IDF最高,椰蓉次之,SDF最低。但3种组分的OHC值均高于橘子膳食纤维(1.27 g/g)和麦麸(1.6 g/g),但是却低于藻类的14.7 g/g和芒果果皮的4.65 g/g。说明椰蓉及其膳食纤维在一定程度上均可作为高纤维成分应用于需要滞留油脂、吸收胆固醇的食品中。另外,IDF的WHC值高达12.71 g/g,约为SDF的18倍;虽然显著低于火龙果皮膳食纤维(30.95 g/g~54.20 g/g)[13],但也略高或相当于苹果、梨、香蕉、酸橙果皮等纤维的 WHC 值(6.3 g/g~12.8 g/g)[14],因此,椰蓉IDF可以作为减少食品水分损失、降低热量和改善黏度的一种功能性食品添加成分。因此,总体来说,制备所得的SDF和IDF与椰蓉相比在WHC、OHC和SC方面都有一定程度的改变或提升,即将椰蓉膳食纤维单独提取制备,然后作为功能组分添加到食品中不仅能发挥更优越的加工特性,还会改善食品的营养和功能性质。
3 结论与讨论
自从1953年Hipsplay第1次提出膳食纤维的概念至今,有关膳食纤维的测定、提取制备、功能评价及开发利用成为了国内外学者的研究热点。膳食纤维也因其调节机体功能,改善人体营养状况的独特生理功能而被誉为“第七大营养素”。目前,国内外提取膳食纤维的方法主要有化学提取法、酶提取法、化学-酶结合提取法、膜分离法、发酵法和物理法[15]。其中以AOAC为中心的酶法,因其操作方便,不需高温、高压水解条件,节约能源,能处理大量样品、可省去中和工艺及设备、产品纯度高等优点,而被很多国家推荐作为膳食纤维的制备方法并实现自动化。因此本文研究了淀粉酶、蛋白酶和糖化酶提取制备椰蓉膳食纤维的工艺参数,结果表明在α-淀粉酶作用时间和用量分别为45 min和0.3%、蛋白酶作用时间和用量分别为45 min和0.2%、糖化酶用量和作用时间分别为20 μL/g和30 min的工艺下,椰蓉DF的提取率可达89.68%。与化学法制备(77.01%)相比,该法显著提高了椰蓉DF的提取率,同时避免了盐酸和氢氧化钠等大量提取废液的产生,具有良好的生态效益[16]。进一步分类制备所得的IDF和SDF与椰蓉原料相比,在理化性质(溶胀性、持水力和持油力)方面有了一定的改变或提升,且以IDF的SC、OHC和WHC最高,分别为15.33 mL/g、6.51 g/g和12.71 g/g,可以作为一种潜在的保持水分、改善食品品质的功能性膳食纤维添加组分,但其对食品品质的影响作用及体内外生理功能评价尚待进一步研究。
[1]Phillips G O.Dietary fibre:A chemical category or a health ingredient?[J].Bioactive Carbohydrates and Dietary Fibre,2013,1(1):3-9
[2]Westenbrink S,Brunt K,van der Kamp J W.Dietary fibre:Challengesin production anduse of food composition data[J].Food Chemistry,2013,140(3):562-567
[3]Fendri L B,Chaari F,Maaloul M,et al.Wheat bread enrichment by pea and broad bean pods fibers:Effect on dough rheology and bread quality[J].LWT-Food Science and Technology,2016,73(11):584-591
[4]Lottenberg A M P,Fan P L T,Buonacorso V.Effects of dietary fiber intake on inflammation in chronic diseases[J].Einstein,2010,8(2):254-258
[5]Yalegama L W C,Karunaratne D N,Sivakanesan R,et al.Chemical and functional properties of fibre concentrates obtained from byproducts of coconut kernel[J].Food Chemistry,2013,141(1):124-130
[6]Raghavendra S N,Rastogi N K,Raghavarao K S M S,et al.Dietary fiber from coconut residue:effects of different treatments and particle size on the hydration properties[J].European Food Research and Technology,2004,218(6):563-567
[7]Raghavendra S N,Ramachandra Swamy S R,Rastogi N K,et al.Grinding characteristics and hydration properties of coconut residue:A source of dietary fiber[J].Journal of Food Engineering,2006,72(3):281-286
[8]Yalegama L L W C,Chavan J K.Studies on utilization of coconut flour as a source of cell wall polysaccharides[EB/OL].[2017-07-25].http://dl.nsf.ac.lk/bitstream/handle/1/12149/PGIATAR-18-126.pdf?sequence=2.2006
[9]肖琼.超声波辅助植物纤维原料酶水解的研究[D].南京:南京林业大学,2006:33-42
[10]刘昊飞.豆渣水溶性膳食纤维酶法制备及其应用[D].哈尔滨:东北农业大学,2008:24-28
[11]邓璀,李志建.酶-化学法提取石磨小麦麸皮不溶性膳食纤维工艺研究[J].河南工业大学学报,2015,36(2):13-16
[12]Rodriguez R,Jimenez A,Fernandezbolanos J,et al.Dietary fibre from vegetable products as source of functional ingredients[J].Trends in Food Science&Technology,2006,17(1):3-15
[13]Hassan F A,Ismail A,Hamid A A,et al.Characterisation of fibrerich powder and antioxidant capacity of Mangifera pajang,K.fruit peels[J].Food Chemistry,2011,126(1):283-288
[14]张玉锋,孙丽平,庄永亮,等.火龙果皮中膳食纤维含量及其物理化学特性[J].食品科学,2012,33(19):164-167
[15]符琼,林亲录,鲁娜,等.膳食纤维提取的研究进展[J].中国食物与营养,2010,16(3):32-35
[16]宋彦博,张玉锋,赵松林,等.椰蓉膳食纤维的提取工艺优化[J].食品工业,2016,37(11):132-135

