不同磷水平下幼套球囊霉与禾草内生真菌对多年生黑麦草生长的影响
郭艳娥, 李应德, 高 萍, 汪治刚, 段廷玉*
(1. 兰州大学草地农业科技学院, 甘肃 兰州 730020; 2. 兰州新区市政投资管理集团有限公司, 甘肃 兰州新区 730300)
磷(P)作为植物生长发育的三大必需营养元素之一,占植物细胞干重的0.2%[1],是植物代谢过程必不可少的物质[2]。我国耕地土壤中有1/3~1/2缺P,且许多土壤中,有效磷质量分数低于10 mg·kg-1,极大地限制了植物生长[3],因此改善P的吸收对促进植物生长和维持生态系统生产力具有重要意义。
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)是一类重要的植物根际促生菌,能与80%以上维管植物根系建立共生关系并形成AM菌根[4]。AMF促进植物生长的效应与菌根侵染改善宿主植物对P的吸收密切相关[5-6],这种作用在供P不足土壤环境中更为显著。菌根化植物对土壤中P元素的摄取包括直接吸收(direct uptake pathway,DUP)与菌根吸收(mycorrhizal uptake pathway,MUP)[7]两条途径。细胞学、生理学以及分子生物学试验证实,共生体之间P元素的转运发生在真菌丛枝结构和宿主皮层细胞之间。AMF借助真菌细胞膜上的磷转运蛋白进行跨膜运输,将土壤中含有的无机态磷酸盐转运到菌根外延菌丝中,在植物与真菌的共生界面又依靠对AM具有特异性的植物磷转运蛋白,将质外体空间中呈游离状存在的磷酸盐转移到皮层细胞[8]。AMF的菌丝无横隔,运输阻力小,其根外菌丝的吸P效率是根系的6倍,转移效率是根系的10倍[9]。
禾草内生真菌对宿主生长的介导效应也与P的有效性密切相关[10]。缺P时,接种内生真菌能促进宿主植物生长。与非感染植株(E-)相比,内生真菌感染(E+)的高羊茅(Festucaarundinacea)根系直径减小,根毛长度增加,进而扩大了根系吸收面积[11]。此外,E+高羊茅还通过根部分泌酚类化合物对P胁迫作出响应[12]。目前,国际上销售的多年生黑麦草(Loliumperenne)种子多含有内生真菌。
在自然界和农业生态系统中,禾草能分别与AMF和内生真菌建立共生关系[13],且有大量关于宿主植物与单一共生菌互作的报道,但二者共同作用对植物生长影响的研究还甚少,不同P水平下两种微生物共同作用对宿主的影响更是鲜有报道。关于禾草内生真菌与AMF的关系,有学者认为二者相互竞争,互相制约[14-16]。如感染内生真菌的高羊茅(Festucaarundinacea)、一年生(L.multiflorum)和多年生黑麦草(L.perenne)根系的菌根侵染率降低[14],禾草内生真菌的存在不同程度抑制了AMF的侵染,同样AMF侵染能够降低禾草内生真菌的菌丝密度和宿主植物叶片的生物碱含量[15-16]。然而,Novas等[17]的研究认为,禾草内生真菌可以增加AMF的侵染率,且在一定浸提液浓度内,AMF的菌丝长度增加。Liu等[18]的报道指出,AMF与禾草内生真菌的互作可能与供试基质的养分状况、内生真菌菌株类型以及AMF种类等诸因素相关。接种近明球囊霉(Glomusclaroideum)的E-植株侵染率高于E+,而接种摩西球囊霉(G.mosseae)的E+植株侵染率显著高于E-[19]。
以往的研究多是基于AMF和禾草内生真菌的关系,所得结论也并不一致[20]。本研究以多年生黑麦草(L.perenne)为供试对象,旨在探究不同P水平下AMF与禾草内生真菌对其生长、养分吸收、光合特性及磷酸酶活性的影响,以期为高效利用共生微生物,促进牧草生长提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1供试植物 多年生黑麦草种子AR1带有内生真菌(E+)、Nil不带内生真菌(E-),由新西兰国家草地研究所(AgResearch)、新西兰皇家科学院院士John Caradus教授提供。
1.1.2丛枝菌根真菌 幼套球囊霉(Claroideoglomusetunicatum),购买于北京市农林科学院植物营养与资源研究所,“丛枝菌根真菌种质资源库BGC”编号为NM01B,以三叶草种子(克朗德)盆栽扩繁所得的孢子、菌根根段、根外菌丝及培养基质作为接种物。
1.2 试验方法
1.2.1试验设计 盆栽试验于2016年9月—11月在兰州大学草地农业科技学院智能温室中进行,共设4个P水平,分别为0(P0)、10 mg·kg-1(P10)、20 mg·kg-1(P20)和30 mg·kg-1(P30)。试验将50 g·pot-1AMF接种物平铺在500 g灭菌的蛭石上面,然后再覆盖150 g蛭石,对照(AMF-)则加等量灭菌接种物和接种物滤液,以保证微生物区系一致[21]。挑选大小一致且籽粒饱满的种子,用10% H2O2对其表面消毒10 min,然后用无菌水冲洗干净,于25℃恒温培养箱催芽[21]。48 h后,选取长势基本一致,大小相近的带菌(E+)和不带菌(E-)黑麦草植株分别移栽至直径18 cm、高19 cm的花盆中,每盆移栽5株,出苗1周后,定苗至3株。定苗后,加入极易被植物吸收利用的0.1 mol·L-1KH2PO4溶液,建立不同P水平处理,P0则加入等量蒸馏水。试验过程中根据不同生长期植物所需,按其饱和含水量的50%~75%称重浇水。共设16个处理,每个处理6个重复。生长8周后收获并测定植物生长及生理生化指标。
1.2.2测定方法 生物量采用烘干法测定;AMF侵染率的测定采用染色镜检法:取0.2 g左右冲洗干净的黑麦草根系,装入15 ml离心管,于10 ml 10%的KOH溶液中沸水浴常压处理30 min,观察根系表皮颜色是否已消除,如颜色已去除,弃去KOH,用蒸馏水冲洗干净,置于2%的HCl中酸化30 min,弃去HCl并进行冲洗,然后用0.05%的Trypan-Blue(曲利苯蓝)染液(w/v,溶剂为乳酸︰甘油︰水=1︰1︰1的混合液),80℃水浴染色20 min,待染色结束后,弃去染液,用蒸馏水冲洗干净,置于50%脱色液中(v/v,甘油︰水=1︰1) 脱色保存,最后用“十字交叉法”测定各处理的AMF侵染率[22-23];全N、全P含量:用球磨仪研磨植物干样,并过2 mm筛,称取0.25 g左右研磨好的植物样,加入3.3 g催化剂(K2SO4和CuSO4研磨后10∶1混合)和10 ml浓H2SO4,420℃消煮2 h,冷却后定容至100 ml,采用流动注射仪(FIAstar 5000 Analyzer,FOSS,Sweden)测定;采用Li-6400便携式光合仪测定叶片光合特性,每盆取5个值,测定参数包括净光合速率、蒸腾速率和气孔导度。叶片与根系磷酸酶活性的测定参照Sadasivam和Manickam的方法[24]。
1.3 数据分析
试验数据录入Microsoft Excel 2007进行整理,采用JMP IN 4(SAS Institute Inc.,SAS Campus Drive,Cary,NC27513,USA)对各指标进行交互效应及方差分析,结果用GraphPad Prism 5.01(GraphPad Software Inc.,San Diego CA)作图。
2 结果与分析
2.1 植物生物量
结果显示:不同P水平下,对照AMF-E-的地上生物量无显著差异(P>0.05)(表1)。AMF与禾草内生真菌单独作用降低了多年生黑麦草的地上生物量,仅P30水平下AMF-E+处理较AMF-E-增加1.95%,P20水平下AMF+E-的地上生物量比P0、P10和P30分别高19.29%,31%和3.17%(表1)。AMF与禾草内生真菌互作时存在交互效应(表2),AMF+E+不同P水平下的地上生物量比AMF-E+分别低14%,1.45%、9.45%和17.74%,P0和P10水平下比AMF+E-分别高3.58%和21.16%,P20和P30水平下比AMF+E-分别低6.85%和3.97%(表1)。

表1 不同处理下多年生黑麦草的生物量Table 1 Biomass of perennial ryegrass under different treatments
注:AMF-E-:未接种对照;AMF-E+:含禾草内生真菌处理;AMF+E-:接种AMF处理;AMF+E+:同时接种AMF和禾草内生真菌处理。图中数据为平均数±标准误。不同小写字母表示不同处理间经LSD法检验差异显著(P<0.05),下同
Note:AMF-E-means control treatment;AMF-E+means grass endophyte treatment;AMF+E-means AMF treatment;AMF+E+means inoculated with AMF and grass endophyte. Data are mean±SE. Different lowercase letters indicate significant differences across treatments at the 0.05 level by LSD test,the same as bellow
P对地下生物量和总生物量的影响一致,P20水平下最高(表1)。不同P水平下,AMF+E-处理的地下生物量和总生物量趋势一致,先降低后增加,但各水平间的差异均不显著(P>0.05)(表1)。AMF-E+地下生物量和总生物量随P水平增加而增加,与AMF互作时,先增加后降低,三者间存在交互作用(表1,表2)。
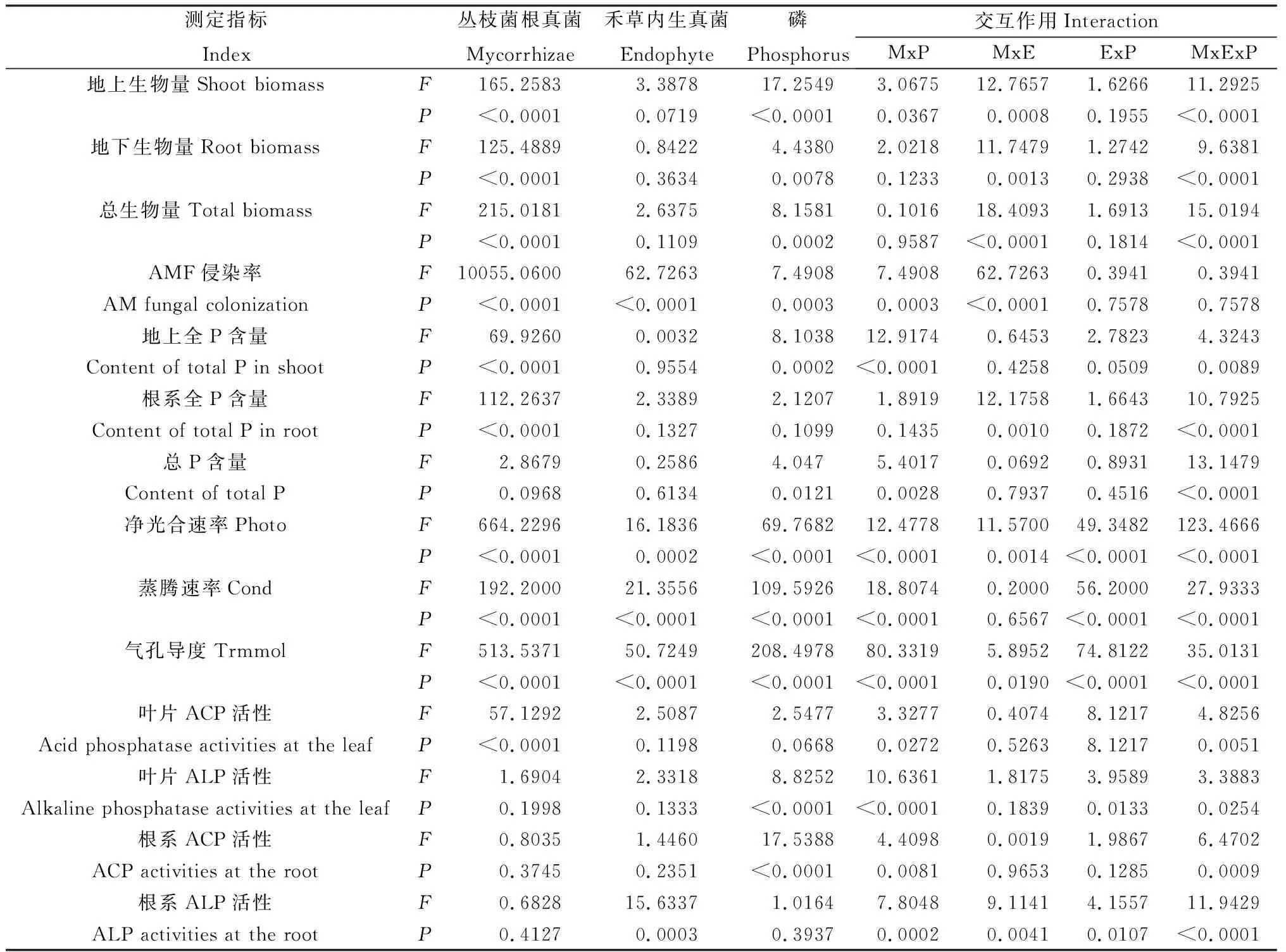
表2 不同P水平下丛枝菌根真菌与禾草内生真菌对多年生黑麦草各指标的方差分析(P值)Table 2 Variance analyses of E- and E+ perennial ryegrass inoculated with or without AMF under differentphosphorus levels (P Value)
注:MxP:AMF与P水平间的交互作用;MxE:AMF与禾草内生真菌间的交互作用;ExP:禾草内生真菌与P水平间的交互作用;MxExP:AMF、禾草内生真菌与P水平三者间的交互作用
Note:MxP means interaction between AMF and phosphorus level;MxE means interaction between AMF and grass endophyte;ExP means interaction between grass endophyte and phosphorus level;MxExP means interaction among AMF,grass endophyte and phosphorus level
2.2 AMF侵染率
未接种AMF的黑麦草根系均未检测到菌根结构。P水平对AMF侵染率产生显著影响(P<0.05),AMF+E-处理P10比P0、P20和P30分别高5.56%,11.48%和14.86%。禾草内生真菌对AMF侵染率产生极显著影响(P<0.01),且二者间存在交互效应(表2),P0、P10、P20和P30水平下AMF+E+的侵染率比AMF+E-分别低16.54%,20.03%,15.85%和15.95%,禾草内生真菌抑制了AMF的侵染(图1)。
2.3 植物全P含量
多年生黑麦草地上全P含量随P水平增加先增加后降低(表3)。AMF显著降低了植株的地上全P含量(P<0.05),并与P水平间存在交互作用(表2),P10水平下AMF+E-的地上全P含量比P0、P20和P30分别低11.02%,26.33%和13.56%(表3)。禾草内生真菌对多年生黑麦草地上、根系和总P含量均未产生显著影响(P>0.05),仅P30水平下AMF-E+处理的P含量高于AMF-E-(表3)。禾草内生真菌、AMF与P水平三者间存在交互效应(表2),P0和P30水平下AMF+E+的地上全P含量高于AMF-E+和AMF+E-处理,P10和P20水平反之(表3)。

图1 不同处理下多年生黑麦草的AMF侵染率Fig.1 AM colonization of perennial ryegrass underdifferent treatments注:不同小写字母表示不同处理间差异显著(P<0.05),下同Note:Different lowercase letters on the bars indicate significant differences across treatments at the 0.05 level,the same as bellow
AMF对根系全P含量产生极显著影响(P<0.01),但与P水平间无交互作用(表2),其与禾草内生真菌互作时随P水平增加,根系全P含量低于AMF+E-或AMF-E+,AMF+E+处理P10比P0、P20和P30的根系全P含量分别高15.58%,17.07%和34.25%。禾草内生真菌与P水平间存在交互效应(表2),P20比P0、P10和P30的根系全P含量分别高46.06%,15.25%和1.21%。对总P含量的影响与根系全P含量一致(表2,表3)。
2.4 植物光合特性
P水平对多年生黑麦草的光合特性产生极显著影响(P<0.01)(表2)。AMF增加了植物的光合特性,并与P水平存在交互效应(表2),P30水平下的净光合速率比P0、P10和P20分别高28.38%,23.27%和10.11%,蒸腾速率高86.96%,26.47%和377.78%,气孔导度高93.55%,21.21%和126.42%(图2)。禾草内生真菌对净光合速率、蒸腾速率和气孔导度的影响,随P水平变化趋势一致,表现为先降低后增加(图2)。AMF与禾草内生真菌共同作用时,净光合速率、蒸腾速率和气孔导度高于或介于AMF-E+和AMF+E-之间,且随P水平增加而降低(表2,图2)。

表3 不同处理下多年生黑麦草的全P含量Table 3 Total P content of perennial ryegrass under different treatments
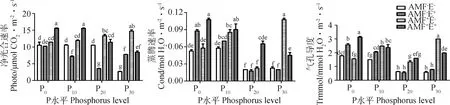
图2 不同处理下多年生黑麦草的光合特性Fig.2 Photosynthetic characteristics of perennial ryegrass under different treatments
2.5 磷酸酶活性
P水平对叶片酸性磷酸酶(Acid phosphatase,ACP)和碱性磷酸酶(Alkaline phosphatase,ALP)的活性产生显著影响(P<0.05)。AMF降低了叶片ACP活性,并与P水平间存在交互效应,P10比P0、P20和P30的叶片ACP活性分别低10.54%,9.97%和14.67%,AMF+E-处理P20水平的ALP活性比P0、P10和P30分别高17.00%,16.91%和18.84%(表2,图3)。随P水平增加,禾草内生真菌对叶片ACP和ALP活性的影响一致,但活性最高所对应P水平异同,P10水平ACP活性比P0、P20和P30分别高29.17%,57.12%和24.41%,ALP活性P30比P0、P10和P20分别高25.09%,9.53%和39.76%(图3)。AMF、禾草内生真菌与P对叶片磷酸酶活性的影响存在交互效应(表2),不同P水平下AMF+E+处理的叶片磷酸酶活性低于或介于AMF-E+和AMF+E-之间(图3)。

图3 不同处理下多年生黑麦草的叶片磷酸酶活性Fig.3 Leaf phosphatase activities of perennial ryegrass under different treatments
P对黑麦草根系ACP活性的影响较ALP显著(P<0.05)(表2)。AMF对根系ACP活性无显著影响(P>0.05),但增加了ALP活性,并与P水平间具有交互效应,根系ACP和ALP活性分别以P20和P30最高(表2,图4)。禾草内生真菌P20水平的ACP活性比P0、P10和P30分别高11.09%,43.42%和183.56%,ALP活性P10比P0、P20和P30分别高21.74%、23.16%和93.46%(图4)。AMF、禾草内生真菌与P水平三者间存在交互效应,AMF+E+处理P10水平的根系ACP和ALP活性低于AMF-E+和AMF+E-,P30水平反之(表2,图4)。

图4 不同处理下多年生黑麦草的根系磷酸酶活性Fig.4 Root phosphatase activities of perennial ryegrass under different treatments
3 讨论
AMF能显著改善宿主植物对养分的吸收[5-6]。Smith等[8]的研究表明,蒺藜苜蓿(Medicagotruncatula)中的P大多通过MUP途径获得。Li等[25]通过盆栽试验证明小麦(Triticumaestivuml)80%的P吸收也是通过MUP途径。本研究中接种AMF对地上和根系全P含量产生显著影响,但不同P水平下AMF+E-的总P含量皆低于AMF-E-,原因可能与基质的养分状况密切相关。在以蛭石为供试基质的研究中,AMF并未通过P的迁移转化来提高植物的P含量,自身还需依赖宿主获取生存所需养分[26]。此外,当基质的养分供应满足植物生长所需时,MUP途径吸收的养分更多地被贮存在菌丝中[25],其协助宿主吸收的养分并未对植物生长产生积极影响,甚至导致植物养分含量的降低[27]。对生物量的影响与全P含量一致。
低P条件下E+植株的生长速率更快,根部累积的P元素也更多[28]。本研究中AMF-E+处理植株的生物量和组织含P量随P供给水平的增加而增加,但仅P30水平下高于AMF-E-。原因可能是试验过程中添加的P累积达一定水平,抑制了禾草内生真菌的作用,但这种抑制效应可通过P水平增加得到补偿或抵消,因而P30水平下表现出的生长优势是P含量增加的结果,而非禾草内生真菌的直接作用。禾草内生真菌与AMF互作时,生物量降低,植物在资源分配上存在权衡,AMF与禾草内生真菌均需从宿主植物获得光合产物,二者相互竞争,互相制约[29-30]。
低P水平能够诱导根系分泌更多ACP,增加非菌根化根系的ACP活性[31]。针对植物体内ACP与P效率的关系,一些学者认为P效率高的植物体内ACP活性较高,表征P元素的再利用能力较强[32]。但也有研究表明ACP是植物在低P胁迫下的被动适应性反应,受胁迫程度高则相应体内ACP活性较高[33]。如Nanamori等[34]对牧草和水稻(Oryzasativa)的研究表明,叶片ACP能够被低P胁迫诱导且与P利用效率显著相关,这与本研究叶片ACP活性的变化相似。然而,Yan等[35]发现低P条件下不同植物叶片的ACP活性与含P状况并无显著相关性,叶片ACP活性与植物体内P的净活化也无显著相关性。原因可能是ACP活性易受供试植物种类、P处理时间或测定条件等的影响,其复杂性导致不同研究者可能得出相互矛盾的结果[36]。因植物只分泌ACP,故ALP活性的增加主要归功于AMF[37]。
AMF的根外菌丝在细胞内外都可产生磷酸酶,细胞外的磷酸酶可增强宿主植物获取P的能力[38]。因此,AMF侵染植物后可以刺激磷酸酶的分泌以及活性的增强,进而改善P营养[39]。Hegeman和Grabau[40]在拟南芥(Arabidopsisthaliana)、番茄(Solanumlycopersicum)等草本植物上分离、鉴定了一些酸性磷酸酶基因,这些基因在低P胁迫下被诱导表达,从而增强磷酸酶的活性[41]。然而,到目前为止,尚缺乏直接证据证实AMF能够调控磷酸酶基因的表达。本试验不同P水平下接种AMF并未显著增加叶片和根系ACP活性,但以P20和P30而非低P诱导下的磷酸酶活性最高,这与全P含量的结果一致,AMF是否通过直接影响植物P营养的吸收促进宿主生长来间接调控磷酸酶的活性,其中的生理生化及其分子机制有待进一步研究。
Sánchez-Blanco等[42]发现AMF增加了迷迭香(Rosmarinusofficinalis)叶片的净光合速率和气孔导度。Wang和郑舜怡等的研究也证实AMF能显著提高生姜(Zingiberofficinace)和辣椒(Capsicumannuum)植株叶片的净光合速率、蒸腾速率和气孔导度[43-44],这与本试验的结果相似。菌根结构的形成扩大了根系的吸收面积,调节气孔开关,使之利于菌根植物的气体交换,并加强了水分与养分的吸收运输,从而加强了光合作用[45]。但因AMF的生长、繁殖需依赖于宿主植物提供的碳水化合物,减少了宿主植物光合产物的积累。加之AMF对宿主生长的影响,使得菌根植物的净光合速率、蒸腾速率、气孔导度等光合特性较非菌根植物复杂,具体机理还有待开展进一步的研究。
随P浓度增加,AMF侵染率先增加后降低,不同供P水平能够促进或抑制AMF的侵染及菌根的形成[46-47],含P量低时菌根的有益效应更显著[48]。P10水平AMF+E-的侵染率较其它浓度高5.56%~14.86%,冯海燕、Chen等[49-50]的研究认为低P条件下AMF侵染率高,高P则抑制菌根的生长和代谢,这与本文的结果一致。禾草内生真菌的存在不同程度抑制了AMF的侵染,降低多年生黑麦草根系的菌根侵染率[15-16]。本研究不同P水平下E-植株的侵染率比E+植株高15.85%~20.03%,原因可能是禾草内生真菌通过种子优先进行垂直传播[51],而AMF只能以侵染植物根系的方式进入宿主,所需侵染时间更长[30]。存在于禾草地上部分的内生真菌较AMF具有空间优势,可优先获得光合碳水化合物,留给可供AMF消耗的光合产物减少,抑制AMF的侵染[52]。此外,禾草内生真菌能够增加植物根系表面积,改变根系形态和构型[53],加强宿主植物对P的吸收和贮存[54],AMF有益作用降低[55],从而间接影响其侵染。
4 结论
随P水平增加,多年生黑麦草的生物量和养分含量先增加后降低,P20最高。供P水平对AMF与禾草内生真菌的效应及互作关系产生重要影响,P10水平下AMF侵染率最高,E+植株在P10~P20水平下生长速率更快,根部累积的P元素也更多,利于植物生长。禾草内生真菌与AMF间存在交互效应,抑制其侵染。

