探讨PD-1和PD-L1蛋白在胃癌组织中的表达及其临床意义
侍孝红
南京鼓楼医院集团宿迁市人民医院病理科,江苏宿迁 223800
胃癌属于消化系统恶性肿瘤,大部分患者就诊时已发展为中晚期,整体生活质量差且生存时间较短,死亡率占癌症死亡的第四位。胃癌的致癌作用为一个复杂的过程,有致癌基因的激活、抑癌基本的失活等多步骤、多基因参与[1-2]。免疫逃逸在肿瘤的发生与进展过程中起到重要作用,肿瘤抗原特异性T细胞的无反应性和诱导凋亡为其主要机制。PD-1和PD-L1蛋白是机体免疫系统中的抑制性通路,其对调节生理性免疫应答的幅度、持续时间以及维持免疫耐受发挥重要作用,效防止免疫应答破坏、损伤正常组织[3-4]。该研究选择2014年6月—2018年8月在该院行胃癌根治术的胃癌患者的石蜡标本66例与肿瘤组织>5 cm的癌旁组织60例,旨在分析PD-1和PD-L1蛋白在胃癌组织中的表达及其临床意义。具体信息如下。
1 资料与方法
1.1 一般资料
选择在该院行胃癌根治术的胃癌患者的石蜡标本66例为观察组,并随机选取肿瘤组织>5 cm的癌旁组织60例为对照组。66例患者中男49例,女17例;年龄25~84岁;平均年龄(58.67±2.34)岁。入组患者或家属均签署知情同意书。该研究经医院伦理委员会审核批准。
1.2 方法
对PD-1和PD-L1蛋白表达采用免疫组织化学PV-6000二步法进行检测,严格参照试剂盒说明书实施操作。将标本蜡块连续切为4 μm厚度的切片,脱蜡、水化后,加入3%过氧化氢溶液,室温下作用10 min。磷酸盐缓冲液(PBS)冲洗5 min,共3遍。完成后,将柠檬酸盐缓冲液(pH 6.0)置入,加热 20 min(微波炉),修复抗原,冷却至室温温度。PBS液冲洗5 min,共3遍。将兔抗人PD-L1多克隆抗体(1:200 稀释鼠)与鼠抗人 PD-1 单克隆抗体(1:200稀释)滴入,4℃孵育过夜。PBS液冲洗5 min,共3遍。分别将50 μL二抗滴加在每张切片上,室温下孵育20 min。PBS液冲洗5 min,共3遍。在每张切片上滴加100 μL DAB显色剂(新鲜配置),闭光显色于室温下。光学显微镜下控制显色时间,5 min后使用蒸馏水将切片冲洗干净,使显色终止。加苏木精复染1 min,自来水冲洗返蓝,经梯度乙醇对切片脱水,完成后行10 min二甲苯透明,中性树胶封固。

表1 PD-1和PD-L1在胃癌组织中的表达比较[n(%)]
1.3 结果判定
PD-1和PD-L1以细胞质或细胞膜有黄-棕褐色颗粒出现为阳性显色。PD-L1表达使用染色强度、半定量积分法结合阳性细胞百分比评估。对切片整个视野在低倍镜下观察,在肿瘤细胞、间质上各选择5个×400高倍视野。染色强度分级:无着色为0分,淡黄色着色为1分,棕黄色着色为2分,棕褐色着色为3分。阳性细胞密度分级:阳性细胞数≤10%为1分,10%~50%为2分,>50%为3分。阳性细胞密度与染色强度得分相乘即为阳性表达结果。肿瘤细胞、间一项结果为阳性,则该样本为阳性表达。D-1阳性结果以细胞计数法实时评估。对切片整个视野在低倍镜下观察,对淋巴细胞密度较高位置进行查找,随机选择5个高倍视野(×400),各计数100个淋巴细胞中PD-1阳性细胞数,PD-1阳性细胞数取均值。以阈值为PD-1阳性细胞数,细胞数高于阈值为阳性表达,反之,则为阴性表达。
1.4 观察指标
比较PD-1和PD-L1在胃癌组织与癌旁组织中的表达情况。分析胃癌组织中PD-1和PD-L1表达与临床病理因素的关系,其包括性别、年龄、肿瘤直径、分化程度、浸润层面、脉管癌栓、淋巴结转移、pTNM分期等。
1.5 统计方法
使用SPSS 21.0统计学软件分析数据,以[n(%)]表示计数资料,χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 PD-1和PD-L1表达情况
PD-L1蛋白在胃癌组织中阳性表达率为66.67%(44/66),癌间质淋巴细胞与癌细胞上表达阳性率分别为33.33%(22/66)、65.15%(43/66)。 PD-1蛋白表达阳性肿瘤浸润淋巴细胞(TIL)数量为 0~50(14.91±4.51)个,阈值为14.91,阳性率为 40.91%(27/66)。观察组中 PD-1和 PD-L1在胃癌组织中阳性表达率明显高于对照组,差异有统计学意义(P<0.05)。 见表 1、图 1~9。

图1 胃癌组织中PD-L1阳性

图4 间质中PD-L1阳性

图5 间质中PD-L1阴性

图6 空白对照

图7 胃癌组织中PD-1阳性
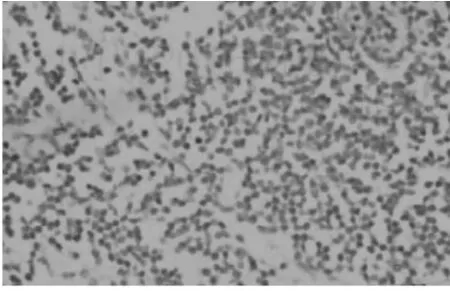
图8 胃癌组织中PD-1阴性
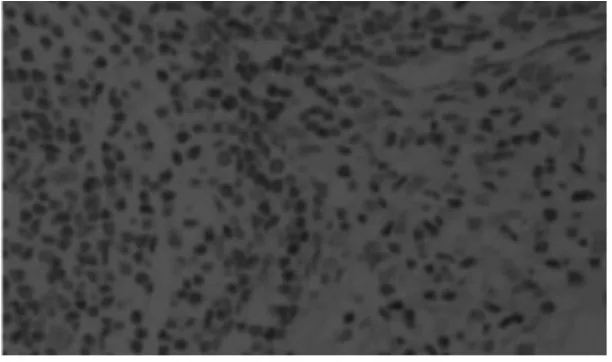
图9 空白对照
2.2 PD-1和PD-L1在胃癌组织中表达与临床病理因素关系
PD-L1在胃癌间质中表达与淋巴结转移有关;PD-L1在胃癌细胞中表达与pTNM分期、脉管癌栓、浸润层面、淋巴结转移有关(P<0.05);胃癌组织中PD-1表达与患者各临床病理因素无关(P>0.05)。 见表2。

表2 PD-1和PD-L1表达与胃癌患者临床病理因素的关系分析
3 讨论
PD-1/PD-L1免疫检查点传递抑制性信号,可对T细胞的活化起到抑制作用,而造成肿瘤免疫耐受,可诱导T细胞活化并将肿瘤细胞杀伤[5-6]。PD-1属于阶段抑制T细胞免疫检查点,可经多种基因使CD25+调节性T(Treg)细胞产生并维持,抑制效应性T细胞功能;可有效增强Treg细胞的活性,促进恶性肿瘤发展;致使PD-L1、2表达细胞的免疫耐受[7-9]。PD-L1属于Ⅰ型穿膜蛋白,其只有在细胞膜上表达才能发挥生物学活性,可激活致癌基因和改变IFN-γ表达以达到其生物效应。PD-L1在癌细胞中表达上升可起到促使浸润、转移的作用,避免CD8+T细胞攻击肿瘤细胞,逃逸机体的免疫监视系统;可使T细胞的存活与增殖减少,对肿瘤恶化与进展起到促进作用[10-11]。PD-L1可经结合B细胞上PD-1,使信号分子Syk、Igα/β发生去磷酸化,传递免疫抑制信号,避免肿瘤受杀伤系统损害和免疫监视。
李毓飞等[12]研究显示,癌组织中PD-1、PD-L1阳性表达率分别为 46.67%(35/75)、37.33%(28/75), 癌旁组织中PD-1、PD-L1 阳性表达率分别为 25.33%(19/75)、10.67%(8/75)。该研究结果显示,观察组中PD-1和PD-L1阳性表达率分别为 66.67%(44/66)、40.91%(27/66), 对照组中无PD-1和PD-L1蛋白表达,这与上述研究结果一致,癌组织中PD-1、PD-L1表达明显高于癌旁组织。但两者阳性率存在明显差异,这可能与两者试剂克隆号不同、检查方式不同等有关。癌间质淋巴细胞PD-L1阳性率略高于癌细胞,可能与癌细胞PD-L1表达诱导周围淋巴细胞凋亡或抑制其浸润所致。癌间质中PD-L1表达与淋巴结转移有关;癌细胞中PD-L1表达与浸润层面、脉管癌栓、淋巴结转移、pTNM分期有关。提示PD-L1可经影响肿瘤微环境、调节免疫,促进肿瘤转移与浸润;肿瘤切除后PD-1和PD-L1仍有可能在残余淋巴结中表达,容易继续影响原发病灶周围微环境的抗肿瘤免疫,导致患者术后生存期缩短。PD-1与PD-L结合,经引起失活效应T细胞核T细胞凋亡,对抗肿瘤免疫起到抑制作用。PD-L1在肿瘤微环境中负向调节免疫反应与肿瘤细胞中的上调,说明阻断PD-1/PD-L信号通路,可能成为胃癌免疫治疗的新策略。
综上所述,PD-1和PD-L1蛋白在胃癌组织中表达显著升高,而PD-L1与患者临床病理特征关系密切,可将其作为胃癌治疗的新靶点。

