双台子河口文蛤碳、氮、磷收支的季节变化
张安国,王丽丽,袁 蕾,马恭博,张学辉,雷 帅,袁秀堂* (.国家海洋环境监测中心,辽宁 大连60;.河北省地矿局第四水文工程地质大队,河北 沧州 06000;.盘山县水产技术推广站,辽宁 盘锦 400)
双壳贝类在河口、浅海和深海等区域均有分布,但以沿岸海域为最重要栖息地,其种类多,数量大.双壳贝类具有较强的滤水能力,通过大量的滤水和摄食来摄取海水中的有机颗粒物质,加快其沉降速率,同时减少海水中的浮游生物量.双壳贝类还通过排泄过程将大量的营养盐排入水体中,对浮游植物生长具有重要意义;特别是无机形态的N()和P()的再循环,成为维持海洋初级生产力的重要营养盐来源[1-8].因此,滤食性双壳贝类通过生物沉积和呼吸排泄作用加快了C、N、P等生源要素在水层与底层间的流动和交换[4-5],在近海沿岸生态系统的物质循环中扮演着重要角色[9].
文蛤(Meretrix meretrix)属于滩涂埋栖性双壳贝类,是我国沿海滩涂重要的经济贝类之一.文蛤分布较广,主要栖息在河口潮间带以下和潮下带靠上的沙质或泥质滩涂[10].双台子河口位于我国渤海辽东湾顶部,滩涂面积约为6.7×104hm2,是我国北方滩涂经济贝类的主要栖息场所之一[11].因此,现场研究该河口滩涂优势种类和重要经济贝类——文蛤的C、N、P等生源要素的收支状况,对评价滩涂埋栖性贝类在河口生态系统物质循环中的作用具有重要意义.
目前,国内外关于双壳贝类生源要素收支的研究报道较少,仅见于我国山东烟台四十里湾栉孔扇贝(Chlamys farreri)[12]、浙江乐清湾和三门湾太平洋牡蛎(Crassostrea gigas)、僧帽牡蛎(Ostrea cucullata)、泥蚶(Tegillarca granosa)、缢蛏(Sinonovacula constricta)的C收支[13];辽宁双台子河口四角蛤蜊(Mactra veneriformis)[14]、庄河海域菲律宾蛤仔(Ruditapes philippinarum)[15]、山东荣成桑沟湾栉孔扇贝、太平洋牡蛎和虾夷扇贝(Patinopecten yesoensis)的C、N、P收支[16]、长江口缢蛏、光滑河蓝蛤C、N收支[17];日本东京湾四角蛤蜊的N收支[18]和荷兰Oosterschelde河口海域贻贝(Mytilus edulis)C、N、P收支[19-20].而关于文蛤的C、N、P收支研究较少,仅见在实验室条件下文蛤的C收支状况[21],未见基于现场条件的文蛤C、N、P收支及生长余力(SFG)的研究.课题组前期[11]在双台子河口海域现场测定了文蛤的主要生理生态学参数,为构建文蛤C、N、P等生源要素收支和估算其SFG提供了基础数据.本研究作为该文的延续,利用现场测定的生理生态学参数估算文蛤的SFG,并构建现场条件下C、N、P收支方程,进而对不同季节文蛤的C、N、P收支状况和SFG进行分析.本研究结果有助于从生源要素角度分析评价滩涂埋栖性贝类在河口生态系统的物质循环中所扮演的生态角色,也可为经济贝类的碳通量以及碳交易提供基础数据.
1 研究海域和研究方法
1.1 研究海域
选择我国渤海双台子河口的盘山海域为现场试验研究区域(图1).该海域的滩涂底质以泥沙质及泥质为主,海水中有机颗粒物含量丰富,是文蛤生长及繁殖的主要场所.试验地点位于双台子河口滩涂高潮线附近面积6hm2、水深1.5~2.0m的池塘中.该池塘通过潮水沟渠与河口海域相通,并根据当地潮汐规律定时纳入新鲜的海水,保证池塘中海水水质条件与自然海区水质条件基本一致.
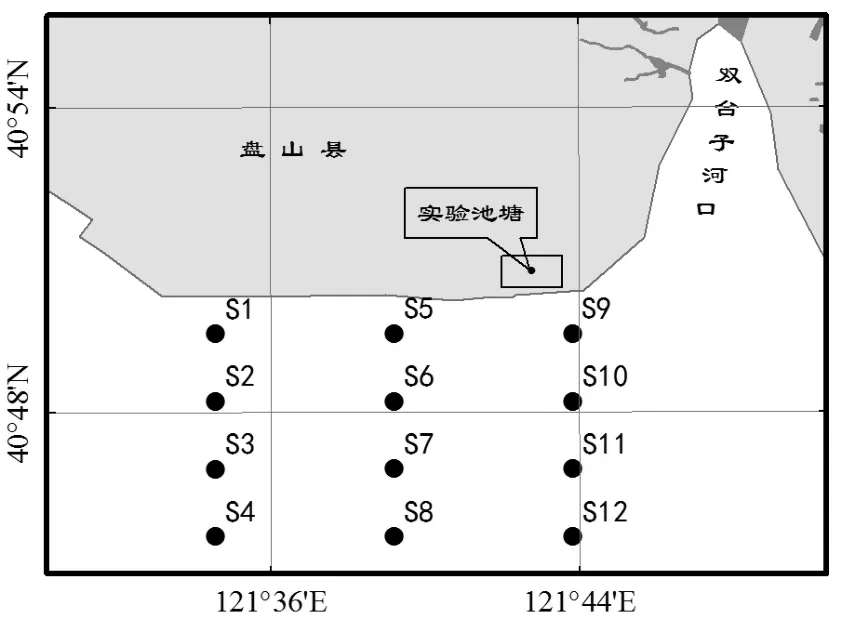
图1 双台子河口试验地点Fig.1 Experimental sites in Shuangtaizi estuary
1.2 文蛤主要生理生态参数和试验池塘环境参数测定
分别于2010年7月(夏季)、10月(秋季)、12月(冬季)及2011年4月(春季)进行文蛤主要生理生态学参数(生物沉积速率、耗氧率、排氨率和排磷率等)和试验池塘相关环境参数的测定.文蛤主要生理生态学参数和试验池塘环境参数的各季节具体数值见文献[11].
1.3 文蛤真粪与假粪比例的估算
研究表明,当海水中颗粒物浓度足够高时可引起贝类产生假粪.因此,为准确判断河口海域文蛤个体是否产生假粪,以及产生的假粪与真粪的比例,本试验参照四角蛤蜊真粪与假粪的测定方法[19](并略作改动)来现场测定二龄和三龄文蛤个体真粪与假粪的比例.具体试验方法如下:现场条件下将文蛤个体分别放入盛有试验池塘海水的塑料烧杯(体积为2L)中,并将塑料烧杯放置于试验池塘边缘,池塘海水不没过烧杯顶部为止,以保持试验温度与池塘海水温度(16℃)一致.试验共设13个塑料烧杯,其中10个放置文蛤,另3个不放文蛤作为对照,试验重复3次.经观察发现,文蛤的假粪一般呈颗粒团状,出现在进水管一端;真粪呈线状,在出水管一端.24h后分别收集文蛤的真粪及假粪,将粪便(真粪和假粪)分别虹吸过滤至事先于450℃下灼烧6h并称量的GF/F滤膜(直径47mm)上,-20℃冷冻保存待测.将试验样品带回实验室后将滤膜在65℃条件下烘干至恒重,用精密电子天平(精确到0.1mg)分别准确称量文蛤产生的真粪和假粪重量.试验时取试验池塘水样过滤,以测定水体的总悬浮颗粒物(TPM),即用上述经过处理的GF/F过滤膜两张分别过滤250~500mL水样,用蒸馏水脱盐并将滤膜在 65℃条件下干燥24h后,称量以测定试验池塘水中的TPM含量.
1.4 文蛤滤水率、摄食率的估算
根据生物沉积法的原理进行文蛤生理生态学参数的测定:

式中:IFR为文蛤对无机物的过滤速率,Rb为文蛤的生物沉积速率.
文蛤的滤水率(CR):
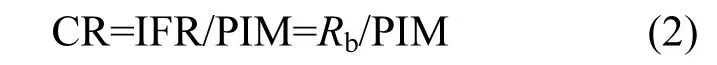
式中:PIM为文蛤所过滤海水中颗粒无机物浓度.Rb的测定方法及结果均引自文献[11].
文蛤的总滤食速率(FR):

式中:TPM为文蛤所过滤海水中的总颗粒物浓度.
当海水中颗粒物浓度足够高以引起贝类假粪的产生时,则文蛤的摄食率(IR):

式中:RR为文蛤对所过滤的食物拒绝摄食的速率,即文蛤假粪的排出速率.因此,当颗粒物浓度很低并不足以引起假粪的产生时,则摄食率IR=FR.
当文蛤产生假粪时,文蛤假粪的排出速率:
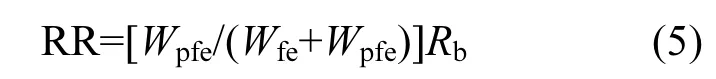
摄食率:

式中:Wfe为文蛤产生的真粪重量,g;Wpfe为文蛤产生的假粪重量,g.
文蛤对颗粒有机物质C、N、P的摄食率(RI)计算公式如下:
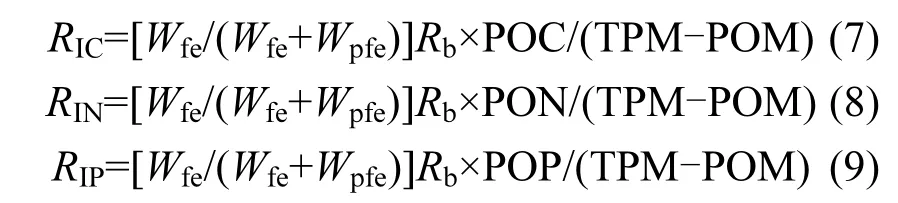
式中:TPM为试验海域水体的总悬浮颗粒物含量,mg/L;POM为颗粒有机质含量,mg/L;POC为颗粒有机碳含量,mg/L;PON为颗粒有机氮含量,mg/L;POP为颗粒有机磷含量,μg/L.
1.5 文蛤C、N、P排遗率的估算
文蛤对颗粒有机物质C、N、P的(排遗率)生物沉积速率:
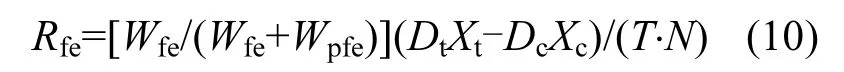
式中:Dt为文蛤捕集器中沉积物的质量,g;Dc为对照组捕集器中沉积物的质量,g;Xt为文蛤捕集器所收集沉积物的C、N、P的百分含量;Xc为对照捕集器所收集沉积物中C、N、P的百分含量;T为时间,d;N为试验用文蛤个数.
1.6 文蛤C、N、P排泄速率的估算
文蛤耗氧率(Ro)、排氨率和排磷率的测定方法及结果均引自文献[11].根据1μmol O2=0.85μmol CO2,碳排泄速率:
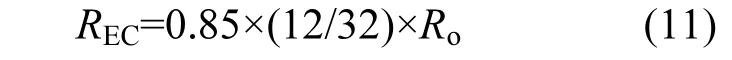
将排氨率和排磷率分别转化为氮排泄速率(RN)和磷排泄速率(RP).
1.7 文蛤C、N、P收支模型
将上述相关参数转换成文蛤C、N、P元素收支模型[19]:
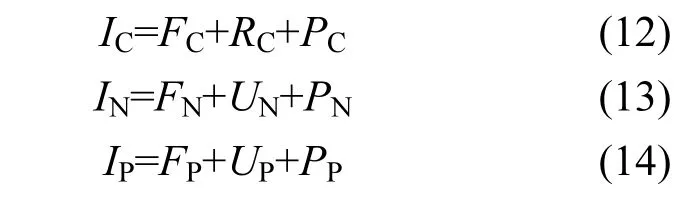
式中:IC为文蛤摄取的有机碳量;FC为文蛤通过粪便排出的碳量;RC为文蛤呼吸代谢消耗的碳量;PC为文蛤用于生长的碳量;IN为文蛤摄取的有机氮量;FN为文蛤通过粪便排出的氮量;UN为文蛤排泄消耗的氮量;PN为文蛤用于生长的氮量;IP为文蛤摄取的有机磷量;FP为文蛤通过粪便排出的磷量;UP为文蛤排泄消耗的磷量;PP为文蛤用于生长的磷量.
1.8 文蛤C、N、P 的SFG及生长效率的估算
在测定文蛤对C、N、P的摄食、排粪、排泄和吸收的基础上对这3种元素的SFG和总生长效率及净生长效率进行计算.
本试验中,文蛤对C、N、P的生长余力分别为:
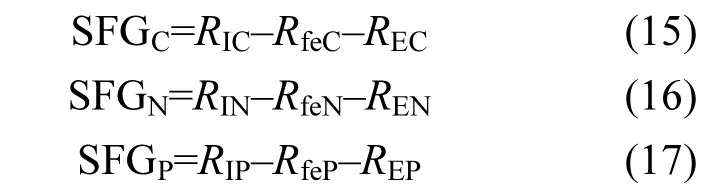
式中:RfeC、RfeN、RfeP分别为文蛤粪便C、N、P排出速率(mg/ind·d),REC、REN、REN分别为文蛤C、N、P排泄速率(mg/ind·d).
参照文献[13,15]分别计算文蛤对C、N、P生源要素的总生长效率(K1)和净生长效率(K2).
1.9 数据标准化和统计分析
应用SPSS19.0软件包对实验数据进行单因素(季节)方差分析,并结合Duncan法进行多重比较.同时利用SPSS19.0软件对文蛤生理生态学参数与水温等环境因子进行Pearson相关分析,并以P=0.05作为差异显著的标准.
2 结果与分析
2.1 文蛤真粪与假粪比例
文蛤真粪和假粪的实验结果分析可知,二龄和三龄文蛤个体在温度为16℃、TPM 为48.5mg/L的条件下产生的真粪所占比例分别为86%和100%.
2.2 文蛤的CR和IR
由表1可以看出,双台子河口文蛤的CR和IR均呈显著的季节性变化(P<0.05),夏季最高,冬季最低.文蛤对C、N、P生源要素的摄食速率表现为RIC>RIN>RIP.相关分析结果显示,文蛤的CR和IR均与海水温度呈显著的相关关系,文蛤的CR与TPM无显著相关性,而摄食率则与TPM呈极显著关系(表2).文蛤的RIC与海水温度及POC浓度呈极显著的正相关关系,而与TPM含量无显著相关性.文蛤的RIN与海水温度及PON含量呈极显著相关性,与TPM含量呈显著相关关系.文蛤的RIP与海水中TPM及POP含量均呈极显著的相关关系,而与海水温度无显著相关性.
2.3 文蛤的RE和Rfe
如表1所示,文蛤的RE和Rfe均呈现明显的季节性变化(P<0.05).文蛤的REC(除夏季外)、REN、REP均低于其RfeC、RfeN、RfeP.相关性分析结果显示,文蛤的REC和RfeC均与海水温度呈显著的相关关系,与TPM均无显著相关性,REC与POC也具有显著相关性,而RfeC与POC无显著相关性(见表2).文蛤的REN与海水温度、TPM及PON均呈显著相关性,RfeN则仅与海水温度有显著的相关关系,而与TPM和PON均无显著相关性.文蛤的REP与海水温度和TPM呈极显著的相关关系,与POP无显著相关性;RfeP则与海水温度、TPM和POP含量均无显著相关关系.
2.4 文蛤对摄取C、N、P的分配
由图2可见,文蛤在春季及秋季时的碳收支顺序依次为粪便碳>呼吸碳>生长碳,在夏季时为生长碳>呼吸碳>粪便碳,冬季时为生长碳>粪便碳>呼吸碳.呼吸碳及粪便碳的分配比例均在春季达到最高值,生长碳所占比例则在夏季最高,在春季最低,且为负值.文蛤摄取氮元素用于生理过程的各组分比例依次为生长氮>粪便氮>排泄氮,其中文蛤用于生长的氮所占比例最高(65%),并在春季及夏季时较高,在春季时达到最高值,两季节间差异不显著;在秋季时较低,在冬季时达到最低值,且秋冬季两者间差异不显著.通过粪便形式排出的氮量占摄食氮的比例较高(33%),并且季节间差异显著,在冬季时达到最高值,在春季时达到最低值.用于排泄消耗的氮量占摄食氮的比例较低(2%),在夏季时达到最高,秋季次之,春季较低,冬季最低,且春季和冬季间差异不显著.文蛤摄食磷量用于生理过程的各组分比例在各季节中(除冬季外)依次为生长磷>粪便磷>排泄磷,其中生长磷所占比例超过50%,在春季达到最高值,夏季时最低,但与秋季和冬季间差异不显著,文蛤通过粪便排出的磷所占比例在秋季时最高,在春季时最低,用于排泄消耗的磷所占摄食磷的比例在夏季最高,冬季最低,且季节间变化显著.
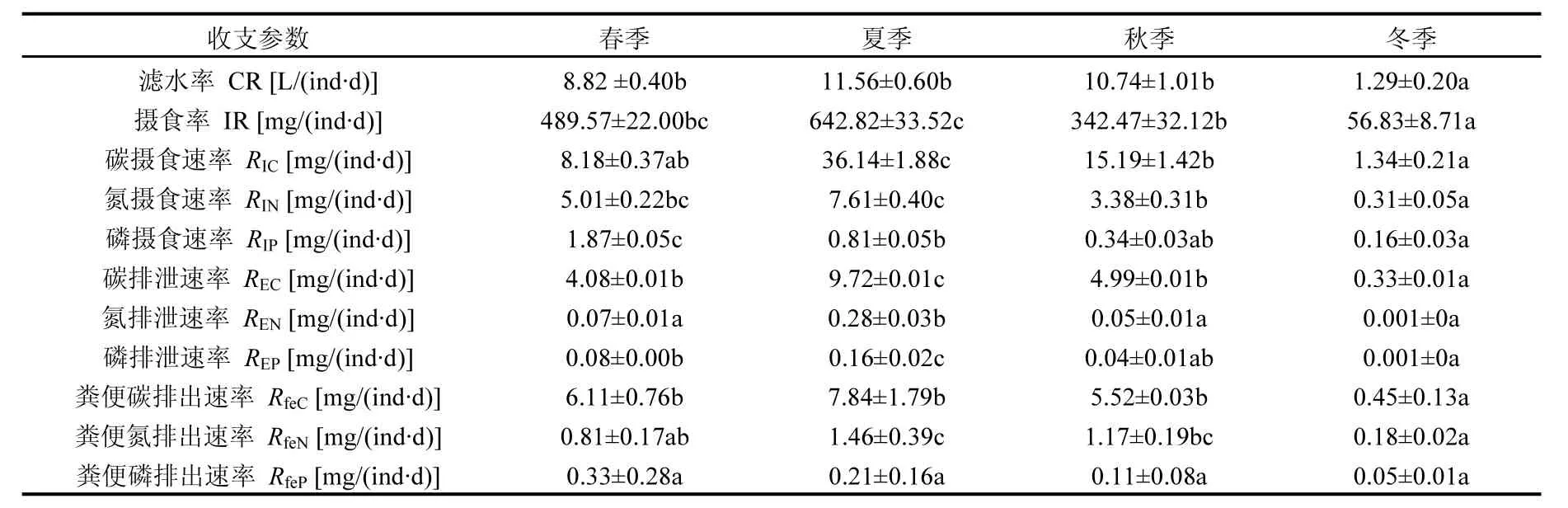
表1 文蛤CR、IR、C、N、P收支参数的季节变化Table 1 Clearance rate, ingestion rate, carbon, nitrogen, and phosphorus parameters of Meretrix meretrix in different seasons (mean±SE)

表2 文蛤生理生态学参数与环境因子的相关系数Table 2 Correlation coefficients between physio-ecological parameters of Meretrix meretrix and environmental variables
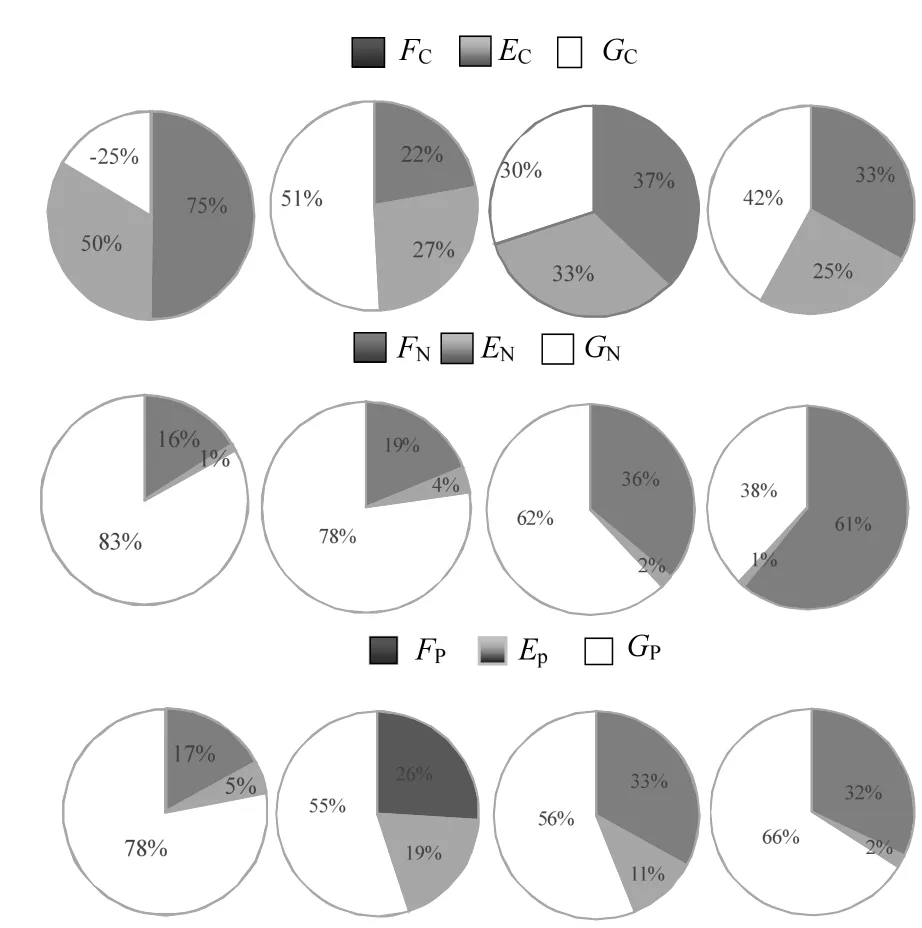
图2 文蛤摄取的C、N、P元素在各生理生态过程中配给比例的季节变化Fig.2 Carbon, nitrogen, and phosphorus allocation into different physio-ecological process of Meretrix meretrix
2.5 文蛤的SFGC、SFGN、SFGP
由图3可见,文蛤的SFGC呈现明显的季节变化,春季时最低,且为负值[-2.11mg C/(ind·d)],夏季时达到最高[18.59mg C/(ind⋅d)],秋季及冬季时均较低,分别为4.69和0.56mg C/(ind·d).相关性分析结果显示(表2),文蛤的SFGC与海水温度和POC含量呈极显著的相关关系,与TPM无显著相关性.
文蛤的SFGN在春季和夏季时较高,分别为4.13 和5.87mg N/(ind·d),且两季节间差异不显著,秋季时较低,冬季时达到最低值,仅为0.13mg N/(ind·d).相关性分析结果显示(表2),文蛤的SFGN与海水温度、TPM及PON含量均呈极显著的相关关系.
文蛤的SFGP呈现明显的季节变化特征(见图3),春季时达到峰值1.45mg P/(ind·d),冬季最低,仅为0.11mg P/(ind·d),夏季及秋季时均较低,分别为0.46 和0.20mg P/(ind·d),且夏季、秋季及冬季间差异不显著.相关性分析结果表明(表2),文蛤的SFGP与TPM及POP呈显著相关性,而与海水温度相关性不显著.
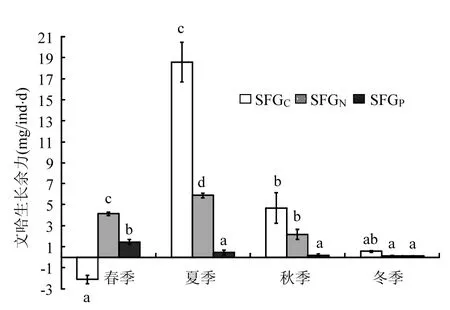
图3 文蛤C、N、P元素生长余力的季节变化Fig.3 Seasonal variations of carbon, nitrogen, and phosphorus scope for growth (SFG) of Meretrix meretrix
2.6 文蛤的KC、KN、KP
文蛤的KC1和KC2呈现明显的季节性(图4),即均在夏季达到最高值,春季达到最低值,且为负值.相关分析结果显示(表2),文蛤的KC1和KC2与海水中POC浓度均呈显著的相关关系,与海水温度和TPM浓度均无显著相关性.
由图4可知,文蛤的KN1季节变化显著,在春季时达到最高,夏季时较高,且两季节间差异不显著,秋季较低,冬季时最低,且秋冬季节间差异不显著.文蛤的KN2均较高,且季节间变化不显著.相关分析结果显示(见表2),文蛤的KN1与海水温度、TPM和PON浓度均呈显著相关性,而KN2与海水温度、TPM和PON浓度均无显著相关性.
如图4所示,文蛤的KP1也呈现明显的季节变化,即文蛤的KP1在春季时最高(78%),夏季时最低(55%),但与秋季及冬季间差异不显著.文蛤的KP2在春季最高,夏季最低.文蛤的KP1、KP2均与POP浓度呈显著的正相关关系;均与TPM浓度无显著相关性;KP2与海水温度呈极显著的负相关关系,而KP1则与温度关系不显著.
实验结果表明,文蛤的KC2、KN2、KP2年均值分别为13%、97%及85%.即基本表现为KN2>KP2>KC2.
图4 文蛤对C、N、P元素总生长效率及净生长效率的季节变化Fig.4 Seasonal variations of total growth efficiency and net growth efficiency of Meretrix meretrix
3 讨论
3.1 文蛤CR及IR的季节变化
研究表明,双壳贝类CR和IR主要受温度等环境因子的影响,在适宜的温度范围内,其CR和IR随温度升高而上升,但超出适宜温度范围时则出现下降[22-26].本研究结果表明,文蛤生长的适宜水温为5.5~32℃,最适水温为15~27℃[27].在本研究中,春季、夏季及秋季时海水温度分别为12、17和28℃,因此实验文蛤处于较适宜的生活环境中,而水温的升高使得海水粘滞性变小且水中生物饵料量也更加丰富,促使摄食生理活动处于较高水平,从而表现出较高的CR和IR,并在夏季达到最高值.冬季时,由于海水温度降至最低值,且水温超出了文蛤的适温范围,从而导致文蛤的滤水和摄食能力减弱.这与其他学者的研究结果基本一致[21,28-29].
3.2 文蛤的SFGC、SFGN、SFGP
研究发现,贝类的SFG作为其体内能量供需机制可以反映出环境因子和生理活动对其生长的瞬间影响,同时周年实验结果也证明生长余力和实际测量的生长状况相一致[19].通过表3可以看出,菲律宾蛤仔个体的SFGC、SFGN、SFGP均高于文蛤和四角蛤蜊.本文推测造成贝类不同种类间特定SFG的差异一方面可能是由于实验海区环境条件不同造成的.资料表明[11,14-15],菲律宾蛤仔实验个体所在的庄河海域与文蛤和四角蛤蜊实验个体所在的双台子河口海域环境条件差异比较明显,两者的温度年均值分别为11.5和14.2℃, 盐度分别为31.3和20.5,TPM含量分别为14.3和46.8mg/L.因此,实验海域的环境条件差异,从而造成菲律宾蛤仔的生长余力高于文蛤和四角蛤蜊.另一方面,不同种类间特定生长余力的差异可能是由于实验贝类种类不同.由于实验贝类文蛤和四角蛤蜊均处于双台子河口海域,所处环境条件基本一致,但是文蛤和四角蛤蜊个体规格不同(文蛤壳高平均为41.48mm,软体干重为1.02g;四角蛤蜊壳高平均为28.74mm,软体干重为0.29g).因此,实验个体不同造成了两者SFG的差异.
SFG反映了贝类获取和利用能量物质的一种平衡,其受贝类的个体大小、繁殖时期、水温以及饵料条件等因素的影响[12,26,30-32].研究发现,栉孔扇贝和长牡蛎的SFGC在夏季时出现负值主要与低饵料浓度有关[12,16,30],这可能与夏季桑沟湾温度偏高(26.7℃)、饵料浓度偏低(5.34mg/L)有关,海水温度超过了贝类适宜的生长温度,其自身生理代谢活动降低[16].菲律宾蛤仔的SFG随饵料浓度的增加而显著增加[31];四角蛤蜊的SFGC与POC浓度呈显著的相关关系[14].本研究结果显示,双台子河口文蛤的SFGC也与该海域水体中的POC呈显著的正相关关系.这说明饵料浓度是影响该河口海域文蛤生长的重要因子之一.文蛤的SFGC在春季时为负值,这种现象主要与该季节海水中POC含量较低有关.如前所述,在春季时,文蛤处于比较适宜的生活环境,但海水中POC含量较低,导致文蛤对有机碳源的摄食率较低,而此时呼吸速率却随着温度升高而迅速增加,即要消耗较大部分的碳量来维持自身的代谢,进而导致SFGC在春季时出现负值.本研究结果显示,文蛤的SFGC和SFGN均与海水温度有显著的相关关系.通过上述分析可以看出,在温度适宜的季节(如春季)时,海区中饵料浓度可能是影响文蛤生长的主要因子;在饵料充足季节(如夏季)时,温度的变化会对文蛤的生长产生较大的影响.总之,在河口海域中文蛤的生长主要受到温度及饵料浓度共同作用的影响.另外,尽管双台子河口海域文蛤的碳生长在春季出现负值,但对整个双台子河口海域而言,文蛤在春季属于碳源,并且从周年平均水平上来说,碳的生长能为正,属于元素的汇,通过文蛤等滤水性贝类的摄食代谢等生理活动,贝类完成了碳源向碳汇转换的过程.
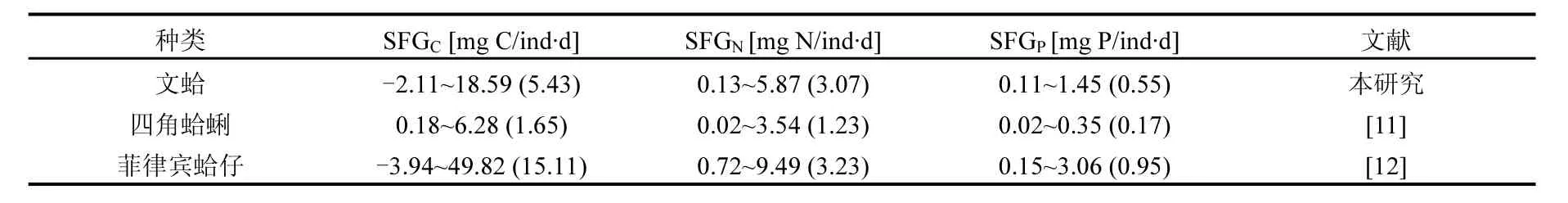
表3 文蛤与其他贝类生长余力比较Table 3 Comparison of scope for growth of Meretrix meretrix and other bivalves
3.3 文蛤的C、N、P生长效率
研究表明,生长效率也常被用来描述贝类生长状况,但由于测定条件的差异,变化范围较大.双壳贝类的K1变化范围为2%~54%, K2变化范围为3%~86%[12-13,19,30],本研究中文蛤的K1和K2大多数数值也处于这一范围内.Smaal等[19]指出贻贝的KC2在秋季及冬季出现负值,主要是由于该季节饵料缺乏造成的.与上述结果类似,在本研究中文蛤的KC1和KC2在春季时出现负值,也是由于该季节海水中POC含量较低,造成对C元素的摄食率较低,其摄取的有机碳源绝大部分通过自身的呼吸作用被消耗掉,从而导致用于生长的碳量为负值.冬季时双台子河口海域海水温度降至最低,文蛤生理代谢活动缓慢,文蛤对C元素的摄食速率也较低,但碳呼吸消耗速率和粪便碳排出速率均降至全年最低值,因此,摄取的碳量仍有部分用于自身的生长.
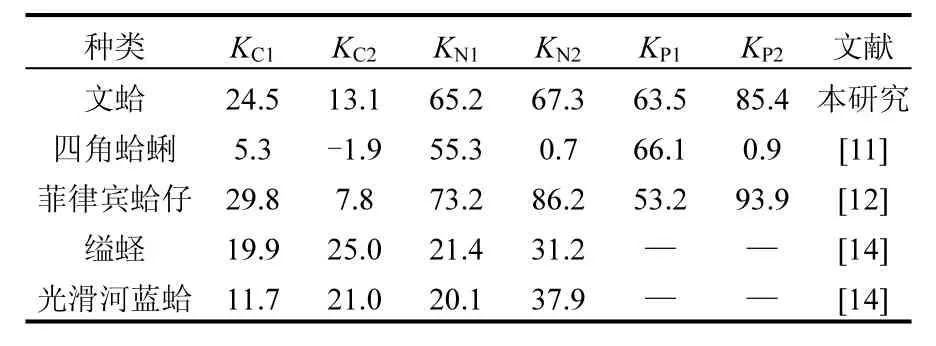
表4 文蛤与其他贝类生长效率比较Table 4 Comparison of growth efficiency of Meretrix meretrix and other bivalves
贝类的净生长效率越高,则表明其摄取的物质中大部分用于自身的生长和繁殖,仅有少部分用于维持代谢[19].本研究发现,文蛤的KC2年均值最低,为13%,而KN2、KP2年均值则很高,分别为97%和85%.即基本表现为KN2>KP2>KC2,这与贻贝[19-20]、栉孔扇贝[30]、四角蛤蜊[14,18]、缢蛏和光滑河蓝蛤[17]等双壳贝类基本一致(表4),说明文蛤等滤食性贝类更趋向于对N、P元素的富集,即与C元素相比,摄取的氮量和磷量大部分用于其自身生长和繁殖.
3.4 文蛤生理生态过程对河口生态系统的影响
滤食性贝类是C、N、P主要生源要素循环的重要媒介之一,在海洋生态系统的物质循环中发挥着重要作用.例如,在菲律宾蛤仔养殖区,生产6000t的蛤仔,可从水体中分别摄取约137t颗粒氮及19t颗粒磷,约91t的总溶解氮及12t的总溶解磷重新进入生态系统循环中,且有16t的氮及0.9t的磷通过收获的方式直接从养殖生态系统物质循环中输出[33].四角蛤蜊每年从双台子河口海水中转移约6710.3、7422.2、1378.4t的POC、PON和POP[14].作者调查发现,2016年双台子河口海域滩涂文蛤的分布密度约为2.3个/m2,其中二龄以上的文蛤个体所占比例为81%,即1.9个/m2.根据上述相关参数,本研究估算出每年每公顷双台子河口海域文蛤可过滤海水56.2t,颗粒有机物摄食量达2656.9kg,摄取的C、N、P总量分别为105.5、28.3和5.5kg,形成可移出的碳汇为37.7kg,同时用于生长的N、P总量分别为21.3和3.8kg.通过分析可以看出,文蛤等滤食性贝类通过摄食水体中的单细胞藻类和颗粒有机物来满足自身的生长所需,摄食的能量主要通过呼吸作用和排泄代谢回到水体,部分通过粪便直接排除体外,作为生物沉积沉降到海底,沉降到海底的C、N、P元素部分通过生物再悬浮重回水体(图5).滤食性贝类增殖不仅增加经济效益,还可以有效地去除海水里的碳元素,并对河口海域的生态系统能量流动和物质循环产生较大影响.
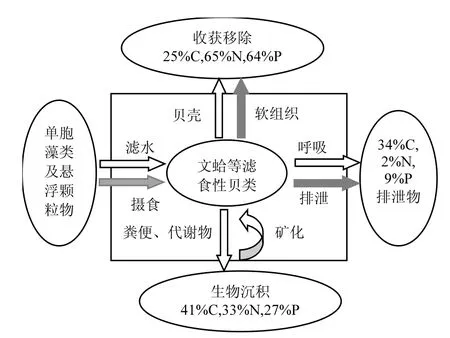
图5 双台子河口文蛤对C、N、P生源要素摄食和利用Fig.5 The ingestion and utilization of carbon, nitrogen,and phosphorus for Meretrix meretrix in Shuangtaizi estuary
4 结论
4.1 文蛤SFGC、SFGN、SFGP均呈现明显的季节变化,即在夏季最高;但SFGC在春季时最低,且为负值,SFGN及SFGP全年均为正值.
4.2 文蛤的C、N、P生长效率季节变化显著,且C、N、P净生长效率基本表现为KN2> KP2> KC2.
4.3 文蛤在春季及秋季时的C收支顺序依次为粪便碳>呼吸碳>生长碳,在夏季时为生长碳>呼吸碳>粪便碳,冬季时为生长碳>粪便碳>呼吸碳.文蛤N收支顺序为生长氮>粪便氮>排泄氮.文蛤P收支顺序为(除冬季外)依次为生长磷>粪便磷>排泄磷.
4.4 文蛤等滤食性贝类更趋向于对N、P元素的富集,即与C元素相比,摄取的氮量和磷量大部分用于其自身生长和繁殖.
4.5 文蛤资源增殖不仅增加经济效益,还可以有效地去除海水里的碳元素,并对河口海域的生态系统能量流动和物质循环产生较大影响.
[1] Cockcroft A C. Nitrogen excretion by the surf zone bivalvesDanax SerraandD. Sordulus[J]. Marine Ecology Progress Series,1990,60:57-65.
[2] 周 毅,杨红生,张福绥.海水双壳贝类的N、P排泄及其生态效应 [J]. 中国水产科学, 2003,10(2):165-168.
[3] 王晓宇,周 毅,杨红生.胶州湾菲律宾蛤仔(Ruditapes philippinarum)呼吸排泄作用的现场研究 [J]. 海洋与湖沼,2011,42(5):722-727.
[4] Prins T C, Smaal A C. The role of the blue musselMytilus edulisin the cycling of nutrients in the Oosterschelde estuary (The Netherlands) [J]. Hydrobiologia, 1994,282-283:413-429.
[5] Zhou Y, Yang H S, Zhang T, et al. Density-dependent effects on seston dynamics and rates of filtering and biodeposition of the suspension-cultured scallopChlamys farreriin a eutrophic bay(northern China): an experimental study in semi-in situ flowthrough systems [J]. Journal of Marine System, 2006,59:143-158.
[6] 臧家业,赵晨英,刘 军.乳山湾邻近海域有机碳的分布与底界面过程 [J]. 中国环境科学, 2017,37(3):1089-1102.
[7] 赵晨英,臧家业,刘 军,等.黄渤海氮磷营养盐的分布、收支与生态环境效应 [J]. 中国环境科学, 2016,36(7):2115-2127.
[8] 许春玲,李绪录,林 梵.深圳湾及邻近沿岸沉积物中碳、氮和磷的分布 [J]. 中国环境科学, 2017,37(7):2691-2698.
[9] 蒋 红,崔 毅,陈碧鹃,等.乳山湾菲律宾蛤仔可溶性氮、磷排泄及其与温度的关系 [J]. 中国水产科学, 2006,13(2):237-242.
[10] 王如才,王昭萍,张建中.海水贝类养殖学 [M]. 青岛:青岛海洋大学出版社, 1993:322-324.
[11] 张安国,袁秀堂,侯文久,等.文蛤的生物沉积和呼吸排泄过程及其在双台子河口水层-底栖系统中的耦合作用 [J]. 生态学报,2014,34(22):6573-6582.
[12] 周 毅,杨红生,张 涛,等.四十里湾栉孔扇贝的生长余力和C、N、P元素收支 [J]. 中国水产科学, 2002,9(2):161-166.
[13] 柴雪良,张炯明,方 军,等.乐清湾、三门湾主要滤食性养殖贝类碳收支的研究 [J]. 上海水产大学学报, 2006,15(1):52-58.
[14] Zhang A G, Yuan X T, Hou W J, et al. Carbon, nitrogen, and phosphorus budgets of the surf clamMactra veneriformis(Reeve)based on a field study in the Shuangtaizi Estuary, Bohai Sea of China [J]. Journal of Shellfish Research, 2013,32(2):275-284.
[15] 张升利,张安国,袁秀堂,等.底播增殖菲律宾蛤仔碳、氮、磷收支[J]. 应用生态学报, 2015,26(4):1244-1252.
[16] 牛亚丽.桑沟湾滤食性贝类碳、氮、磷、硅元素收支的季节变化研究 [D]. 舟山:浙江海洋学院, 2014.
[17] 吕昊泽.缢蛏、光滑河蓝蛤和河蚬对盐度的适应性及碳、氮收支研究 [D]. 上海:上海海洋大学, 2014.
[18] Hiwatari T, Kohata K, Iijima A. Nitrogen budget of the bivalveMactra veneriformis, and its significance in benthic-pelagic systems in the Sanbanse area of Tokyo bay [J]. Estuarine, Coastal and Shelf Science, 2002,55:299-308.
[19] Smaal A C, Vonck A P M A. Seasonal variation in C, N, and P budgets and tissue composition of the musselMytilus edulis[J].Marine Ecology Progress Series, 1997,153:167-179.
[20] Jansen H M, Strand Q, Verdegem M, et al. Accumulation, release and turnover of nutrients (C-N-P-Si) by the blue musselMytilus edulisunder oligotrophic conditions [J]. Journal of Experimental Marine Biology and Ecology, 2012,416-417:185-195.
[21] 范建勋.文蛤能量代谢的研究 [D]. 宁波:宁波大学, 2010.
[22] Kuang S, Fang J, Sun H, et al. Seasonal studies of filtration rate and absorption efficiency in the scallopChlamys farreri[J].Journal of Shellfish Research, 1997,16:39-45.
[23] 常亚青,王子臣.皱纹盘鲍的个体能量收支 [J]. 应用生态学报,1998,9(5):511-516.
[24] 董 波,薛钦昭,李 军.温度对菲律宾蛤仔滤食率、清滤率和吸收率的影响 [J]. 海洋水产研究, 2000,21(1):37-42.
[25] 栗志民,刘志刚,邓海东.温度和盐度对企鹅珍珠贝清滤率、滤食率、吸收率的影响 [J]. 水产学报, 2011,35(1):96-103.
[26] Guzma´n-Agu¨ero J E, Nieves-Soto M, Hurtado M A, et al.Feeding physiology and scope for growth of the oysterCrassostrea corteziensis(Hertlein, 1951) acclimated to different conditions of temperature and salinity [J]. Aquaculture International, 2013,21:283-297.
[27] 赫崇波,陈洪大.滩涂养殖文蛤生长和生态习性的初步研究 [J].水产科学, 1997,16(5):17-20.
[28] Tang B J, Liu B Z, Yang H S, et al. Oxygen consumption and ammonia-N excretion ofMeretrix meretrixin different temperature and salinity [J]. Chinese Journal of Oceanology and Limnology, 2005,23(4):469-474.
[29] 范建勋,林志华,肖国强,等.饥饿对3种不同规格文蛤耗氧率和排氨率的影响 [J]. 海洋科学, 2009,33(10):73-76.
[30] 周 毅,杨红生,张福绥.栉孔扇贝生理生态学特征的实验研究[J]. 应用生态学报, 2003,14(3):227-233.
[31] 董 波,李 军,王海燕,等.不同温度与饵料浓度下菲律宾蛤仔的能量收支 [J]. 中国水产科学, 2003,10(5):398-403.
[32] Helson J G, Gardner J P A. Variation in scope for growth: a test of food limitation among intertidal mussels [J]. Hydrobiologia,2007,586:373-392.
[33] Nizzoli D, Bartoli M, Viaroli P. Nitrogen and phosphorous budgets during a farming cycle of the Manila clamRuditapes philippinarum: Anin situexperiment [J]. Aquaculture, 2006,261:98-108.

