脊髓背角胶质细胞及p38 MAPK参与介导髓核致炎大鼠神经根痛*
王益敏 易增兴 林世清 张嘉明 蔡 哲 贺秋兰 魏 明 孙来保△ 邹学农
(1惠州市中大惠亚医院麻醉科,惠州516081;2宜春学院 江西省天然药物活性成分研究重点实验室,宜春336000;3中山大学附属第一医院麻醉科,广州 510080;4中山大学附属第一医院骨科学研究所,广州 510700)
持续或复发时间超过3~6个月的疼痛称为慢性疼痛,与一般伤害不同,它失去了生理性疼痛感受的警示作用[1]。腰腿痛是非常常见的慢性疼痛,发病率大约在20%~30%,且具有年轻化趋势,严重影响着人们的工作和生活,造成了沉重的社会负担,而造成腰腿痛最主要的病因是腰椎间盘突出症(lumbar intervertebral disc herniation, LDH),治疗LDH诱发的慢性腰腿痛是当前急需解决的问题。以往认为突出的髓核压迫神经根是LDH引发腰腿痛的主要原因,现在更多观点指出,它是因为突出髓核诱发炎症反应导致疼痛外周和中枢敏感化。本课题组前期研究表明,背根神经节内NOS,COX-2,3型酸敏感性离子通道及CGRP受体1等参与了外周敏化的调节机制[2]。胶质细胞是中枢神经系统内的重要支持细胞,但其致炎效应与中枢敏化的内在联系,以及它在诱发炎症性疼痛中发挥的作用,有待于进一步研究。本实验旨在探索脊髓背角胶质细胞及其相关炎症因子参与诱导髓核致炎大鼠神经根痛,为临床治疗腰椎间盘突出导致的慢性腰腿痛提供理论依据。
方 法
1.实验动物
SPF级雄性成年SD大鼠150只,体重220~250 g,由广东省医学实验动物中心提供,许可证号:SCXK(粤)2013-0002。分笼饲养,室温 (20±2)℃ , 维持大鼠12/12昼夜交替(每天8:00~20:00光照)。本实验严格遵守中山大学动物保护和使用的规定。
2.主要试剂及仪器
兔抗鼠p38 MAPK一抗(AF6456)、兔抗鼠p-p38 MAPK一抗(Thr180)购自美国Af fi nity公司;兔抗鼠小胶质细胞一抗OX-42 (Ab1211)购自美国abcam公司,兔抗鼠星型胶质细胞一抗GFAP (3670P)购自美国Cell Signaling公司,兔抗鼠神经元细胞一抗NeuN (NBP1-92693)购自美国NOVUS公司;HRP标记山羊抗兔(GB23303)、FITC山羊抗小鼠荧光二抗(GB22301)、EDTA (PH 9.0)抗原修复液(G1203)购自武汉谷歌生物科技有限公司;SB203580购自广州天骏生物技术有限公司;二甲亚砜(DMSO)购自美国Sigma公司;倒置荧光显微镜(Eclipse Ti-SR)购自日本尼康公司,von Frey纤毛仪购自美国Stoelting公司。
3. 动物模型建立、分组及处理
(1)动物模型建立:参照文献[3]建立动物模型,10%水合氯醛麻醉大鼠 (3.5 ml/kg, i.p.),以髂嵴最高点连线为中心做30 mm左右正中切口,咬除左侧L5下关节突、L6上关节突和L5半椎板,暴露左侧L5背根神经节,止血后用无菌生理盐水冲洗伤口。取鼠尾近段根部2个节段自体髓核,置于L5背根神经节上。将PE-10导管向头侧硬膜外腔轻柔置入约4 mm,另一端经皮下隧道,从颈后引出固定并封管,止血后逐层关闭切口。术后大鼠单笼饲养,用2%利多卡因10 μl 判断导管位置。Sham 组取髓核组织但不将其置于背根神经节上,余操作同前。
(2)动物分组及处理:150只雄性SD大鼠分为两个部分,第一部分66只采用随机数字表法随机分为空白组(Blank组,12只)、假手术组(Sham组,12只)、模型组(NP组,42只),检测所有大鼠术前1天,术后1、3、7、12、14、21和28天的50% MWT。Blank组和Sham组于术后3天,NP组于术后1、3、7、14、28天取L4~6脊髓背角,免疫荧光检测胶质细胞和p-p38表达及变化,免疫荧光双标技术检测胶质细胞与p-p38共表达情况。第二部分84只分为Blank组(12只)、Sham组(12只)、NP组(12只)、溶剂对照组(DMSO组,12只)和p38MAPK抑制剂SB203580组(SB组,36只),DMSO组和SB组于术后第2天经硬膜外腔分别注射50 μl 10% DMSO和0.1% SB203580。检测所有大鼠术前1天,术后1 d,给药后1 h、3 h、5 h、7 h、12 h、24 h的50% MWT。其中Blank组,Sham组和NP组于术后2 d,DMSO组于给药后3h,SB组于药后 3 h、7 h、12 h、24 h取术侧腰段 L4~6脊髓背角,通过 Western blot技术检测p-p38 MAPK及p38 MAPK蛋白的表达。
4. 50% 机械痛缩足阈值 (50% mechanical withdrawal threshold, 50% MWT)测定
制模前,每日9:00~16:00将大鼠放于有机玻璃箱中适应环境,并测定术前一天的基础值。术后行为学测试时间定于9:00~16:00 进行, 测试前所有大鼠均置于玻璃箱中适应30 min,待安静后开始进行测试。根据 Chaplan 等[4]报道的方法稍加改进检测50% MWT:大鼠在透明有机玻璃箱内自由活动, 待安静后以不同折力的 von Frey 纤毛刺激大鼠足底,避开肉垫使之稍成S形,每次持续6~8 s。大鼠后肢迅速畏缩或撤回,认为是阳性反应。从 2 g开始 , 当该力度的刺激不能引起阳性反应,则给予相邻大一级的力度进行刺激;如果出现阳性反应则予相邻小一级力度的刺激,连续进行,每个强度反复刺激5次,将出现3次以上阳性反应的最小von Frey纤维强度定为大鼠的50% MWT。两次刺激之间至少间隔15 s。
5. 免疫荧光检测胶质细胞及p-p38MAPK激活及表达含量
大鼠在选定时间点以20%乌拉坦深麻醉下经主动脉快速灌注400 ml生理盐水后,继而4%多聚甲醛灌注固定30 min。将L4-6脊髓节段取出,4%多聚甲醛后固定24 h,然后依次用10%、20%和30%蔗糖溶液梯度脱水3天。做连续冠状冰冻切片(10 μm/片),切片依次脱蜡、孵育、水洗、浸泡、抗原修复后分别加入OX-42 (1:200),GFAP (1:300),NeuN (1:400),p-p38MAPK一抗 (1:1 000),4℃孵育48 h, 水洗、孵育后 DAB 显色、 苏木素复染,透明、封片。荧光双标染色的切片同时加入两种不同种属来源的单克隆一抗混合孵育,随后再添加各自的荧光二抗混合液进行孵育。Image-Pro Plus 6.0软件分析免疫荧光方法:每组内每张切片随机挑选3个100倍视野进行拍照。拍照时尽量让组织充满整个视野,保证每张照片的背景光一致。采用尼康倒置荧光显微镜观察并采集图像(紫外激发波长330~380 nm,发射波长420 nm;FITC绿光激发波长465~495 nm,发射波长515~555 nm;CY3红光激发波长510~560 nm,发射波长590 nm)。DAPI染出来的细胞核在紫外的激发下为蓝色,阳性表达为相应荧光素标记的红光或者绿光。应用Image-Pro Plus 6.0软件将荧光照片转换为黑白图片然后选取相同的黑色作为判断所有照片阳性的统一标准,对每张照片进行分析得出每张照片阳性的累积光密度值 (integrated optical density, IOD)。
6. Western blot检测给药后不同时间点脊髓背角p38MAPK及p-p38MAPK蛋白
分别配置5%浓缩胶和10%分离胶(SDS-PAGE)进行电泳,按每孔相同蛋白量(30 µl)上样进行电泳(恒压80 V 40 min,120 V 1.5 h)。然后再将凝胶中的蛋白电转至PVDF膜上(恒流250 mA 1 h)。5%脱脂牛奶封闭3小时,兔抗鼠p38 MAPK及p-p38MAPK一抗(1:1 000) 4℃孵育过夜。TBS洗膜3次,每次5 min。再加入二抗(l:2 500),室温下孵育l h。TBST洗膜,3×10 min。将膜与ECL试剂反应后,在暗房中依次压片、显影、定影。
7. 统计学分析
应用 SPSS 13.0 软件进行统计分析,计量资料以均数±标准差(±SD)表示。用Levene法检测各组样本方差是否齐性,方差齐性时,术后不同时间点的 50% MWT 和p38及p-p38相对蛋白浓度比较采用重复测量设计的 Friedman ANOVA 方差分析,p-p38的 IOD 值的组间比较采用 One-way ANOVA 方差分析,差异有统计学意义时用 LSD法两两比较;方差不齐时,50% MWT 和p-p38相对蛋白浓度比较采用多因素方差分析,两两比较用 Dunnett' s T3 法,p-p38的 IOD 值组间比较采用 Kruskal-Walllis 秩和检验,P < 0.05为差异有统计学意义。
结 果
1.建模前后各组大鼠机械痛敏阈值的变化
各组大鼠术前的50% MWT比较,差异无统计学意义。与Blank组相比,Sham组大鼠的50%MWT在术后第1天稍有下降 (P < 0.05), 随后逐渐恢复至术前水平;NP组在术后第1天即出现50%MWT下降,术后第3天下降更为明显,持续至术后第 28 天 (P < 0.05,见图 1)。
2.小胶质细胞激活含量变化
与Blank组和Sham组比较,NP组术后1天、3天及7天脊髓背角小胶质细胞激活,第1天即出现IOD值上升,第3天升高达峰值 (P < 0.05),至第14天和28天显著降低(P < 0.05,见图2、3)。
3.星形胶质细胞激活含量变化
与Blank组和Sham组比较,NP组术后7 d、14 d、28 d脊髓背角星形胶质细胞激活,且术后第7天开始出现IOD值升高,第14天上升达峰值,持续至术后第28天(P < 0.05,见图4、5)。
4. p-p38表达及含量变化
与Blank组和Sham组比较,NP组术后1天、3天及7天脊髓背角p-p38表达,且术后第1天即开始出现IOD值升高,第3天上升达峰值(P < 0.05),术后第14天和28天显著降低(P < 0.05,见图6、7)。
5. p-p38蛋白在细胞内的表达定位
模型组大鼠术后第7 d脊髓背角内p-p38、小胶质细胞、星形胶质细胞以及神经元表达阳性,免疫荧光双标显示p-p38主要表达于激活的小胶质细胞,少量表达于神经元,激活的星形胶质细胞内无p-p38表达(见图8)。
6. 给予p38 MAPK抑制剂SB203580后大鼠机械痛敏阈值的变化
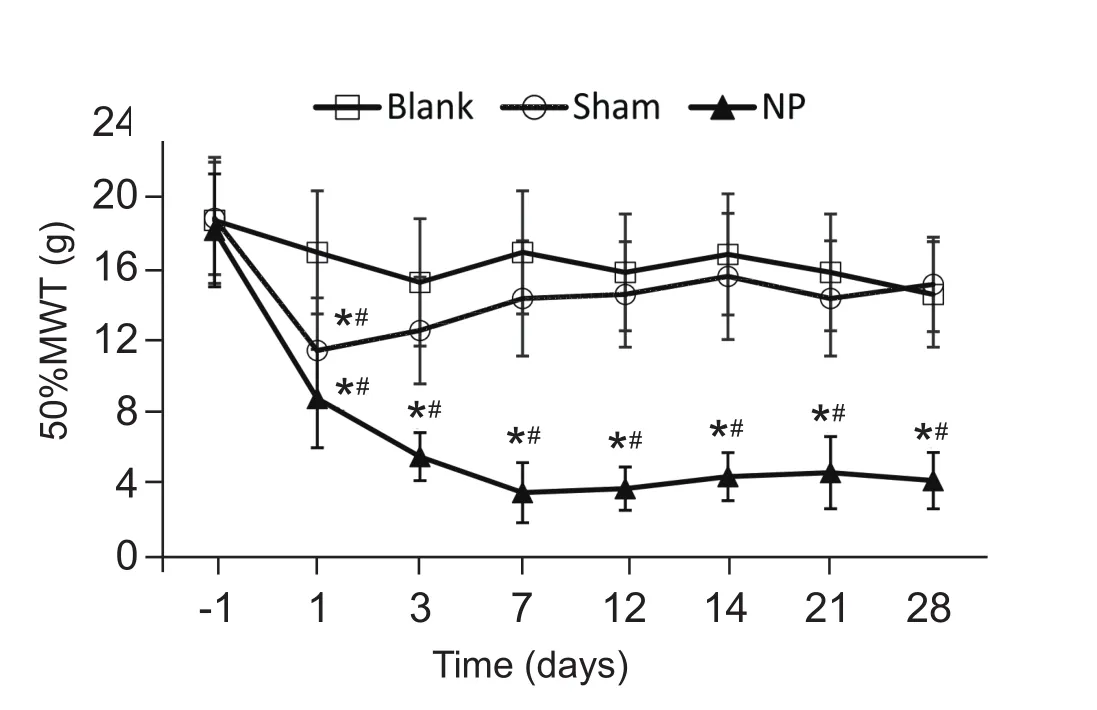
图1 手术前后各组大鼠术侧后足50% MWT的比较*P < 0.05,与 Blank组相比,#P < 0.05,与术前50% MWT值相比Fig.1 The comparison of preoperative and postoperative 50% MWT of different groups of rats*P < 0.05,compared with group Blank; #P < 0.05,compared with 50% MWT before surgery.
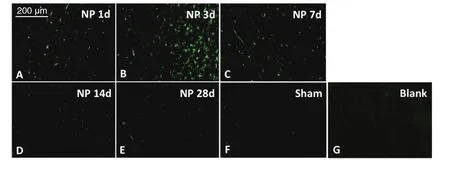
图2 各组大鼠脊髓背角中小胶质细胞表达的比较A-E分别为模型组术后1、3、7、14、28天脊髓背角内小胶质细胞免疫荧光表达结果;F,G分别为假手术组与空白组术后第7天脊髓背角内小胶质细胞免疫荧光表达结果,Scale bar = 200 µmFig. 2 The activation of microglia in the spinal dorsal horn of different group of rats.A-E: reveal the immuno fl uorescence of microglial marker OX-42 in the spinal cord on postoperative day 1, 3, 7, 14 and 28 in Group NP, respectively; F, G: show the immuno fl uorescence of microglial marker OX-42 in the spinal cord on postoperative day 7 in Group Sham and Blank, respectively. Scale bar = 200 µm.
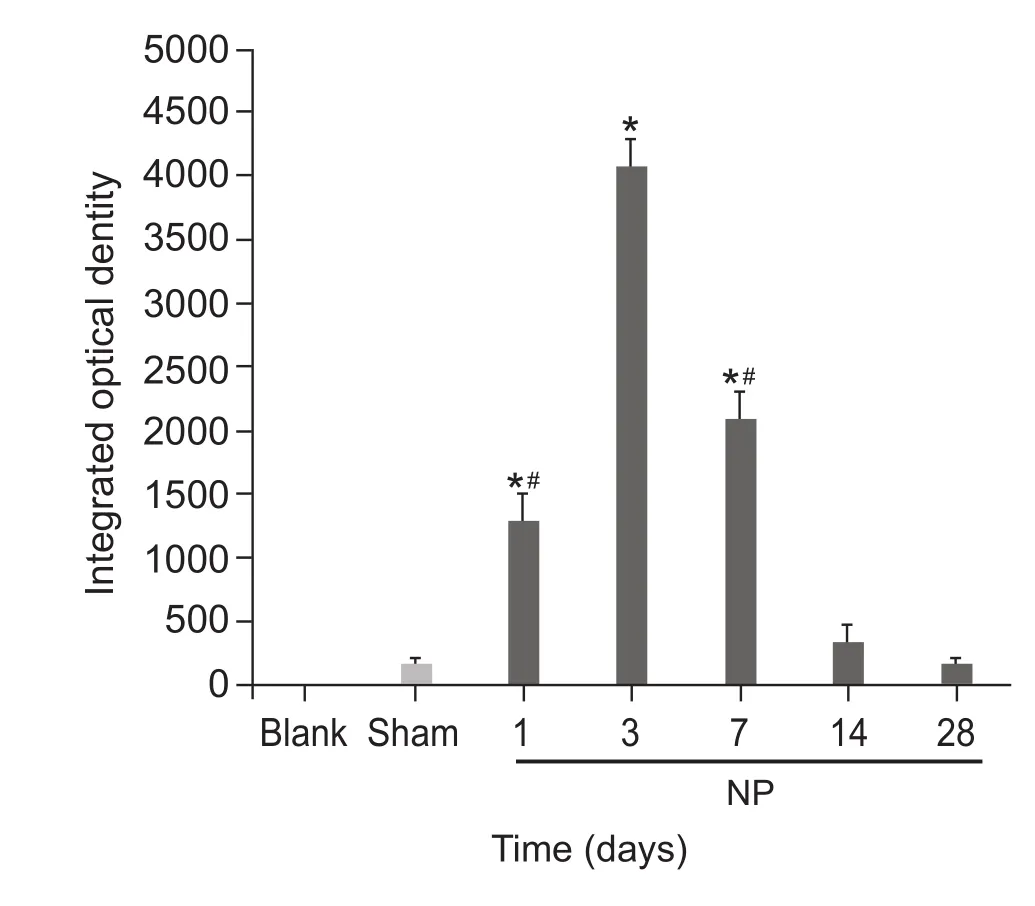
图3 各组大鼠脊髓背角小胶质细胞积分光密度值的比较 (n = 6,±SD)*P < 0. 05,与 Sham 组相比;#P < 0.05,NP 组内与术后3天相比Fig.3 Integrated optical density value of OX-42 in spinal dorsal horn of different group of rats (n = 6,±SD)*P < 0.05, compared with group Sham; #P < 0.05,compared with 3 days after surgery in group NP.
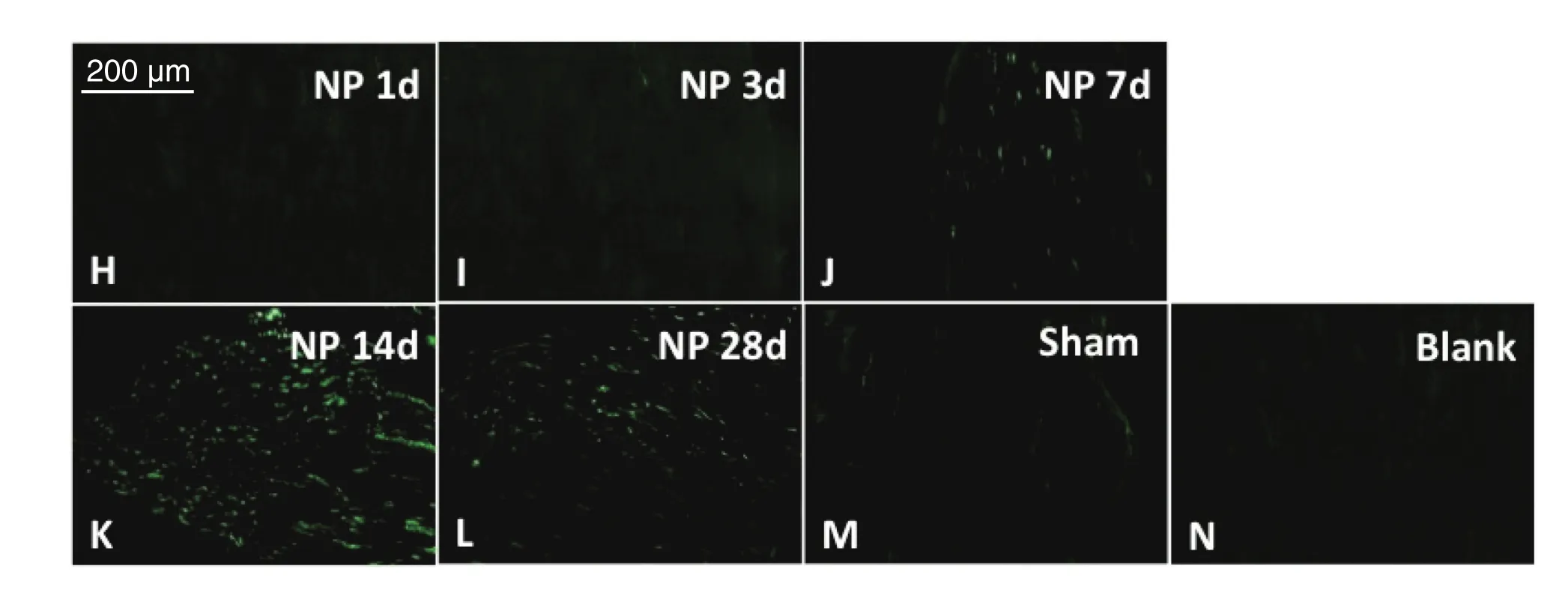
图4 各组大鼠脊髓背角中星形胶质细胞表达的比较H-L分别为模型组术后1、3、7、14、28天大鼠脊髓背角内星形胶质细胞免疫荧光表达结果;M,N分别为假手术组与空白组术后第7天大鼠脊髓背角内星形胶质细胞免疫荧光表达结果,Scale bar = 200 µmFig. 4 The activation of astrocytes in the spinal dorsal horn of different group of rats H-L: The immuno fl uorescence of astrocyte marker GFAP in the spinal cord on postoperative day 1, 3, 7, 14 and 28 in Group NP, respectively;M, N: The immuno fl uorescence of astrocyte marker GFAP in the spinal cord on postoperative day 7 in Group Sham and Blank, respectively. Scale bar = 200 µm.
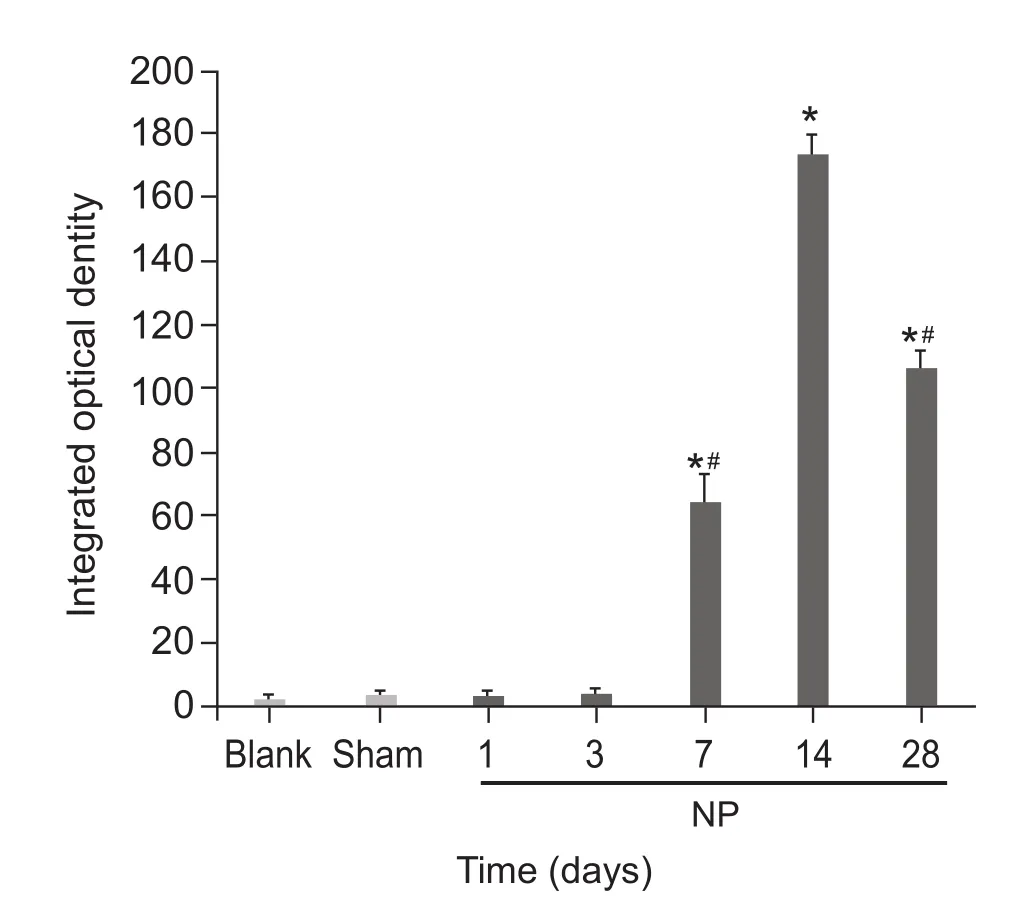
图5 各组大鼠脊髓背角星形胶质细胞积分光密度值的比较(n = 6,±SD)*P < 0. 05,与 Sham 组相比,#P < 0.05,NP 组内与术后14天相比Fig.5 Integrated optical density value of GFAP in spinal dorsal horn of different group of rats (n = 6,±SD)*P < 0. 05, compared with group Sham; #P < 0.05,compared with 14 days after surgery in group NP.
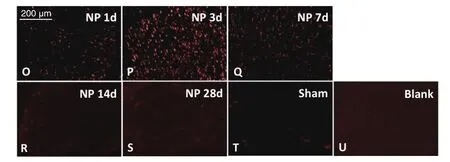
图6 各组大鼠脊髓背角中p-p38表达的比较O-S分别为模型组术后1、3、7、14、28天大鼠脊髓背角内p-p38免疫荧光表达结果;T与U分别为假手术组与空白组术后第7天大鼠脊髓背角内p-p38免疫荧光表达结果,Scale bar = 200 µmFig. 6 The expression of p-p38 in the spinal dorsal horn of different group of rats O-S: reveal the immuno fl uorescence of p-p38 in the spinal cord on postoperative day 1, 3, 7, 14 and 28 in Group NP,respectively; T, U show the immuno fl uorescence of p-p38 in the spinal cord on postoperative day 7 in Group Sham and Blank, respectively. Scale bar = 200 µm.
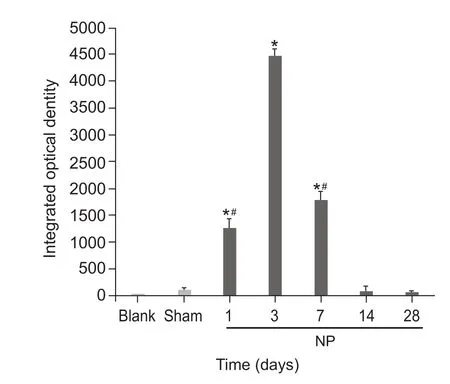
图7 各组大鼠脊髓背角p-p38积分光密度值的比较(n = 6,±SD)*P < 0.05,与 Sham 组相比,#P < 0.05,NP 组内与术后3天相比Fig.7 Integrated optical density value of p-p38 in spinal dorsal horn of different group of rats (n = 6,±SD)*P < 0.05, compared with Group Sham;#P < 0.05,compared with 3 days after surgery in group NP.
与Blank组比较,NP组,Sham组,DMSO组和SB组大鼠术后第1天痛阈均下降(P < 0.05);与Sham组相比较,术后第2天给药前,NP组、DMSO组和SB组的50% MWT均下降(P < 0.05)。在给药后3 h、5 h、7 h及12 h,SB 组大鼠的50%MWT较给药前升高(P < 0.05),与相同时间点NP组和DMSO组比较,SB组大鼠的50% MWT升高(P < 0.05),在给药后3 h达峰值,而药后24 h恢复到给药前水平;与给药前相比,DMSO组在给药后各时间点50% MWT比较差异无统计学意义;给药前后各时间点,NP组和DMSO组50% MWT比较差异无统计学意义(见图9)。
7. p38及p-p38蛋白表达结果及变化
硬膜外给药后各组大鼠在相应时间点取出L4~6脊髓背角提取总蛋白后检测p 38蛋白相对浓度,各标本均使用β-actin作为内参蛋白,定为1。免疫印记条带显示,给药后各组大鼠脊髓背角p38蛋白表达无统计学差异。与Sham组相比较,NP组,DMSO组和SB组p-p38蛋白表达均升高(P < 0.05);与相同时间点NP组和DMSO组比较,SB组p-p38蛋白浓度在给药后3 h,7 h,12 h下降,其中3 h下降最为明显(P < 0.05)。NP组与DMSO组比较,p-p38蛋白表达差异无统计学意义(见图10)。
讨 论
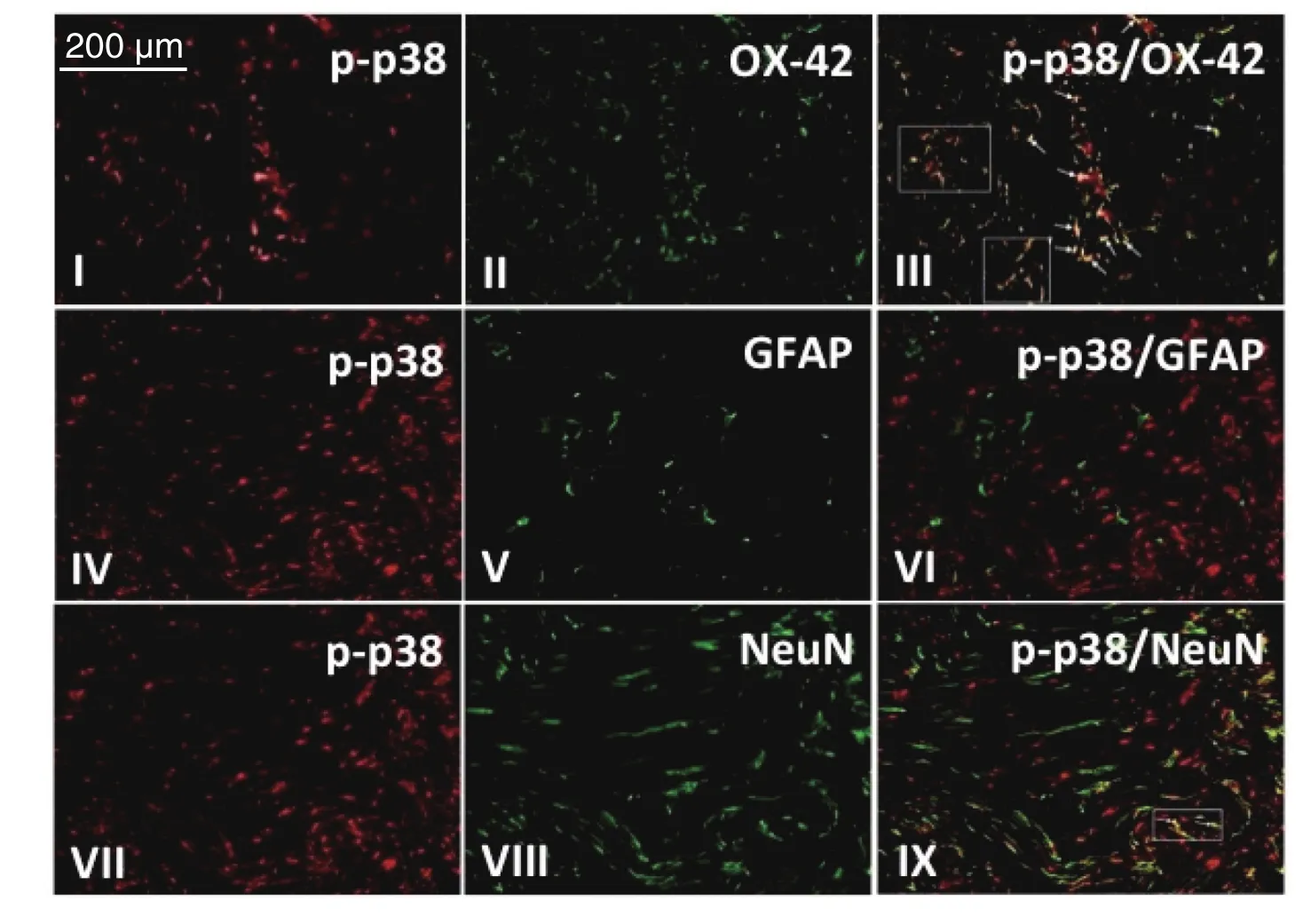
图8 免疫荧光双标检测p-p38与神经胶质细胞共表达情况I、IV、VII红色区域为为模型组大鼠术后第7 d脊髓背角p-p38阳性表达;II,V,VIII绿色区域分别为小胶质细胞、星形胶质细胞和神经元阳性表达;III为I,II融合后结果,显示p-p38与小胶质细胞大量共表达;VI为IV和V融合后结果,显示p-p38与星型胶质细胞共表达阴性;IX为VII和VIII融合后结果,显示p-p38与神经元细胞少量共表达,图中箭头及方框内所示黄色区域为共表达部位,Scale bar = 200 µmFig.8 The co-expression of p-p38 and glial cells by Immunohistochemical double-staining method In the fi gure, the red areas of I, IV, and VII are the immuno fl uorescence of p-p38 in the spinal cord on postoperative day 7; The green areas of II, V and VIII are the immuno fl uorescence of the markers for microglia, astrocyte and neuron in the spinal cord on postoperative day 7. Double-labeled immuno fl uorescence of p-p38, OX-42 (a microglia marker), glial fi brillary acidic protein(GFAP, an astrocyte marker), and neuronal speci fi c nuclear protein (NeuN, a neuronal marker) in the spinal dorsal horn were shown in III, VI and IX. III: Double-staining for p-p38 (red) and OX-42 (green) reveals a heavy co-localization (arrows, yellow);VI: Double-labeling of p-p38 (red) with GFAP (green) showed no co-localization; IX: Double-staining demonstrates little co-localization (arrows, yellow) of p-p38 (red) and NeuN (green) in neurons of the spinal dorsal horn. Scale bar = 200 µm.
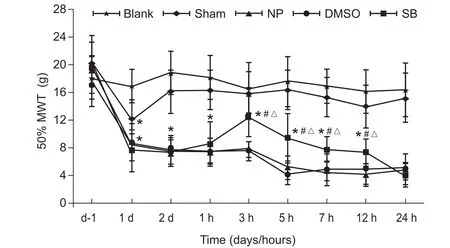
图9 给药前后各组大鼠术侧后足50% MWT的比较(n = 6,±SD)*P < 0.05,与Blank组比较; #P < 0.05,与DMSO组相比;△P < 0.05,与SB组给药前相比Fig.9 The comparison of before and after administration 50% MWT of different groups of rats(n = 6,±SD)*P < 0.05, compared with Group Blank; #P < 0.05, compared with Group DMSO; △P < 0.05, compared with before administration in group SB.

图10 术后不同时点各组大鼠脊髓背角 p38 反应条带和相对蛋白浓度A:Western Blot 实验获得各组的p38和p-p38 蛋白条带图;B:不同时间点p38蛋白相对含量;C:不同时间点p-p38 蛋白相对含量,*P < 0.05,与Sham组相比;#P < 0.05,与NP组和DMSO组相比;△P < 0.05,SB组与给药后3 h相比Fig.10 The expression and relative concentration of p-p38 in different groups of rats at different time points after surgery A: p38 and p-p38 protein band diagram of each group detected by Western Blot. B: p38 protein relative content at each time point. C: p-p38 protein relative content at each time point, *P < 0.05, compared with group Sham. #P < 0.05,compared with group NP and DMSO; △P < 0.05, compared with 3h after administration in group SB.
目前针对腰椎间盘突出症主要有机械受压、化学性神经根炎和自身免疫学三种学说,神经根炎性学说是当前研究热点。突出髓核作为抗原可被免疫系统识别,激发机体自身免疫反应,从而容易导致过度的炎症反应[5~7]。Takahashi 等发现突出的髓核组织内含有炎症因子如 TNF-a 等,对于髓核组织诱发神经病理性疼痛至关重要[8]。许多研究在动物模型中也己经证实,突出的髓核组织接触神经根后能够产生明显的外周痛觉过敏[9,10]。本课题组早期构建的动物模型中,通过将大鼠自体尾髓转移至L5背根神经节,可诱发大鼠术后疼痛行为学发生改变,同时证明其背根神经节内存在COX-2,NOS等炎症介质的表达,说明自体髓核诱发了外周炎症反应[3]。
在脊髓水平,对疼痛的调制主要发生在脊髓背角。组织损伤引发感受器的极度活跃能引起脊髓伤害性感受器终端处神经传导物质和神经调节物质的释放增加,还能影响脊髓突触的可塑性,同时持续的痛觉传入也增强了脊髓背角突触传递,最终导致了突触后的脊髓背角神经元的极度活跃,即中枢敏感化[11]。研究表明,由脊髓背角到大脑皮层的痛觉传导通路间突触传递长时程增强介导了疼痛的中枢敏化[12]。胶质细胞作为中枢神经系统的重要细胞组成成分,在正常生理条件下主要起支持细胞的作用,而胶质细胞激活后与神经元细胞之间发生紧密联系,这一过程在不同类型的神经退行性疾病以及脊髓背角疼痛易化过程中均发挥了重要作用[13]。在中枢神经系统内,胶质细胞主要包括小胶质细胞,星型胶质细胞和少突胶质细胞三种[14],小胶质细胞在神经病理性疼痛和急性炎症性疼痛中起重要作用,星型胶质细胞在急性和慢性神经元性疾病如癫痫,休克和缺血性疾病中发挥着积极效应[15],两者均在脊髓水平参与了疼痛的中枢敏化机制。课题组前期研究发现脊髓背角上存在如ERK等炎症因子及相关通路的表达,而导致髓核致炎症大鼠神经根痛[16]。在本实验中,我们采用大鼠自体髓核致炎模型,手术模型组机械痛阈值均在术后第1天开始降低,到第7天降至最低,可持续至术后28天,模型建立成功。我们通过取L4~6脊髓背角组织做免疫荧光检测发现,模型组小胶质细胞和星型胶质细胞出现明显阳性。对不同天数的大鼠进行取材,检测结果发现两者的表达时间并不一致,在术后第3天,主要是小胶质细胞的激活,而星型胶质细胞在术后第7天出现激活,并持续至术后28天,我们推测可能是与小胶质细胞参与炎症的发生而星型胶质细胞参与炎症的发展和维持有关,在炎症形成早期,主要诱发小胶质细胞的激活,而中晚期主要发生在星型胶质细胞,可能是在炎症的发生与发展中存在由急性转为慢性的过程,或者由外周敏化转向中枢敏化的过程。
丝裂酶原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)通路的激活在神经可塑性诱导和维持上起到重要作用,如外周敏化和中枢敏化,因而加剧了伤害后所导致的痛觉过敏[17]。MAPK 有三个主要家族:ERKs、JNKs和p38 MAPKs,其中p38蛋白激酶在神经损伤,脊髓损伤,炎症,糖尿病,辣椒素和足底切开等多种疼痛模型的发生和发展中具有重要作用[18]。在病理性疼痛的发病机制中,p38 MAPK汇集了多种激酶反应通路,表明其可能在伤害性感受神经元引起的可塑性改变中发挥重要作用。本研究结果提示,在脊髓背角内存在p38 MAPK激活和p-p38蛋白的表达,并且其表达和维持时间与小胶质细胞相接近。免疫荧光双标显示,p-p38与小胶质细胞标记物OX-42大量共表达,表明p-p38主要表达于小胶质细胞,这与Wen等[18]的研究相类似。为了进一步验证p38 MAPK参与了髓核致炎大鼠神经根痛,我们在炎症发生的早期(术后第2天)经硬膜外导管给予p38 MAPK激酶的抑制剂SB203580,可短暂地降低(约12 h)伤害性机械刺激的痛敏反应,其中在给药后3 h出现明显的痛阈值增高。研究证实MAPK的灭活是由一组双特异性磷酸蛋白酶(MKPs)将苏氨酸与酪氨酸去磷酸化作用恢复至基态水平导致,而SB203580能够特异性地与该两种非常相近的蛋白质序列结合并抑制其活性,发挥对p38 MAPK通路的阻断效应[19],这可能是本实验中SB203580改善大鼠机械性痛敏发挥抗炎效果的主要原因。由此,我们认为p38 MAPK参与了诱发髓核致炎大鼠神经根痛。
本研究的不足之处在于我们只对小胶质细胞与p38蛋白的表达进行了分析,也仅仅说明两者参与介导了髓核致炎大鼠神经根痛觉过敏,而对于p38基因如何在小胶质细胞内表达,它们又是通过何种机制发挥生物学效应的,还有待于进一步的实验探讨。
综上所述,脊髓背角胶质细胞和p38 MAPK参与了髓核致炎大鼠神经根痛,p-p38 MAPK主要表达在小胶质细胞,在术后第2天给予p38 MAPK抑制剂可暂时缓解机械性痛觉过敏,为今后治疗突出髓核诱发的神经根炎性痛提供了理论依据。
[1]Treede RD, Rief W, Barke A, 等. ICD-11慢性疼痛分类. 中国疼痛医学杂志, 2015, 21(7):486 ~ 488.
[2]吴海璇,冯璐璐,贺秋兰,等. 蛇床子素对髓核致坐骨神经痛大鼠DRG中CGRPR1表达的影响.中国药理学通报, 2014, 30(1):49 ~ 54.
[3]魏明,张劲军,贺秋兰,等. 新型腰椎间盘突出致坐骨神经痛大鼠模型及硬膜外腔置管方法的建立.中国疼痛医学杂志, 2011, 12(9):744 ~ 748.
[4]Chaplan SR, Bach FW, Pogrel JW, et al. Quantitative assessment of tactile allodynia in the rat paw. Neurosci Methods, 1994, 53:55 ~ 63.
[5]Ghahreman A, Bogduk N. Predictors of a favorable response to transforaminal injection of steroids in patients with lumbar radicular pain due to disc herniation. Pain Med, 2011, 12(6):871 ~ 879.
[6]Melchionda D, Milillo P, Manente G, et al. Treatment of radiculopathies:a study of ef fi cacy and tollerability of paravertebral oxygen-ozone injections compared with pharmacological anti-in fl ammatory treatment. Biol Regul Homeost Agents, 2012, 26(3):467 ~ 74.
[7]Kang SS, Hwang BM, Son HJ, et al. The dosages of corticosteroid in transforaminal epidural steroid injections for lumbar radicular pain due to a herniated disc.Pain Physician, 2011, 14(4):361 ~ 370.
[8]Cuellar JM, Montesano PX, Carstens E. Role of TNF-alpha in sensitization of nociceptive dorsalhom neurons induced by application of nucleus pulposiis to L5 dorsal root ganglion in rats. Pain, 2004,110(3):578 ~ 587.
[9]Kim SJ, Park SM, Cho YW. Changes in expression of mRNA for interleukin-8 and effects of interleukin-8 receptor inhibitor in the spinal dorsalhom in a rat model of lumbar disc hemiatio. Spine, 2011, 36(25):2139 ~ 2146.
[10]Basbaum AI, Bautista DM, Scherrer G. Cellular and molecular mechanisms of pain. Cell, 2009, 139(2):267 ~ 284.
[11]Kuner R. Central mechanisms of pathological pain. Nat Med, 2010, 16(11):1258 ~ 1266.
[12]刘先国,庞瑞萍,周利君,等. 感觉神经损伤,还是运动神经损伤引起神经病理性疼痛?中国疼痛医学杂志 , 2015, 21(3):161 ~ 168.
[13]Ji RR, Suter MR. p38MAPK, Microglial signaling, and neuropathic pain. Mol Pain, 2007, 3:33.
[14]Gao YJ, Ji RR. Targeting astrocyte signaling for chronic pain. Neurotherapeutics, 2010, 7:482 ~ 493.
[15]Ji RR, Berta T, Nedergaard M. Glia and pain: Is chronic pain a gliopathy? Pain, 2013, 154(01):S10 ~ S28.
[16]冯璐璐,吴海璇,徐辉,等. 脊髓背角ERK/MAPK通路在髓核致炎大鼠神经根炎性痛维持中的作用.中国疼痛医学杂志, 2014, 20(7):456 ~ 462.
[17]Obata K, Noguchi K. MAPK activation in nociceptive neurons and pain hypersensitivity. Life Sci, 2004,74(21):2643 ~ 2653.
[18]Wen YR, Suter MR, Ji RR, et al. Activation of p38 Mitogen-activated Protein Kinase in Spinal Microglia Contributes to Incision-induced Mechanical Allodynia.Anesthesiology, 2009, 110:155 ~ 165.
[19]张涛,杨承祥,王汉兵. P38MAPK信号通路与疼痛的关系.中国疼痛医学杂志, 2012, 18(3):177 ~ 180.

