kre1Δ酿酒酵母孢子固定肌酐酶体系的构建及其酶学分析
潘华平,中西秀树,孔军,高晓冬
(江南大学 生物工程学院,糖化学与生物技术教育部重点实验室,江苏 无锡,214122)
二倍体酿酒酵母(Saccharomycescerevisiae)在缺乏氮源及处于非发酵型碳源的条件下会进入减数分裂和产孢过程并最终形成子囊孢子[1]。酵母孢子壁的组成从内到外依次为甘露糖层、葡聚糖层、壳聚糖层和二酪氨酸层[2](图1-A)。研究发现,各层孢子壁的形成时间是有先后顺序的,即只有当内层的孢子壁形成后,外层的孢子壁才能依次形成[3]。最先合成的甘露糖层由大量的甘露糖蛋白组成[4];葡聚糖层主要是以β-1,3-葡聚糖为主链及β-1,6-葡聚糖为支链组成[5];Chs3是壳聚糖层中几丁质的合成酶[6],敲除CHS3后会导致壳聚糖层无法形成,进而导致外层的二酪氨酸层缺失;Dit1是二酪氨酸合成酶,敲除DIT1后无法形成二酪氨酸层[7]。此外,有一些功能未知的基因,如OSW2,也会影响孢子壁的形成,敲除OSW2后虽然不影响各层孢子壁的形成,但会改变孢子壁的通透性,并表现出乙醚敏感性[4]。成熟的酵母孢子是一种休眠细胞,孢子壁中的壳聚糖层和二酪氨酸层赋予孢子抵抗外界胁迫(如有机溶剂,高温及酶降解等)压力的能力。研究表明二酪氨酸层不仅具有抗蛋白酶及糖苷水解酶类降解的能力,而且可以阻挡孢内的可溶性分泌蛋白外泌及阻止孢外各类有害的酶扩散进入到孢子内部[8-9]。
基于酵母孢子壁的独特性,实验室利用酵母孢子开发了一种新型的酶生物固定法,即酿酒酵母孢子微胶囊酶固定法。该方法的原理是将目标酶的基因与酵母分泌信号肽连接重组转入酿酒酵母孢子中,表达的目标酶在往外分泌的过程中会被孢子壁中的壳聚糖层吸附住,同时也会被二酪氨酸层拦截,并阻挡其分泌到孢外,使目标酶被包埋固定在孢子壁中。反应时,直接用孢子微胶囊酶进行催化反应即可。由于酵母孢子壁具有抗胁迫能力,因此,被固定在孢子壁中的酶也具有抗逆性。此外还可通过基因工程手段改变孢子壁的通透性,保留孢子微胶囊酶抗逆性的同时,提高催化酶活(图1-B)。
实验室前期研究表明,利用有孢子壁缺陷的酵母孢子(如osw2Δ,dit1Δ孢子)包埋固定的酶,其酶活显著高于野生型孢子,而且osw2Δ孢子微胶囊酶还表现出较强的抗逆性及较好的可重复利用性等优势[10-12]。KRE1是孢子壁中β-1,6-葡聚糖合成的基因。敲除KRE1后,虽然不影响孢子壁的形成,但可能影响孢子壁的通透性并表现出乙醚敏感性[13]。为了验证kre1Δ孢子是否具有与osw2Δ孢子一样的酶胶囊载体性能,本课题利用kre1Δ孢子及其他有孢子壁缺陷的酵母孢子对肌酐酶(creatininase CA)进行固定,并对其酶学性能进行了研究。
1 材料与方法
1.1 菌株、质粒和引物
本研究所用的菌株、质粒及引物详见表1。
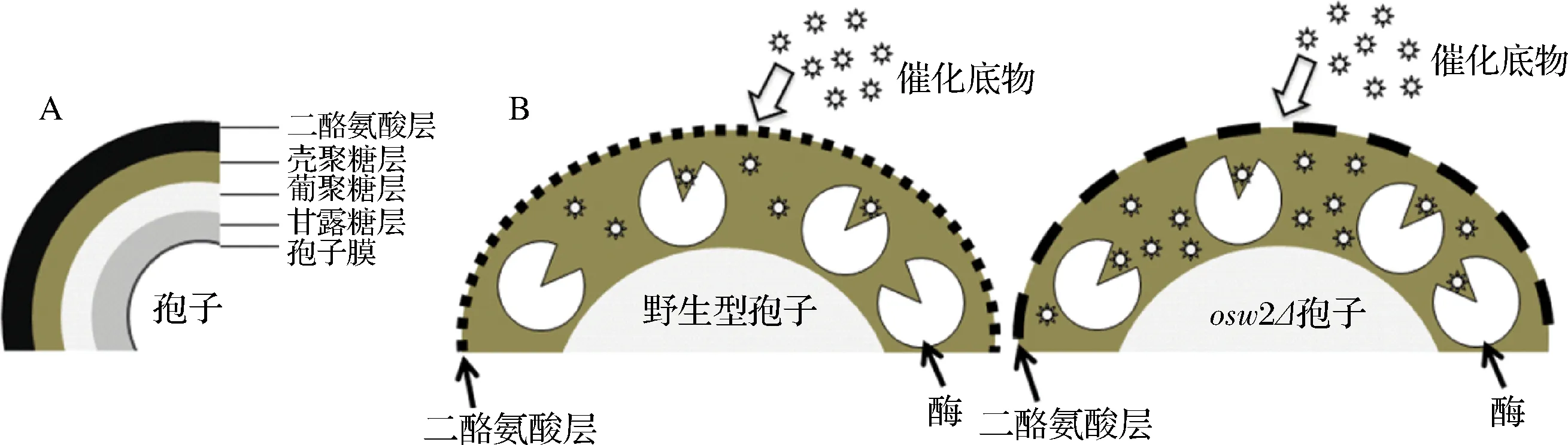
A-酵母孢子壁结构;B-孢子微胶囊酶催化反应图1 酵母孢子微胶囊酶固定化示意图Fig.1 Yeast spore-encapsulated enzyme

菌株/质粒/引物基因型/说明/序列来源AN120MATα/MATaARG4/arg4-NspIhis3ΔSK/his3ΔSKho::LYS2/ho::LYS2leu2/leu2lys2/lys2RME1/rme1::LEU2trp1::hisG/trp1::hisGura3/ura3[14]chs3ΔMATα/MATaARG4/arg4-NspIhis3ΔSK/his3ΔSKho::LYS2/ho::LYS2leu2/leu2lys2/lys2RME1/rme1::LEU2trp1::hisG/trp1::hisGura3/ura3chs3Δ::his5+/chs3Δ::his5+[4]dit1ΔMATα/MATaARG4/arg4-NspIhis3ΔSK/his3ΔSKho::LYS2/ho::LYS2leu2/leu2lys2/lys2RME1/rme1::LEU2trp1::hisG/trp1::hisGura3/ura3dit1Δ::his5+/dit1Δ::his5+[15]osw2ΔMATα/MATaARG4/arg4-NspIhis3ΔSK/his3ΔSKho::LYS2/ho::LYS2leu2/leu2lys2/lys2RME1/rme1::LEU2trp1::hisG/trp1::hisGura3/ura3osw2Δ::his5+/osw2Δ::his5+[12]kre1ΔMATα/MATaARG4/arg4-NspIhis3ΔSK/his3ΔSKho::LYS2/ho::LYS2leu2/leu2lys2/lys2RME1/rme1::LEU2trp1::hisG/trp1::hisGura3/ura3kre1Δ::kanMX6/kre1Δ::kanMX6本研究质粒pRS424⁃TEFpr⁃ss⁃CA⁃3HATRP1标记多拷贝含信号肽的CA⁃3HA基因[11]引物HP27TATGCTACAGTAAAGACCTCTTCAACTTCTGCAAGACAATCAAAAAAAAACGGATCCCCGGGTTAATTAA本研究HP28ATTTTTACTCTTATATATGTATATGTTTGTGTTTATTTCTGAATAAAAATGAATTCGAGCTCGTTTAAAC本研究HP29TCATAAACTGAGAATGGGGC本研究HP30GCTGATGCATCAAGTTTGTC本研究
1.2 培养基、主要试剂和溶液
1.2.1 培养基
LB-氨苄培养基:蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,氨苄抗生素终质量浓度 50 μg/mL,琼脂粉20 g/L(固体培养基)。
YPAD培养基:酵母提取物10 g/L,Peptone-A 20 g/L,腺嘌呤0.03 g/L,葡萄糖 20 g/L,琼脂粉20 g/L(固体培养基)。
YPAce培养基:酵母提取物10 g/L,Peptone-A 20 g/L,腺嘌呤0.03 g/L,醋酸钾 20 g/L。
产孢培养基:醋酸钾 20 g/L。
氨基酸缺陷型培养基(SD培养基):YNB 6.7 g/L,氨基酸缺陷型粉末 4 g/L,葡萄糖 20 g/L,琼脂粉20 g/L(固体培养基)。
1.2.2 主要试剂
Lyticase,Creatinine 购自Sigma-Aldrich公司(中国,上海);酵母提取物、蛋白胨购自Oxoid公司;质粒抽提试剂盒、Peptone-A、酵母基础氮源培养基(YNB)、氨苄抗生素、腺嘌呤、脱脂奶粉购自上海生工生物工程有限公司;SDS-PAGE 凝胶配制试剂盒、ClarityTMWestern ECL Substrate 显色剂购自碧云天生物技术公司;一抗Mouse anti-HA、二抗Goat anti-mouse IGg-HRP购自北京全式金生物技术有限公司;PVDF膜购自Bio-RAD公司;葡萄糖、琼脂粉、醋酸钾、α-萘酚、二乙酰、Na2CO3、NaHCO3、磷酸盐、NaOH及无水甲醇等分析纯试剂购自国药集团化学试剂有限公司。
1.2.3 实验溶液
原生质体溶液:K3PO3溶液浓度50 mmol/L,pH 7.5,山梨醇浓度1.4 mol/L,β-巯基乙醇浓度40 mmol/L。
TBST溶液:5 mol/L的NaCl 30 mL,1 mol/L的Tris·HCl(pH 8.0)10 mL,吐温-20取0.5 mL,再加去离子水定容至1 L。
尿素溶液:尿素48.04 g,NaCl 0.585 g,1 mol/L的Tris·HCl(pH 8.0)取2.5 mL,加水定容至100 mL。
转膜缓冲液:甘氨酸14.4 g,Tris 3.03 g,无水甲醇200 mL,加水定容至1 L。
5 g/L 脱脂牛奶:脱脂奶粉5 g,加TBST溶液定容至100 mL。
pH反应缓冲液:pH 2~5,50 mmol/L醋酸钠溶液;pH 6~9,50 mmol/L KH2PO4/K2HPO4溶液;pH 10~12,50 mmol/L Na2HPO4/Na3PO4。
1.3 实验方法
1.3.1 肌酐酶质粒在酿酒酵母菌株中的重组转化
肌酐酶质粒pRS426-TEFpr-ss-CA-3HA由孔军提供[11]。将该质粒分别转入野生型(wt)、dit1Δ、chs3Δ、osw2Δ及kre1Δ菌株中,然后将转化细胞液涂到尿嘧啶缺陷型培养基平板上进行筛选,长出来的单菌落就是阳性重组转化子。同时也将空载pRS426-TEF转到野生型中作为对照组。
1.3.2 重组酵母菌株的生长、产孢及孢子纯化
将阳性重组转化子接种到5 mL的尿嘧啶缺陷型培养基中,30 ℃摇床过夜培养,取1 mL培养液转接到80 mL的YPAce培养基中,30 ℃摇床培养24 h,4 000g离心1 min收集细胞,用无菌水洗1遍后将细胞重悬于80 mL的产孢培养基中,30 ℃摇床培养24 h后镜检产孢率。当产孢率大于90%时,4 000g离心1 min收集孢子。由于成熟的孢子被母细胞子囊壳包裹,因此必需先用细胞壁裂解酶(lyticase)对子囊壳进行裂解,再超声破碎,使孢子从子囊壳中释放出来,然后用Percoll密度梯度离心方法分离纯化孢子[12-16],将分离后的孢子进行真空冷冻干燥备用。
1.3.3 蛋白质免疫印迹分析肌酐酶在酵母孢子中的表达
将含有肌酐酶(CA-3HA)的菌株及对照用产孢培养基产孢后,收集孢子。然后将孢子重悬于500 μL的含有蛋白酶抑制剂的8 mol/L尿素溶液中,加入适量玻璃珠。按振荡1 min、冰上1 min的循环破碎孢子,振荡破碎40 min后,9 000g离心10 min,取上清液,用Nano Drop 2000分光光度计测定蛋白质浓度。然后统一上样50 μg蛋白进行SDS-PAG电泳(5%的浓缩胶,10%的分离胶),电泳结束后,从下到上按滤纸、PVDF膜、凝胶、滤纸的叠放顺序放入电转仪 (25 V,1.0 A,30 min) 内进行转膜,转膜完毕后用50 g/L的脱脂牛奶室温封闭PVDF膜2 h,一抗(mouse anti-HA,1∶5 000稀释)室温孵育2 h,TBST溶液洗3次(10 min/次),二抗(goat anti-mouse IgG HRP,1∶6 000稀释)室温孵育2 h,TBST溶液洗3次后,用ECL显色试剂盒对PVDF膜显色,再用Image Quant LAS4000 进行拍照。
1.3.4 肌酐酶酶活检测
肌酐酶酶活的测定方法参考KIKKOMAN (Kikkoman, Noda Japan) C1-E肌酐酶活力测定方法。原理是通过测定肌酸产量来检测,即肌酐被肌酐酶降解后,产生肌酸,在碱性条件和α-萘酚的催化下,肌酸的胍基与二乙酰生成紫红色物质,该物质在OD525处有最大吸收峰。然后再根据OD525值来计算酶活。单位肌酐酶活定义为:在37 ℃和pH 6.8的反应液中,水解生成1 μmol肌酸所需的肌酐酶的量即为1 U。所有的酶活测试都是用5 mg冷冻干燥孢子或50 μL (1.4 U) 的游离酶加入到反应液中,37 ℃,反应10 min后加入终止液并置于冰上,加入显色液后测量OD525值。
为了测定温度对肌酐酶活的影响,本研究测定了游离酶及孢子微胶囊酶反应液(pH 6.5)在不同温度下(30~90 ℃)的酶活。为了测定pH对肌酐酶活的影响,本研究测定了不同pH反应缓冲液在60 ℃下反应的酶活。为了检测孢子微胶囊肌酐酶的可重复利用性,统一称取5 mg冷冻干燥的孢子进行反应,首次反应结束后离心收集孢子,测定上清中的酶活,用含有0.5% Triton X-100的0.6 mol/L NaCl溶液洗涤孢子1遍,然后再次测量孢子的肌酐酶活,如此重复操作4次。
1.3.5 孢子微胶囊肌酐酶的抗逆性研究
为了检测肌酐酶抗蛋白酶K的性能,统一称取5 mg冷冻干燥孢子或20 μL游离酶,加入100 μL蛋白酶K(终浓度为30 U/mL)缓冲液(50 mmol/L Tris-HCl pH 7.5,10 mmol/L CaCl2),37 ℃孵育12 h。然后用含有0.5% Triton X-100的0.6 mol/L NaCl溶液洗涤孢子2遍,再测定酶活。为了检测肌酐酶抗SDS的性能,统一称取5 mg冷冻干燥孢子或20 μL游离酶,加入100 μL 5% SDS,30 ℃孵育10 min。然后用含有0.5% Triton X-100的0.6 mol/L NaCl溶液洗涤孢子2遍,再测定酶活。
1.3.6 数据统计分析
统计数据为3次独立重复实验的平均值,数据分析用Microsoft Excel软件处理。
2 结果与讨论
2.1 肌酐酶在酵母孢子中的表达
为了检测肌酐酶在各突变株孢子内的表达水平差异,需要进行蛋白免疫印记(Western blot)分析且上样量一致。从图2中可知,除对照组没有条带外,其他孢子中都有条带,但不同孢子中肌酐酶的表达水平有明显差异,也即不同突变株孢子包埋固定肌酐酶的能力有差异。由于野生型、osw2Δ、kre1Δ孢子都有二酪氨酸层,所以三者固定肌酐酶的量基本一致。dit1Δ孢子虽无二酪氨酸层,但有壳聚糖层能吸附部分肌酐酶,因此其固定肌酐酶的量明显少于野生型、osw2Δ、kre1Δ孢子,而chs3Δ孢子缺少壳聚糖层和二酪氨酸层,不能吸附、阻止肌酐酶外泄,所以chs3Δ孢子基本不能固定肌酐酶。

图2 蛋白免疫印迹分析肌酐酶在酵母孢子中的表达Fig.2 Western blot analysis of creatininase expression level in yeast spores
为了验证该推论是否正确,分别对野生型、chs3Δ孢子及对照组中的培养液进行酶活测定(见图3),发现chs3Δ孢子培养液中的肌酐酶活性显著高于野生型孢子的培养液,而野生型孢子培养液的酶活明显高于对照组,是因为孢子壁中壳聚糖层和二酪氨酸层的形成需要一段时间,在孢子壁没有完全组装形成之前,是无法阻止肌酐酶外泄的,所以野生型孢子的培养液也有酶活。该结果说明,孢子壁中的壳聚糖层和二酪氨酸层是影响孢子固定肌酐酶能力的主要因子,特别是二酪氨酸层对孢子固定肌酐酶的能力有重要影响。同时,该结果也说明kre1Δ孢子固定肌酐酶的能力与野生型、osw2Δ孢子相同。
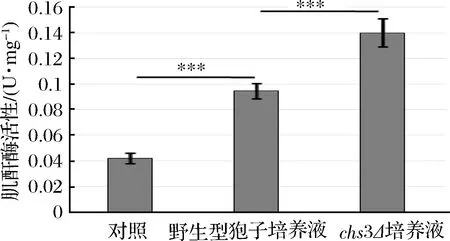
图3 不同突变体孢子培养液中肌酐酶活性Fig.3 Activity of creatininase in the cultureof different mutant spores (***p<0.001)
2.2 孢子中肌酐酶的酶活比较
为了检测肌酐酶在孢子内是否有活性,需要进行酶活检测(图4)。图4-A的结果表明,kre1Δ孢子与osw2Δ孢子的肌酐酶活最高,dit1Δ孢子的酶活略低于kre1Δ、osw2Δ,这三者间的酶活无明显差异,但都显著高于野生型孢子与chs3Δ孢子的肌酐酶活,而不含肌酐酶的对照组酶活最低,显著低于野生型孢子。图4-A与图2的结果略有不同,图2中野生型孢子包埋固定肌酐酶的量明显多于dit1Δ孢子,但酶活却显著低于dit1Δ孢子,原因是野生型孢子中的二酪氨酸层完整严密,所以能包埋固定较多的肌酐酶,但同时也阻碍了孢外底物与酶充分接触,因此酶活较低。

A-不同突变体孢子酶活;B-野生型完整孢子与野生型破碎孢子酶活图4 孢子微胶囊固定肌酐酶活性Fig.4 Activity of spore-encapsulated creatininase (*p<0.05;***p<0.001)
为了验证该假设是否正确,取等量的野生型孢子两份,1份进行破碎处理,另1份不破碎,然后对这两份样品中的肌酐酶活进行测定。从图4-B中可看出,野生型破碎孢子中的酶活明显高于野生型完整孢子中的酶活,说明野生型孢子中的二酪氨酸层确实会阻碍底物与酶的接触反应,从而影响其酶活。而dit1Δ孢子虽无二酪氨酸层,但还有壳聚糖层能吸附固定部分肌酐酶,所以其固定酶的能力有所减弱,但由于没有二酪氨酸层的阻挡,孢外底物可充分与壳聚糖层上的肌酐酶接触反应,所以dit1Δ孢子的酶活反而比野生型孢子的酶活高(图4-A)。而kre1Δ与osw2Δ虽有二酪氨酸层,但二者的孢子壁可能出现一定程度的松散,增加了孢子壁的通透性。这样既能包埋固定较多的酶,同时孢外底物也能通过二酪氨酸层与酶接触反应,所以酶活较高。而chs3Δ孢子没有二酪氨酸层和壳聚糖层,基本不能包埋固定肌酐酶,所以酶活较低。该结果表明kre1Δ孢子与osw2Δ孢子一样,不仅能固定较多的酶,而且酶活也显著高于野生型孢子。
2.3 孢子中肌酐酶的可重复利用性分析
由于野生型孢子与kre1Δ、osw2Δ孢子都能固定较多的酶,而dit1Δ孢子虽然固定酶的能力有所减弱,但酶活较高。因此以可重复利用性为标准来进一步确认孢子微胶囊肌酐酶的稳定性。从图5中可看出,在重复利用5次后,野生型孢子的肌酐酶相对酶活下降最慢,其残留肌酐酶的相对酶活还有87.36%,其次为kre1Δ,其相对酶活还有85.13%,而后是osw2Δ,其相对酶活还有78.86%,而dit1Δ孢子肌酐酶的相对酶活下降最快,其残留肌酐酶的相对酶活只有56.97%。该结果表明kre1Δ与osw2Δ孢子一样都有较好的可重复利用性,同时酶活也高。
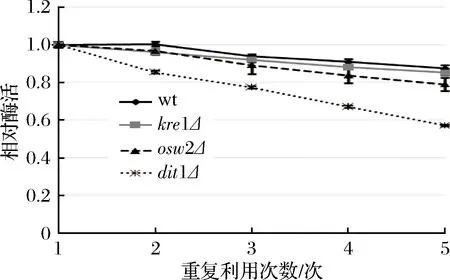
图5 孢子微胶囊肌酐酶的可重复利用性分析Fig.5 The reusability of encapsulated creatininase
2.4 孢子肌酐酶的抗逆性分析
为了研究孢子微胶囊肌酐酶是否具有抗逆性,分别利用蛋白酶K和5%的SDS对孢子微胶囊酶及游离酶进行处理,然后检测肌酐酶活,并与未经蛋白酶K及SDS处理的酶活进行比较。从图6中可看出,经蛋白酶K处理后,野生型、kre1Δ、osw2Δ及dit1Δ孢子的相对酶活分别为96.47%,86.81%,83.02%,73.26%;经5%的SDS处理后(图7),野生型、kre1Δ、osw2Δ及dit1Δ孢子的相对酶活分别为92.63%,84.63%,82.25%,66.36%。而游离肌酐酶的抗逆性较弱,经蛋白酶K及SDS处理后,其相对酶活分别为40.65%,41.02%。该结果表明孢子固定的肌酐酶都表现出较强的抗蛋白酶K及抗SDS能力,且孢子微胶囊肌酐酶的抗逆性显著高于游离酶。同时,该结果也说明不同孢子壁缺陷的孢子,其抗逆性也有差异,因dit1Δ孢子没有二酪氨酸层的保护,所以抗逆性不如有二酪氨酸层的孢子,而kre1Δ孢子与野生型、osw2Δ孢子一样都有较强的抗逆性。
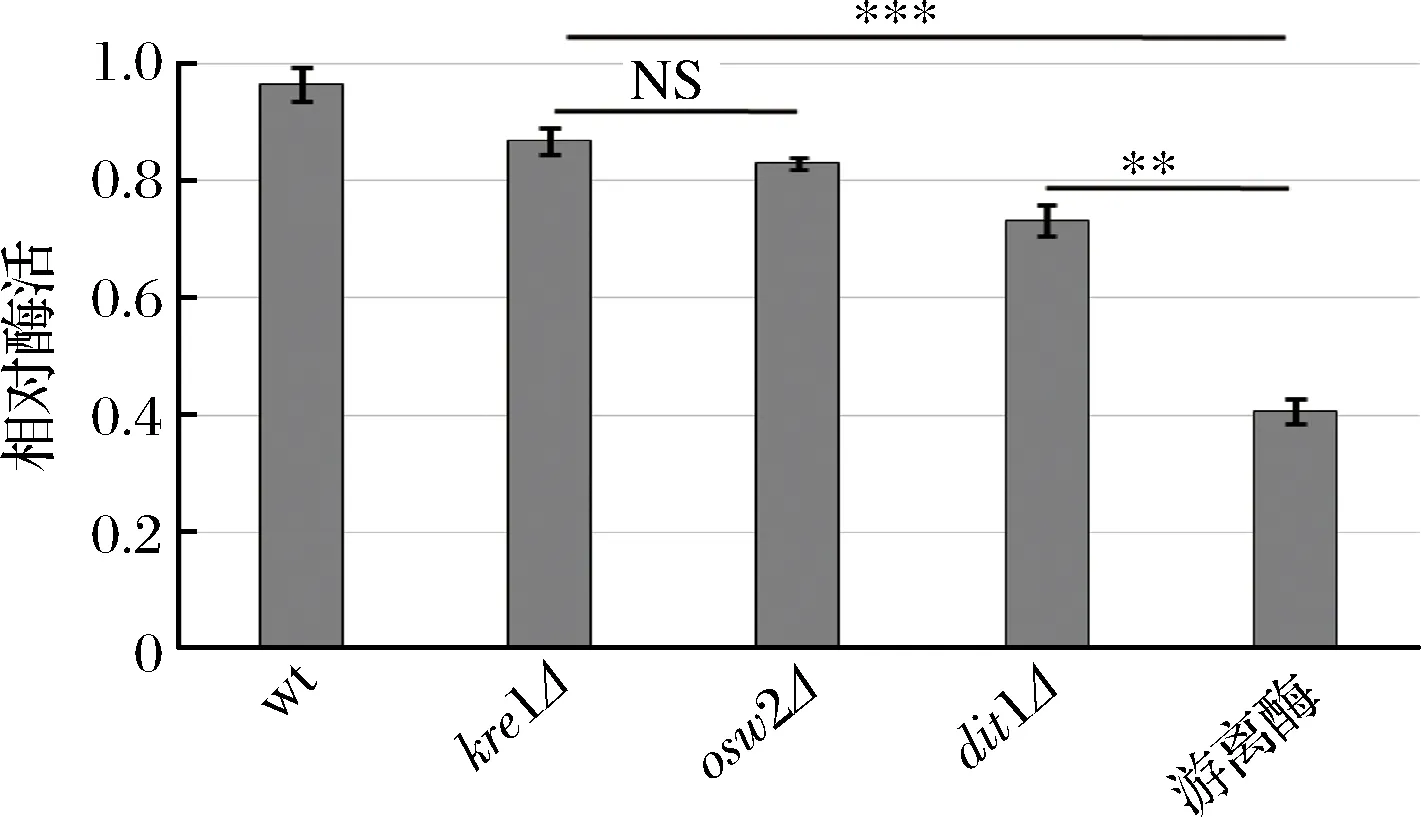
图6 孢子微胶囊肌酐酶抗蛋白酶K能力分析Fig.6 Stability of encapsulated creatininase against proteinase K treatment (NS,不显著**p<0.01;***p<0.001)
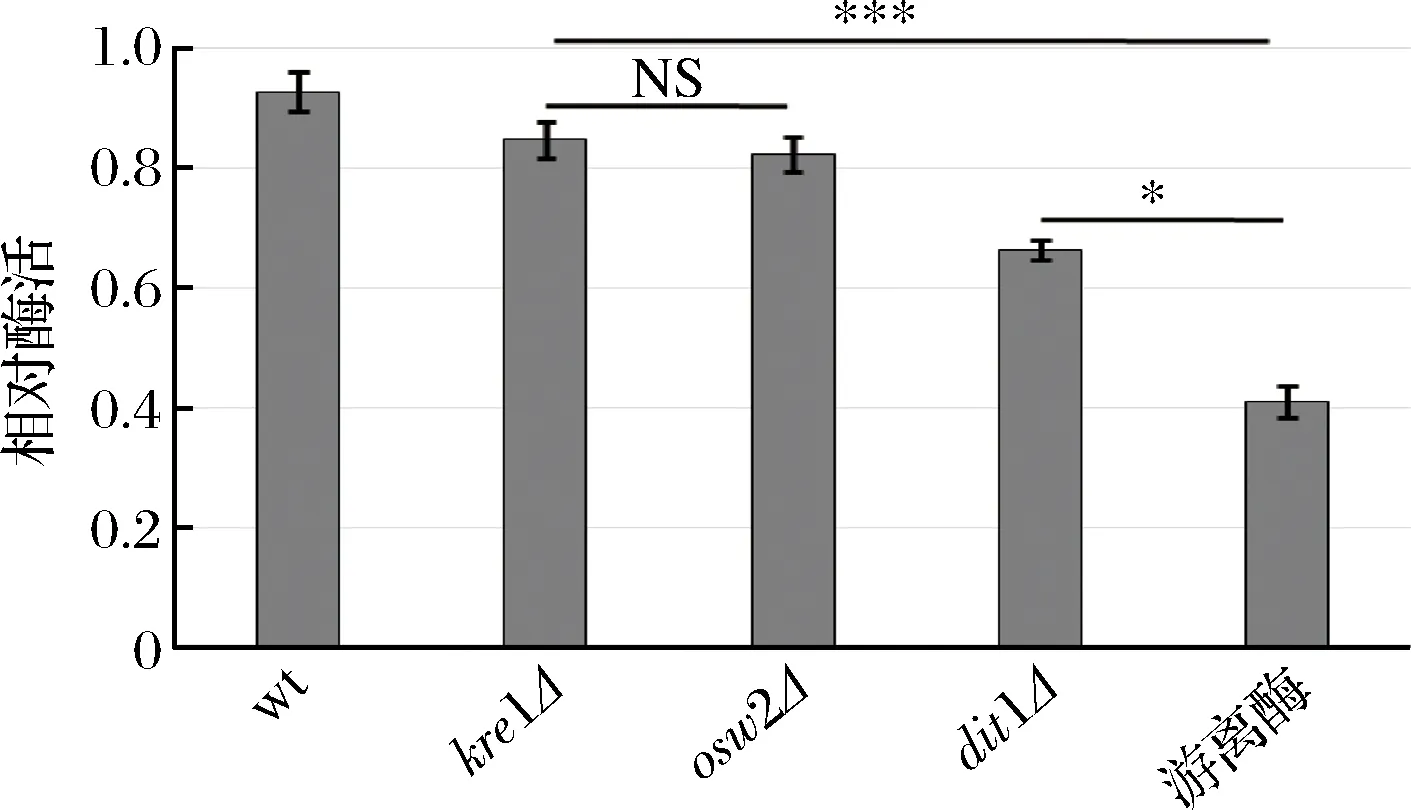
图7 孢子微胶囊肌酐酶抗SDS能力分析Fig.7 Stability of encapsulated creatininase against SDS treatment (NS,不显著*p<0.05;***p<0.001)
2.5 温度和pH对肌酐酶的影响
综合上述结果可知,dit1Δ孢子在可重复利用性及抗逆性等方面都逊色于其他类型孢子,因此为了研究不同温度和pH对孢子微胶囊肌酐酶的影响,只对野生型、kre1Δ、osw2Δ及对照组游离酶进行分析。从图8中可看出,孢子微胶囊肌酐酶和游离肌酐酶的酶活最适温度都为60 ℃,当温度高于60 ℃以后,游离肌酐酶的酶活逐渐下降,在90 ℃高温时,游离酶的相对酶活只有60%左右。与游离肌酐酶相比,经孢子固定的肌酐酶在不同温度下都表现出较好的稳定性,即使在90 ℃高温条件下,孢子固定的肌酐酶相对酶活依然维持在80%以上,说明孢子固定的肌酐酶具有较好的耐高温性。在不同pH条件下反应时,孢子固定的肌酐酶和游离肌酐酶的相对酶活最适pH均为6.0 (图9)。当大于pH 7.0,游离肌酐酶的相对酶活随着pH值升高而迅速下降,当pH 12.0时,游离酶的相对酶活降到40%以下,而孢子固定的肌酐酶相对酶活虽然也有所下降,但依然维持在80%以上,说明孢子固定的肌酐酶表现出较广范围的pH耐受性。同时,该结果也表明kre1Δ孢子与野生型、osw2Δ孢子一样,都有较好的耐高温性及较广范围的pH耐受性。
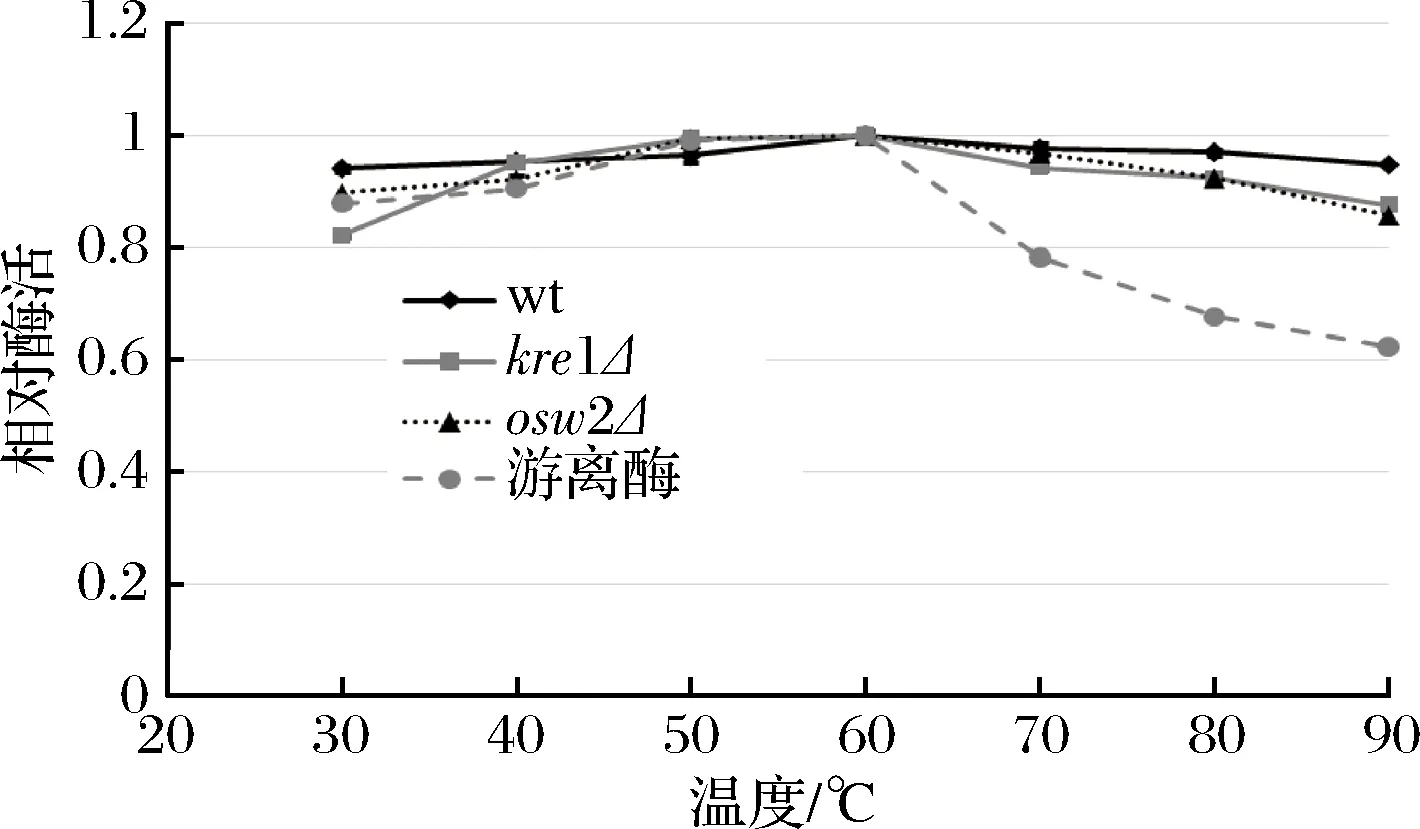
图8 温度对孢子微胶囊肌酐酶活的影响Fig.8 The effect of temperature on activity of the spore- encapsulated creatininase
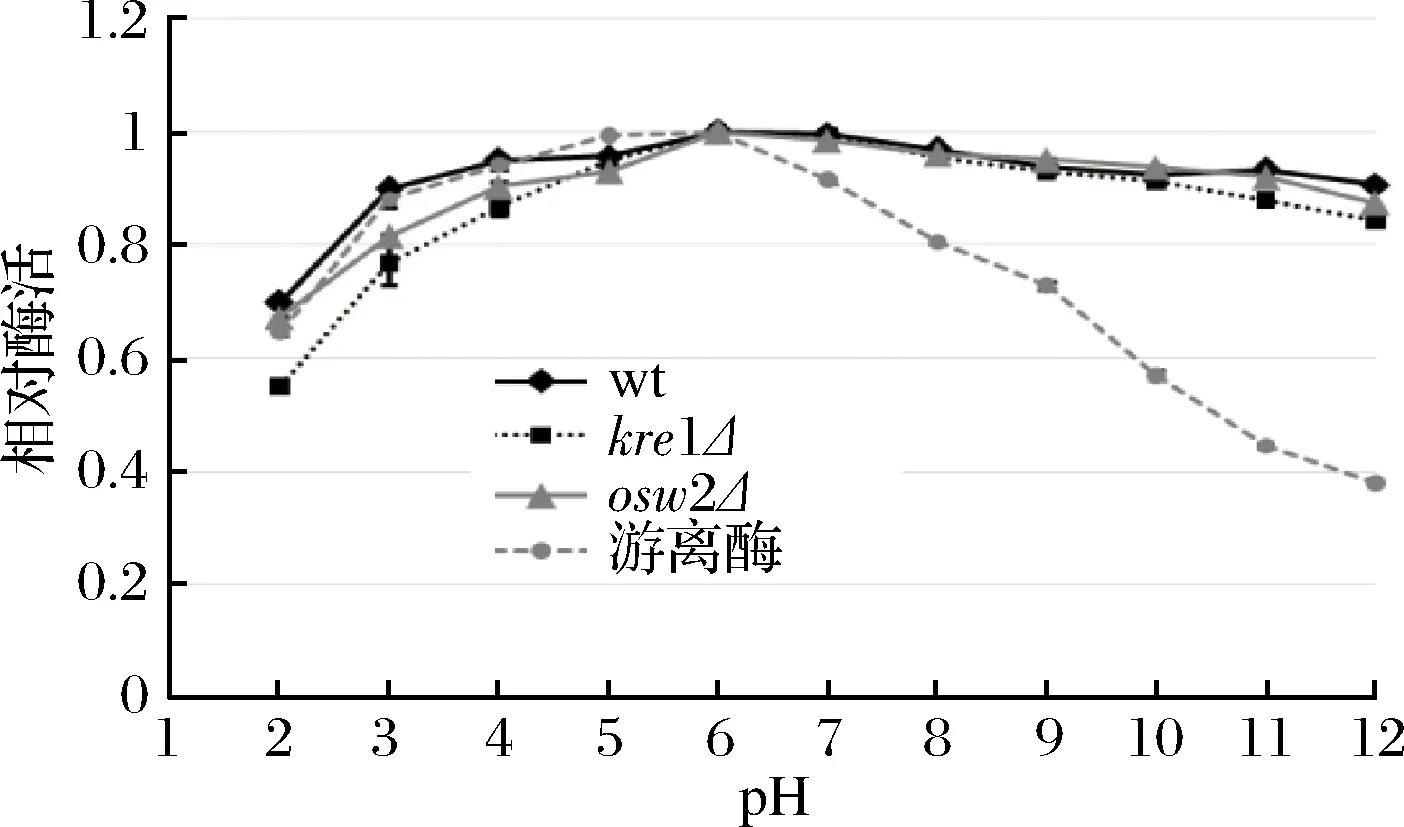
图9 pH对孢子微胶囊肌酐酶活的影响Fig.9 The effect of pH on activity of the spore- encapsulated creatininase
3 结论
利用不同孢子壁缺陷的酵母孢子对肌酐酶进行固定,并对孢子微胶囊肌酐酶的酶学性能进行了分析。虽然KRE1与OSW2功能不同,但kre1Δ孢子固定的肌酐酶酶学性能与osw2Δ孢子固定的肌酐酶学性能相近,二者酶活都显著高于野生型孢子。因游离肌酐酶没有任何保护,直接暴露在环境中,所以不能重复利用且抗逆性较弱,其酶活受外界的温度、pH等因素的影响较大,而孢子固定的肌酐酶由于有孢子壁,特别是二酪氨酸层的保护,表现出较好的可重复利用性,不仅抗逆性强而且具有较强的耐高温性及较广范围的pH耐受性。因此,kre1Δ孢子也可作为优良的酶固定化载体在以后的研究中加以应用。
肌酐酶也称肌酐酰胺水解酶,可将肌酐催化生成肌酸,肌酸在碱性条件和α-萘酚的催化下可生成紫红色物质,该物质在OD525处有最大吸收峰。因肌酐在很多肾脏类疾病中都有重要的诊断指示作用[17],但游离的肌酐酶在强酸、强碱和高温等条件下不稳定,同时也存在不易长期贮存、无法重复利用及不易保持活力等缺点,其应用受到一定的限制。而固定化后的酶,有较高的稳定性且能重复利用,可在一定程度上解决这些问题。目前,固定化酶的方法主要有化学法和物理法两大类,化学法包括交联法和结合法;物理法包括吸附法与包埋法。但这些方法各有缺点[18],如交联法反应条件比较激烈,交联过程需要酶分子参与化学反应,固定化后酶容易失活且不易回收;结合法反应条件较苛刻,操作工艺复杂且固定化后酶活力有所下降;吸附法固定的酶与载体的结合力较弱,容易受外界因素影响而脱离;包埋法则易受包埋孔径的限制,大分子底物难与被包埋的酶分子接触,只适合小分子催化底物的反应。酵母孢子微胶囊酶固定法是一种新型的生物固定方法。该方法的优势是直接在酵母孢子内表达酶,无需提纯酶,即可直接应用;生产工艺简单,不改变酶分子结构,固定化后酶活较高;可常温长期储存,而且具有较好的抗逆性及可重复利用性;同时还可利用分子生物学手段改变孢子壁通透性,提高酶活。鉴于游离肌酐酶存在诸多应用限制,而用酵母孢子微胶囊肌酐酶固定法可有效克服这些困难。因此,有望用酵母孢子建立一种快速方便的肌酐酶临床诊断方法,本研究为该方法的建立提供了一定的理论依据。
[1] NEIMAN A M. Ascospore formation in the yeastSaccharomycescerevisiae[J]. Microbiology & Molecular Biology Reviews Mmbr, 2005, 69(4): 565-584.
[2] RIJ K V. Electron microscopy of germinating ascospores ofSaccharomycescerevisiae[J]. Archives of Microbiology, 1978, 117(1): 73-77.
[3] TACHIKAWA H, BLOECHER A, TATCHELL K, et al. A Gip1p-Glc7p phosphatase complex regulates septin organization and spore wall formation [J]. Journal of Cell Biology, 2001, 155(5): 797-808.
[4] COLUCCIO A, BOGENGRUBER E, CONRAD M N, et al. Morphogenetic pathway of spore wall assembly inSaccharomycescerevisiae[J]. Eukaryotic Cell, 2004, 3(6): 1 464-1 475.
[5] LESAGE G, BUSSEY H. Cell wall assembly inSaccharomycescerevisiae[J]. Microbiol Mol Biol Rev, 2006, 70(2): 317-343.
[6] PAMMER M, BRIZA P, ELLINGER A, et al.DIT101 (CSD2,CAL1), a cell cycle-regulated yeast gene required for synthesis of chitin in cell walls and chitosan in spore walls [J]. Yeast, 1992, 8(12): 1 089-1 099.
[7] BRIZA P, ECKERSTORFER M, BREITENBACH M. The sporulation-specific enzymes encoded by theDIT1 andDIT2 genes catalyze a two-step reaction leading to a solubleLL-dityrosine-containing precursor of the yeast spore wall [J]. Proceedings of the National Academy of Sciences, 1994, 91(10): 4 524-4 528.
[8] BRIZA P, ELLINGER A, WINKLER G, et al. Characterization of aDL-dityrosine-containing macromolecule from yeast ascospore walls [J]. Journal of Biological Chemistry, 1990, 265(25): 15 118-15 123.
[9] SUDA Y, RODRIGUEZ R K, COLUCCIO A E, et al. A screen for spore wall permeability mutants identifies a secreted protease required for proper spore wall assembly [J]. Plos One, 2009, 4(9): 1-10.
[10] KONG Jan, LI Zi-jie, ZHANG Hui-jie, et al. Production of encapsulated creatinase using yeast spores [J]. Bioengineered, 2016,8(4): 1-9.
[11] KONG Jun, LI Zi-jie, ZHANG Hui-jie, et al. Consecutive hydrolysis of creatinine using creatininase and creatinase encapsulated inSaccharomycescerevisiaespores [J]. Biotechnology Letters, 2017,39(2): 261-267.
[12] SHI L, LI Z, TACHIKAWA H, et al. Use of yeast spores for microencapsulation of enzymes [J]. Applied & Environmental Microbiology, 2014, 80(15): 4 502-4 510.
[13] PAN H P, WANG N, TACHIKAWA H, et al. ß-1,6-glucan synthesis-associated genes are required for proper spore wall formation inSaccharomycescerevisiae[J]. Yeast, 2017,34(1):431-446.
[14] NEIMAN A M, KATZ L, BRENNWALD P J. Identification of domains required for developmentally regulated SNARE function inSaccharomycescerevisiae[J]. Genetics(Print), 2000, 155(4): 1 643-1 655.
[15] ZHANG H, TACHIKAWA H, GAO X D, et al. Applied usage of yeast spores as chitosan beads [J]. Applied & Environmental Microbiology, 2014, 80(16): 5 098-5 105.
[16] 李毅, 李子杰, 中西秀树, 等. 木糖异构酶酿酒酵母孢子“微胶囊”的构建及酶学性质分析 [J]. 食品与发酵工业, 2015, 41(4): 6-11.
[17] 李萍, 赵莹, 余霆. 肌酐在肾小球滤过功能损伤诊断中的价值的系统评价 [J]. 中国循证医学杂志, 2004, 4(11): 752-758.
[18] 隋颖. 生物酶固定化方法的研究新进展 [J]. 山东化工, 2013, 42(8): 71-72.

