马克斯克鲁维酵母生物转化2-苯乙醇工艺优化及耐高温特性分析
牛明福,李亚恒,陈金帅,李阳
1(河南科技大学 食品与生物工程学院,河南 洛阳,471023) 2(洛阳市微生物发酵工程技术研究中心,河南 洛阳,471023) 3(河南科技大学,微生物资源开发与利用重点实验室,河南 洛阳,471023)
2-苯乙醇(2-phenylethanol,2-PE)又称β-苯乙醇,是一种具有柔和而持久玫瑰香气的芳香醇,广泛应用于日化和食用香精中[1-2]。目前主要采用化学合成或从天然物中提取获得该成分。化学合成2-苯乙醇虽已步入工业化生产阶段,但其产物中存在诸多复杂且难以除去的副产物,如氯乙醇、邻氯乙苯、联苯等副产物,并伴随刺激性气味,严重危害人体健康。许多芳香植物如玫瑰、茉莉、风信子等的精油中含有2-苯乙醇,但含量极低,从中提取的2-苯乙醇不仅价格昂贵,且难以满足市场需求[3-4]。因此,通过微生物发酵法生产天然2-苯乙醇得到了国内外研究人员的广泛关注[5]。
多种酵母具有合成2-苯乙醇的能力,如酿酒酵母(Saccharomycescerevisiae)、毕赤酵母(Pichiasp.)、马克斯克鲁维酵母(Kluyveromycesmarxianus)及异常汉逊酵母(Hansenulaanomala)等[6],主要通过艾氏途径(Ehrlich pathway),将L-苯丙氨酸转化成2-苯乙醇[7-8]。限制酵母转化合成2-苯乙醇能力的因素有两方面:一方面是发酵过程中存在严重的产物抑制效应,这是影响2-苯乙醇产量的主要瓶颈之一[9];另一方面,为了控制因发酵产热造成的温度上升,需要安装控温装置,导致生产成本增加[10]。因此,筛选2-苯乙醇耐受性能较好且具有耐高温能力的优质菌株是实现生物转化2-苯乙醇工业化生产的关键。在前期研究中,本课题组筛选出1株耐高温且2-苯乙醇耐受性良好的马克斯克鲁维酵母LY1菌株,其最适生长温度为37 ℃,在基础转化培养基中发酵2-苯乙醇的产量为0.96 g/L。马克斯克鲁维酵母是一种具有可利用底物广泛、生长速率较快等优势的耐高温酵母[11]。本试验通过单因素与响应面分析,探讨主要培养基成分对酵母合成2-苯乙醇的影响,得到较优的培养基组成,并研究LY1菌株在高温条件下的发酵性能。
1 材料与方法
1.1 材料
1.1.1 菌种
马克斯克鲁维酵母LY1菌株、酿酒酵母AC菌株:由河南科技大学微生物基因工程研究室分离鉴定。
1.1.2 培养基
固体YPD培养基(g/L):葡萄糖 20.0,蛋白胨 20.0,酵母浸粉 10.0,琼脂粉 20.0,自然pH值。
液体种子培养基(g/L):葡萄糖 20.0,蛋白胨 20.0,酵母浸粉 10.0,自然pH值。
基础转化培养基(g/L):葡萄糖 60.0,蛋白胨 6.0,MgSO40.5,KH2PO45.0,L-苯丙氨酸 6.0,自然pH值。
1.1.3 主要试剂
L-苯丙氨酸:生工生物公司(上海)股份有限公司,纯度98.5%;2-苯乙醇标准品:生工生物公司(上海)股份有限公司,纯度98.0%;甲醇:西陇化工股份有限公司,色谱纯。
1.2 主要设备
恒温组合式摇床(HYL-C2),太仓市强乐实验设备有限公司;高效液相色谱仪(1260 Infiity),美国安捷伦科技有限公司。
1.3 方法
1.3.1 种子液的制备
将保种管中的酵母菌划线接入固体YPD培养基,于28 ℃培养48 h。从培养皿挑取1环单菌落至5 mL种子培养基中,于28 ℃、200 r/min振荡培养24 h。
1.3.2 2-苯乙醇的转化合成
将种子液按10%接种量接种于转化培养基,28 ℃条件下200 r/min振荡培养48 h。
1.3.3 2-苯乙醇的检验方法
采用反相高效液相色谱法测定2-苯乙醇的产量[12],转化培养48 h后,发酵液经12 000 r/min离心10 min,小心吸取上清,用0.22 μm有机系滤膜过滤。HPLC检测条件为:Venusil MP C18色谱柱(4.6 mm×250 mm),进样量10 μL,流动相为(甲醇)∶(水)=6∶4,流速0.6 mL/min,柱温30 ℃,检测波长260 nm,检测时间12 min。
1.3.4 单因素试验
以2-苯乙醇产量为指标,分别考察转化培养基主要成分对2-苯乙醇合成的影响,包括L-苯丙氨酸添加量、碳源种类及添加量、氮源种类及添加量[13]。各项添加水平如下:
L-苯丙氨酸:0、2.0、4.0、6.0、8.0、10.0、12.0 g/L;
不同种类碳源:葡萄糖、麦芽糖、蔗糖、菊粉、乳糖、甘油均为60.0 g/L;
碳源:20.0、40.0、60.0、80.0、100.0、120.0 g/L;
不同种类氮源:酵母浸粉、蛋白胨、尿素、硫酸铵均为6.0 g/L;
氮源:0、2.0、4.0、6.0、8.0、10.0、12.0 g/L。
1.3.5 响应面优化试验设计
在单因素试验的基础上,选取3个自变量,以2-苯乙醇产量为响应值,采用Box-Behnken设计方法对培养基成分进行三因素三水平响应面分析试验,利用Design-Expert软件进行数据处理和回归分析[14]。
1.3.6 耐受性试验
用无菌水将种子液稀释,吸取200 μL均匀涂布于含不同质量浓度2-苯乙醇(0、0.5、1.0、1.5、2.0、2.5、3.0、3.5 g/L)的固体培养基上,分别置于28、36、42 ℃恒温培养箱中培养72 h,计算长出的酵母菌落数。
1.3.7 高温发酵试验
将种子液接种到优化后的转化培养基中,分别在28、30、32、34、36、38、40、42 ℃条件下进行发酵,测定发酵液中2-苯乙醇的质量浓度。
2 结果与分析
2.1 单因素试验结果
2.1.1L-苯丙氨酸添加量对2-苯乙醇合成的影响
艾氏途径中,L-苯丙氨酸作为底物参与2-苯乙醇的合成。L-苯丙氨酸添加量对2-苯乙醇合成的影响如图1所示,当L-苯丙氨酸质量浓度范围在0~6 g/L时,2-苯乙醇产量增加幅度较大,L-苯丙氨酸添加量超过8.0 g/L时,2-苯乙醇产量基本稳定,但底物质量浓度的增加会使转化率呈下降趋势[15],造成原料利用率降低。因此,L-苯丙氨酸最佳添加量应为8 g/L。
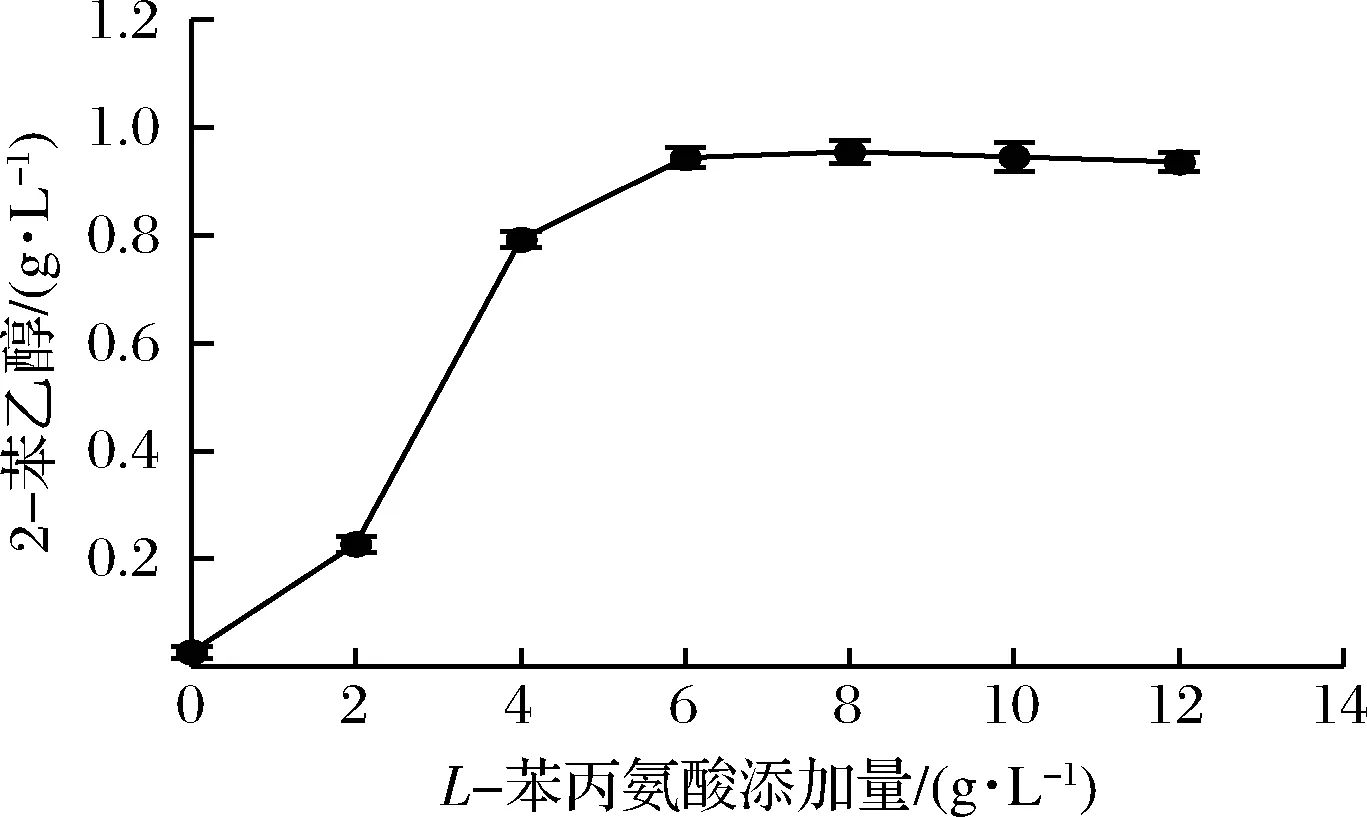
图1 L-苯丙氨酸添加量对转化2-苯乙醇的影响Fig.1 Effects of L-Phe dosage on 2-PE production
2.1.2 碳源种类对2-苯乙醇合成的影响
马克斯克鲁维酵母可以产生菊粉酶、乳糖酶等水解酶,与其他酵母相比可利用的底物较广泛[16]。碳源种类对2-苯乙醇合成的影响如图2所示,LY1菌株能够较好地利用葡萄糖和蔗糖作为碳源,以供生物转化2-苯乙醇,亦能利用菊粉,但以麦芽糖、乳糖、甘油作为碳源的2-苯乙醇产量较低。因此,选择产量最高且成本较低的蔗糖作为碳源进行后续试验。
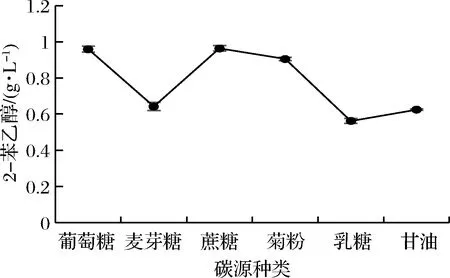
图2 不同碳源对转化2-苯乙醇的影响Fig.2 Effects of carbon sources on 2-PE production
2.1.3 碳源添加量对2-苯乙醇合成的影响
以蔗糖作为碳源,考察不同添加量对转化2-苯乙醇的影响,结果见图3。蔗糖质量浓度在20.0~40.0 g/L范围内时,随着蔗糖添加量的增加,2-苯乙醇产量显著提高。但随着蔗糖的继续添加,2-苯乙醇产量呈下降趋势,说明在高糖环境下,酵母细胞内外渗透压的差异影响了菌体的正常生长,导致2-苯乙醇产量下降。因此,确定蔗糖的最佳添加量是40.0 g/L。
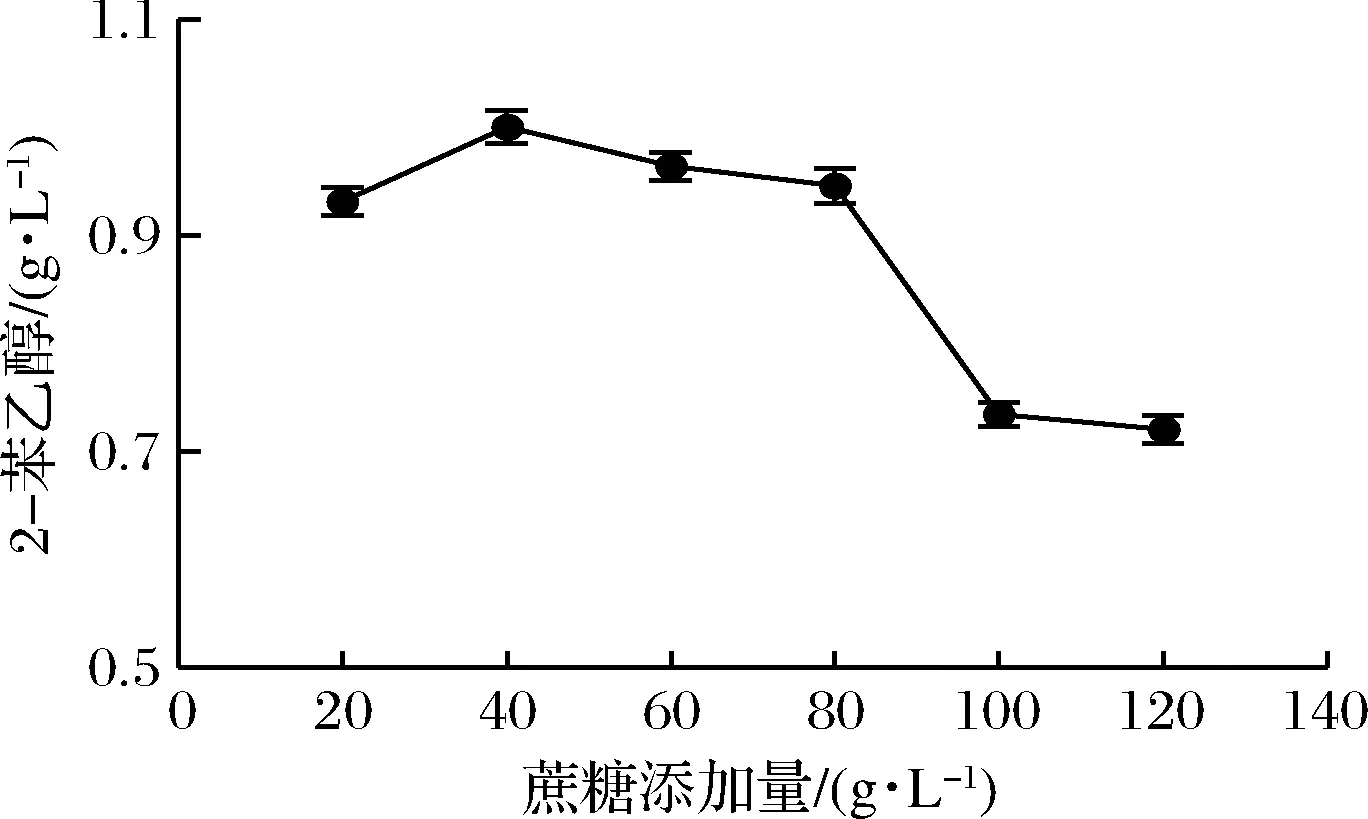
图3 蔗糖添加量对转化2-苯乙醇的影响Fig.3 Effect of sucrose dosage on 2-PE production
2.1.4 氮源种类对2-苯乙醇合成的影响
氮源分为有机氮和无机氮,选择酵母浸粉、蛋白胨、尿素、(NH4)2SO44种常用氮源[17],分别考察添加不同氮源和不添加氮源(仅以L-苯丙氨酸作为唯一氮源)对LY1菌株转化2-苯乙醇的影响,结果如图4所示。
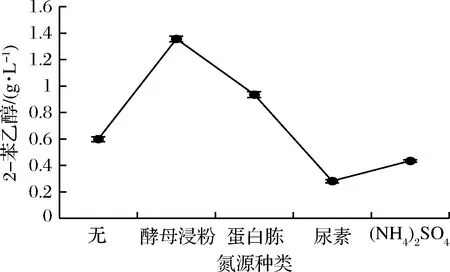
图4 不同氮源对转化2-苯乙醇的影响Fig.4 Effects of nitrogen sources on 2-PE production
酵母浸粉或蛋白胨作为氮源以供酵母利用时,转化2-苯乙醇的效果高于尿素和(NH4)2SO4,说明LY1菌株利用有机氮的能力高于无机氮。当L-苯丙氨酸作为唯一氮源时,2-苯乙醇转化效果并不理想,是因为L-苯丙氨酸作为氮源不能满足酵母正常生长需求,导致菌体活性不高,转化2-苯乙醇的能力也随之下降。因此,选择酵母浸粉作为转化氮源以供后续试验。
2.1.5 氮源添加量对2-苯乙醇合成的影响
以酵母浸粉为氮源,考察氮源添加量对2-苯乙醇合成的影响,结果见图5。随着酵母浸粉添加量的增加,2-苯乙醇产量呈上升趋势,当酵母浸粉质量浓度超过6.0 g/L时,2-苯乙醇产量略有下降。说明添加适量的氮源有利于2-苯乙醇的合成,氮源过量对转化2-苯乙醇的效果并不明显。当培养基中酵母浸粉质量浓度超过10.0 g/L时,高效液相色谱的结果会受到酵母浸粉的影响,无法检测2-苯乙醇产量。因此,确定酵母浸粉的最佳添加量是6.0 g/L。
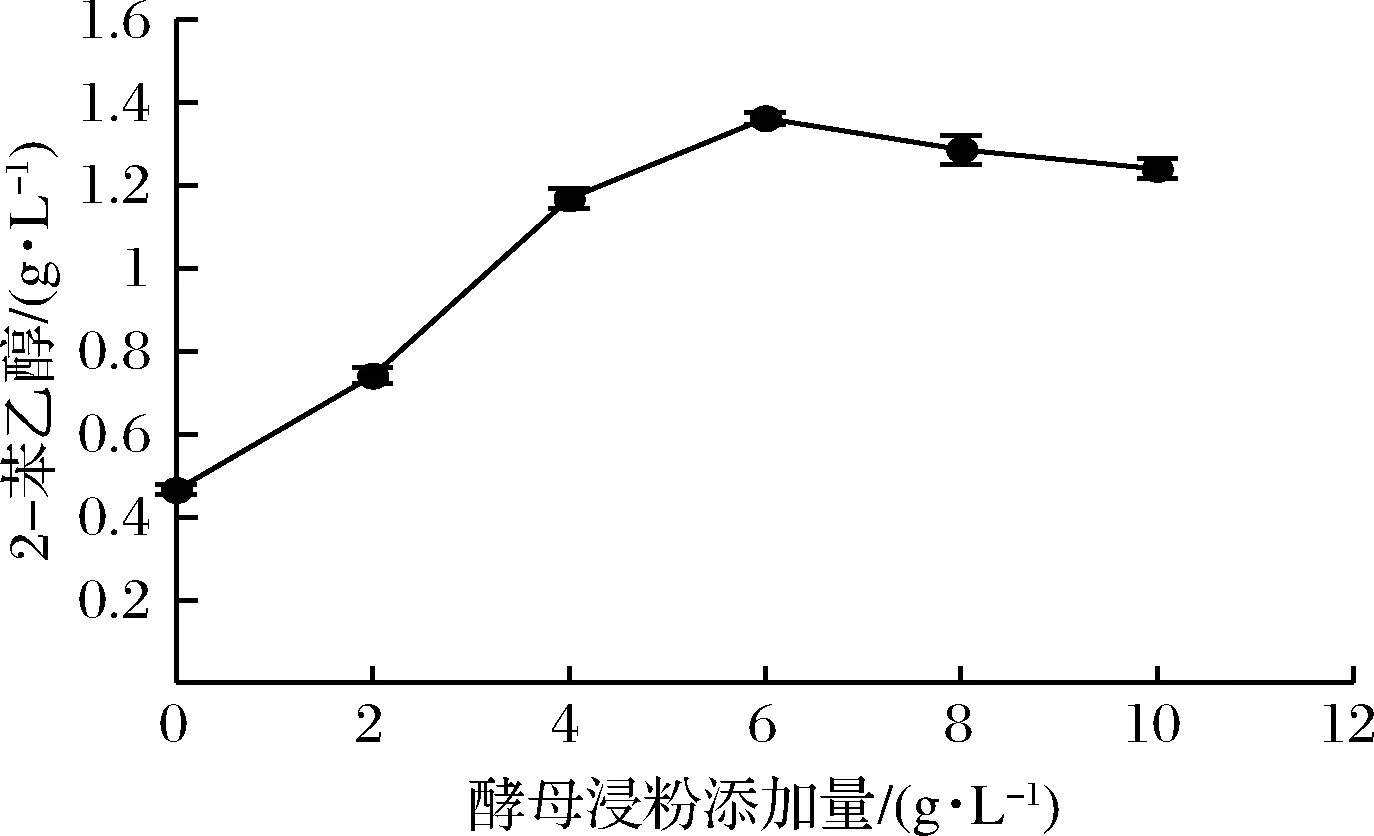
图5 酵母浸粉添加量对转化2-苯乙醇的影响Fig.5 Effect of yeast extracts dosage on 2-PE production
2.2 响应面分析试验结果
综合单因素试验结果,选取L-苯丙氨酸添加量(A)、蔗糖添加量(B)、酵母浸粉添加量(C)作为3个自变量,以2-苯乙醇产量作为响应值,设计三因素三水平响应面分析试验,考察3种培养基成分与2-苯乙醇合成之间的关系。试验设计方案与结果见表1。
对表1中的数据进行逐步回归拟合,得到如下回归方程:Y=1.44+3.125E-003A+0.018B+0.054C+2.000E-003AB-7.500E-004AC-2.500E-003BC-8.125E-003A2-0.054B2-0.079C2,其响应值与自变量之间呈线性关系且较为显著(P>F=0.000 1,线性相关系数R2=0.989 6),该方程可用于分析和预测2-苯乙醇的产量。
根据回归方程得到最优培养基组成为:L-苯丙氨酸8.39 g/L,蔗糖43.25 g/L,酵母浸粉6.68 g/L,预测2-苯乙醇的产量为1.448 g/L。为证实预测结果,用以上配方重复试验3次,得2-苯乙醇平均产量为1.450 g/L,实验值与预测值拟合性良好。
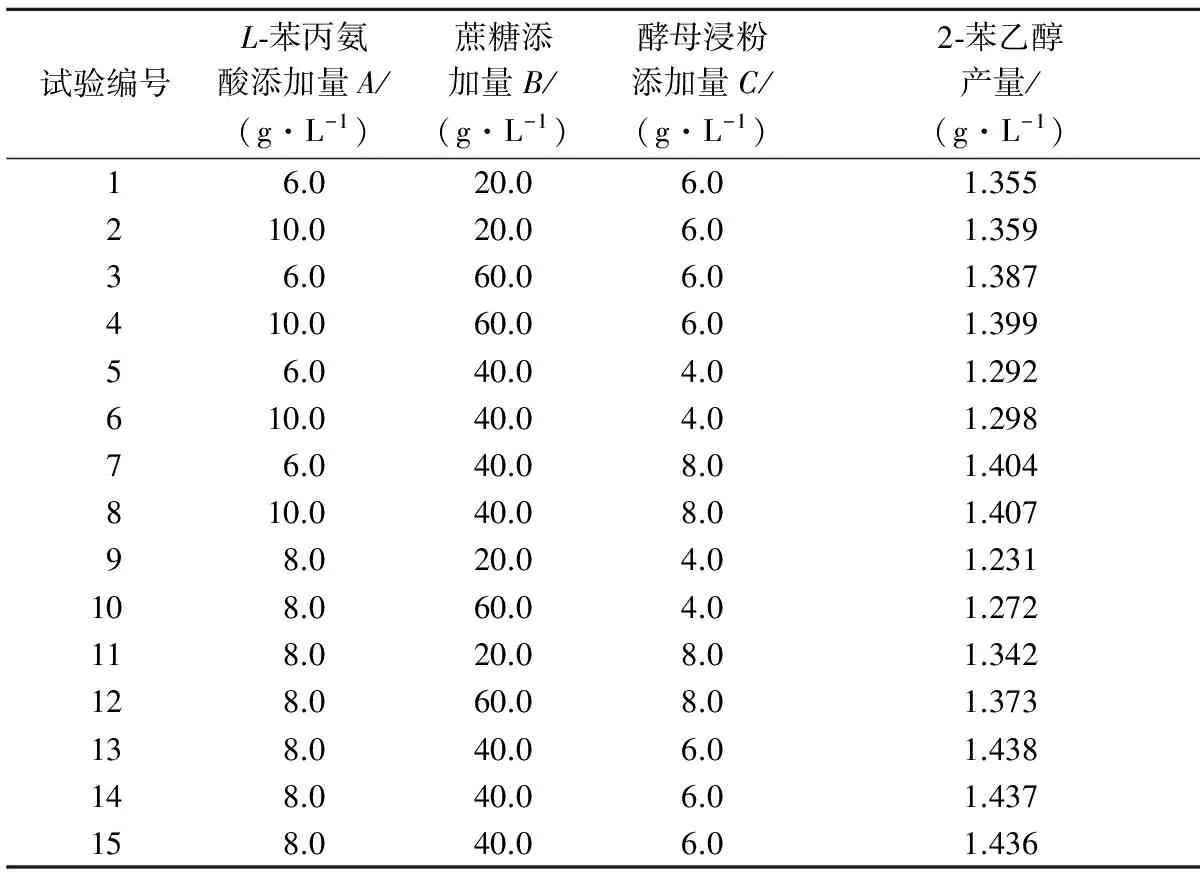
表1 响应面试验设计及响应值Table 1 Experimental design and correspondingresponse value
2.3 因素间的交互影响
对响应面试验进行方差分析,回归方程的交互项中只有BC项显著(p=0.047 3),其余交互项均不显著。说明蔗糖与酵母浸粉添加量对2-苯乙醇合成的影响显著,而L-苯丙氨酸添加量对其影响不显著。响应面回归方程拟合绘制响应面图形,如图6。
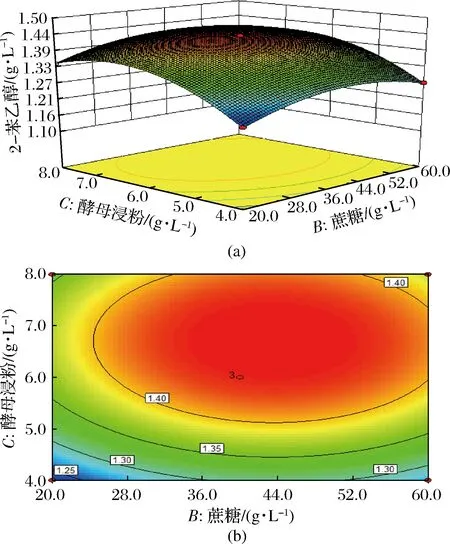
图6 蔗糖与酵母浸粉影响2-苯乙醇产量的响应面和等高线Fig.6 Response surface and contour of the effect on 2-PE production by saccharose and yeast extracts
图6-a是以蔗糖与酵母浸粉添加量为变量生成的响应面图,两者添加量的增加均会使2-苯乙醇产量增大,过量的蔗糖与酵母浸粉不利于2-苯乙醇的生物合成。图6-b中等高线的形状可以反映交互效应的强弱,等高线图成椭圆形,说明两因素之间交互作用显著,对2-苯乙醇合成的影响较大。
2.4 耐受性试验结果
一般酵母菌的最适生长温度在28 ℃左右,而马克斯克鲁维酵母是一种耐高温酵母,可以在42 ℃的高温条件下进行发酵。将酵母菌涂布于含有不同质量浓度2-苯乙醇的固体培养基中,在28~42 ℃培养,考察高温对酵母细胞耐受2-苯乙醇的影响,结果如表2所示。
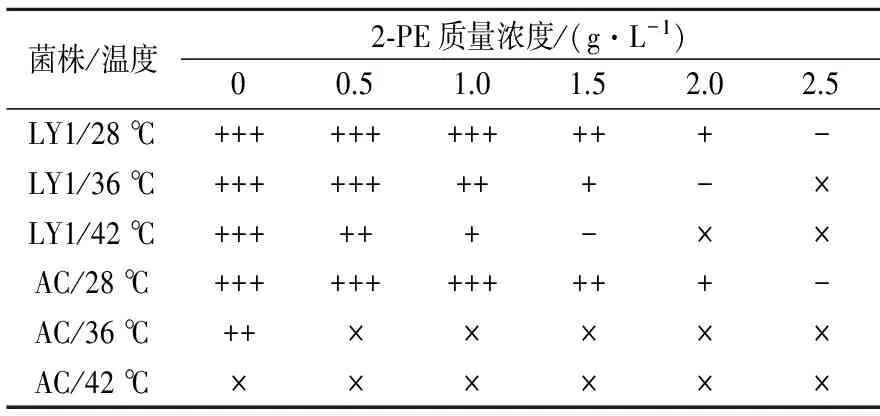
表2 不同温度下2-苯乙醇耐受性结果Table 2 The tolerance of 2-PE under different temperatures
注:+表示生长状况;-表示征耐受极限;×表示完全不生长。
当培养温度为28 ℃时,马克斯克鲁维酵母LY1菌株和酿酒酵母AC菌株的最高2-苯乙醇耐受质量浓度均为2.5 g/L。2-苯乙醇添加量过高会抑制酵母的生长繁殖[18],随着培养温度升高和2-苯乙醇质量浓度的增加,酵母菌落数不断减少表明:高温和2-苯乙醇的联合胁迫作用导致LY1菌株的2-苯乙醇耐受能力降低,37 ℃时的耐受质量浓度为2.0 g/L,且42 ℃时的耐受质量浓度仍为1.5 g/L。然而,酿酒酵母AC菌株的耐受能力较差,42 ℃时仅高温胁迫已完全抑制其正常生长,在37 ℃时虽能正常生长但2-苯乙醇耐受质量浓度几乎为0 g/L。说明马克斯克鲁维酵母具有较强的高温和2-苯乙醇耐受能力,且具有很大的高温发酵2-苯乙醇的潜力。
2.5 高温发酵试验结果
将种子液接种到上述优化后的转化培养基中,在28~42 ℃温度范围内进行发酵,考察高温对LY1菌株转化2-苯乙醇的影响,确定最适发酵温度,结果如图7所示。发酵温度在28~32 ℃范围内时,2-苯乙醇产量较高且稳定,说明LY1菌株转化2-苯乙醇的最佳温度范围在28~32 ℃。随着温度的继续上升,2-苯乙醇产量逐渐下降,在42 ℃时,2-苯乙醇产量为0.809 g/L,说明LY1菌株高温发酵能力较强,在42 ℃高温环境下仍具有一定转化2-苯乙醇的能力。
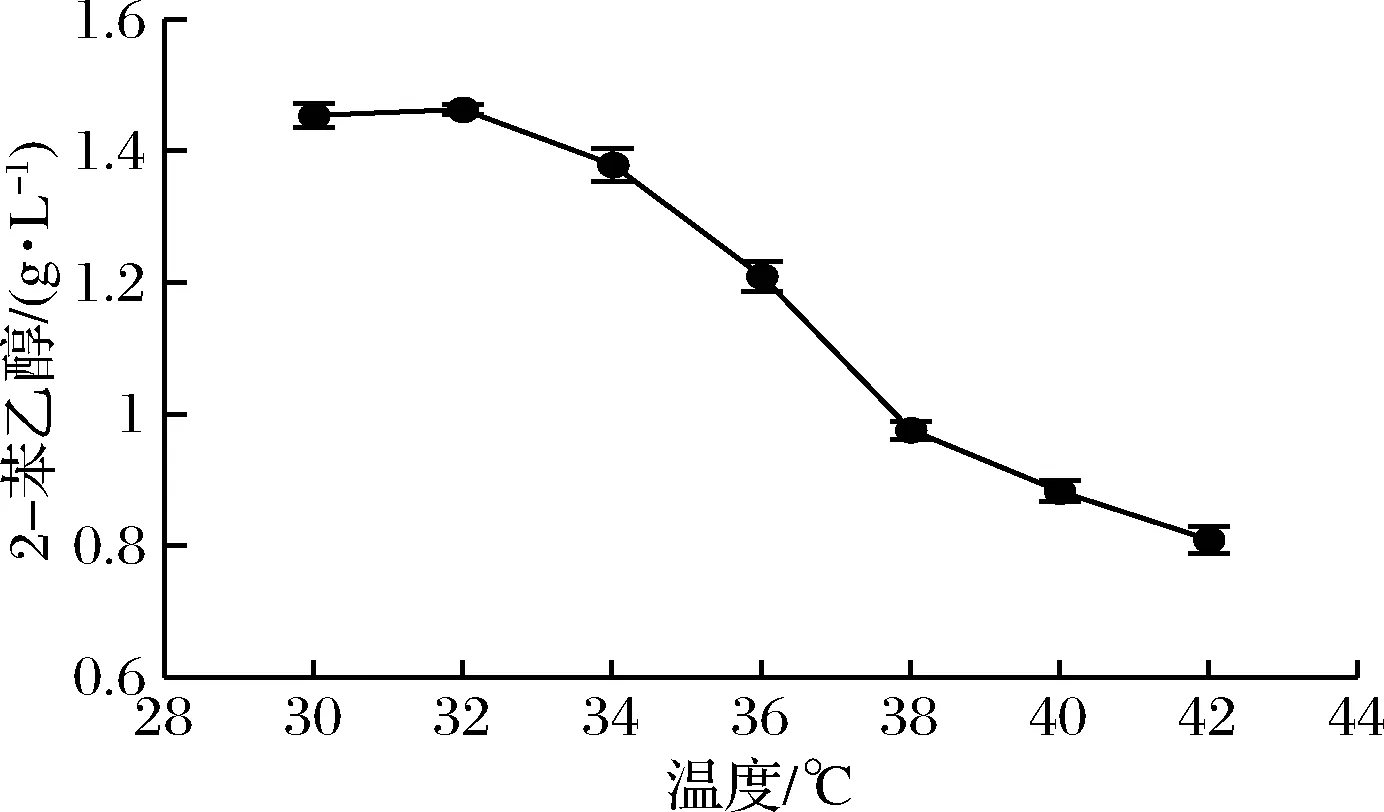
图7 发酵温度对转化2-苯乙醇的影响Fig.7 Effect of fermentation temperature on 2-PE production
目前,国内外有关温度对酵母转化2-苯乙醇影响的报道较少。黄筱萍等[15]研究了不同转化温度对酿酒酵母SH003合成2-苯乙醇的影响,其最适转化温度为28~30 ℃,低于26 ℃和高于32 ℃产物浓度明显下降。明红梅等[19]研究了温度对传统浓香型大曲中分离筛选的异常威克汉姆酵母菌株J7发酵生产2-苯乙醇的影响,发现在33 ℃下发酵时,2-苯乙醇产量最高,并采用响应面法对发酵条件进行优化,当发酵温度为35 ℃时,2-苯乙醇产量为63.50 mg/kg。通常酵母菌转化2-苯乙醇的发酵温度为28~30 ℃,而耐高温酵母可以在35 ℃以上合成2-苯乙醇。ETSCHMANN等[20]筛选出的耐热性马克斯克鲁维酵母CBS600菌株在35 ℃条件下,在以糖蜜为碳源的合成培养基中发酵41 h后,2-苯乙醇终产量达到0.89 g/L。ESHKOL等[21]从耐热酿酒酵母菌株Ye9系列中筛选到了1株能够耐受2.5 g/L以上2-苯乙醇的Ye9-612,30 ℃发酵72 h后,产量达到0.85 g/L。LY1菌株与其他耐高温菌株相比,在35 ℃以上高温条件下具有更强的2-苯乙醇发酵能力。LY1菌株的最适生长温度为37 ℃,而其2-苯乙醇的最适转化温度低于最适生长温度可能与2-苯乙醇合成的相关酶的活性及稳定性有关[19]。对比耐受性试验结果,LY1菌株在36 ℃时的2-苯乙醇产量远低于耐受极限,其高温发酵2-苯乙醇的产量仍具有较大的提升空间。
3 结论
微生物转化合成2-苯乙醇具有成本低、产品质量高等优点,已受到广泛关注。如何提高微生物转化合成2-苯乙醇的产量是近年来的研究重点之一。发酵培养基成分及培养条件能很大程度上影响酵母细胞生产2-苯乙醇的产量。本研究通过单因素试验筛选出合适的转化碳源和氮源,并对主要培养基成分的添加量进行响应面分析,优化后的结果为:L-苯丙氨酸8.39 g/L,蔗糖43.25 g/L,酵母浸粉6.68 g/L。在优化后的转化培养基中发酵48 h后,2-苯乙醇产量可达到1.450 g/L,较优化前提高了51.0 %。与其他耐高温菌株相比,LY1菌株在35 ℃以上具有更强的2-苯乙醇发酵能力,且在42 ℃高温条件下仍具有一定的2-苯乙醇耐受和发酵能力,后续研究可从基因改造方向入手[22],提高其高温和2-苯乙醇耐受性能,进一步提高转化2-苯乙醇的能力。
[1] 丁东栋, 崔志峰, 徐翔, 等. 生物转化法合成2-苯乙醇的研究进展[J]. 工业微生物, 2017,47(2):53-60.
[2] 陈先锐, 王肇悦, 何秀萍. 酵母菌合成2-苯乙醇的研究进展[J]. 生物工程学报, 2016,32(9):1 151-1 163.
[3] 汪琨, 沈情佳, 魏秀燕, 等. 酿酒酵母CWY132发酵罐小试生产2-苯乙醇[J]. 食品与发酵工业, 2011,37(4):102-106.
[4] 崔志峰, 沈情佳, 汪琨, 等. 酿酒酵母CWY132以糖蜜为碳源生产2-苯乙醇的培养条件[J]. 食品与发酵工业, 2010,36(11):10-13.
[5] LU Xin-yao, WANG Yu-qing, ZONG Hong, et al. Bioconversion ofL-phenylalanine to 2-phenylethanol by the novel stress-tolerant yeastCandidaglycerinogenesWL2002-5[J]. Bioengineered, 2016,7(6):418-423.
[6] PIRES E J, TEIXEIRA J A, BRáNYIK T, et al. Yeast: The soul of beer's aroma: A review of flavour-active esters and higher alcohols produced by the brewing yeast[J]. Applied Microbiology & Biotechnology, 2014,98(5):1 937-1 949.
[7] 杜闪, 王雪花, 杨政茂, 等. 生物转化合成β-苯乙醇代谢途径及其调控的研究[J]. 食品与发酵工业, 2014,40(1):168-173.
[8] 王成涛, 梁婧如, 尹胜, 等. 溶氧量对酿酒酵母及其工程菌的β-苯乙醇合成代谢的影响及调控效应[J]. 中国食品学报, 2016,16(8):78-86.
[9] 杜春迎, 赵辉, 赵志昌, 等. 发酵工业中酿酒酵母耐性机制的研究进展[J]. 食品工业科技, 2012,33(13):378-382.
[10] 陈瑾. 马克斯克鲁维酵母高温乙醇发酵工艺研究[D]. 武汉:武汉轻工大学, 2015.
[11] MORRISSEY J P, ETSCHMANN M M, SCHRADER J, et al. Cell factory applications of the yeastKluyveromycesmarxianus for the biotechnological production of natural flavour and fragrance molecules[J]. Yeast, 2015,32(1):3-16.
[12] 曹明乐.Enterobactersp.以糖为原料生物法合成2-苯乙醇[D]. 济南:山东大学, 2012.
[13] GETHINS L, GUNESER O, DEMIRKOL A, et al. Influence of carbon and nitrogen source on production of volatile fragrance and flavour metabolites by the yeastKluyveromycesmarxianus[J]. Yeast, 2015,32(1):67-76.
[14] 荣绍丰, 付艳丽, 何艳, 等. 酿酒酵母AS2.1182发酵产β-苯乙醇的研究[J]. 食品与发酵工业, 2009,33(8):69-73;77.
[15] 黄筱萍, 黄国昌, 刘兰, 等. 酿酒酵母SH003生物转化2-苯乙醇条件的优化[J]. 食品研究与开发, 2015,36(22):154-158.
[16] LANE M M, MORRISSEY J P.Kluyveromysesmarxianus: A yeast emerging from its sister’s shadow[J]. Fungal Biology Reviews, 2010,24(1-2):17-26.
[17] 唐育岐, 刘天明, 赵修报, 等. 高产2-苯乙醇酵母菌株的筛选及培养基优化[J]. 中国食品添加剂, 2012(3):137-142.
[18] 王航, 孟春, 石贤爱, 等. 2-苯乙醇对酿酒酵母生理生化特性影响[J]. 微生物学通报, 2012,39(6):749-755.
[19] 明红梅, 周健, 陈蒙恩, 等. 大曲中异常威克汉姆酵母发酵产苯乙醇的条件优化[J]. 湖北农业科学, 2015,54(14): 3 492-3 496.
[20] ETSCHMANN M M W, SELL D, SCHRADER J. Medium optimization for the production of the aroma compound 2-phenylethanol using a genetic algorithm[J]. Journal of Molecular Catalysis B: Enzymatic, 2004, 29(1-6):187-193.
[21] ESHKOL N, SENDOVSKI M M, KATZ-EZOV T, et al. Production of 2-phenylethanol fromL-phenylalanine by a stress tolerantSaccharomycescerevisiaestrain[J]. Journal of Applied Microbiology, 2009, 106(2):534-542.
[22] KIM T, LEE S, OH M. Biosynthesis of 2-phenylethanol from glucose with genetically engineeredKluyveromycesmarxianus[J]. Enzyme and Microbial Technology, 2014,61-62:44-47.

