麦芽搭配及淀粉酶系活力对麦汁糖组分的影响
韩智立,胡淑敏,刘佳,董建军,余俊红,尹花,黄淑霞,贾士儒*
1(天津科技大学 生物工程学院,天津,300457) 2(啤酒生物发酵工程国家重点实验室,山东 青岛,266000) 3(青岛啤酒股份有限公司,山东 青岛,266000)
大麦是啤酒酿造的主要原料,通过制麦产生各种水解酶(淀粉酶、蛋白酶等),糖化过程中将麦芽中的大分子物质逐步水解为酵母可以吸收利用的营养成分,因此麦芽品质对啤酒的风味、口感和营养等方面的影响较大[1]。大麦中淀粉含量占其干重的58%~65%,故淀粉水解是酿造过程中最重要的生化反应之一,其糖化产物麦汁中的糖组成(单糖、二糖、三糖等可发酵性糖)直接影响酵母的吸收、代谢以及成品啤酒的风味和口感[2]。例如,发酵性糖(单糖、二糖及三糖)是麦汁中糖的主要成分,酵母会按照一定的顺序进行吸收利用,因此其浓度和比例会影响酵母对麦汁的发酵速率和程度,进而影响到啤酒的口味[3]。此外,麦汁中存在一定比例的四糖及以上的不可发酵性糖,文献表明其浓度及分子量分布会影响啤酒的口感[4-5]。因此,稳定的麦汁糖组成是保证酵母发酵以及成品酒风味一致性的关键。
麦芽中含有3种重要的淀粉水解酶:α-淀粉酶、β-淀粉酶和极限糊精酶。α-淀粉酶从内部水解淀粉α-(1,4)-糖苷键,将淀粉降解为麦芽糖、麦芽三糖和低聚寡糖(糊精);β-淀粉酶从淀粉的非还原端水解α-(1,4)-糖苷键,产生麦芽糖和糊精。极限糊精酶是麦芽中唯一的脱支酶,具有高度的特异性,专门从内部水解淀粉的α-(1,6)-糖苷键,作用的产物是直链淀粉,这些产物可以被α-淀粉酶及β-淀粉酶进一步水解。糖化过程中,3种淀粉酶发挥协同作用,逐步将淀粉水解为麦汁中的单糖、二糖、三糖及四糖及以上糖,因此3种淀粉酶的活力及比例会影响麦汁中各种糖的浓度和比例,从而影响麦汁组分的一致性[6]。
大麦质量容易受生产年份、种植区域、气候、品种的影响而产生波动,直接影响酵母的生理状态、发酵过程的酿造性能,乃至影响产品的口感和风味一致性,且原料品种、质量也影响原料利用率,决定着酿造过程的经济性。无论在麦芽品种内还是品种间,不同淀粉酶系的活力差异很大,导致麦汁的浸出率、糖组分及发酵度等存在较大波动,最终影响产品的一致性。目前国外对不同品种麦芽淀粉酶系活力差异,以及全麦酿造时淀粉酶系活力与麦汁发酵度的关系已有报道[7]。但针对国内含辅料(大米)的酿造工艺,麦芽淀粉酶活力与麦汁极限发酵度,尤其是与麦汁糖组成的关系尚不清楚。因此阐明麦芽淀粉酶系活力及搭配对麦汁糖组成的关系,可为原料配方、糖化工艺调整、酶制剂添加提供理论指导,最终保证麦汁糖谱组成以及啤酒风味一致性。
本实验首先分析了国内大生产中普遍应用的7种麦芽(Metcalfe、Copeland、 Hind marsh、Bass、Baudin、Scope、Gairdner)共26个麦芽样品的淀粉酶活力,相关性分析确定了麦芽淀粉系活力与常规指标的关系。在此基础上,模拟大生产含辅料(大米)酿造糖化工艺,研究配方麦芽淀粉酶系活力与麦汁极限发酵度、糖组成的关系。
1 材料与方法
1.1 材料与仪器
麦芽,加拿大麦芽 Metcalfe、Copeland,澳大利亚麦芽 Hindmarsh、Bass、Baudin、Scope、Gairdner;酒花,青岛大花;酿酒酵母、大米、马来酸(Maleic acid,sigma M0375;100 mmol/L);DTT;苹果酸(Malic acid,sigma M0875);NaCl、NaOH;EDTA;Na3PO4·12H2O; 牛血清白蛋白;a-淀粉酶、β-淀粉酶及极限糊精酶专一性底物,爱尔兰Megazyme公司。
Anto Parr, Austria ;高速离心机,美国Sigma 公司;EBC粉碎仪,德国Buhler公司;LB-8糖化仪,德国Lochner公司;高效液相色谱仪,美国Waters公司。
1.2 实验方法
1.2.1 麦芽常规指标的测定
麦芽的总氮、可溶性氮、库尔巴哈值、浸出率和糖化力的测定参照QB/T 1686—2008。
1.2.2 麦芽淀粉酶活力测定
α-淀粉酶活力:1个酶活力单位定义为,在规定的实验条件下,过量耐高温α-葡萄糖苷酶存在时,每分钟从BPNPG7产生1微摩尔硝基苯酚所需要的α-淀粉酶的数量,被称为1个酶活单位。
β-淀粉酶活力:1个酶活力单位定义为,在规定的实验条件下,过量的耐热β-葡萄糖苷酶存在时,每分钟由G3-β-PNP产生1微摩尔PNP所需要的β-淀粉酶的数量,被称为1个酶活单位。
极限糊精酶活力:一个酶活力单位被定义为,在实验条件下,每分钟由普鲁兰多聚糖释放1微摩尔葡萄糖所需的极限糊精酶量。
按文献报道,采用Megazyme公司建立的专一性的显色底物Cerelpha, Betamy1-5, 及Limit DextriZyme测定α-淀粉酶、β-淀粉酶及极限糊精酶活性[8]。
α-淀粉酶活力测定:向装有300 mg麦芽粉的离心管中加入5 mL淀粉提取缓冲液,混匀,20 ℃振荡提取16 h。提取结束后12 000 r/min离心15 min,留上清淀粉酶提取液备用。将淀粉酶提取液稀释250倍,取50 μL提取液加入2 mL离心管,40 ℃温浴2 min,加入50 μLα-淀粉酶底物,40 ℃反应10 min,后加入750 μL α-淀粉酶终止液,混匀后测定405 nm处的吸光值。
β-淀粉酶活力测定,提取过程同α-淀粉酶的提取,将淀粉酶提取液稀释25倍,取50 μL提取液加入2 mL离心管,40 ℃温浴2 min,加入50 μLβ-淀粉酶底物,40 ℃反应10 min,后加入750 μLβ-淀粉酶终止液,混匀后测定405 nm处的吸光值。
极限糊精酶活力测定:向装有300 mg麦芽粉的离心管中加入5 mL加入DTT的淀粉提取缓冲液,混匀,20 ℃振荡提取16 h。提取结束后12 000 r/min离心15 min,留上清淀粉酶提取液备用。取11.5 mg的Azurine-crosslinked-pullulan专一性底物于平底管中,40 ℃温浴2 min,后加入100 μL极限糊精酶提取液,40 ℃准确反应10 min,加入1 mL极限糊精酶终止液,12 000 r/min离心40 min,测定上清在595 nm处的吸光值。
1.2.3 麦汁的制备
1.2.3.1 协定法麦汁制备工艺
准确称取50.0 g麦芽粉样品于已知重量的糖化杯中,加入45 ℃的水200 mL,在不断搅拌下于45 ℃水浴中保温30 min。使醪液以1 ℃/min的速度,升温加热水浴,在25 min内升至70 ℃,此时于杯内加入70 ℃的水100 mL,使醪液于70 ℃下保温1 h后,在10~15 min内迅速冷却至室温。用水冲洗搅拌器,擦干糖化杯外壁,加水使其内容物准确称量为450.0 g。用玻璃棒搅动糖化醪,并用中速滤纸过滤,将最初收集的约100 mL滤液返回重滤,收集滤液于干燥烧杯中。
1.2.3.2 大生产麦汁制备工艺
采用的工艺路线如图1。
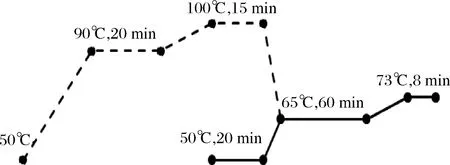
图1 糖化工艺曲线Fig.1 Mashing craft curve
糊化:取粳米粉30.0 g于糊化杯,依次加入100 mL蒸馏水、10 μL耐高温淀粉酶。糖化:取70.0 g麦芽粉,依次加入280 mL蒸馏水、18.6 μL乳酸。糖化醪液用单层中速滤纸过滤,并加入150 mL于73 ℃保温的蒸馏水进行洗糟。在滤后的麦汁中加入0.320 g酒花、25 μL乳酸,煮沸60 min,煮沸结束后待冷却至室温,用双层中速滤纸过滤,滤后的麦汁调糖度为13.0 °P,得到的麦汁用于下一步分析。
实验中采用加麦与澳麦按照1∶1的比例搭配使用,并按照大生产麦汁制备工艺制备麦汁。
1.2.4 麦汁极限发酵度的测定
量取100 mL麦汁样品隔水煮沸10 min,后转移至500 mL三角瓶,加入20.0 g用滤纸吸干水分的酵母饼,塞好棉塞,置于摇床,18 ℃,150 r/min,振荡16 h。发酵结束后,发酵液用双层中速滤纸过滤,滤得的发酵液用Anto Parr测定其极限发酵度。
1.2.5 麦汁糖组分的测定
按照文献报道采用体积排阻色谱结合离子交换模式分离并定量检测麦汁中的葡萄糖、麦芽糖、麦芽三糖及麦芽四糖及以上糖(糊精)[9]。
2 结果与分析
2.1 不同品种麦芽淀粉酶活性差异分析
通过分析7个麦芽品种共26个麦芽的淀粉酶系活力发现,α-淀粉酶、β-淀粉酶和极限糊精酶活力范围分别为151~335 U/g,455~1 121 U/g和245~468 mU/g(表1)。β-淀粉酶活力最高,α-淀粉酶次之,极限糊精酶活性最低,仅为α-淀粉的千分之一;进一步利用方差显著性分析发现,不同麦芽品种间α-淀粉酶(p<0.01)、β-淀粉酶(p<0.01)和极限糊精酶(p<0.01)活性水平差异都极显著(表2)。
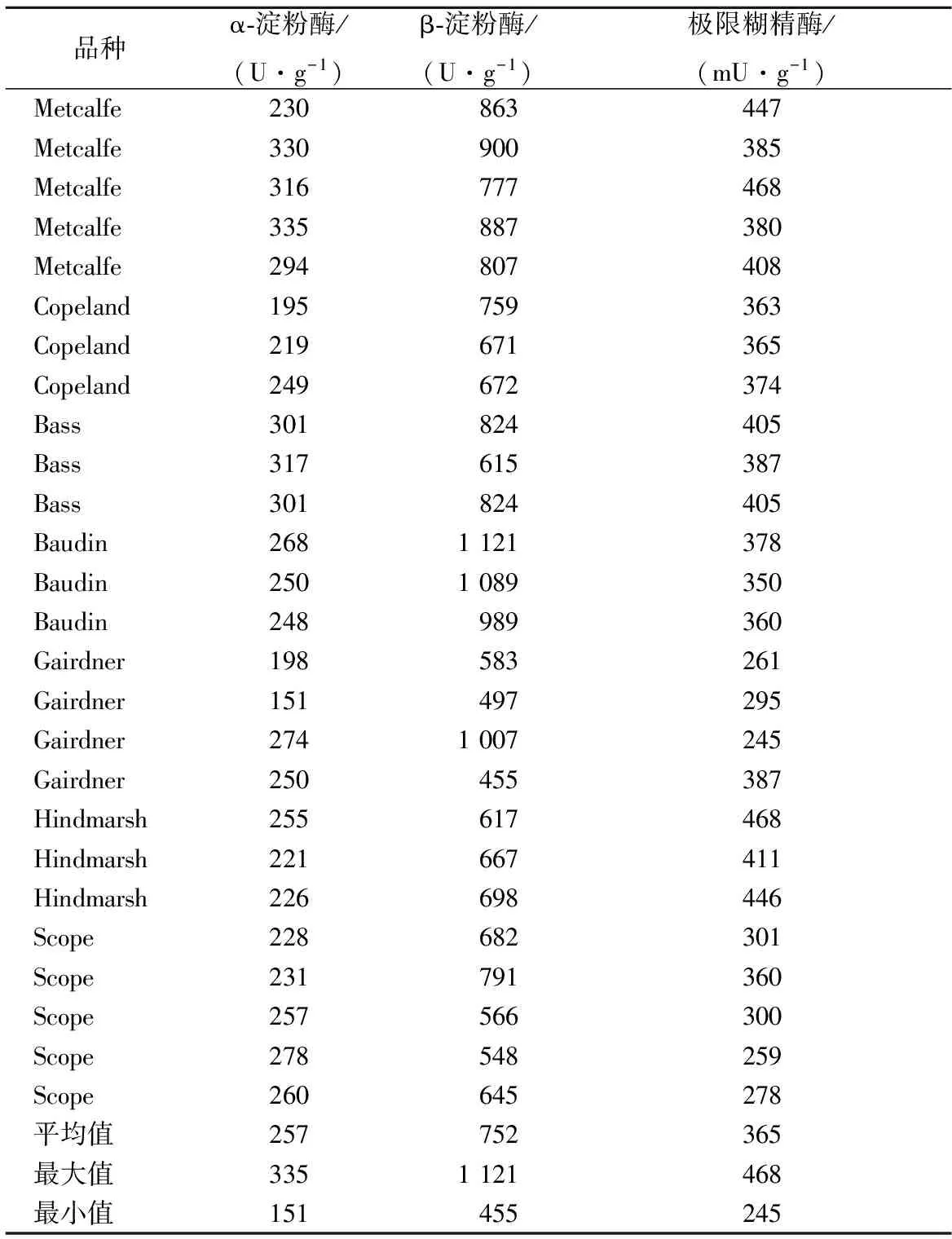
表1 麦芽淀粉酶系活力Table 1 Amylase activity of malt
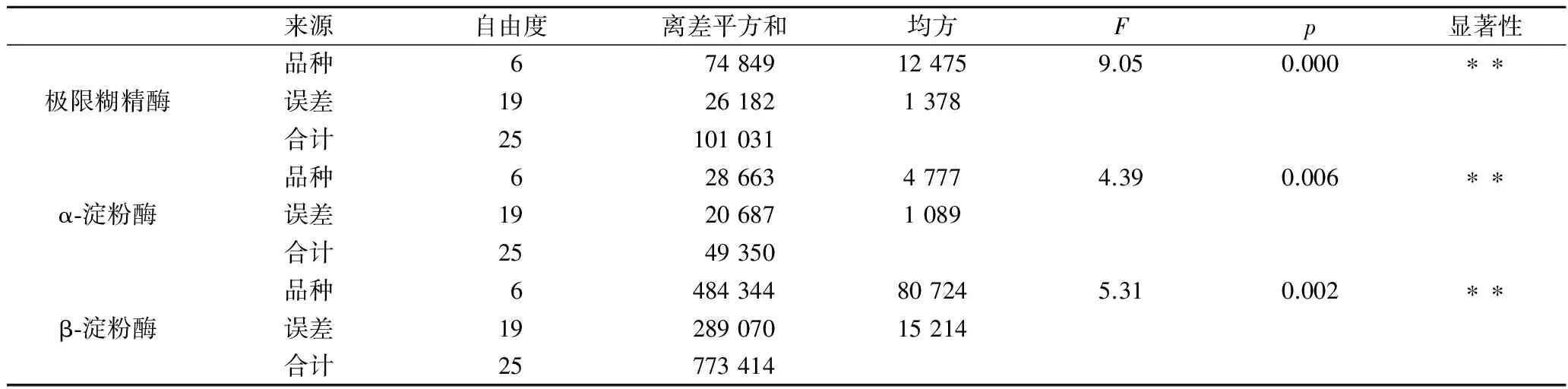
表2 不同品种麦芽的α-淀粉酶、β-淀粉酶和极限糊精酶活性差异的显著性分析Table 2 Significance analysis of α-amylase, β-amylase and limit dextrinase in different malt varieties
注: “*”为显著(p<0.05); “**”为极显著(p<0.01),下表同。
从图2可以看出,Metcalfe及Bass的α-淀粉酶活力较高,而Copeland、Gairdner及Hindmarsh活力较低;Baudin的β-淀粉酶明显高于其他品种;Metcalfe与Hindmarsh的极限糊精酶显著高于其他品种,因此不同麦芽之间不仅淀粉酶活力不同,其3种淀粉酶的比例也存在较大差异,这种差异势必会带来麦汁糖组成的波动。此外,同一品种内麦芽淀粉酶系活力差异较大,尤其是Gairdner麦芽,这也表明,淀粉酶活力除了受品种影响外,与产地、年份以及制麦工艺有关。
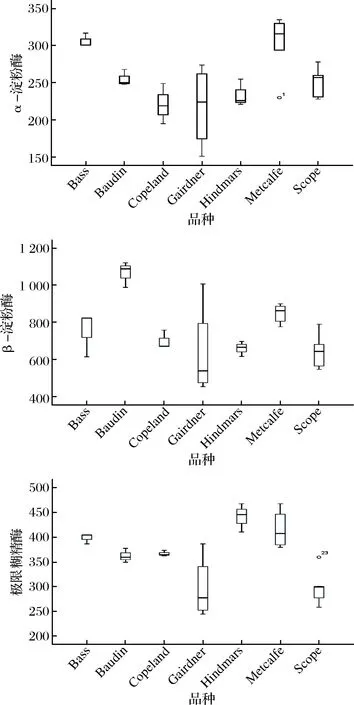
图2 不同品种麦芽淀粉酶活力的箱线图Fig.2 Boxplots of amylase activity in different varieties malt
2.2 麦芽淀粉酶系活力与常规指标的关系
选取实际生产中最常使用的6个麦芽,分析加麦Copeland、Metcalfe、澳麦Bass、Hindmarsh、Gairdner、Scope 6个品种麦芽常规指标及淀粉酶系活力。表3所示,加麦的浸出率普遍低于澳麦、蛋白质含量高于澳麦,这与前期研究中蛋白质含量与浸出率呈负相关结论一致[10]。
目前普遍采用糖化力评价麦芽淀粉水解能力,除Bass之外,加麦糖化力均高于澳麦。此外,糖化力接近的加麦Metcalfe(339)与Copeland(331),Metcalfe淀粉酶系活力显著高于Copeland。糖化力接近的加麦Metcalfe和澳麦Bass,虽然β-淀粉酶活力一致,但α-淀粉酶和极限糊精酶比例差异显著。因此与糖化力相比较,淀粉酶系活力评价淀粉水解能力更为精细。相关性分析(表4)表明糖化力与极限糊精酶(r=0.932,p<0.01)、β-淀粉酶(r=0.926,p<0.01)呈显著正相关关系,这与前期报道一致[11]。
表4所示,α-氨基氮与糖化力(r=0.905,p<0.05)、极限糊精酶(r=0.913,p<0.05)、α-淀粉酶(r=0.813,p<0.05)和β-淀粉酶(r=0.870,p<0.05)之间存在显著的正相关关系。α-氨基氮反映麦芽中蛋白水解成氨基酸的能力,也间接地反映了麦芽蛋白酶活性水平。糖化力及淀粉酶反映麦芽淀粉的水解能力,表明淀粉水解与蛋白水解存在一定相关性。
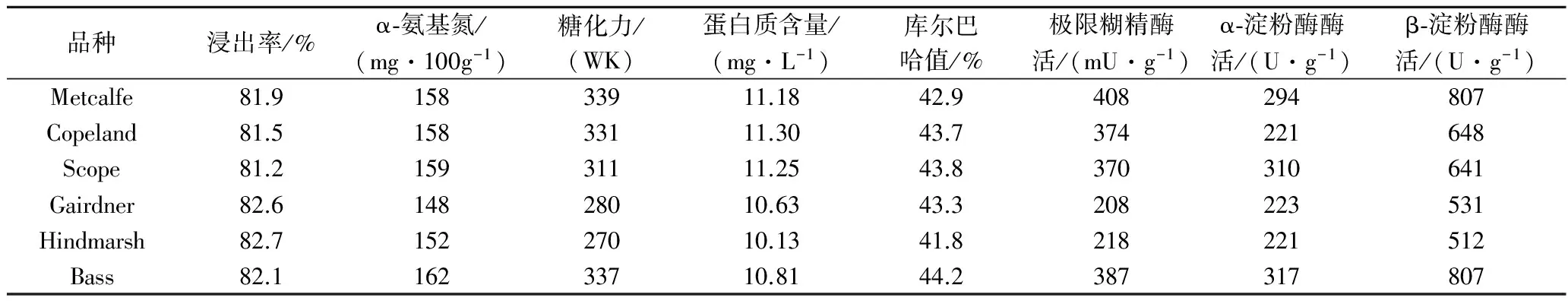
表3 实验所用麦芽常规指标与酶活力的分析Table 3 The malt index and amylase activity of malt used in experiment
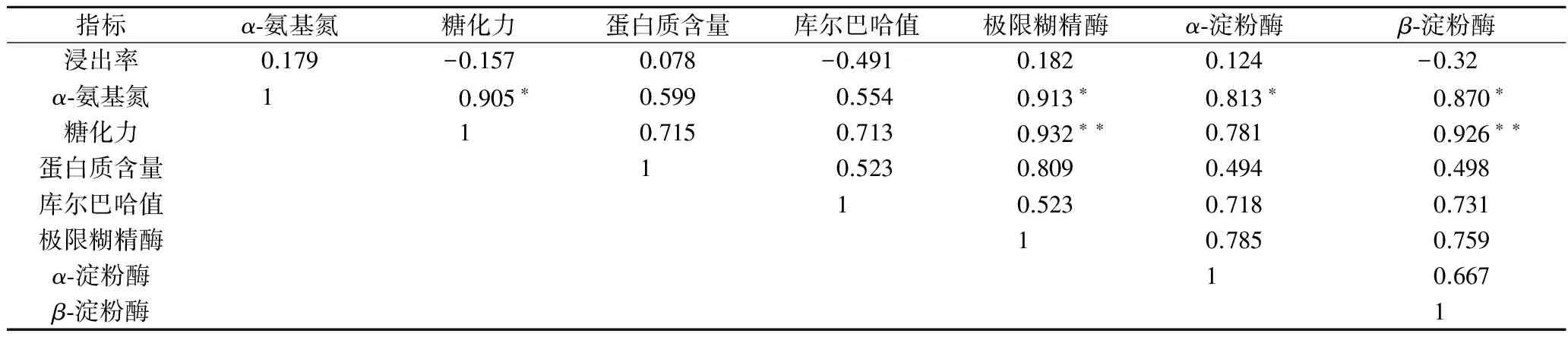
表4 麦芽常规指标与淀粉酶活力的相关分析Table 4 The correlationship between malt index and amylase activity
2.3 麦芽指标与协定法制备麦汁中糖组成相关性分析
按照协定法制备麦汁,相关性分析麦汁糖组成与麦芽指标之间关系发现(表5),麦芽蛋白含量与不可发酵性糖含量(r=-0.964,p<0.01)之间存在极显著的负相关性,这是由于高蛋白质的麦芽其浸出率低,因此水解产生的不可发酵性糖较少。不可发酵性糖含量与极限糊精酶(r=-0.855,p<0.05)存在显著的负相关关系,而与其他两种淀粉酶无显著相关。这与麦芽70%淀粉为支链淀粉,且极限糊精酶是唯一水解支链的脱支酶有关。麦芽三糖与麦芽糖化力(r=0.891,p<0.05)、β-淀粉酶(r=0.837,p<0.05)存在显著正相关关系。
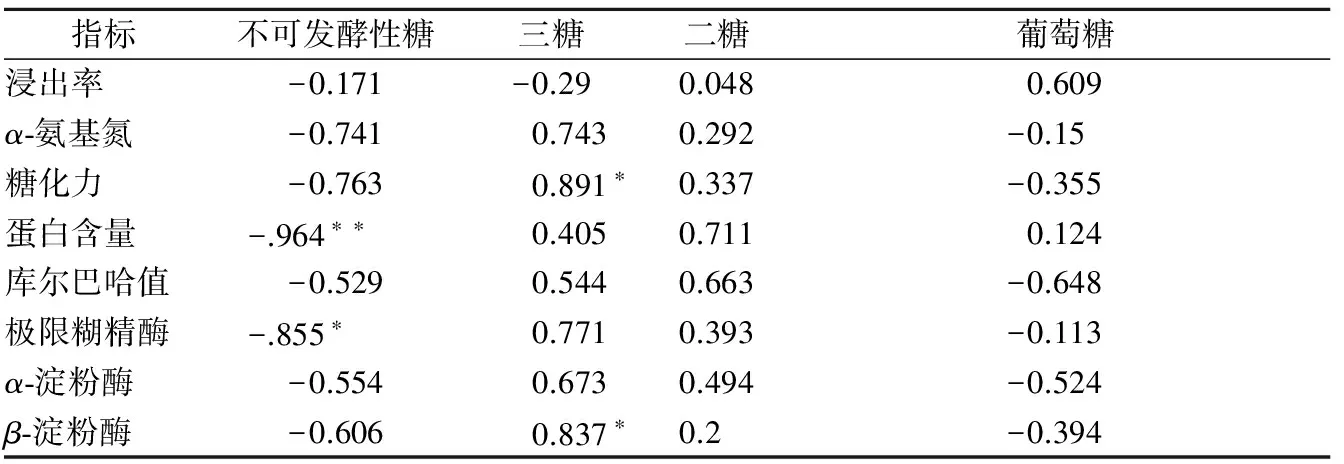
表5 麦芽指标与协定麦汁中糖组分的相关性分析Table 5 The correlationship between malt index andsugar composition
2.4 搭配对麦芽淀粉酶活的影响
实际大生产中为了配方的稳定和麦汁组分的一致性,不同麦芽搭配使用,为了研究搭配对配方麦芽淀粉酶系活力的影响,按照不同比例(0∶100、25∶75,50∶50,75∶25,100∶0)将Metcalfe和Gairnder进行搭配,测定配方麦芽的淀粉酶系活力,通过比较实际值和按照比例的理论计算,确定搭配对淀粉酶系活力的影响。从图3所示,搭配后麦芽淀粉酶系活力均高于理论值,表明麦芽之间具有协同效应。文献表明,麦芽中存在淀粉酶类的抑制因子,可被蛋白酶水解从而释放有活性的淀粉酶,因此搭配后高酶活麦芽中的蛋白酶活性可促进低酶活麦芽中有活性的淀粉酶的释放,从而提高了配方麦芽淀粉酶系活力。也有文献报道,糖化过程中外添加蛋白酶可有效提高糖化过程中淀粉酶的活力[12]。因此实际生产中,低酶活麦芽可通过搭配高酶活力麦芽提高自身的淀粉水解能力。
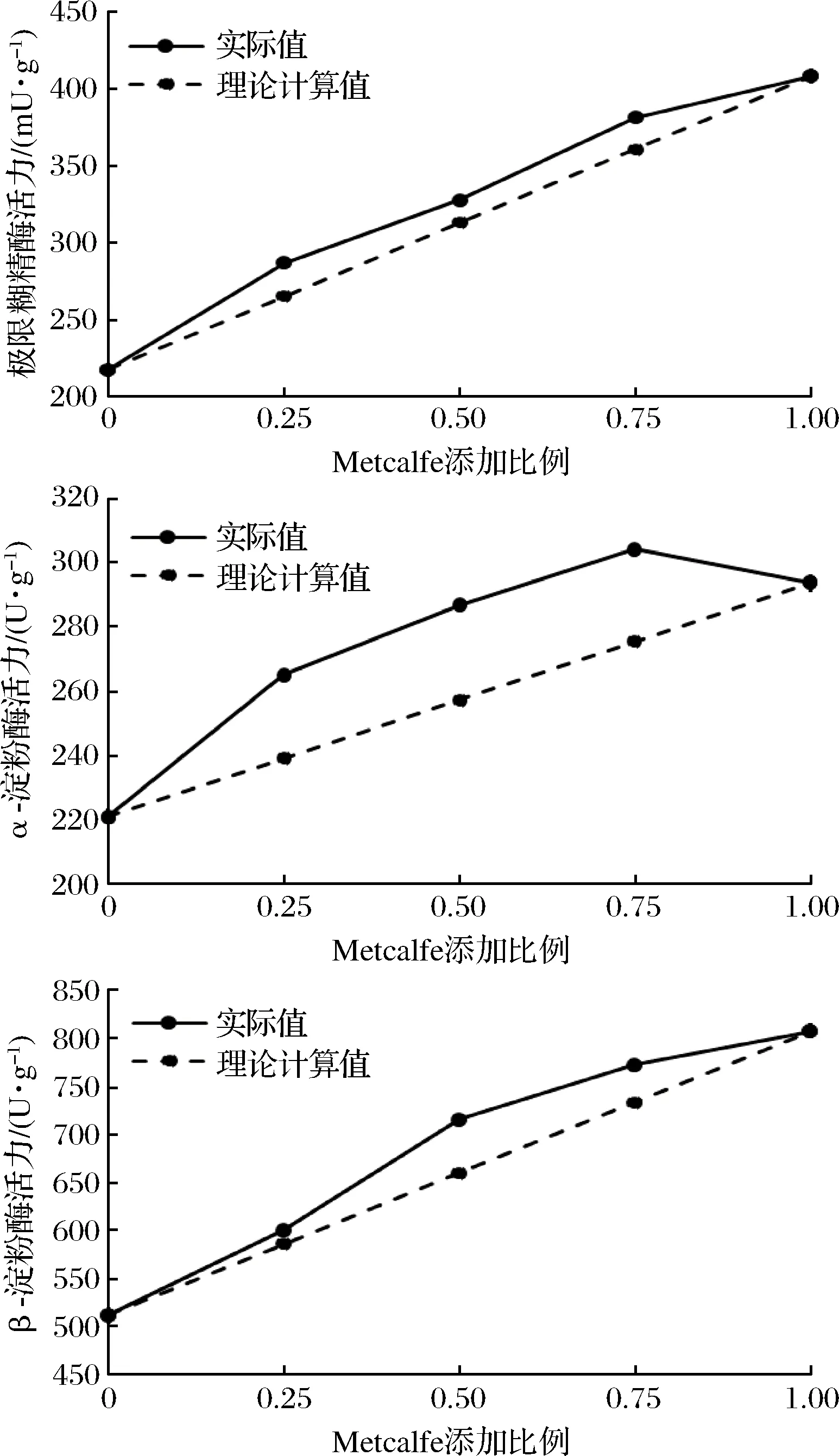
图3 麦芽搭配使用后酶活力理论计算值与实际检测值的关系Fig.3 The relationship between calculation and actual value in blending malt注: 预测值=麦芽a单独使用时的测定值× 搭配时所占比例+麦芽b单独使用时的测定值×搭配时所占比例, 加麦Metcalfe 和澳麦Hindmarsh搭配.
2.5 配方麦芽淀粉酶系活力与麦汁糖谱的关系
与国外全麦酿造工艺不同,国内啤酒大多是辅料比较高的配方工艺。为研究含辅料酿造工艺下配方麦芽淀粉酶活对麦汁糖组成的影响,将加麦Metcalfe、Copeland分别与Bass、Scope、Hindmarsh按照不同比例(0∶100、25∶75,50∶50,75∶25,100∶0)搭配,模拟大生产糖化工艺,按照辅料比30%进行麦汁制备,分析麦汁极限发酵度及麦汁糖组成。
极限发酵度反映麦汁的可发酵能力,是麦汁的重要质量指标之一。如表6所示,极限发酵度与麦汁的可发酵性糖含量(r=0.870,p<0.01)存在极显著的正相关。极限发酵度高,麦汁可发酵性产物多,不可发酵性糖少,导致啤酒存在寡淡感。极限发酵度过低,会导致麦汁营养不足,降低酵母发酵性能。
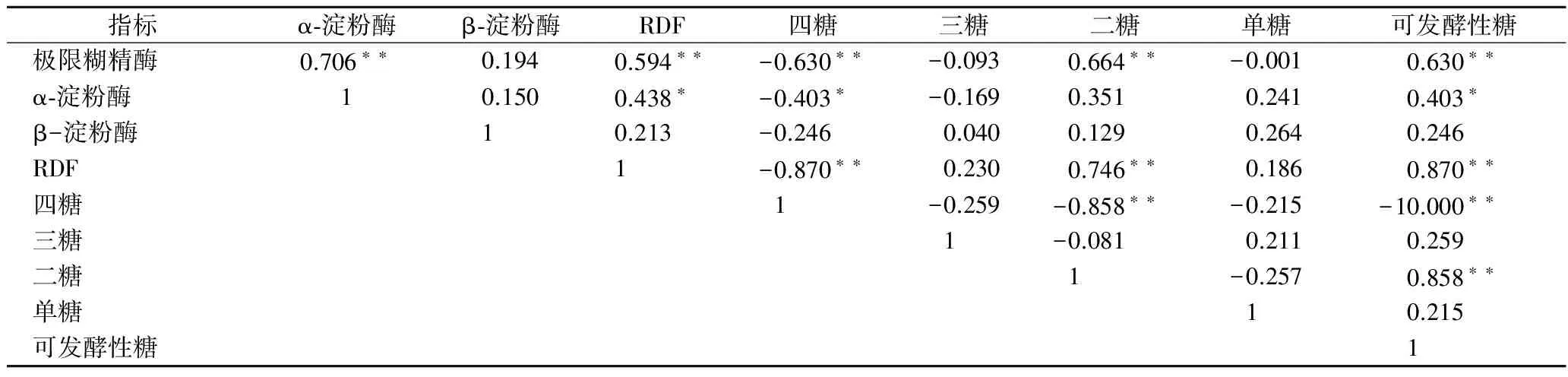
表6 配方麦芽指标与辅料比例的麦汁组分的相关性分析Table 6 The correlationship between the index and wort sugar composition in blending malt
相关性分析表明(表6),极限糊精酶与麦汁的极限发酵度(r=0.594,p<0.01)、麦芽糖(r=0.664,p<0.01)、可发酵性糖(r=0.630,p<0.01)之间存在极显著的相关关系,与不可发酵性糖(r=-0.630,p<0.01)存在显著负相关,表明极限糊精酶是麦芽淀粉水解的限速酶,极限糊精酶活力越高,麦汁中不可发酵性糖比例越低。因此,可通过测定麦芽极限糊精酶活力预测麦汁的极限发酵度与麦汁糖组成,保证麦汁组分的一致性。
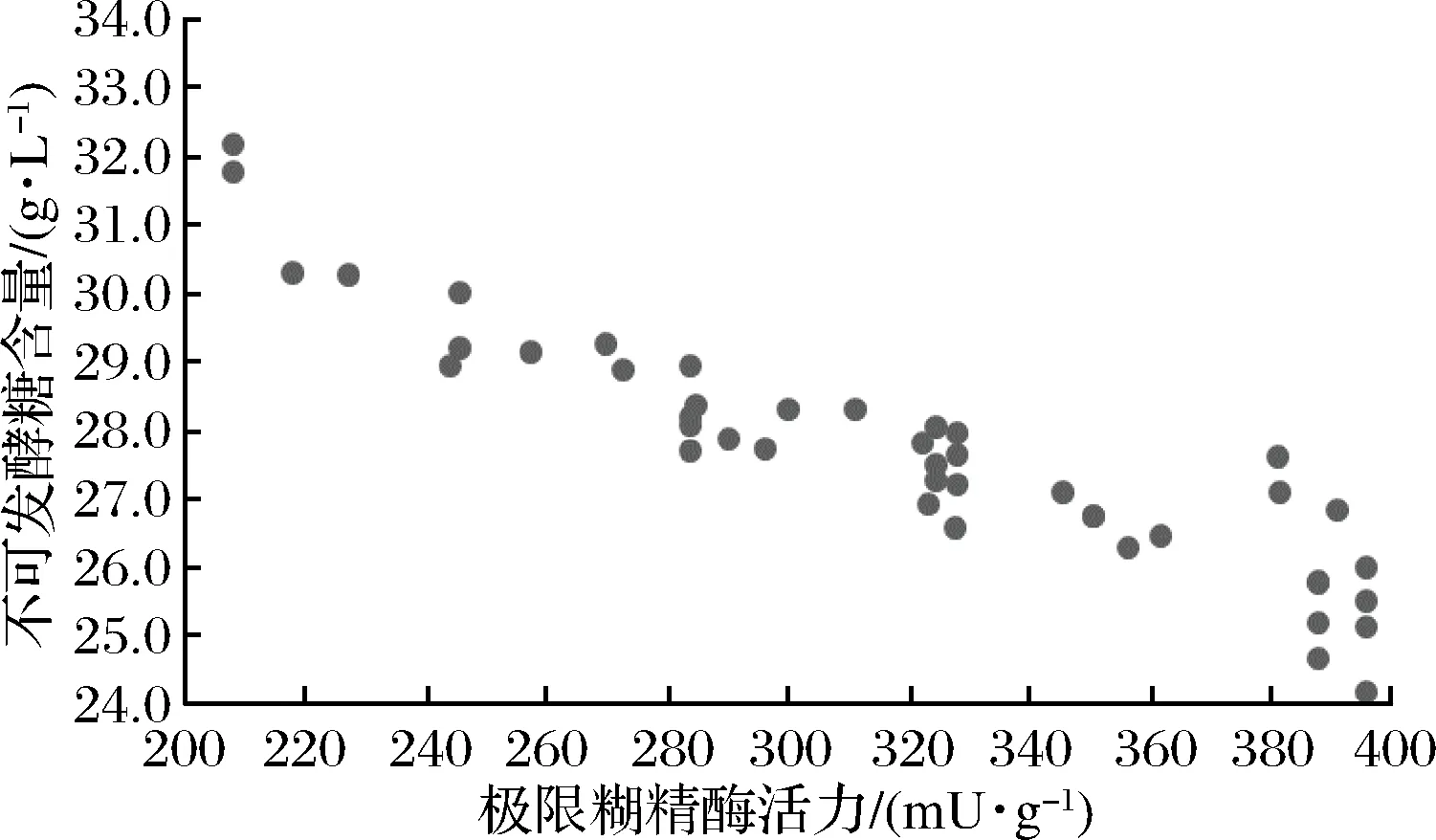
图4 极限糊精酶活力与麦汁不可发酵糖比例关系图Fig.4 The relationship between limit dextrinase activity and the ratio of unfermentable sugars
由表7、表8和回归分析可知,方程的一次项具有显著性, 得到响应值与实验因子之间是线性关系符合一次模型:不可发酵糖比例=15.1-7.55 极限糊精酶酶活+0.014 4α-淀粉酶+0.075 4 浸出物- 0.345加麦比例。分析根据所得模型的拟合值与实验值的关系得到图5,从图5可以看出,得到的线性关系与实验结果拟合较好。因此可以根据该线性模型对麦汁中不可发酵性糖的比例进行大致估测。由模型可以看出,麦汁的不可发酵性糖的比例和麦芽浸出率、配方麦芽加麦比例、澳麦比例、α-淀粉酶活力及极限糊精酶活力相关,麦汁中不可发酵性糖和极限糊精酶活力是负相关,这是因为极限糊精酶是一种去分支酶,它可以将α-淀粉酶和β-淀粉酶作用后的支链糊精进一步分解,从而有效减少麦汁中不可发酵性糖的量。另外,不可发酵性糖比例和配方麦芽中加麦使用比例呈负相关,这可能是由于加麦本身淀粉酶活力普遍要高于澳麦的淀粉酶活力,因此加麦比例增加有助于麦芽淀粉的水解,将大分子糖降解为小分子的可发酵性糖。
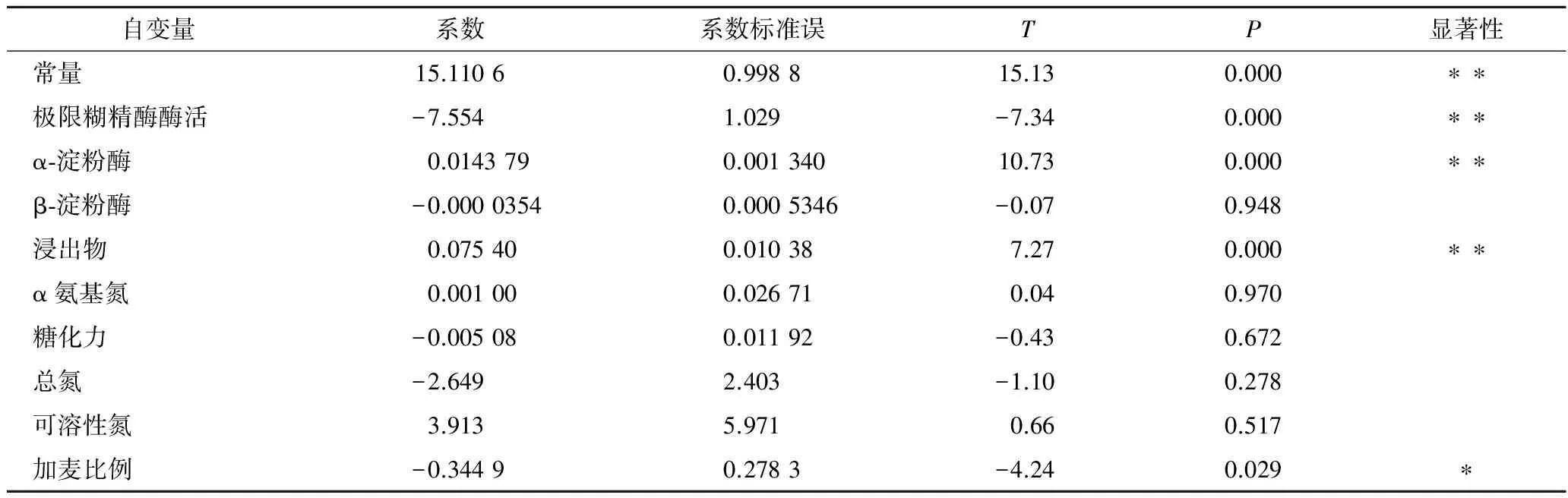
表7 回归系数的估计和T检验Table 7 Estimation of regression coefficients and T test
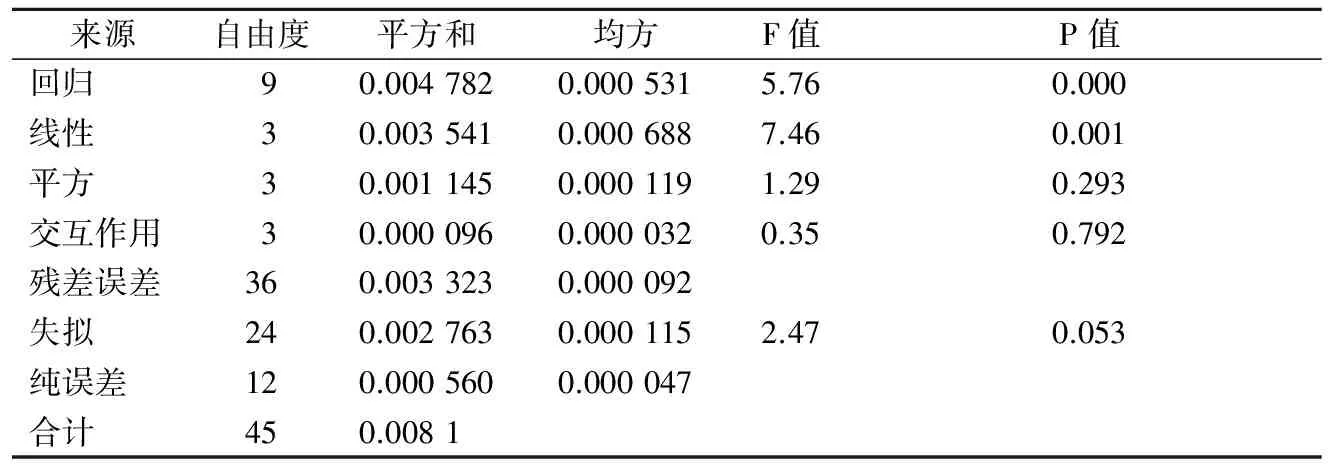
表8 回归方程的各项方差分析及F值检验Table 8 Variance analysis of regression equation and F test
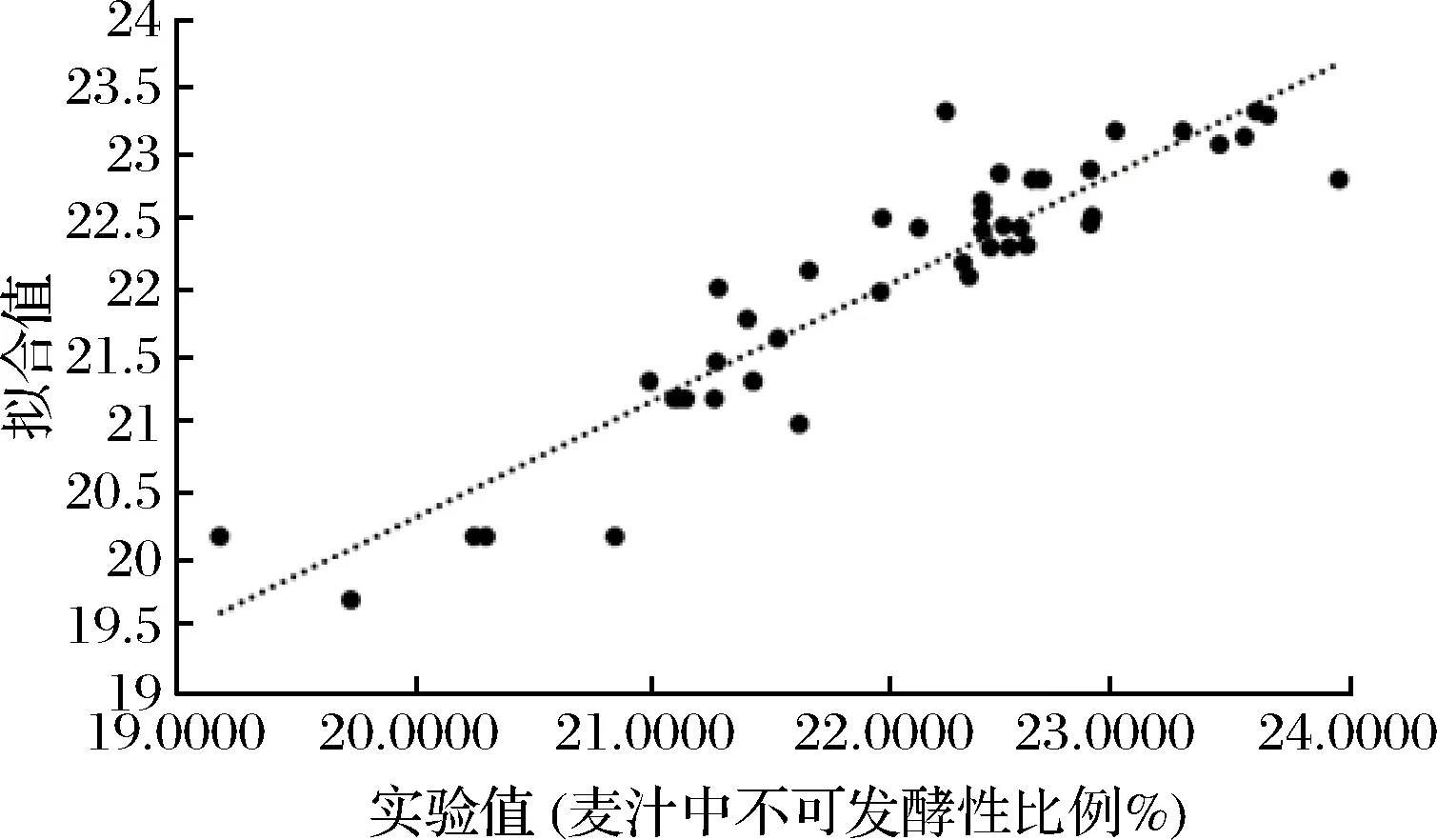
图5 麦汁中不可发酵性糖比例实验值与拟合值Fig.5 Experimental value and fitted value about the ratio of unfermentable sugars in wort
在实际生产中,利用该线性模型可以根据麦芽的相关指标,对应调整糖化工艺,从而可以得到含有固定比例不可发酵性糖的麦汁。从而对于原料麦芽和大麦质量的波动,改变制麦工艺或糖化工艺从而保证麦汁和啤酒在组成和口感上的一致性,保证了产品的品质。
3 结论与讨论
糖是麦汁中最主要的成分,各种糖的浓度及比例会影响酵母的吸收代谢及成品酒的啤酒风味,因此控制麦汁的一致性是实现啤酒风味一致性的关键。但作为农副产品原料——大麦(或麦芽),会受品其种、种植区域、种植环境及制麦工艺的影响,从而使麦芽品质产生较大波动。因此准确预测大麦(或麦芽)的性能,确定品种性能差异,是保证麦汁及啤酒一致性的关键。
通常人们用糖化力来评价麦芽淀粉水解能力,文献报道以及实际酿造过程中发现,糖化力接近的麦芽其淀粉水解能力差异很大,因此国外更倾向于使用淀粉酶系活力代替糖化力,来预测麦芽的淀粉水解能力。
本实验分析了不同品种淀粉酶系活力,明确了搭配对麦芽淀粉酶活力的协同作用,阐明了高辅料酿造工艺下决定麦汁糖组成的关键酶是极限糊精酶。这为大麦育种、配方使用、糖化工艺调整以及酶制剂使用提供理论指导意义,从而有效控制麦汁糖组成的一致性以及啤酒风味一致性。
通过分析搭配实验中麦芽指标和麦汁糖组分的关系,得出了麦芽浸出率、α-淀粉酶活力、极限糊精酶活力、配方麦芽中加麦使用比例及澳麦使用比例与13°P麦汁中不可发酵性糖的比例之间的等量关系,这为实际生产中保证麦汁和啤酒的一致性,提供了有效的指导。
[1] 张新忠.大麦发芽过程中淀粉酶活性变化及其与麦芽品质关系研究[D].扬州:扬州大学, 2010.
[2] 胡雪莲,蔡勇,高文举.麦汁组成对快速发酵中酵母代谢的重要性[J].啤酒科技,2013(6):63-72.
[3] 张艳艳.发酵过程酵母对麦汁糖的吸收和代谢[J].啤酒科技,2007(5):62-65.
[4] BREFORT H, GUINARD J X, BUHLERT J E, et al. The contribution of dextrins of beer sensory properties. II. Aftertaste[J]. Journal of the Institute of Brewing, 1989,95(6):431-435.
[5] RÜBSAM H, GASTL M, BECKER T. Influence of the range of molecular weight distribution of beer components on the intensity of palate fullness[J]. European Food Research & Technology, 2013, 236(1):65-75.
[6] MACGREGOR A W, BAZIN S L, MACRI L J, et al. Modelling the contribution ofα-amylase,β-amylase and limit dextranase to starch degradation during mashing [J]. Journal of Cereal Science, 1999,29:161-169.
[7] EVANS. Improved prediction of malt fermentability by measurement of the diastatic power enzymesβ-Amylase,α-Amylase, and limit dextrinase: I. survey of the levels of diastatic power enzymes in commercial malts[J]. Journal of the American Society of Brewing Chemists, 2008, 66(4):223-232.
[8] EVANS, D E, A more cost-and labor-efficient assay for the combined measurement of the diastatic power enzymesβ-amylase,α-amylase, and limit dextrinase[J]. Am Soc Brew Chem, 2008, 66: 215-222
[9] 单连菊,王成红,单凌青,等.高效液相色谱法测定啤酒、发酵液和麦汁中的可发酵糖和有机酸[J]. 分析化学, 2000, 28(4):524-524.
[10] 柳小宁,潘永东,张华瑜,等.蛋白质含量与大麦及麦芽品质指标间的相关趋势分析[J].江苏农业科学, 2015, 43(6):278-280.
[11] 林亚康,俞志隆.大麦成熟籽粒中β-淀粉酶水平与麦芽糖化力的相关分析[J].遗传,1990(4):12-14.
[12] HU S, DONG J, FAN W, et al. The influence of proteolytic and cytolytic enzymes on starch degradation during mashing[J]. Journal of the Institute of Brewing, 2015, 120(4):379-384.

