唐古特白刺叶化学成分及其抗炎活性研究
敖亮,李静,刘宇宏
(延安大学附属医院风湿科,陕西 延安 716000)
唐古特白刺 Nitraria tangutorum Bobr.是蒺藜科(Zygophyllceae)白刺属(Nitraria L.)的一种落叶灌木,主要分布于亚洲、欧洲、非洲及澳洲[1],作为防风固沙的优势灌木,在生态环境保护中具有重要的作用。在我国,白刺属植物主要分布于青海、新疆、甘肃、宁夏、内蒙古等地,资源十分丰富,尤其在青海省柴达木盆地分布最广[2]。民间用于治疗脾胃虚弱、消化不良、神经衰弱、感冒等症。近年来研究发现,白刺叶具有调节血糖、血脂、血压、改善免疫、抗疲劳等保健功能[3-4]。目前对唐古特白刺叶的化学成分研究发现,黄酮和生物碱类化合物是唐古特白刺叶的主要化学成分[5]。本实验从唐古特白刺叶中分离得到10个化合物,分别鉴定为3,3′,4′-三-O-甲基鞣花酸(1)、苜蓿素-7-O-β-D-葡萄糖苷(2)、邻苯二甲酸二丁酯(3)、鼠李秦素(4)、异杨梅二醇(5)、三春水柏枝素 A(6)、(3S,5R,6S,7E)-3,5,6-三羟基-7-香波龙大柱烯-9-酮(7)、1,2,3,4-四氢-1,3,4-三氧代-β-咔啉(8)、3-羟基-β-咔啉(9)、β-咔啉-1-羧酸(10)。化合物 1~10均为从该属植物中首次分离得到。对化合物5~10进行了抗炎活性评估,发现咔啉生物碱对脂多糖(LPS)刺激的巨噬细胞炎症因子生成均呈现较强的抑制作用,化合物8、9和10活性最高。对活性成分的IC50进行了计算,为进一步研究其抗炎作用机制以及进一步开发应用唐古特白刺提供依据。
1 仪器和材料
600MHz核磁共振波谱仪(TMS为内标,Varian公司);Agilent 1260高效液相色谱仪(Agilent公司);半制备液相色谱仪(江苏汉邦科技有限公司);C18HCE半制备色谱柱(250 mm×20 mm,北京华普新创科技有限公司);柱色谱硅胶(100~200目),薄层硅胶板(青岛海洋化工厂);色谱级甲醇,其他试剂均为分析级(山东禹王化工厂)。
唐古特白刺叶于2015年7月采摘于柴达木盆地,由中国科学院西北高原生物研究所卢学峰研究员鉴定为唐古特白刺Nitraria tangutorum Bobr.的叶。
2 方法
2.1 提取与分离
唐古特白刺叶5 kg,阴干后粉碎并且过筛,用95%的乙醇水加热回流提取3次,每次2 h,料液比1∶8,合并提取液,过滤,浓缩,得浸膏200.0 g。浸膏用水(1 L)混悬,然后分别用等体积(1.0 L)的石油醚、乙酸乙酯、正丁醇进行液液萃取3次,将乙酸乙酯部位的萃取液浓缩,得到浸膏47.0 g(E),取E 40.0 g,用硅胶拌样进行硅胶柱色谱分离,以三氯甲烷-甲醇-水(9∶1∶0.1→7∶3∶0.1)为洗脱系统进行梯度洗脱,得到7个组分Fr.1~7。Fr.3(5.6 g)以三氯甲烷-甲醇-水(9∶1∶0.1)等度洗脱,得到 5个组分Fr.3A~3E。其中Fr.3B(126.0mg)经过半制备色谱进行分离,用乙腈-水(12%~23%,梯度洗脱50 min)进行梯度洗脱得到5个组分,经半制备液相反复纯化得到化合物 1(2.1 mg),4(1.3 mg)、8(2.3mg)、9(1.9mg)、10(2.6 mg)。Fr.3C(95.4 mg)经过半制备色谱进行分离,用乙腈-水(5%~19%,梯度洗脱55 min)进行梯度洗脱得到5个组分,经半制备液相反复纯化得到化合物2(1.7 mg)、3(2.2 mg)、5(2.1 mg)、6(1.8 mg)、7(2.9 mg)。
2.2 抗炎活性研究
2.2.1 供试品配制 取化合物5~10分别用DMSO配制成20 mg·mL-1储存液,加药时用无血清DMEM培养基分别稀释成1、3、5、10、15、25μg·mL-1(所选化合物浓度均未对细胞产生毒性作用)的待测试样品溶液。
2.2.2 细胞培养 RAW264.7细胞用含10%胎牛血清(FBS)的DMEM培养基进行培养,置于5%CO2、37℃、饱和湿度的细胞培养箱中培养。待细胞生长至对数生长期时进行传代,2~3 d传代1次。取3代后的细胞用于接下来的炎症因子抑制实验研究。
2.2.3 炎症因子检测 取对数生长期的RAW264.7细胞用0.25%胰酶消化约1 min后,吸去胰酶,用含有10%FBS的DMEM培养基中和胰酶作用,轻轻吹打成单细胞悬液,离心弃上清液,用完全培养基重悬细胞并计数后,调整细胞悬液至1×105个·mL-1,按每孔100μL的培养体积接种至96孔培养板,置于37℃、5%CO2、饱和湿度条件下培养12 h,然后饥饿处理12 h后,吸去每孔上清液,每孔再加入100μL无血清DMEM培养基配制的相应分组培养液,随机分为对照组、LPS(1μg·mL-1)组、LPS(1μg·mL-1)+化合物 5~10(1、3、5、10、15、25μg·mL-1)组,加入相应药物后,每组设3个复孔,置于5%CO2、37℃、饱和湿度条件下培养24 h后,取上清液用于肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)炎症因子的表达情况检测,并最终计算化合物的IC50值。
3 结果
3.1 结构鉴定
化合物1:淡黄色粉末。ESI-MS m/z:345.120 2[M+H]+。1H-NMR(600 MHz,DMSO-d6)δ:7.56(1H,s),7.66(1H,s),4.03(3H,s),4.05(3H,s),4.07(3H,s);13C-NMR(150 MHz,DMSO-d6)δ:111.23(C-1),140.97(C-2),140.22(C-3),152.64(C-4),111.68(C-5),112.55(C-6),158.35(C-7),111.97(C-1′),141.49(C-2′),140.85(C-3′),153.83(C-4′),107.49(C-5′),113.39(C-6′),158.54(C-7′),56.75(4′-OMe),61.33(3′-OMe),61.04(3-OMe)。数据与文献报道基本一致[6],故鉴定化合物 1为 3,3′,4′-三-O-甲基鞣花酸。
化合物2:黄色粉末。ESI-MS m/z:493.140 3[M+H]+。1H-NMR(600 MHz,DMSO-d6)δ:12.98(1H,s,5-OH),9.43(1H,s,4′-OH),6.47(1H,d,J=1.9 Hz,H-6),6.96(1H,d,J=1.9 Hz,H-8);13C-NMR(150 MHz,DMSO-d6)δ:182.5(C-4),164.6(C-2),163.4(C-7),161.5(C-5),157.3(C-9),148.7(C-3′,5′),140.5(C-4′),120.7(C-1′),105.8(C-10),104.9(C-2′,6′),104.5(C-3),99.9(C-6),95.7(C-8),100.5(C-1″),77.7(C-5″),73.6(C-2″),76.8(C-3″),69.9(C-4″),60.9(C-6″)。结合文献[7],确认化合物2为苜蓿素-7-O-β-D-葡萄糖苷。
化合物3:无色油状液体。EI-MS m/z:287.201 4[M-H]-。1H-NMR(600 MHz,CDCl3)δ:7.72(1H,m),7.60(1H,m),4.29(2H,m),1.46(2H,m),1.72(2H,m),0.97(3H,m);13C-NMR(150 MHz,CDCl3)δ:169.2(C-7),133.5(C-1,6),129.8(C-2,5),132.2(C-3,4),66.6(C-1′,1″),31.7(C-2′,2″),20.2(C-3′,3″),14.0(C-4′,4″)。数据与文献报道基本一致[8],故鉴定化合物3为邻苯二甲酸二丁酯。
化合物4:黄色针晶。ESI-MS m/z:331.310 2[M+H]+。1H-NMR(600 MHz,DMSO-d6)δ:7.79(1H,d,J=2.0 Hz,H-2′),7.75(1H,dd,J=2.0,8.5 Hz,H-6′),6.97(1H,d,J=8.5 Hz,H-5′),6.77(1H,d,J=2.0 Hz,H-8),6.35(1H,d,J=2.0 Hz,H-6),3.86(3H,s,3′-OCH3),3.87(3H,s,7-OCH3);13C-NMR(150 MHz,DMSO-d6) δ: 175.9, 160.3, 164.9, 156.0, 148.9,147.4, 147.0, 136.1, 121.8, 121.8, 111.6,115.5,104.0,97.4,92.0,56.0,55.8。经与文献对照[9],化合物4鉴定为鼠李秦素。
化合物5:白色粉末。ESI-MS m/z:443.112 7[M+H]+。1H-NMR(600 MHz,CDCl3):0.55(1H,dd,J=13.4,3.7 Hz,H-18),0.85,0.87,0.89,0.91,0.94,0.94,1.05(3H each,all s,Me×7),1.0(1H,dd,J=13.4,3.7 Hz,H-19β),1.4(1H,t,J=13.4 Hz,H-19a),1.06~1.7(19H,m),1.74(1H,dd,J=15.3,3.4 Hz,H-16),1.9(1H,tm,J=15 Hz,H-2β),2.0(1H,dm,J=13 Hz,H-7β),2.08(1H,dd,J=15.3,8.2,H-16),3.28(1H each,d,J=11.1 Hz,H-2β),3.38(1H,t,J=2.7 Hz,H-3),5.47(1H,dd,J=8.2,3.4 Hz,H-15);13C-NMR(150 MHz,CDCl3):159.3,115.5,65.5, 76.2, 49.2, 48.8, 44.7, 41.2, 40.3,39.2, 38.0, 37.5, 37.3, 35.8, 33.5, 33.5,32.6, 32.2, 30.8, 29.9, 28.6, 28.2, 27.9,26.2,25.0,22.2,21.5,18.7,17.3,15.2。数据与文献报道基本一致[10],故鉴定化合物5为异杨梅二醇。
化合物6:白色粉末。ESI-MS m/z:619.143 2[M+H]+。1H-NMR(600 MHz,CD3COCD3)δ:7.14(1H,d,J=2.0 Hz,H-2′),6.84(1H,d,J=8.0 Hz,H-5′),7.01(1H,dd,J=8.0,2.0 Hz,H-6′),7.52(1H,d,J=16.0 Hz,H-7′),6.33(1H,d,J=16.0 Hz,H-8′),5.57(1H,dd,J=8.0,3.0 Hz,H-15),4.69(1H,t,J=2.7 Hz,H-3),1.01(3H,s,CH3),1.00(6H,s,CH3×2),0.96(3H,s,CH3),0.95(3H,s,CH3),0.92(3H,s,CH3),0.88(3H,s,CH3);13C-NMR(150 MHz,CD3COCD3)δ:178.7,166.3,160.8,147.9,145.6,144.6,127.1,121.8,115.8,115.7,116.5,114.6,77.6,50.8,50.8,49.3,41.8,41.2,39.2,38.2,36.8,35.3,33.6,37.4,33.8,33.2,31.9,31.7,30.9,29.0,28.9,27.7,25.9,22.7,22.0,21.5,18.6,17.4,15.0。数据与文献报道基本一致[11],故鉴定化合物6为三春水柏枝素A。
化合物7:白色无定型粉末(甲醇)。ESI-MS m/z:243.225 0[M+H]+。1H-NMR(CD3OD,600 MHz)δ:7.16(1H,d,J=15.6 Hz,H-7),6.19(1H,d,J=15.6 Hz,H-8),3.76(1H,m,H-3),2.33(1H,dd,J=14.4,5.2 Hz,H-4a),2.29(3H,s,H-10),1.67(1H,dd,J=14.4,9.2 Hz,H-4b),1.58(1H,dd,J=12.8 Hz,3.6 Hz,H-2a),1.26(1H,dd,J=12.8,10.8 Hz,H-2b),1.19(3H,s,H-12),1.18(3H,s,H-13),0.97(3H,s,H-11);13C-NMR(CD3OD,150 MHz)δ:200.5(C-9),145.7(C-7),133.9(C-8),70.9(C-6),68.8(C-5),64.5(C-3),47.7(C-2),41.5(C-4),36.3(C-1),29.9(C-12),27.7(C-10),25.5(C-11),20.3(C-13)。数据与文献报道基本一致[12],故鉴定化合物7为(3S,5R,6S,7E)-3,5,6-三羟基-7-香波龙大柱烯-9-酮。
化合物8:黄色粉末。ESI-MS m/z:214.321 9[M]+。1H-NMR(600 MHz,DMSO-d6):7.37(1H,ddd,J=7.7,1.3,0.9 Hz,H-6),744(1H,ddd,J=8.1,7.1,1.3 Hz,H-7),7.63(1H,ddd,J=8.1,1.1,0.9 Hz,H-8),8.36(1H,ddd,J=7.7,1.3,0.9,H-5),11.87(1H,brs,H-9),13.35(1H,brs,H-2);13C-NMR(150 MHz,DMSO-d6):113.67(C-8),115.61(C-11),121.35(C-5),123.04(C-12),123.82(C-6),126.27(C-7),135.20(C-20),137.65(C-13),157.85(C-3),159.09(C-l),170.05(C-4)。数据与文献报道基本一致[13],故鉴定化合物8为1,2,3,4-四氢-1,3,4-三氧代-β-咔啉。
化合物9:黄色固体。ESI-MS m/z:226.157 4[M+H]+。1H-NMR(600 MHz,DMSO-d6)δ:11.93(1H,brs,1-H),7.09(1H,d,J=6.8 Hz,5-H),6.99(1H,d,J=6.8 Hz,6-H),8.03(1H,d,J=7.9 Hz,9-H),7.39(1H,td,J=7.9,1.0 Hz,10-H),7.18(1H,td,J=7.9,1.0 Hz,11-H),7.55(1H,d,J=7.9 Hz,12-H),11.39(1H,brs,3-OH)。13C-NMR(150 MHz,DMSO-d6)δ:155.8,139.2,128.2, 126.3, 124.6, 124.5, 122.2, 121.4,119.6,112.6,99.8。数据与文献报道基本一致[14],故鉴定化合物 9为 3-羟基-β-咔啉。
化合物10:黄色粉末。ESI-MS m/z:213.108 9[M+H]+。1H-NMR(600 MHz,DMSO-d6)δ:11.15(1H,s,H-9),8.45(1H,d,J=5.4,H-3),8.43(1H,d,J=5.4,H-4),8.33(1H,d,J=8.1,H-5),7.85(1H,d,J=8.1,H-8),7.63(1H,d,J=8.1,H-7),7.33(1H,d,J=8.1,H-6);13C-NMR(150 MHz,DMSO-d6,)δ:141.9(C-1),135.6(C-3),118.5(C-4),122.3(C-5),129.5(C-6),120.3(C-7),113.3(C-8),131.9(C-10),119.9(C-11),131.6(C-12),135.6(C-13),165.9(1-COOH)。数据与文献报道基本一致[15],故鉴定化合物10为 β-咔啉-1-羧酸。
3.2 抗炎活性
在炎症因子抑制作用筛选结果中,化合物5~10对LPS刺激的RAW264.7细胞释放的促炎因子TNF-α和IL-6均具有不同程度的抑制作用,显示了较好的体外抑制促炎因子的活性作用,其中化合物5、6、8和9对不同炎症因子的抑制作用分别表现出最强的效果,结果见表1。
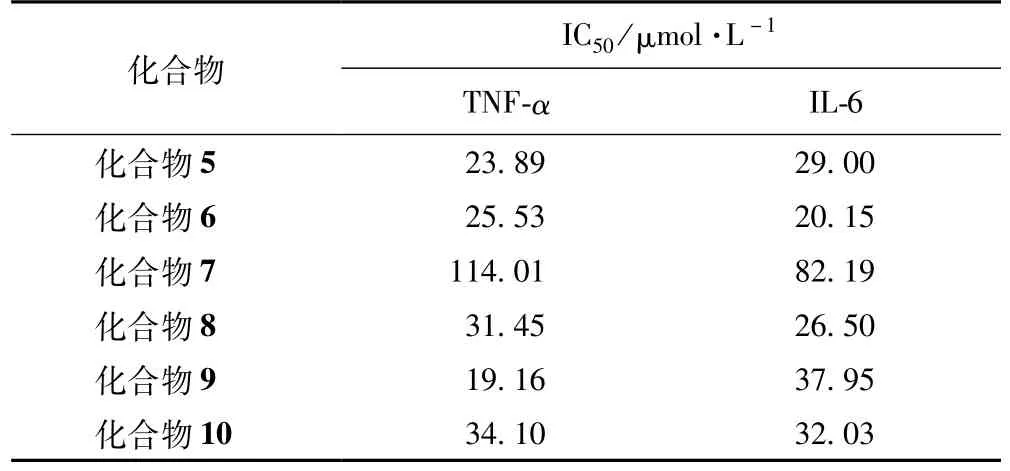
表1 化合物5~10对LPS刺激RAW 264.7细胞产生TNF-α和IL-6的影响
[1] 潘晓云,魏小平,尉秋实,等.多倍化—白刺属的系统分类、进化特征及应用前景[J].植物学通报,2003,20(5):632-638.
[2] 阿布都·沙力克努尔巴衣,潘晓玲.白刺属植物的化学成分分析及系统学意义[J].新疆大学学报:自然科学版,2003,20(1):50-54.
[3] 贾忠建,朱广军,王继和.唐古特白刺黄酮类化合物的研究[J].兰州大学学报(自然科学版),1991,27(3):102-107.
[4] 樊莲莲,刘金荣,赵文彬,等.唐古特白刺不同时期果实及叶所含黄酮的比较[J].中医药导报,2007,13(5):7-8.
[5] 刘利平,燕玲.白刺属植物化学成分的研究现状与发展趋势[J].内蒙古农业大学学报(自然科学版),2009,30(1):316-320.
[6] 柳润辉,陈丽莉,孔令义.乌桕树皮中的鞣花酸衍生物[J].中国药科大学学报,2002,33(5):370-373.
[7] He Q,Zhu E Y,Wang Z T,et al.Flavones Isolated from Codonopsis xundianensis[J].Chin Pharm J,2004,13(3):212-213.
[8] 严振,田洋,马跃平,等.雷公藤根化学成分研究[J].中国现代中药,2010,12(1):23-24.
[9] 张丽,赵钟祥,林朝展,等.青天葵化学成分的研究[J].中药新药与临床药理,2012,23(4):453-455.
[10]Merfort I,Buddrus J,Nawwar M A M,et al.A triterpene from the bark of Tamarix aphylla[J].Phytochemistry,1992,31(11):4031-4032.
[11]Li S,Dai S J,Chen R Y,et al.Triterpenoids from the stems of Myricaria paniculata[J].JAsian Nat Prod Res,2005,7(3):253-257.
[12]Park JH,Lee D G,Yeon SW,et al.Isolation ofmegastigmane sesquiterpenes from the silkworm(Bombyx mori L.)droppings and their promotion activity on HO-1 and SIRT1[J].Arch Pharm Res,2011,34(4):533-542.
[13]Koike K,Ohmoto T,Ikeda K.β-Carboline alkaloids from Picrasma quassioides[J].Phytochemistry,1990,29(9):3060-3061.
[14]JiaoW H,Gao H,Li C Y,et al.β-Carboline alkaloids from the stems of Picrasma quassioides[J].Magn Reson Chem,2010,48(6):490-495.
[15]Lai Z Q,Liu W H,Ip S P,et al.Seven alkaloids from Picrasma quassioides,and their cytotoxic activities[J].Chem Nat Compd,2014,50(5):884-888.

