rL-IL29对肺腺癌A549细胞生物学特性的影响及相关机制
杭敏,严玉兰,邵小美,张日婷,步雪峰
(1.江苏大学医学院,江苏镇江212013;2.江苏大学附属人民医院呼吸内科,江苏镇江212002;3.江苏大学附属人民医院普外科,江苏 镇江212002)
肺癌是最常见的恶性肿瘤之一,发病率及死亡率在多数国家均呈上升趋势[1]。尽管目前包括手术、放化疗及靶向治疗在内的主要治疗手段在不断进步,但多数患者治疗过程中病情仍迅速进展和出现复发转移。局部浸润和转移是癌症致死的主要原因,肿瘤细胞的迁移和侵袭也是促进肿瘤转移的关键环节。本实验组前期研究已发现,表达IL-29的重组新城疫病毒 LoSota株(recombinant Newcastle disease virus LoSota line expressing IL-29,rL-IL29)能抑制肺腺癌A549细胞的增殖及迁移,但未进一步观察其对肺癌细胞株侵袭力的影响及其可能的作用机制[2]。故本实验将rL-IL29感染肺腺癌A549细胞,采用CCK法、划痕试验及Transwell侵袭实验观察A549细胞的增殖、迁移和侵袭,并运用蛋白质印迹法检测细胞 E-钙黏蛋白、MMP2、波形蛋白及AKT/NF-κB相关蛋白的表达水平,进一步探索rLIL29对肺腺癌A549细胞增殖、迁移和侵袭的影响及其可能机制。
1 材料与方法
1.1 细胞株与主要试剂
人肺腺癌A549细胞株由江苏大学基础医学研究所保存,LoSota株新城疫病毒(Newcastle disease virus LoSota,NDVL)、鸡抗NDV HN蛋白抗体由中国农业科学院哈尔滨兽医研究所惠赠;rL-IL29由本课题组成员在中国农业科学院哈尔滨兽医研究所构建。DMEM及胎牛血清(维森特生物技术南京公司);CCK8试剂盒(南京厚载生物科技有限公司);Transwell小室(美国康宁公司);鼠抗β-肌动蛋白抗体(美国Santa Cruz公司);兔抗IL-29、E-钙黏蛋白、MMP2(72、66 kDa)、波形蛋白、p-AKT、P65抗体(美国博士德生物公司);HRP标记的山羊抗鼠二抗、HRP标记的山羊抗兔二抗(康为世纪公司);HRP标记的兔抗鸡二抗(美国Earthox公司)。
1.2 A549细胞的培养及病毒感染分组
NDVL及rL-IL29病毒原液的滴度分别为鸡胚半数感染量(50%egg infective doses,EID50)109.1、108.5 EID50/mL左右。用无血清的DMEM分别稀释NDVL及rL-IL29原液(1∶1 000)。接种对数生长期A549细胞在含10%胎牛血清的DMEM培养基中,置于37℃、5%CO2的培养箱培育2~3 d换液,待细胞密度达70%~80%时,随机分为PBS组、NDVL组及rL-IL29组,分别加入PBS及稀释后的NDVL及rL-IL29病毒液,继续培养24 h。
1.3 蛋白质印迹法检测A549细胞中NDV HN、IL-29、E-钙黏蛋白、MMP2、波形蛋白及 PI3K/AKT/NF-κB通路相关蛋白的表达
分别收集上述3组细胞并提取蛋白,BCA试剂盒定量各组蛋白。配置SDS-PAGE凝胶(10%的分离胶和5%的浓缩胶),蛋白上样,先80 V 20min,再120 V 70 min电泳,结束后350 mA恒流转膜1.5 h(电压60~70 V),脱脂奶粉室温封闭1 h;加入鸡抗NDV HN蛋白抗体(1∶800)或兔抗 IL-29、E-钙黏蛋白、MMP2、波形蛋白、p-AKT、P65抗体(1∶300)以及鼠抗β-肌动蛋白抗体(1∶2 000),4℃孵育过夜;TBST洗膜30 min/次,共3遍,后分别加入相应的二抗37℃保温箱孵育1 h;TBST洗膜30 min/次,共3遍,曝光获得目的条带。采用β-肌动蛋白作为内参,测定各泳道目的蛋白的灰度值并计算比值。
1.4 CCK8法检测rL-IL29感染对A549细胞增殖的影响
用无血清DMEM稀释病毒原液至以下浓度:1×10-2、1×10-3、1×10-4、1×10-5。将对数生长期A549细胞用含10%胎牛血清的DMEM培养基制成约1×105个/mL密度的细胞悬液,取100μL置96孔板(边缘孔用无菌水填充),置37℃、5%CO2培养箱孵育过夜。每孔加入不同浓度的NDVL及rLIL29感染细胞,以加入PBS作为对照组,每组设3个复孔,置37℃、5%CO2培养箱孵育24 h。每孔加入10μL CCK8溶液,37℃孵育1 h。同时设置空白孔(仅加培养基及CCK8溶液,无细胞)。用酶标仪测定450 nm各孔的D值。细胞活力(%)=(实验组D值-空白D值)/(对照组D组-空白D值)×100%。
1.5 划痕实验检测rL-IL29感染对A549细胞迁移的影响
接种对数生长期A549细胞于24孔板中,用含10%胎牛血清的DMEM培养基培育,待细胞汇合度达80%~90%时,用无菌200μL加样枪头在细胞层中纵向划一条直线,保持宽度均匀一致;PBS洗3遍后,分别加入DMEM培养基稀释后的PBS(对照组)、NDVL及 rL-IL29(1∶1 000);每组均设立2个复孔。分别于划痕后0、48 h在倒置相差显微镜下观察划痕间距。
1.6 Transwell法检测rL-IL29感染对A549细胞侵袭的影响
将对数生长期A549细胞,用无血清DMEM配制成约1×105个/mL密度的细胞悬液,取200μL滴入24孔板Transwell小室的上室,下室分别加入含10%胎牛血清的DMEM培养基稀释的PBS(对照组)、NDV及 rL-IL29(1∶1 000)各500μL,每组均设立2个复孔,37℃、5%CO2的培养箱内培育24 h。用棉签擦去Transwell上室聚碳酸酯膜表面的细胞,PBS洗2遍,将上室置于4%多聚甲醛中固定15 min。PBS洗2遍后,结晶紫染色20 min,再用PBS洗2遍后,倒置相差显微镜下计数10个不同视野的细胞数,计算平均值。
1.7 统计学处理
2 结果
2.1 感染rL-IL29后的A549细胞表达NDV HN和IL-29蛋白
蛋白质印迹检测结果显示,rL-IL29及NDVL感染A549细胞24 h后,NDV-HN蛋白在NDVL组及rLIL29组均稳定表达,且rL-IL29组表达量高于NDVL组,而PBS组未见NDV-HN表达;rL-IL29组IL-29蛋白的表达水平明显高于NDVL组和PBS组。见图1。
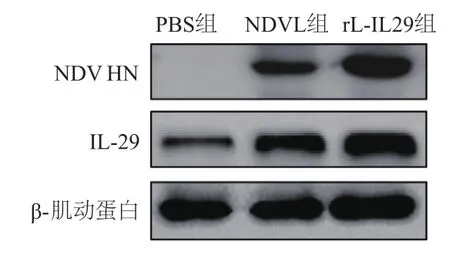
图1 A549细胞感染rL-IL29后NDV HN和IL-29蛋白的表达
2.2 rL-IL29感染后A549细胞增殖能力下降
CCK8细胞增殖实验结果显示,rL-IL29及NDVL感染A549细胞24 h后能够抑制细胞的增殖,且rL-IL29组的细胞活力明显低于 NDVL组(P<0.05);随着病毒稀释倍数的增加,NDV组及 rLIL29组A549细胞活力逐步增强。见图2。
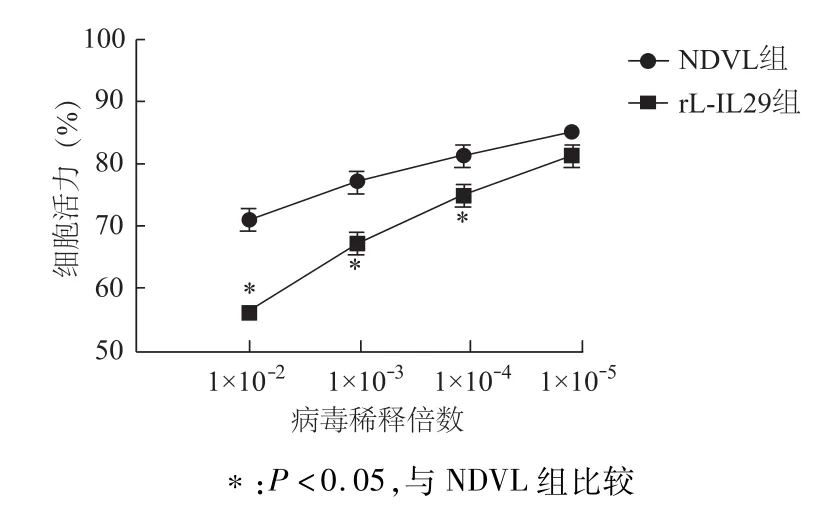
图2 不同浓度的rL-IL29及NDVL对A549细胞生长的影响
2.3 A549细胞感染rL-IL29后迁移能力降低
划痕后48 h显微镜下观察各组细胞由两侧向中央迁移的距离,结果显示rL-IL29组A549细胞迁移率明显低于 NDVL组和 PBS组(t=10.87,20.04;P<0.05),NDV组A549细胞迁移率明显低于PBS组(t=25.92,P<0.05)。见图3。
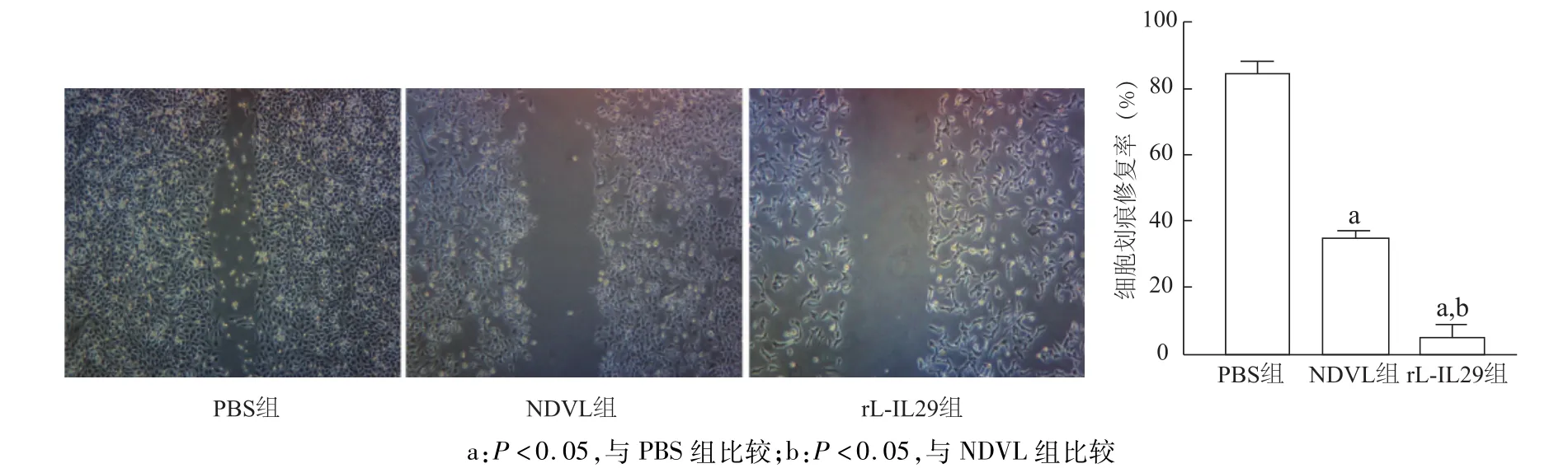
图3 rL-IL29及NDVL感染对A549细胞迁移能力的影响(划痕实验×40)
2.4 A549细胞感染rL-IL29后侵袭能力降低
Transwell检测显示,rL-IL29组A549细胞穿过Transwell小室的细胞数明显少于NDVL组和PBS组(t=10.29,14.97;P<0.05),NDVL组 A549细胞穿过Transwell小室的细胞数亦明显少于PBS组(t=8.449,P<0.05)。见图4。
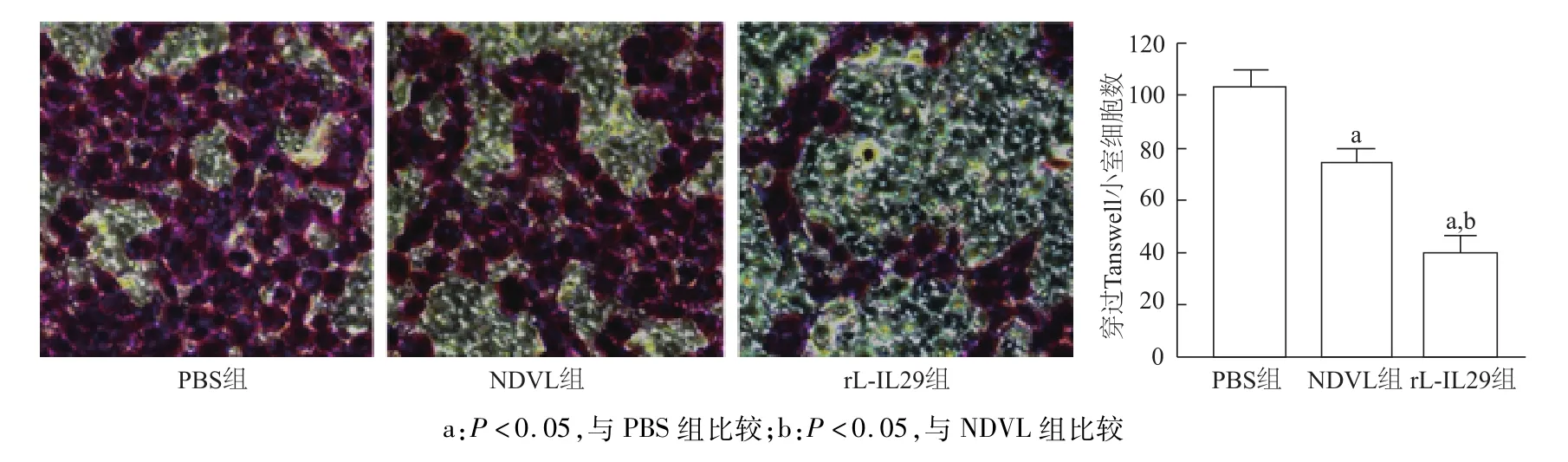
图4 rL-IL29及NDVL感染对A549细胞侵袭力的影响(Transwell侵袭实验×200)
2.5 rL-IL29感染对 A549细胞中 E-钙黏蛋白、MMP2、波形蛋白及AKT/NF-κB相关蛋白表达的影响
蛋白质印迹结果显示,与PBS组比较,NDVL组A549细胞中E-钙黏蛋白表达量显著增加(t=12.65,P<0.05),而波形蛋白、MMP2前体和激活体(66 kDa/72 kDa)、p-AKT及 P65蛋白表达均明显降低(t=2.97,2.86,6.871,3.286,3.534;均 P<0.05)。与 NDVL组比较,rL-IL29组A549细胞E-钙黏蛋白表达量明显增加(t=18.66,P<0.05),其余蛋白表达均明显下降(t=6.04,6.018,11.25,5.095,9.058;均 P<0.05)。见图5。
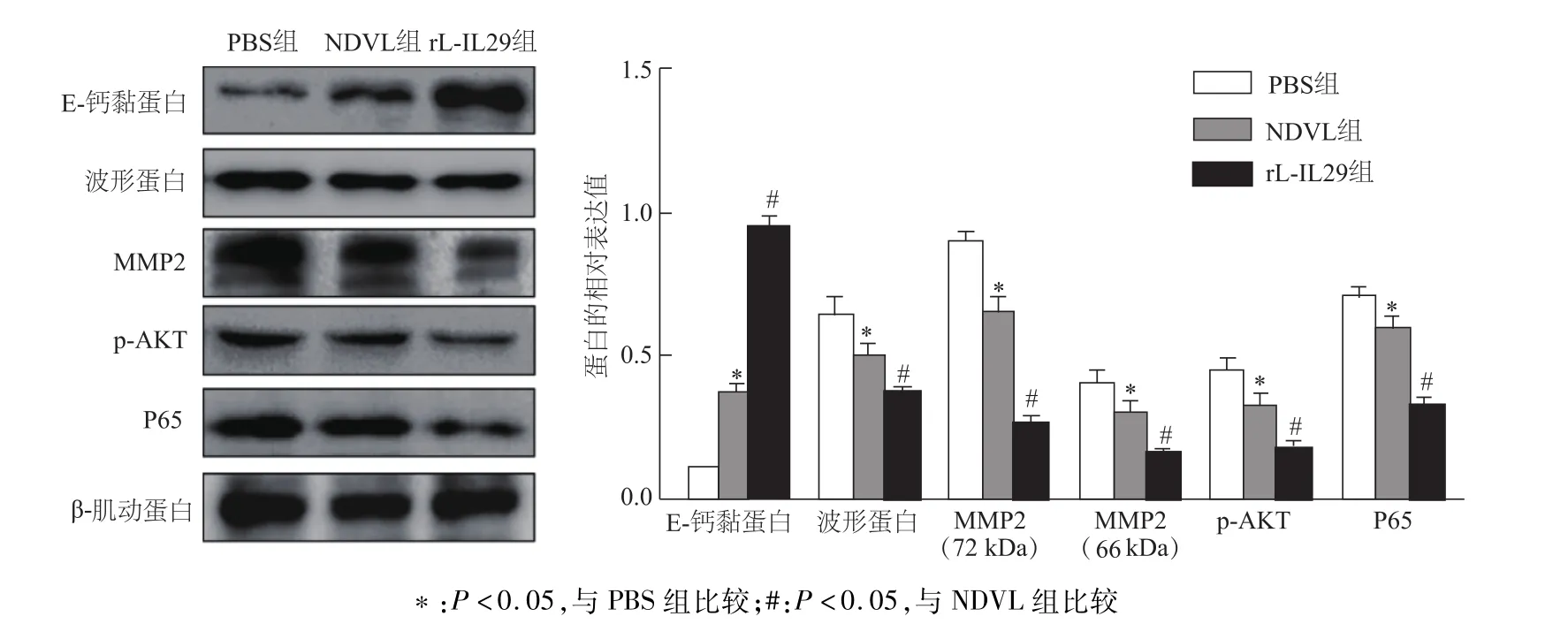
图5 感染rL-IL29及NDVL后A549细胞中E-钙黏蛋白、MMP2、波形蛋白及AKT/NF-κB相关蛋白的表达
3 讨论
NDV属于溶瘤病毒,能高度选择性杀伤肿瘤细胞且不损伤正常细胞。近年来大量研究表明溶瘤病毒治疗肿瘤安全且有效[3-5]。IFNλ家族是2003年Sheppard等[6]首先报告的一组新型人白细胞介素(interleukin,IL),又名Ⅲ型 IFN,包括 IL-29(IFN-λ1)、IL-28A(IFN-λ2)和 IL-28B(IFN-λ3)。其结构与Ⅰ型IFN相似,功能较Ⅰ型IFN增强,具有抗病毒、抗增殖、抗肿瘤以及免疫调节等生物学活性。人体中IL-29活性最强。研究发现人体不同器官的IL-28R1表达水平具有明显差异,IL-29在多种细胞中均有表达,而IL-29通过与IL-28R1结合发挥生物学效应,说明 IL-29的特异性靶细胞呈高度局限性[7]。因此,与Ⅰ型IFN相比,IL29疗效高而毒副反应小。Numasaki等[8]通过质粒转导 IFNλ促使鼠纤维肉瘤MCA205细胞分泌m IFN-λ,发现体内成瘤受到明显抑制且皮下瘤肺转移灶明显减少。
上皮细胞间质化对肿瘤细胞的原位侵袭和远处转移过程起重要作用。上皮细胞间质转化过程通常伴有上皮标志物如E-钙黏蛋白等的下调和间质标志物如波形蛋白等的上调[9]。基质金属蛋白酶如MMP2/9,能降解基底膜细胞外基质、促进肿瘤细胞侵袭周边结缔组织进入脉管系统形成转移灶[10-11]。本研究蛋白质印迹结果显示,rL-IL29感染后可上调E-钙黏蛋白表达水平及下调MMP2、波形蛋白表达。推测rL-IL29可通过调控上皮细胞间质化相关因子活性抑制肿瘤细胞的侵袭及迁移。
PI3K/AKT信号通路与肿瘤的发生、发展密切相关,其活化可促进肿瘤细胞的增殖及转移,抑制凋亡及阻断肿瘤新生血管形成等[12]。活化的AKT(p-AKT)通过下游多种途径对靶蛋白进行磷酸化而发挥作用[13]。本研究结果显示,rL-IL29可下调A549细胞株中AKT的磷酸化水平。另已发现PI3K/AKT转导路径通过调节肺腺癌MMPs表达参与肿瘤转移及浸润[14]。因此rL-IL29对肺腺癌A549细胞株的侵袭、转移能力的影响可能与PI3K/AKT信号通路相关。PI3K/AKT的下游蛋白NF-κB是机体内具有多种调控作用的转录因子,参与了肿瘤细胞的分化、凋亡和迁移,可促进肿瘤发展的进程[15]。P65为NF-κB家族的重要成员,一般以非活性的 P65/P50/IκB(κB抑制物)聚体复合物存在于胞质内[16],受到炎症因子刺激后磷酸化激活从而发挥促肿瘤作用。研究发现[17],NF-κB可调节 MMPs的表达,从而促进肿瘤迁移、侵袭。本实验结果表明,rL-IL29可下调P65蛋白表达水平。因此推测rL-IL29可通过AKT/NF-κB路径调节肺腺癌A549细胞株的侵袭、转移能力。
综上,本研究表明rL-IL29可能通过阻碍AKT/NF-κB信号通路,上调 E-钙黏蛋白的表达和下调MMP2、波形蛋白的表达,从而抑制肺腺癌A549细胞的侵袭及迁移,但具体的作用机制仍需进一步证实。
[参考文献]
[1]Torre LA,Bray F,Siegel RL,etal.Global cancer statistics,2012[J].CA Cancer JClin,2015,65(2):87-108.
[2]严玉兰,刘沙,李米,等.rNDVIL-29对肺腺癌 A549细胞恶性生物学行为的影响[J].中国肿瘤生物治疗杂志,2017,24(5):510-515.
[3]Hotte SJ,Lorence RM,Hirte HW,et al.An optimized clinical regimen for the oncolytic virus PV701[J].Clin Cancer Res,2007,13(3):977-985.
[4]Lorence RM,Roberts MS,O′Neil JD,et al.Phase 1 clinical experience using intravenous administration of PV701,an oncolytic Newcastle disease virus[J].Curr Cancer Drug Targets,2007,7(2):157-167.
[5]Chai Z,Zhang P,Fu F,etal.Oncolytic therapy of a recombinant Newcastle disease virus D90 strain for lung cancer[J].Virol J,2014,11:84.
[6]Sheppard P,KindsvogelW,Xu W,etal.IL-28,IL-29 and their classⅡ cytokine receptor IL-28R[J].Nat Immunol,2003,4(1):63-68.
[7]Witte K,Witte E,Sabat R,et al.IL-28A,IL-28B,and IL-29:promising cytokines with typeⅠ interferonlike properties[J].Cytokine Growth Factor Rev,2010,21(4):237-251.
[8]NumasakiM,Tagawa M,Iwata F,et al.IL-28 elicits antitumor responses againstmurine fibrosarcoma[J].J Immunol,2007,178(8):5086-5098.
[9]Fuxe J,Vincent T,Garcia de Herreros A.Transcriptional crosstalk between TGF-βand stem cell pathways in tumor cell invasion:role of EMT promoting Smad complexes[J].Cell Cycle,2010,9(12):2363-2374.
[10]Zhang D,Lu C,Ai H.Rab5a is overexpressed in oral cancer and promotes invasion through ERK/MMP signaling[J].Mol Med Rep,2017,16(4):4569-4576.
[11]Zhou RT,He M,Yu Z,et al.Baicalein inhibits pancreatic cancer cell proliferation and invasion via suppression of NEDD9 expression and its downstream Akt and ERK signaling pathways[J].Oncotarget,2017,8(34):56351-56363.
[12]Maoa R,Zou F,Yang L,et al.The loss of MiR-139-5p promotes colitis-associated tumorigenesis by mediating PI3K/AKT/Wnt signaling[J].Int JBiochem Cell Biol,2015,69:153-161.
[13]Zhang R,Sun S,Ji F,et al.CNTN-1 enhances chemoresistance in human lung adenocarcinoma through induction of epithelial-mesenchymal transition by targeting the PI3K/Akt pathway[J].Cell Physiol Biochem,2017,43(2):465-480.
[14]Niu H,Wu B,Peng Y,et al.RNA interference-mediated knockdown of RhoGDI2 induces the migration and invasion of human lung cancer A549 cells via activating the PI3K/Akt pathway[J].Tumour Biol,2015,36(1):409-419.
[15]Zhao M,Gao Y,Wang L,etal.Overexpression of integrin-linked kinase promotes lung cancer cell migration and invasion via NF-κB-mediated upregulation ofmatrix metalloproteinase-9[J].Int JMed Sci,2013,10(8):995-1002.
[16]Sasaki K,Iwai K.Roles of linear ubiquitinylation,a crucial regulator of NF-κB and cell death,in the immune system[J].Immunol Rev,2015,266(1):175-189.
[17]Amin H,Wani NA,Farooq S,et al.Inhibition of invasion in pancreatic cancer cells by conjugate of EPA with β(3,3)-Pip-OH via PI3K/Akt/NF-kB pathway[J].ACSMed Chem Lett,2015,6(10):1071-1074.

