肺炎合并脓毒症患儿血清可溶性晚期糖基化终末产物受体及维生素D的检测
张晓蒙,苏秦,朝鲁门其其格,李琳琳,庄蒙丽
(内蒙古医科大学附属医院儿科,内蒙古呼和浩特010000)
脓毒症是由感染因素使炎性介质爆发失控性反应引起的全身炎症反应综合征,死亡率逐年增高[1]。小儿肺炎因病情迁延或治疗不当,极易演变成重症肺炎,发展成全身感染,导致脓毒症的发生。小儿重症肺炎目前也成为诱发脓毒症的主要危险因素[2-3]。因此,脓毒症早期进行有效的预测有助于医生对疾病进行诊断[4]。可溶性晚期糖基化终末产物受体(soluble receptor of advanced glycation endproducts,sRAGE)是RAGE胞外区可溶部分,可竞争性结合RAGE的多种配体,抑制促凝、促炎及生物氧化应激反应,进而对机体产生保护作用。研究显示,sRAGE在多种急慢性炎症反应的始动和持续作用中起重要作用,并且还参与整个脓毒症的病理生理过程[5]。维生素D是一种脂溶性维生素,参与机体激素分泌的调节、免疫功能的调控以及细胞增殖与分化等[6]。研究发现,重症ICU患者血清维生素D水平显著降低,是患者死亡的独立危险因素[6]。脓毒症常伴随低血钙、低蛋白血症,进而会引起维生素D的半衰期缩短或降解,也会导致血清中的25(OH)-D3水平降低。近来多项研究发现,血清降钙素原、超敏C反应蛋白(hs-CRP)等对脓毒症的早期诊断及预后有一定的预测价值[7-8],但 RAGE及维生素D在脓毒症的发生发展过程中的预测价值尚不清楚。因此,本研究观察肺炎合并脓毒症患儿血清中RAGE及维生素D水平的变化并探讨两者对病情评估的意义。
1 对象与方法
1.1 病例
随机选取2015年5月至2017年6月于本院儿科就诊住院的134例肺炎及肺炎合并脓毒症患儿,并且均已获得患儿家长的知情同意。将134例患儿按照全身性感染相关性器官功能衰竭(SOFA)评分[8]分为非脓毒症组(n=32)和脓毒症组(n=102);非脓毒症组男19例,女13例,平均年龄为(38.23±23.65)月;再将 102例脓毒症患儿根据1995年中华医学会儿科学会急救组制定的小儿危重病例评分法(pediatric critical illness score,PCIS)标准进行评分[9],分为非危重脓毒症组(80分 <PCIS≤100分,n=34),男18例,女16例,平均年龄为(40.11±21.76)月;脓毒症危重组(71分 <PCIS≤80分,n=33),男20例,女13例,平均年龄为(39.78±25.11)月;极危重组(PCIS≤70分,n=35),男 21例,女 14例,平均年龄为(42.88±24.89)月。另选取 30例健康儿童作为对照组,男 18例,女 12例,平均年龄为(41.46±23.86)月。各组患儿治疗前的一般资料间的差异均无统计学意义(P>0.05),具有可比性。
1.2 诊断标准
均符合美国重症医学会(SCCM)与欧洲危重病学会(ECICM),美国危重病医学会及欧洲危重病协会联合发布的《拯救脓毒症运动:2016国际脓毒症和感染性休克管理指南》[9]。
1.3 排除标准
排除自身免疫性疾病、遗传代谢性疾病、肿瘤患儿;支原体肺炎及病毒性肺炎患儿;其他部位感染引发脓毒症者;3月内接受免疫抑制剂或长期服用糖皮质激素的患儿,并剔除治疗不足24 h死亡或未能坚持治疗患儿。
1.4 方法
所有入选患儿在入院24 h后均进行PCIS评分,入院后第1天清晨空腹采集外周肘正中静脉血4 mL,静置3 h后取血清。ELISA法检测各组患儿血清中的 sRAGE、25(OH)-D3、降钙素原及 hs-CRP浓度;试剂盒为上海裕平生物科技有限公司产品;550型酶标仪为美国BD公司产品。具体操作严格按照试剂盒说明书进行。
1.5 统计学处理
所得资料均采用SPSS 15.0统计软件分析,计量资料以均数±标准差(±s)表示,多组之间计量资料比较采用单因素方差分析,进一步两两比较采用LSD-t检验,计数资料采用χ2检验;sRAGE、25(OH)-D3与 PCIS评分的相关性分析采用Spearman相关性检验,P<0.05表示差异有统计学意义。
2 结果
2.1 sRAGE、25(OH)-D3浓度及 PCIS评分比较
由表1可知,5组间血清sRAGE浓度差异有统计学意义(F=83.44,P<0.05)。非脓毒症组、非危重脓毒症组、脓毒症危重组、极危重组sRAGE浓度均高于对照组(P<0.05),其中脓毒症危重组、极危重组sRAGE浓度高于非危重脓毒症组(P<0.05),极危重组 sRAGE浓度高于脓毒症危重组(P<0.05)。
5组间血清25(OH)-D3、降钙素原及hs-CRP含量间的差异均有统计学意义(F=86.81,65.35,42.61,P均 <0.05)。与对照组比较,各病例组患儿三者含量均明显降低(P<0.05),其中脓毒症危重组、极危重组25(OH)-D3的浓度显著低于非危重脓毒症组(P<0.05),而PCT及hs-CRP水平则高于非危重脓毒症组(P<0.05)。
非危重脓毒症组、脓毒症危重组和极危重组的死亡率差异亦有统计学意义(χ2=20.92,P<0.05);其中极危重组最高,脓毒症危重组次之,非危重组最低。
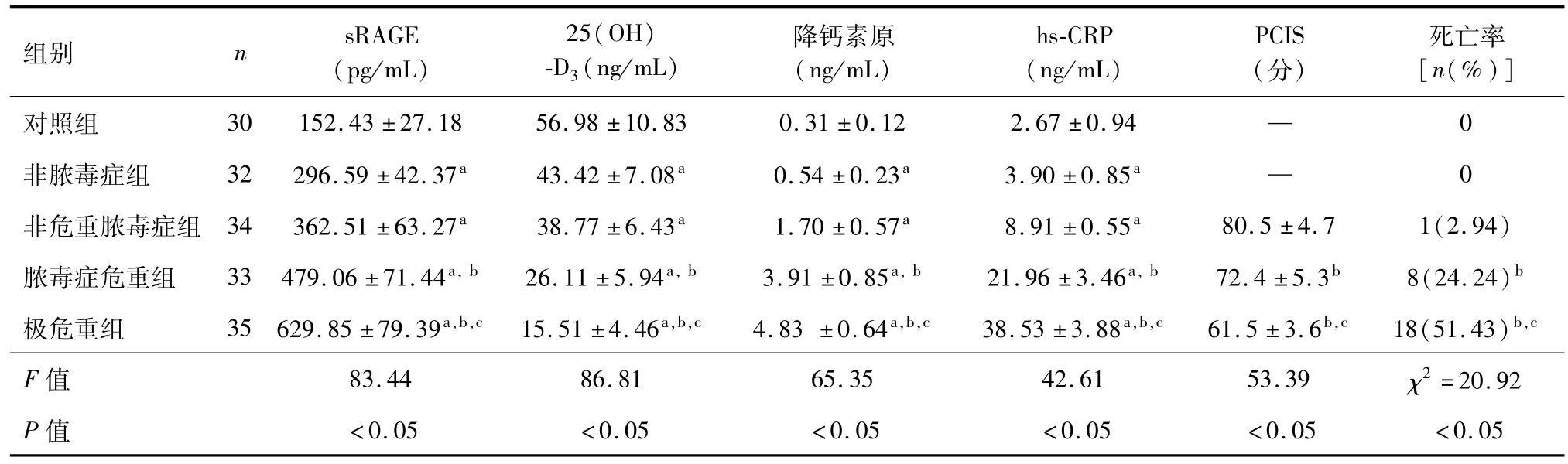
表1 各组患儿sRAGE、25(OH)-D3含量及PCIS评分比较
2.2 sRAGE、25(OH)-D3浓度及 PCIS的相关性分析
由图1、图2可见,患儿血清sRAGE与PCIS评分呈明显负相关(r=-0.913,P<0.05),25(OH)-D3与 PCIS评分呈明显正相关(r=0.873,P<0.05)。

图1 脓毒症患儿sRAGE与PCIS评分相关性

图2 脓毒症患儿25(OH)-D3与PCIS评分相关性
2.3 ROC曲线分析
sRAGE、25(OH)-D3、降钙素原和 hs-CRP预测脓毒症的敏感度分别为 86.2%、80.2%、79.1%、68.8%;特异度分别为 99.5%、98.9%、87.4%、61.4%;ROC曲线下面积为 0.932、0.901、0.786、0.684。见图3。

图3 sRAGE、25(OH)-D3、降钙素原及hs-CRP预测脓毒症的ROC曲线
3 讨论
RAGE是一个跨膜受体,可以与多个配体结合,而HMGB1就是高级糖基化终产物RAGE的特异性配体,RAGE可通过HMGB1介导巨噬细胞凋亡。正常组织中RAGE低表达,与不同配体结合可激活不同的信号途径,且与其配体结合后可上调自身的表达;而脓毒症患儿组织中的RAGE与配体结合后,加上炎症介质的诱导,使细胞持续处于激活状态,多种细胞信号途径被激活,RAGE持续高表达,维持和扩大炎症反应[10-11]。已有研究表明,RAGE是小儿脓毒症预后的重要预测因素[12]。本研究结果显示,肺炎患儿及肺炎合并脓毒症患儿的RAGE均高于健康儿童,提示RAGE与脓毒症的发生、发展相关,可用于脓毒症预后评价。本研究中,随着PCIS评分下降,脓毒症患儿的RAGE水平逐渐升高,二者呈负相关,并且PCIS评分越低RAGE浓度越高,尤以急危重组RAGE浓度最高。由此可见,RAGE浓度与PCIS评分对于肺炎合并脓毒症患儿病情预后的诊断具有一定的价值,sRAGE可作为脓毒症预后评价的早期生物标志物。
维生素D在肝脏中转化为25(OH)-D3,又在1α-羟化酶的作用下转化为具有活性的1,25(OH)2-D3;25(OH)-D3为维生素 D的活化形式,通常以血清中25(OH)-D3作为评估机体维生素D水平的有效指标[13-14]。脓毒症患儿的维生素D缺乏发生率高,且维生素 D缺乏也与其预后相关。研究发现[15],肺炎患儿的炎症反应及感染程度越重,25(OH)-D3水平越低;危重症患儿25(OH)-D3水平显著低于健康者,且与未合并脓毒症患儿相比,合并脓毒症患儿的25(OH)-D3水平明显降低。本研究显示,肺炎及肺炎合并脓毒症患儿血清25(OH)-D3水平显著低于健康儿童,并且随着脓毒症病情的进展,患者血清25(OH)-D3的水平降低更明显,与PCIS评分成正相关,表明25(OH)-D3可以反映脓毒症的病情严重程度,这与李慧丽等[6]的研究一致。
PCIS评分是国内应用最广泛、最权威且客观有效的评分法,可对患儿的病情危重程度进行准确评判。本研究发现,随着脓毒症病情进展,PCIS评分明显降低。此外,脓毒症患儿血清中的sRAGE和25(OH)-D3与疾病的危重程度密切相关,由此表明,sRAGE和25(OH)-D3可作为脓毒症早期诊断及预后的重要指标。肺炎合并脓毒症患儿早期发病急,病情进展快,发病初期病情变化观察不及时可致治疗方案的调整严重滞后。本研究通过ROC曲线分析得出,sRAGE和25(OH)-D3的敏感性及特异性较PCT和hs-CRP高,表明肺炎合并脓毒症患儿早期血清sRAGE和25(OH)-D3浓度变化更能反映病情严重程度及预后。
综上所述,sRAGE和25(OH)-D3的检测对肺炎合并脓毒症患儿病情的严重程度判断有重要的价值,适合在临床中推广应用。
[参考文献]
[1]张俊光,黄东华.芪参活血颗粒对肺炎合并脓毒症患儿血清炎症反应的影响[J].天津医药,2017,45(5):510-513.
[2]杨秀霖,王程毅,郑启安,等.重症肺炎合并脓毒症患儿炎症因子及凝血指标与危重症评分相关性分析[J].中国循证儿科杂志,2013,8(4):300-303.
[3]李虹光,徐晓军,杨建荣,等.肺炎合并脓毒症患儿血清降钙素原水平变化的临床意义[J].解放军预防医学杂志,2016,34(5):709-711.
[4]齐英征.降钙素原与小儿危重病例评分对脓毒症患儿预后的影响[J].中国当代儿科杂志,2014,16(2):190-193.
[5]彭正良,卿国忠,尹剑,等.可溶性晚期糖基化终末产物受体在脓毒症早期诊断中的价值[J].中南医学科学杂志,2016,44(4):414-416.
[6]李慧丽,田昭涛.脓毒症患者血清维生素D水平变化及意义[J].山东医药,2015,55(20):52-53.
[7]庄明峰,徐晓涵,刘大东,等.CORM-2通过 PKCθ/Munc18a信号途径抑制脓毒症血小板α颗粒的释放[J].江苏大学学报(医学版),2016,26(1):35-39,44.
[8]陈琛,苏华,蒋丽娜,等.血清IL-4、NT-proBNP及PCT检测在脓毒症患者预后的应用[J].检验医学与临床,2017,14(6):762-764.
[9]Rhodes A,Evans LE,Alhazzani W,et al.Surviving sepsis campaign:international guidelines for management of sepsis and septic shock:2016[J].Intensive Care Med,2017,43(3):304-377.
[10]陈璐,冯伟,郭轶男.右美托咪啶对脓毒症急性肺损伤大鼠 IL-10表达的干预作用[J].解剖学研究,2016,38(1):16-18,24.
[11]张娈娈,王奇坤,陈德,等.脓毒症患者血浆可溶性晚期糖基化终末产物受体水平与心功能的关系[J].中国循环杂志,2016,31(1):73-76.
[12]赖世超.可溶性晚期糖基化终末产物受体在小儿脓毒症病情及预后评估中的价值[J].成都医学院学报,2017,12(4):457-460.
[13]陈朝彦,罗佐杰,胡杰妤,等.维生素D缺乏与脓毒症预后相关性研究[J].中国实用内科杂志,2014,34(11):1087-1090.
[14]黄梦,李克诚,徐旭,等.血清25- OH- 维生素D在儿童脓毒症发病机制中的研究[J].中国全科医学,2017,20(S2):5-8.
[15]丁玲,李温慈,张宇.维生素D对婴幼儿肺炎的临床价值探讨[J].儿科药学杂志,2017(3):18-21.

