共抑制RAD18和REV1基因显著增加顺铂对肺癌细胞的毒性
金君,李坚,袁荣霞
(江苏大学附属医院呼吸内科,江苏镇江212001)
近年来全世界每年约有近1 600万人死于肺癌[1]。大多数患者确诊时已是局部晚期或晚期肺癌。顺铂作为晚期非小细胞肺癌联合化疗方案中的基本药物,在临床长期使用过程中引起的肿瘤细胞耐药性使其治疗效果逐渐降低[2]。顺铂主要通过作用于DNA导致其形成链间交联和链内交联,造成DNA损伤,由此干扰DNA的复制与转录过程,最终导致细胞死亡。链间交联指DNA链间发生了错误的共价交联,是毒性最强的一种DNA损伤,如不及时修复,链间交联会转换成DNA双链断裂(DSB)。相关研究发现,肿瘤细胞对顺铂的耐药性与DNA损伤修复能力增强有关。根据DNA损伤的类型和位点,链间交联损伤的修复方式可分为核苷酸切除修复、非同源末端连接、同源重组修复、跨损伤合成(translesion synthesis,TLS)修复和范可尼贫血(Fanconi anemia,FA)通路等[3]。而与其他通路不同的是,TLS通路可通过复制性DNA聚合酶越过损伤的DNA位点继续进行DNA链复制来耐受DNA损伤[2-3]。
近年来的研究发现,肺癌细胞获得性耐药与FA通路以及TLS通路等的再活化有关[2-4]。在链间交联损伤修复过程中,FA通路、TLS通路和其他信号通路交互作用,共同参与这种DNA损伤的修复。FA是一种罕见的常染色体隐性遗传病,绝大部分由FA相关基因失活引起。这种遗传病会导致患者的体细胞对DNA交联剂类化疗药物(如顺铂)异常敏感,并且使患者更易发生肿瘤和骨髓衰竭[5]。目前已经证实FA通路由19个FA蛋白(FANCA-FANCNT)组成,其中任何一个蛋白的缺失都有可能导致细胞对DNA交联性损伤剂的高度敏感,这也构成了抑制FA通路蛋白增加铂类药物对肿瘤细胞毒性的作用机制[6]。
RAD18作为一种E3泛素连接酶可与RAD6结合形成RAD6/RAD18复合体,通过诱导增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)的单泛素化和招募TLS聚合酶来激活TLS通路。RAD6/RAD18还可通过诱导FANCD2的单泛素化激活FA通路[7-8]。同时单泛素化的FANCD2亦可通过招募TLS聚合酶激活TLS通路。REV1属于TLS聚合酶中的Y家族成员,在链间交联和DSB损伤的修复中扮演了重要角色,具有为其他TLS聚合酶提供平台的作用[9-10]。其他Y家族的DNA聚合酶通过REV1作用域与REV1相互作用,在DNA损伤耐受机制中行使功能。例如,DNA聚合酶η的一个PIP结构域与REV1作用域重叠,可与REV1结合并激活下游蛋白[11]。
本实验应用siRNA技术沉默 A549/DDP细胞的FA通路和TLS通路的上游调节基因RAD18以及TLS通路的REV1基因后,观察FANCD2及PCNA的单泛素化水平、细胞增殖率、细胞周期以及细胞凋亡率变化,探讨抑制 RAD18和 REV1后逆转 A549/DDP细胞对顺铂耐药性的可行性及机制。
1 材料与方法
1.1 材料
肺癌A549和A549/DDP细胞株(中科院上海生命科学研究院);RMPI 1640培养液以及胎牛血清(以色列Bioind公司);顺铂注射液(江苏豪森制药有限公司);siRNA套装:含RAD18与REV1的特异性siRNA及阴性对照siRNA(广州锐博生物科技有限公司);LipofectamineTM2000试剂盒(美国Invitrogen公司);CCK-8检测试剂盒(日本同仁化学研究所);Annexin V-FITC/PI流式细胞凋亡检测试剂盒与PI/RNase细胞周期检测试剂(美国 BD公司);RAD18和PCNA蛋白抗体(美国 Cell Signaling公司);REV1和 FANCD2蛋白抗体(美国 Santa Cruz公司);羊抗鼠二抗、羊抗兔二抗、PVDF膜、牛血清白蛋白和ECL发光剂(美国Millipore公司)。
1.2 细胞培养及siRNA转染
用含有0.1%青霉素与链霉素(双抗)及10%胎牛血清的RMPI 1640培养液培养A549和A549/DDP细胞株,在37℃,5%CO2饱和湿度培养箱中孵育。
将处于对数生长期的A549/DDP细胞均匀接种于6孔板,使每孔密度相近,约为80%。过夜培养后用不含胎牛血清及双抗的培养液(空白培养液)饥饿细胞2 h。取 siRNA储存液2.5μL及 LipofectamineTM2000试剂5μL分别溶于250μL空白培养液中,室温孵育5 min后,在20 min内加入每孔含空白培养液1 mL的上述6孔板中。转染6~8 h后,用只含10%胎牛血清的培养液继续培养,以备后续实验使用。
1.3 蛋白质印迹法检测肺癌细胞株中各蛋白的表达
提前1 d将A549和转染前后的A549/DDP细胞株分别接种于6孔板中,待细胞处于对数生长期时,分别加入含顺铂浓度梯度为 0、1.25、2.5、5、10和20μg/mL的2 mL培养液培养24 h后,先用预冷(4℃)1×PBS冲洗各孔3次,弃上清液,再每孔加入细胞裂解液90μL,用细胞刮板分别取出细胞裂解物于标记的EP管中,干式恒温器100℃煮沸5 min,细胞超声破碎仪破碎30 s,常温离心机2 000 r/min离心1 min后,置于-20℃冰箱保存。蛋白样品行10%SDS-PAGE,根据蛋白分子量大小选择转膜90~120 min,后续用脱脂牛奶封闭1 h,相应的一抗REV1羊抗人(1∶1 000)、RAD18(1∶1 000)、FANCD2(1∶1 000)和 PCNA(1∶1 000)兔抗人低温(4℃)摇床孵育过夜,用TBST洗膜(15 min×3次),羊抗鼠 IgG(1∶10 000)和羊抗兔 IgG(1∶10 000)二抗孵育1 h,现配现用ECL发光剂,用化学发光成像仪曝光,Lane 1D凝胶分析软件分析其灰度。每个蛋白的相对含量为蛋白的表达量与对应的β-肌动蛋白比值,FANCD2单泛素化水平为FANCD2长短片段之比即L/S,PCNA单泛素化水平为PCNA-mUb与PCNA的比值。实验重复3次。
1.4 CCK-8法检测A549/DDP细胞的增殖率
将转染前后的A549/DDP细胞株接种于96孔板,使每孔密度约为2×103个,同时设置3个复孔。在96孔板各孔中分别加入含顺铂浓度梯度为0、1.25、2.5、5、10和20μg/mL的 100μL培养基分别培养24和48 h,用空白培养液作为空白组进行校正。每孔加入含10%CCK-8试剂的培养液100 μL,培养箱孵育1~2 h后,酶标仪上检测光密度(D)值。细胞增殖率=[(实验组D平均值-空白组D平均值)/(阴性对照组D平均值-空白组D平均值)]×100%。实验重复3次。
1.5 流式细胞术检测A549/DDP细胞的凋亡率
以6孔板培养转染前后的A549/DDP细胞,使其密度约为2×105/孔。加入含顺铂浓度为10μg/mL的2 mL培养液培养48 h,用无EDTA胰蛋白酶消化细胞,低温离心机2 000 r/min离心10 min,用预冷(4℃)1×PBS重悬细胞,再次离心,倒尽上清液,取1×连接缓冲液500 mL轻柔缓慢稀释成细胞悬液,加入流式管中,顺序加入5μL的Annexin VFITC和5μL的PI染色液同时轻摇混匀,室温避光15 min,流式细胞仪检测细胞凋亡率(发射波长530 nm、激发波长488 nm)。实验重复3次。
1.6 流式细胞术测细胞周期
6孔板培养转染前后的A549/DDP细胞,使各孔密度约为2×105/孔。每孔用10μg/mL的2 mL培养液培养48 h后,用无EDTA的胰蛋白酶消化细胞,收集细胞于流式管中,用3 mL PBS重悬细胞,1 500 r/min离心10 min后,弃上清液,逐滴加入预冷的75%乙醇5 mL,混匀细胞,4℃避光过夜且超过18 h。低温离心机1 500 r/min离心10 min,用1×PBS清洗细胞两次,弃上清液,每管加入500μL PI/RNase染色液,过200目筛网后再加入标记好的流式管中,4℃避光保存,采用流式细胞仪检测细胞周期。实验重复3次。
1.7 统计学处理
应用SPSS 22.0统计学软件分析结果,实验数据以均数±标准差(±s)表示,多组比较行单因素方差分析,两组均数比较行SNK-q检验,实验组与对照组均数比较行Dunnett-t检验,P<0.05为差异有统计学意义。采用Bliss法计算肺癌细胞增殖的半数抑制浓度(50 percent inhibitory concentration,IC50)。
2 结果
2.1 A549和 A549/DDP细胞经顺铂处理后的RAD18、REV1蛋白表达水平
经不同浓度顺铂处理24 h后,A549细胞的RAD18蛋白和REV1蛋白表达水平随着顺铂浓度的升高而下降;而A549/DDP细胞的RAD18、REV1蛋白表达随着顺铂浓度升高而升高;在顺铂浓度为0时,A549/DDP细胞组 RAD18蛋白表达水平与A549细胞组无明显差异(t=1.739,P=0.097),在其他的顺铂浓度点耐药细胞中这两个蛋白的表达量均明显高于 A549细胞(均 P<0.05)。A549/DDP细胞中RAD18和REV1蛋白的表达上调表明FA通路和TLS通路功能增强,提示与该细胞株对顺铂耐药有关。见图1和图2。
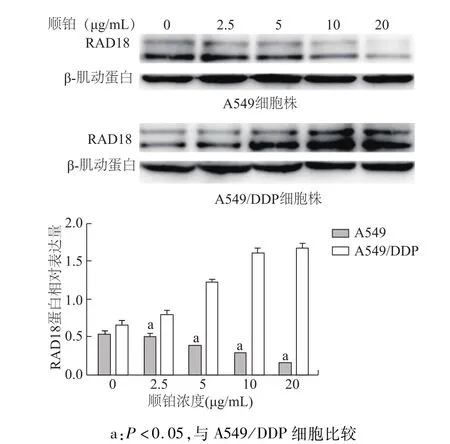
图1 A549和A549/DDP细胞经不同浓度顺铂处理后RAD18蛋白的表达水平
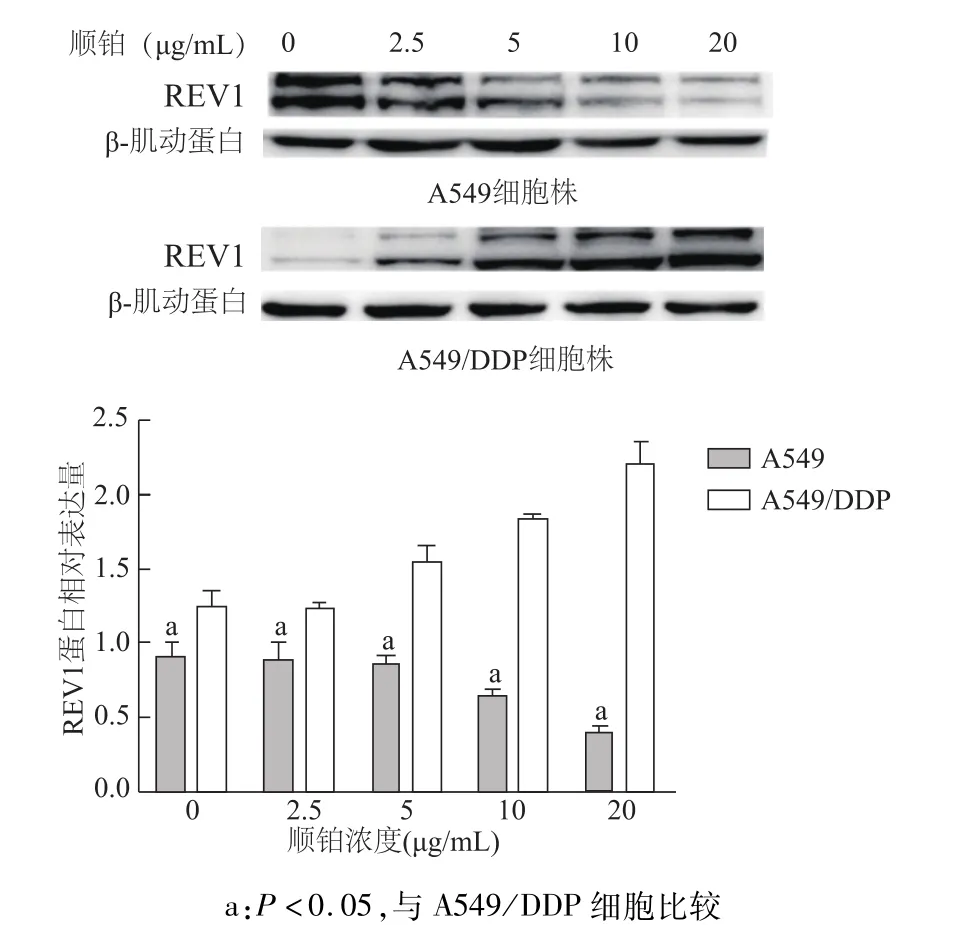
图2 A549和A549/DDP细胞经不同浓度顺铂处理后REV1蛋白的表达
2.2 转染 siRNA前后 A549/DDP细胞 REV1和RAD18蛋白的表达
A549/DDP细胞分别转染 REV1-siRNA和RAD18-siRNA后,REV1蛋白和RAD18蛋白表达水平均比阴性对照组和空白对照组明显降低(均P<0.05);阴性对照组与空白对照组组间差异均无统计学意义(P>0.05)。见图3和图4。表明REV1-siRNA和RAD18-siRNA转染有效。
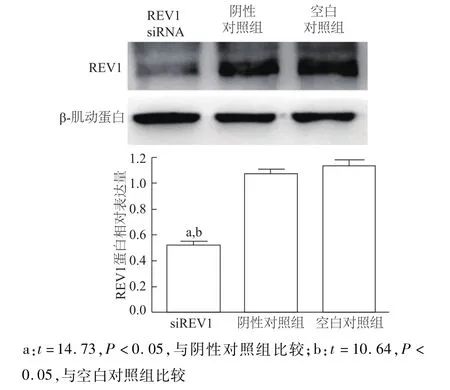
图3 A549/DDP细胞转染REV1-siRNA后REV1蛋白相对表达水平
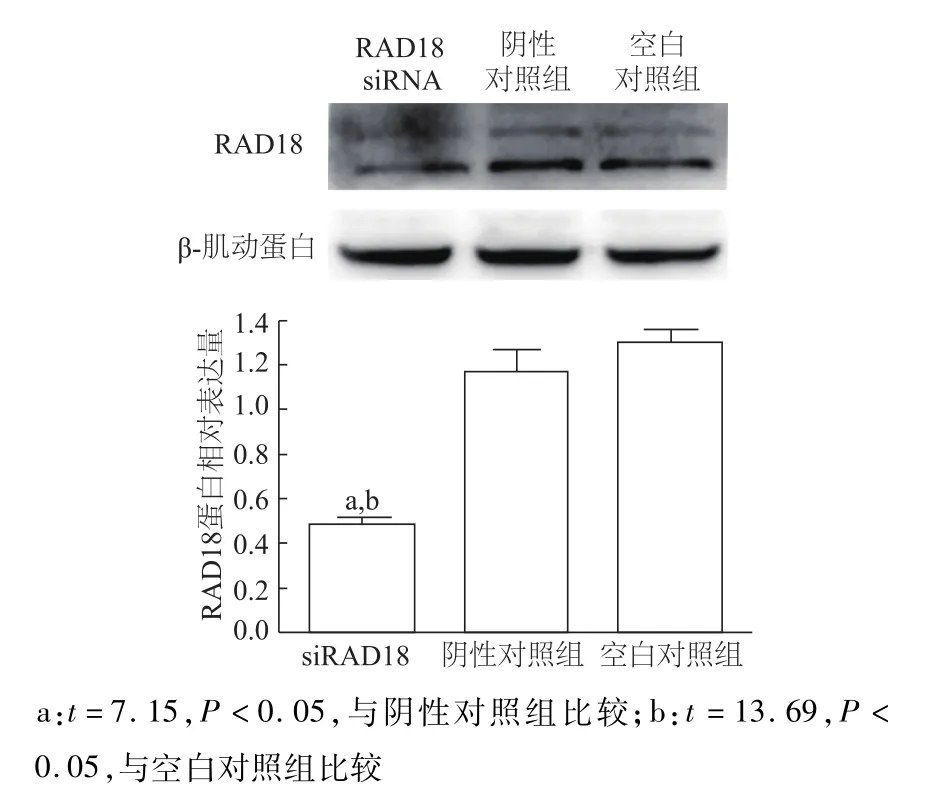
图4 A549/DDP细胞转染RAD18-siRNA后RAD18蛋白相对表达水平
2.3 A549/DDP细胞转染 RAD18-siRNA前后FANCD2单泛素化水平
蛋白质印迹结果显示,转染RAD18-siRNA后,经不同浓度顺铂处理24 h后的 A549/DDP细胞FANCD2蛋白单泛素化水平较转染前明显降低(均P<0.05)(图5),表明沉默 RAD18基因后抑制了FANCD2的单泛素化,RAD18位于FA通路的上游,是调控FA通路重要因子。
2.4 A549/DDP细胞转染 RAD18-siRNA前后 PCNA单泛素化水平
转染RAD18-siRNA后,经不同浓度顺铂处理24 h后A549/DDP细胞的PCNA单泛素化水平明显降低(均 P<0.05,图6),表明 RAD18是参与 PCNA单泛素化调控的重要组分。RAD18和RAD6形成的RAD6/RAD18复合物可通过诱导PCNA单泛素化继而激活TLS通路。沉默RAD18基因可使TLS通路的PCNA单泛素化水平明显降低,表明RAD18不仅参与了FA通路的激活,也是TLS通路的调控因子。
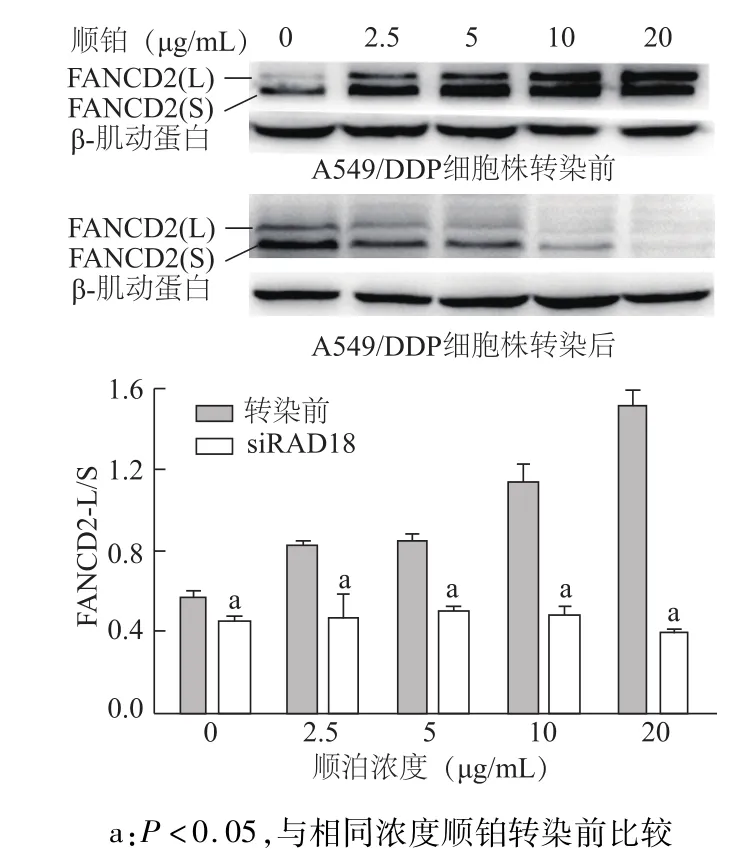
图5 A549/DDP细胞转染RAD18-siRNA后FANCD2单泛素化水平
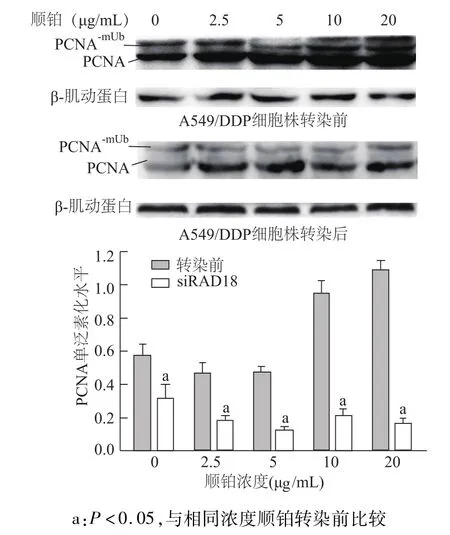
图6 A549/DDP细胞转染RAD18-siRNA后PCNA单泛素化水平
2.5 分别及共转染RAD18-siRNA和REV1-siRNA对A549/DDP细胞顺铂敏感性的影响
2.5.1顺铂对转染不同siRNAs的 A549/DDP细胞增殖的抑制作用 A549/DDP细胞分别和共转染RAD18-siRNA和REV1-siRNA,经顺铂处理24 h和48 h后的IC50较未转染细胞均明显降低 (均P<0.05),共转染细胞的 IC50较单转染 RAD18-siRNA或REV1-siRNA细胞进一步下降(均P<0.05)。见表1。图7和图8显示,随着顺铂浓度的增高,单转染组与共转染组的细胞增殖率逐渐降低,且呈剂量依赖性,共转染组的细胞增殖率下降较单转染组更为明显(均P<0.05),而两个单转染组之间的细胞增殖率无明显差异(P>0.05)。随着顺铂作用时间的增加,细胞增殖率继续降低,呈现出时间依赖性。这些结果表明沉默RAD18和REV1基因可明显增加顺铂耐药肺癌细胞对顺铂的敏感性,这两个基因共沉默则可进一步增强顺铂对A549/DDP细胞的细胞毒性。

表1 转染不同siRNAs后A549/DDP细胞对顺铂的IC50 μg/mL
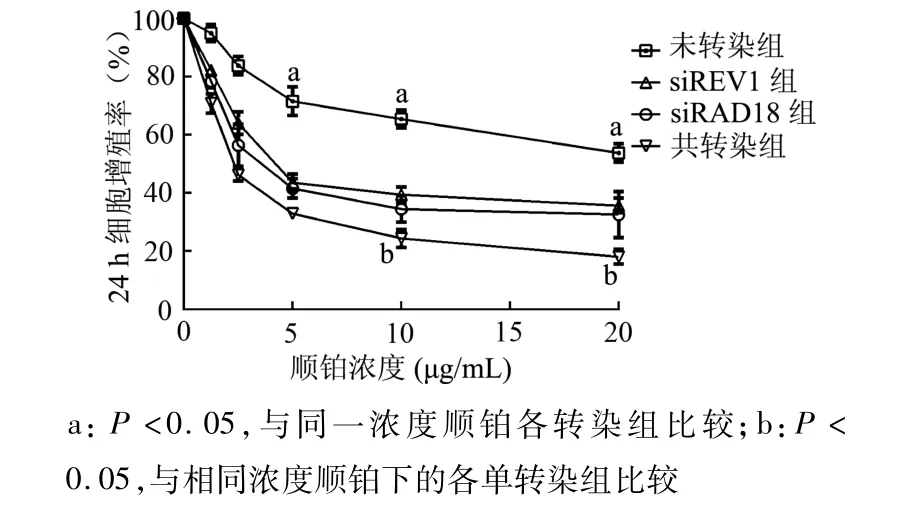
图7 A549/DDP细胞转染不同siRNAs后经顺铂处理24 h的增殖率
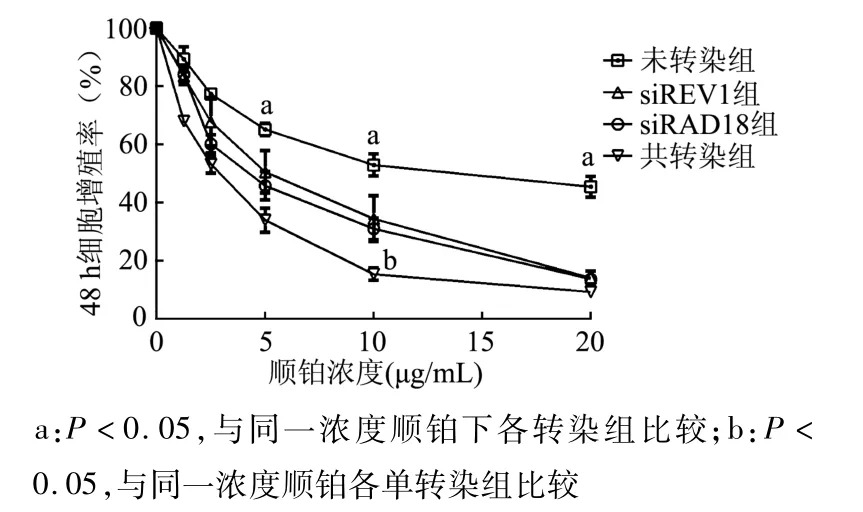
图8 A549/DDP细胞转染不同siRNAs后经顺铂处理48 h的增殖率
2.5.2转染不同siRNAs后 A549/DDP细胞经顺铂诱导的凋亡率 流式细胞术检测结果表明,A549/DDP细胞分别转染RAD18-siRNA和REV1-siRNA以及两者共转染后,早期凋亡率分别为(24.60±2.11)%、(23.33±3.13)%和(40.55±1.01)%,均明显高于未转染细胞组的早期凋亡率 (12.62±1.75)% (均 P<0.05)。两个单转染组之间的细胞早期凋亡率无明显差异(t=0.583,P>0.05),但共转染组细胞的早期凋亡率明显高于两个单转染组(均 P<0.05)。见图9。

图9 A549/DDP细胞转染不同siRNAs后经10μg/m L顺铂处理48 h的凋亡率
2.5.3A549/DDP细胞转染不同 siRNAs后顺铂诱导的细胞周期变化 分别和共转染RAD18-siRNA以及 REV1-siRNA后,A549/DDP细胞经10μg/mL顺铂处理48 h,应用流式细胞仪检测细胞周期,结果发现3个转染组G2期细胞数比例较未转染组明显增加(均P<0.05),且共转染组比单转染组增加更为明显(均P<0.05)。表明转染RAD18-siRNA和(或)REV1-siRNA后,A549/DDP细胞主要阻滞于G2期。见图10。
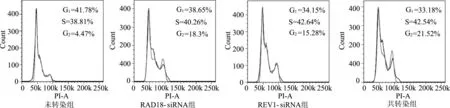
图10 各组A549/DDP细胞经10μg/m L顺铂处理48 h的细胞周期
3 讨论
顺铂主要是通过抑制DNA的复制杀伤肿瘤细胞,顺铂引起的DNA损伤类型包括链间交联、DSBs、单链断裂和染色体重排[12]。相关研究表明肿瘤细胞的DNA损伤修复能力是顺铂耐药的主要原因之一,而顺铂耐药是一个涉及多个DNA损伤修复通路的复杂过程[13]。因此,探明肿瘤细胞为了应对这些DNA损伤而具备的多种DNA修复机制是解决顺铂耐药的前提。
肿瘤细胞通过DNA损伤反应机制不断检查染色体DNA是否存在受损或被阻滞的DNA复制叉。当细胞发生DNA交联损伤时,可激活经典的FA通路产生修复反应,首先该通路的8个上游FA蛋白以及FA相关蛋白被活化形成FA核心复合物,然后单泛素化FANCD2和FANCI,再形成复合物ID,定位于受损的DNA,继而募集并激活FA通路的下游蛋白到DNA损伤部位,经过与其他DNA修复通路蛋白的相互作用,修复损伤DNA[14]。有文献报告,当细胞DNA交联损伤发生时,除了FA核心复合物可以引起FANCD2的单泛素化,RAD18和RAD6形成的复合物也参与触发FA通路的这一关键步骤[15]。FANCD2单泛素化是FA通路激活过程的中心环节,也是FA通路被激活的标志。FANCD2单泛素化水平反映了FA通路的激活状态。研究显示应用siRNA干扰技术直接下调FANCD2或者下调FA通路上游的蛋白表达,可以抑制FANCD2单泛素化,通过阻滞FA通路激活,抑制化疗药物诱导DNA损伤的修复,从而增加肿瘤细胞对化疗药物的敏感性[16-18]。本研究应用 siRNA转染技术敲减RAD18基因导致FANCD2的单泛素化水平明显下降,并显示出顺铂对耐药肺癌细胞A549/DDP的细胞毒性明显增强,顺铂诱导的细胞凋亡率明显增加,以及细胞周期S/G2阻滞效应增强,证明RAD18作用于FA通路上游,直接参与调控和诱导FANCD2的单泛素化以及FA通路的激活,参与了DNA交联损伤的修复。
DNA修复通路模型表明,致DNA损伤因子作用于细胞后导致DNA复制叉停滞、双螺旋解开并产生异常的单链DNA。这些DNA单链未复制的区域被异常的单链DNA结合蛋白即复制蛋白A包被,继而招募RAD18到DNA损伤位点,启动TLS通路等参与的复制后修复[3]。RAD6与 RAD18结合后形成的RAD6/RAD18主要通过诱导PCNA单泛素化而激活TLS,促使特异性DNA聚合酶在DNA损伤部位募集,触发 TLS通路的 DNA修复反应[19]。作为TLS聚合酶Y家族重要成员的REV1具有特殊的BRCT结构域,能与PCNA结合并发生相互作用[20]。亦有研究发现,FA核心复合物对REV1的募集也有调控效应,提示FA通路和TLS通路之间有着密切的相互作用[21]。本实验沉默RAD18基因后显示PCNA蛋白的单泛素化水平明显下调,表明RAD18在TLS通路被激活的PCNA单泛素化过程中发挥了不可或缺的作用。
本次实验证实,顺铂对A549/DDP细胞的毒性作用明显低于A549细胞,而顺铂诱导的A549/DDP细胞REV1和RAD18蛋白表达水平明显高于A549细胞,顺铂可诱导 A549/DDP细胞的 FANCD2和PCNA单泛素化水平呈剂量依赖性升高,提示FA通路与TLS通路均参与了A549/DDP细胞内顺铂诱导DNA交联损伤的修复,或者说参与了A549/DDP细胞对顺铂的耐药。应用siRNA转染敲减RAD18基因下调其蛋白表达后可明显抑制FANCD2和PCNA单泛素化水平,与此同时能显著增强顺铂对A549/DDP的细胞毒性,表明RAD18在FA和TLS两个通路参与的顺铂所致DNA损伤修复过程中发挥了作用[22]。此外,本研究中细胞增殖率和细胞凋亡实验结果显示,敲减REV1基因亦能明显增加顺铂对A549/DDP细胞的杀伤效应,证实REV1在TLS通路参与的顺铂诱导的DNA交联损伤修复中具有重要作用。值得注意的是,RAD18和REV1基因共沉默后增加顺铂对A549/DDP细胞毒性的作用强于分别单独沉默RAD18和REV1基因,提示虽然RAD18在FA和TLS两个通路中参与DNA修复过程,与REV1共同作用在TLS通路,但RAD18和REV1的DNA修复功能并不完全重叠在一个相同的DNA修复通路中。此外,RAD18或REV1亦可能通过FA和TLS通路之外的其他途径或机制,参与DAN交联损伤的修复,导致共沉默A549/DDP细胞的这两个基因对顺铂的致敏效应强于单基因沉默。RAD18和REV1在DNA交联损伤修复过程中可能存在的不同作用机制需要进一步深入研究。
综上所述,本研究显示,FA通路和TLS通路在顺铂所致肺癌细胞DNA交联损伤的修复中发挥了重要作用,这两个通路功能上调是肺癌细胞对顺铂耐药的主要机制之一。分别抑制这两个通路中的RAD18和REV1蛋白均可增加顺铂对 A549/DDP细胞的细胞毒性,而共抑制RAD18和REV1可进一步增强顺铂对A549/DDP细胞的杀伤效应,显示出对顺铂耐药的逆转效应。我们的研究结果为今后应用分子生物学技术或小分子抑制剂抑制RAD18和REV1,逆转肺癌细胞对顺铂的耐药性,提高肺癌化疗效果提供了实验依据。
[参考文献]
[1]Ferlay J,Soerjomataram I,Dikshit R,etal.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int JCancer,2015,136(5):E359.
[2]Jain A,Jahagirdar D,Nilendu P,et al.Molecular approaches to potentiate cisplatin responsiveness in carcinoma therapeutics[J].Exp Rev Anticancer Ther,2017,17(9):1-11.
[3]Haynes B,Saadat N,Myung B,et al.Crosstalk between translesion synthesis,Fanconi anemia network,and homologous recombination repair pathways in interstrand DNA crosslink repair and development of chemoresistance[J].Mutat Res Rev Mutat Res,2015,763:258-266.
[4]Jiang HG,Chen P,Su JY,et al.Knockdown of REV3 synergizeswith ATR inhibition to promote apoptosis induced by cisplatin in lung cancer cells[J].JCell Physiol,2017,232(12):3433-3443.
[5]D′Andrea AD,Grompe M.The Fanconi anaemia/BRCA pathway[J].Nat Rev Cancer,2003,3(1):23-34.
[6]Ceccaldi R,Sarangi P,D′Andrea AD.The Fanconi anaemia pathway:new players and new functions[J].Nat Rev Mol Cell Biol,2016,17(6):337-349.
[7]Lehmann AR.Translesion synthesis in mammalian cells[J].Exp Cell Res,2006,312(14):2673-2676.
[8]Plosky BS,Vidal AE,Fernández de Henestrosa AR,et al.Controlling the subcellular localization of DNA polymerases iota and eta via interactions with ubiquitin[J].EMBO J,2006,25(12):2847-2855.
[9]Sharma S,Helchowski CM,Canman CE.The roles of DNA polymeraseζand the Y family DNA polymerases in promoting or preventing genome instability[J].Mutat Res,2013(743/744):97-110.
[10]Kanao R,MasutaniC.Regulation of DNA damage tolerance in mammalian cells by post-translationalmodifications of PCNA[J].Mutat Res,2017(803/805):82-88.
[11]Masuda Y,Kanao R,Kaji K,et al.Different types of interaction between PCNA and PIP boxes contribute to distinct cellular functions of Y-family DNA polymerases[J].Nucleic Acids Res,2015,43(16):7898-7910.
[12]Aguilera A,Gómez-González B.Genome instability:a mechanistic view of its causes and consequences[J].Nat Rev Genet,2008,9(3):204-217.
[13]Galluzzi L,Senovilla L,Vitale I,et al.Mechanisms of cisplatin resistance[J].Oncogene,2012,31(15):1869-1883.
[14]Liu T,Ghosal G,Yuan J,et al.FAN1 acts with FANCI-FANCD2 to promote DNA interstrand cross-link repair[J].Science,2010,329(5992):693-696.
[15]Park HK,Wang H,Zhang J,et al.Convergence of Rad6/Rad18 and Fanconi anemia tumor suppressor pathways upon DNA damage[J].PLoS One,2010,5(10):e13313.
[16]陈玉娇,李坚,姜贺果,等.siRNA抑制FANCF基因增加肺癌细胞对顺铂的敏感性[J].江苏大学学报(医学版),2014,24(3):195-200.
[17]熊婷,陈小琼,魏恒,等.PJ34对多发性骨髓瘤 RPMI8226细胞体外生长及其对马法兰敏感性的影响[J].现代肿瘤医学,2014,22(3):489-493.
[18]陈康,李坚,李玫瑜.FAAP20和RAD51C基因敲减对肺癌细胞顺铂敏感性的影响[J].江苏大学学报(医学版),2016,26(1):5-10.
[19]Yang W,Woodgate R.What a difference a decade makes:insights into translesion DNA synthesis[J].Proc Natl Acad Sci U S A,2007,104(40):15591-15598.
[20]Lim K,Lee MK,Duong PT,et al.Biophysical characterization of the interaction between FAAP20-UBZ4 domain and Rev1-BRCT domain[J].FEBS Lett,2015,589(20 Pt B):3037-3043.
[21]Kim H,D′Andrea AD.Regulation of DNA cross-link repair by the Fanconi anemia/BRCA pathway[J].Gene Develop,2012,26(13):1393-1408.
[22]Chen P,Li J,Chen YC,et al.The functional status of DNA repair pathways determines the sensitization effect to cisplatin in non-small cell lung cancer cells[J].Cell Oncol,2016,39(6):1-12.

