地衣芽孢杆菌B-1和鞘氨醇单胞菌SC-1原生质体制备与再生条件的研究
陈切希, 简志青, 贾冬英, 迟原龙, 姚 开
(1.四川大学轻纺与食品学院,四川成都 610065; 2.元智大学生物工程与科技研究所,台湾桃园 32003)
近年来,随着人类对农产品的需求量不断增大,农药的使用量也呈不断上升趋势,然而长期使用造成了农畜产品和土壤中农药的残留量超标。β-氯氰菊酯是一种重要的拟除虫菊酯类农药,广泛施用可能导致环境中残留量超标,直接或间接对人类健康造成威胁[1-2]。微生物降解法具有安全、环保、无二次污染等特点被广泛应用于农产品以及土壤中农药的降解。目前,具有转化效率高的微生物已被应用于环境或农作物土壤中残留农药的降解[3],然而多数菌株只能将β-氯氰菊酯(β-CY)降解为3-苯氧基苯甲酸(3-PBA)[4]。原生质体融合技术是工业上微生物育种的一种重要手段,可以在种间、属间以及跨界融合[5]。原生质体制备和再生是其融合过程非常关键的环节,直接决定育种的效率[6]。笔者所在实验室前期从污染土壤中分离到地衣芽孢杆菌B-1和鞘氨醇单胞菌SC-1,前者可以将β-CY降解为3-PBA,后者可以将 3-PBA 继续降解[7]。吴双研究表明,制备的菌株B-1和菌株SC-1可湿性粉剂可以修复β-CY污染的土壤,有效降低小白菜中β-CY残留[8]。本研究探讨了地衣芽孢杆菌 B-1 和鞘氨醇单胞菌SC-1的原生质体制备和再生条件,以期为通过原生质体融合技术选育β-CY和3-PBA高效降解菌奠定基础。
1 材料与方法
1.1 材料与仪器
地衣芽孢杆菌B-1(BacilluslicheniformisB-1)为实验室前期从茶园土壤分离驯化并保存的菌种,适宜条件下对β-CY 降解率为94.12%。鞘氨醇单胞菌SC-1(Sphingomonassp. SC-1)为笔者所在实验室前期从农药厂排污渠下游土壤中分离并保存的菌种,可以矿化降解 3-PBA。
β-CY原药(含量96.8%,荣城化工公司),3-PBA标准品(纯度>98%,梯希爱化成工业有限公司),溶菌酶(100 000 U/mg,Sigma公司),酸水解酪蛋白、胰蛋白胨、酵母膏、琼脂(BD公司),蔗糖、葡萄糖、顺丁烯二酸、琥珀酸钠、甘露醇、青霉素、甘氨酸、BSA(Sigma公司),其他试剂均为国产分析纯。
LB培养基:胰蛋白胨10 g,酵母膏5.0 g,NaCl 10 g,去离子水1 000 mL,pH值7.0,吐温80 2.0 mL,121 ℃灭菌 20 min;LB琼脂培养基:LB培养基中加入琼脂18 g和定量β-CY 或3-PBA工作液,使其浓度为100 mg/L,121 ℃灭菌20 min;再生培养基DM3:参照文献[9]制备,用于菌株B-1原生质体的再生;再生培养基:胰蛋白胨10 g,酵母膏5.0 g,NaCl 10 g,蔗糖171 g,去离子水1 000 mL,pH值7.0,吐温80 2.0 mL,121 ℃灭菌20 min,用于菌株SC-1原生质体再生;原生质体稳定液(SMM):0.5 mol/L蔗糖,0.02 mol/L MgCl2,0.02 mol/L顺丁烯二酸,pH值6.5,121 ℃灭菌20 min;Tris-HCl缓冲液:Tris-HCl 0.01 mol/L,pH值8.0,121 ℃灭菌 20 min;EDTA溶液:EDTA 0.1 mol/L,用KOH溶液调pH值至 8.0,121 ℃灭菌20 min;溶菌酶液:用SMM溶液分别配制溶菌酶浓度为2.0 mg/mL和10 mg/mL溶液,0.22 μm膜过滤除菌,-20 ℃保存备用。
SP-830 PLUS可见光分光光度计(Metertech公司),UB-10 精密酸度计(Denver公司),Axiostar Plus光学显微镜(Zeiss公司),CF16RXII高速冷冻离心机(Hitachi公司)。
1.2 试验方法
1.2.1菌株B-1和菌株SC-1生长曲线绘制将菌株 B-1 和菌株SC-1分别划线接种于β-CY或3-PBA浓度为100 mg/L的LB琼脂斜面培养基上,30 ℃培养48 h,无菌生理盐水洗下菌苔,混匀,按5.0%体积比例接入β-CY或 3-PBA 浓度为100 mg/L的LB培养基,30 ℃振荡(180 r/min)培养24 h,每隔2 h取样,测其吸光度D600 nm,以培养时间对D600 nm作图。
1.2.2菌株B-1原生质体的制备和再生按5.0%的体积比例将菌株B-1接入β-CY浓度为100 mg/L的LB培养基中,30 ℃振荡(180 r/min)培养至对数生长期。SMM洗涤菌体2次,离心(4 ℃,8 000 r/min)10 min,SMM重悬并调其D600 nm为1.2,取少量适当稀释后涂布于LB平板,30 ℃培养 24~48 h,菌落数记为A;余下的菌悬液中加入不同浓度的溶菌酶液,37 ℃振荡(100 r/min)30 min,离心(4 ℃,4 000 r/min)10 min,沉淀重悬于SMM,涂布于LB琼脂培养基和再生培养基DM3,30 ℃培养24~48 h,菌落数分别记为B(未被除壁的菌体细胞)和C(再生菌体细胞),按下式计算菌株B-1原生质体的形成率和再生率[10]:
形成率=(A-B)/A×100%;
再生率=(C-B)/(A-B)×100%。
1.2.3菌株SC-1原生质体的制备和再生按5.0%的体积比例将菌株SC-1接种于3-PBA浓度为100 mg/L的LB培养基,30 ℃振荡(180 r/min)培养至对数生长期。Tris-HCl缓冲液洗涤菌体2次,离心(4 ℃,12 000 r/min)10 min,Tris-HCl缓冲液重悬并调D600 nm为1.4,加入EDTA溶液,使其终浓度为10 mmol/L,37 ℃振荡(100 r/min)20 min。SMM洗涤菌体2次,重悬于SMM,加入溶菌酶溶液,37 ℃振荡(100 r/min)15 min,离心(4 ℃,4 000 r/min)10 min,沉淀重悬于SMM[11,12]。SMM梯度稀释,涂布于再生培养基,30 ℃培养96~120 h。菌株SC-1原生质体的形成率和再生率计算方法同“1.3.2”节。
1.2.4影响菌株原生质体形成和再生的因素
1.2.4.1甘氨酸和青霉素对原生质体形成和再生的影响分别在菌株B-1和菌株SC-1生长延滞期加入甘氨酸(终浓度为1.0 mg/mL)或在生长对数期中期加入青霉素(终浓度为2.5 U/mL),测定并计算原生质体的形成率和再生率。
1.2.4.2溶菌酶浓度对原生质体形成和再生的影响当菌株B-1生长至对数末期时(13 h),分别用不同浓度的溶菌酶作用15 min;当菌株SC-1生长至对数末期(12 h)时,EDTA预处理,分别用不同浓度的溶菌酶作用20 min;测定并计算原生质体的形成率和再生率。
1.2.4.3溶菌酶作用时间对原生质体形成和再生的影响用溶菌酶分别对菌株 B-1 和菌株SC-1作用不同时间,测定原生质体的形成率和再生率。
1.2.4.4EDTA浓度对原生质体形成和再生的影响分别用不同浓度的EDTA溶液对菌株SC-1进行预处理,测定并计算原生质体形成率与再生率。
1.2.4.5稳定剂对原生质体形成和再生的影响考察相同浓度(0.5 mol/L)稳定剂(琥珀酸钠、蔗糖、氯化钠、甘露醇)的再生培养基分别对菌株B-1和菌株SC-1再生率的影响。
1.2.4.6原生质体制备和再生适宜条件的确定基于上述单因素试验结果,对原生质体制备和再生的适宜条件进行试验确认。
1.3 数据处理
所有试验平行重复3次,使用软件Origin 9.0和Excel 2017对试验数据进行分析处理。
2 结果与分析
2.1 菌株B-1和菌株SC-1的生长曲线
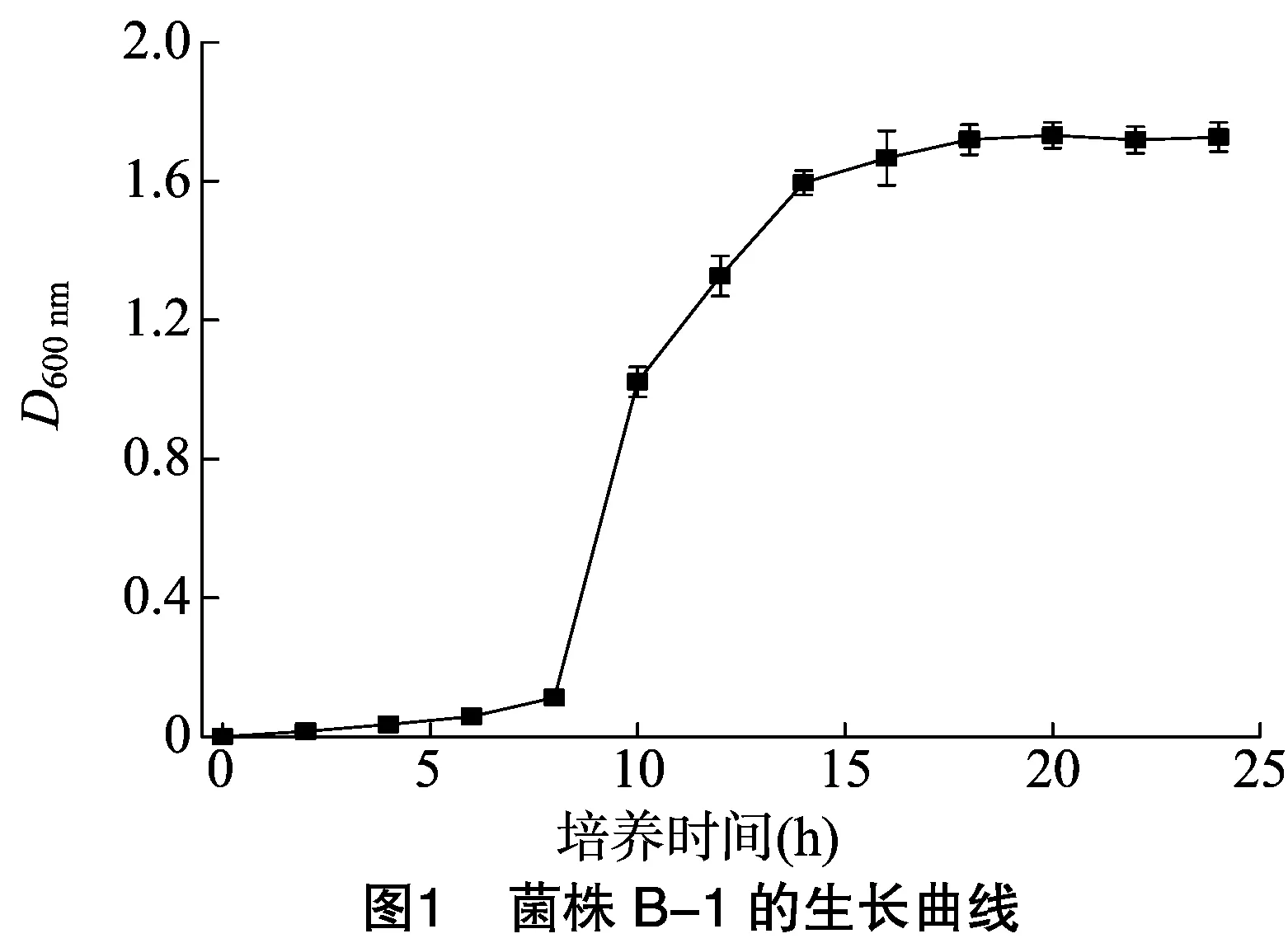
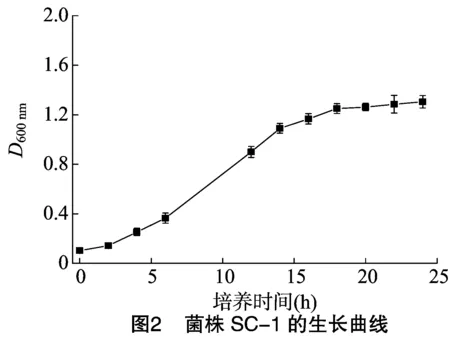
菌株B-1和菌株SC-1的生长曲线如图1和图2所示。可以看出,菌株B-1的延滞期为8 h,16 h后进入稳定期;菌株SC-1经过2 h的延滞期进入对数生长期,18 h后进入稳定期。对数期菌体的生理状态相对一致,代谢旺盛,对溶菌酶的敏感性强,有利于原生质体形成和再生,对数期末菌体数最多,方便收集[13],因此菌株B-1和菌株SC-1菌龄分别是13 h和12 h。
2.2 影响原生质体形成和再生的因素
2.2.1甘氨酸和青霉素对原生质体形成和再生的影响甘氨酸是细菌细胞壁的结构类似物,可能掺入细胞壁中,扰乱肽聚糖的相互交联,导致细胞壁结构的不完整,不利于细胞的生长[13]。青霉素可能与转肽酶结合,抑制其侧链末端的丙氨酸与五肽桥的连接,影响转肽作用与肽键的形成,所以增强菌体对溶菌酶的敏感性,有利于细胞原生质体的形成[14]。表1结果表明,2个菌株的培养过程中分别加入甘氨酸或青霉素的原生质体形成率虽然略有提高,但是原生质体的再生率显著降低。
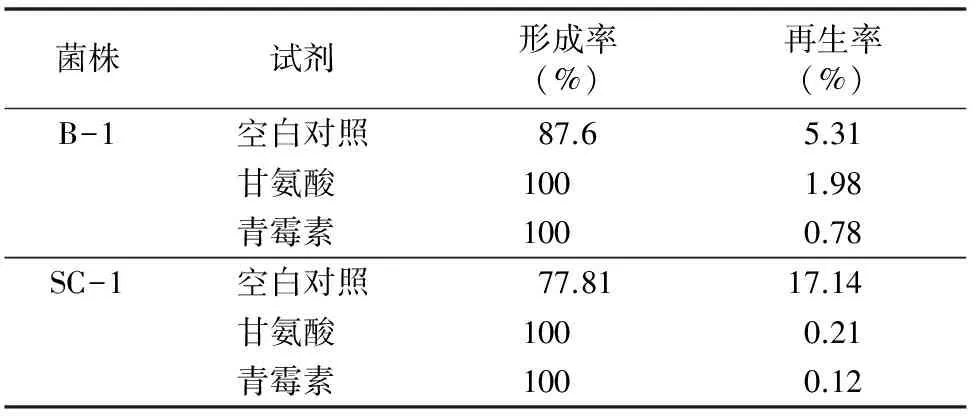
表1 甘氨酸和青霉素对菌株原生质体形成和再生的影响
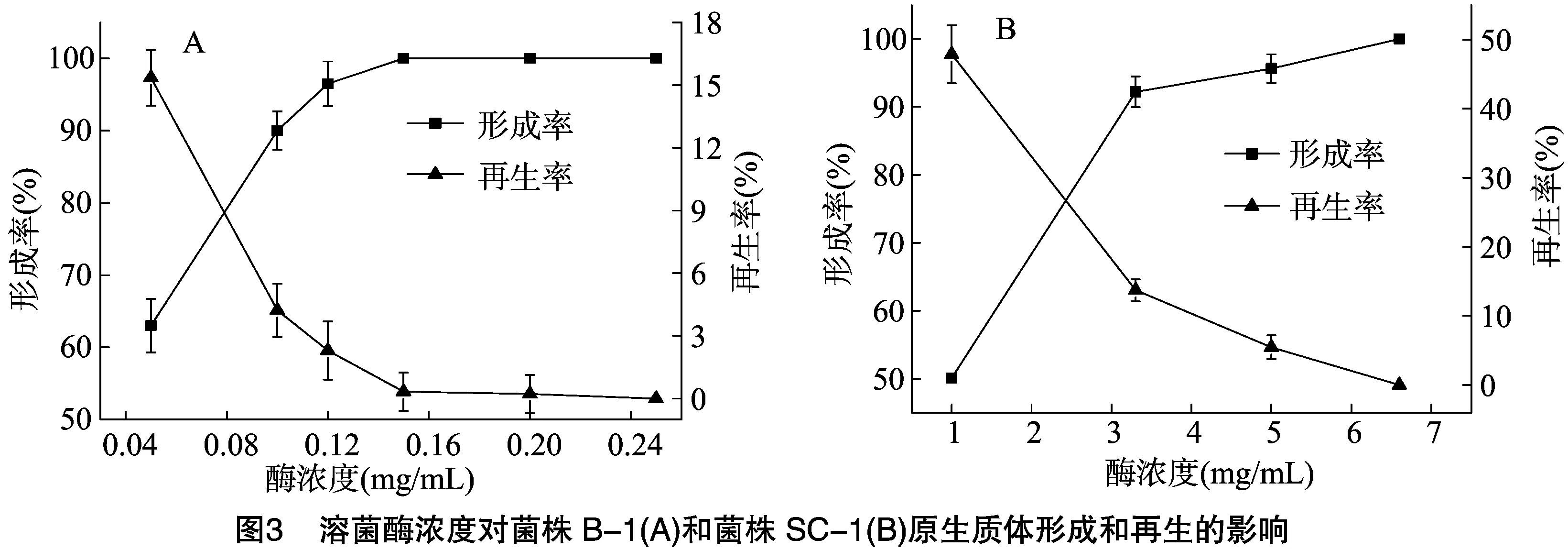
2.2.2溶菌酶浓度对原生质体形成和再生的影响由图3可以看出,2个菌株原生质体形成率均随溶菌酶浓度的增加而提高,而再生率呈下降趋势;当溶菌酶浓度为0.1 mg/mL 时,菌株B-1的原生质体形成率(90%)和再生率(4.61%)较高;当溶菌酶浓度为3.33 mg/mL时,菌株SC-1的形成率(90.2%)和再生率(13.73%)较高;当酶浓度继续增加,2个菌株的原生质体形成率提高不明显, 但原生质体再生率显著下降。因为溶菌酶酶解细胞壁的原因是它可以破坏细胞壁肽聚糖的β-1,4糖苷键,浓度越高破坏效果越明显,易导致脱壁过度,使其失去再生细胞壁的引物[13-14],所以当其浓度过高时,再生率显著降低。
2.2.3溶菌酶作用时间对原生质体形成和再生的影响由图4可以看出,初始阶段菌株B-1和菌株SC-1原生质体形成率随作用时间的延长迅速提高,15 min后提高缓慢,而再生率随作用时间的延长而降低。溶菌酶作用时间短,原生质体表面的细胞壁碎片较多,可作为细胞壁再生的引物,但作用时间过长,菌体细胞壁碎片被全部酶解,而且原生质体容易受损,导致其再生困难[15]。
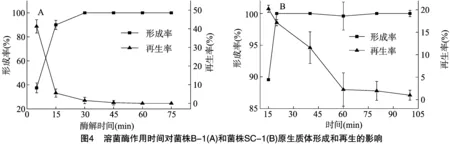
2.2.4EDTA浓度对原生质体形成和再生的影响由图5可以看出,随着EDTA浓度增加,菌株SC-1的原生质体形成率提高,而再生率呈现下降趋势。以原生质体形成率与再生率的乘积最大作为判断原生质体制备条件的依据[16],EDTA预处理的适宜浓度为5 mmol/L。EDTA对菌株SC-1进行预处理可明显提高原生质体的形成率,因为EDTA可以通过螯合作用破坏菌株SC-1细胞壁的外膜,有利于溶菌酶与肽聚糖的接触,提高原生质体的形成率,但是EDTA对原生质体具有毒害作用,随着作用时间延长,原生质体的再生率下降[11]。
2.2.5稳定剂对原生质体形成和再生的影响由表2可以看出,琥珀酸钠是菌株B-1原生质体再生的较理想稳定剂,其再生率(6.82%)最高;蔗糖是菌株SC-1原生质体再生的较理想稳定剂,再生率(26.54%)最高。稳定剂一方面可以调节渗透压维持原生质体的稳定有利于再生,另一方面原生质体可能会利用稳定剂代谢产酸,导致再生培养基的pH值下降,不利于原生质体的再生,选择合适的稳定剂对原生质体的再生至关重要。
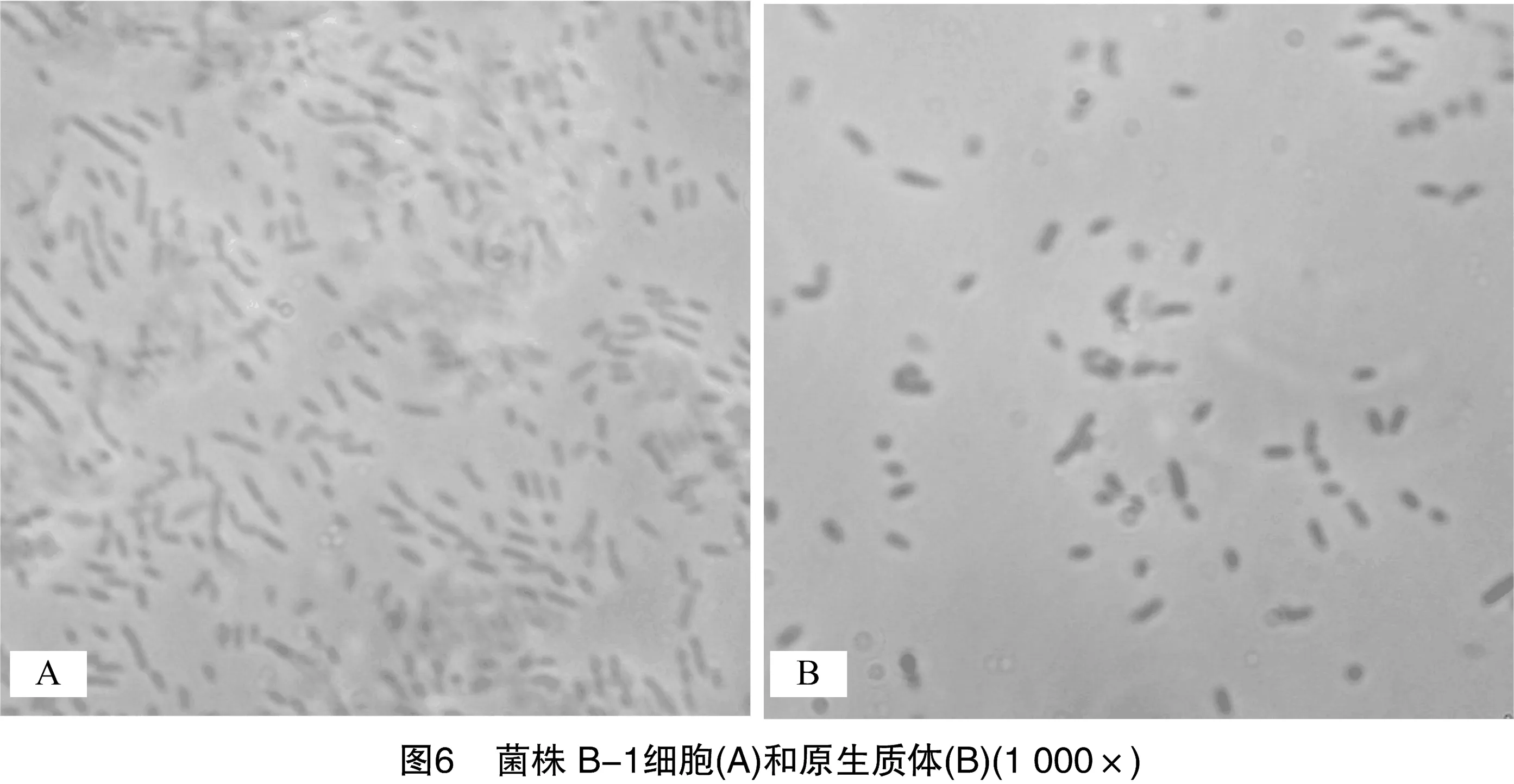
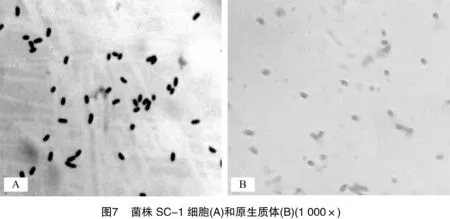
2.2.6原生质体制备适宜条件的验证基于单因素试验结果,确定菌株B-1原生质体制备的适宜条件为:菌龄13 h,溶菌酶浓度0.1 mg/mL,溶菌酶作用时间15 min;菌株SC-1原生质体制备的适宜条件为:菌龄12 h,EDTA浓度 5 mmol/L,溶菌酶浓度3.33 mg/mL,溶菌酶作用时间15 min。验证试验结果显示,菌株B-1原生质体形成率为93.11%,再生率为7.22%;菌株SC-1原生质体形成率为95.37%,再生率为27.04%。2个菌株原生质体制备前后的显微镜图像如图6和图7所示。可以看出,长杆状的菌株B-1细胞和短杆状的菌株SC-1细胞多数转变为球形。
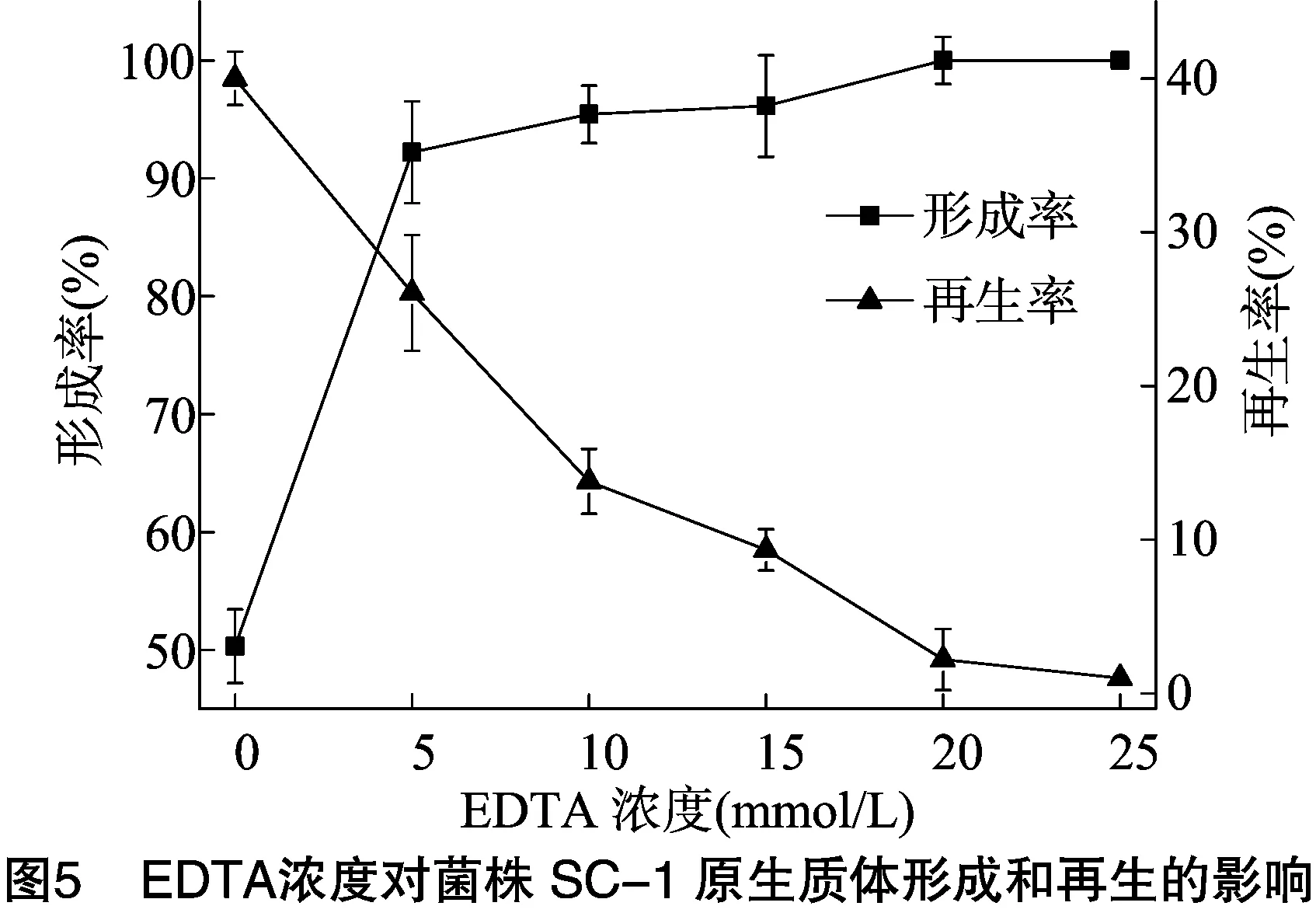
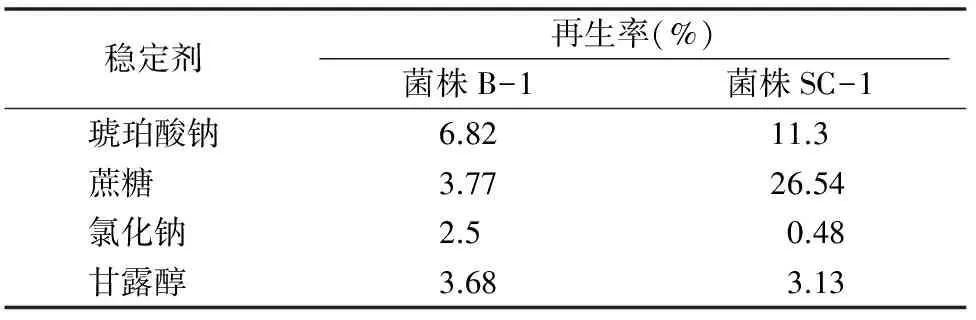
表2 稳定剂对菌株B-1和菌株SC-1原生质体再生的影响
3 结论
原生质体制备是原生质体融合的关键技术之一,要制备有活性且大量的原生质体,需要对不同菌株进行合适的处理。本研究对分离得到的地衣芽孢杆菌B-1和鞘氨醇单胞菌 SC-1 原生质体进行研究,发现菌龄、溶菌酶浓度及作用时间等因素对原生质体的形成和再生影响明显。本研究获得了具有活性的原生质体,适宜条件下菌株B-1和菌株SC-1的原生质体形成率和再生率均较高,为后续通过原生质体融合技术选育β-CY高效降解菌奠定了基础。
参考文献:
[1]McKinlay R,Plant J A,Bell J N B,et al. Endocrine disrupting pesticides:implications for risk assessment[J]. Environment International,2008,34(2):168-183.
[2]Poonam S,Sumaya F,Rambir S. Neurotoxic effect of cypermethrin and protective role of resveratrol in Wistar rats[J]. International Journal of Nutrition,Pharmacology,Neurological Diseases,2014,4(2):104-111.
[3]Singh B K. Organophorus-degrading bacteria:ecology and industrial applications[J]. Nature Review Microbiology,2009,7:156-163.
[4]McCoy M R,Yang Z,Fu X,et al. Monitoring of total type Ⅱ pyrethroid pesticides in citrus oils and water by converting to a common product 3-phenoxybenzoic acid[J]. Journal of Agricultural and Food Chemistry,2012,60(20):5065-5070.
[5]崔俊涛,张伟,曹天舒. 阿特拉津降解融合子的原生质体制备及其筛选[J]. 农业环境科学学报,2008,27(6):2269-2273.
[6]武朝霞. 嗜酸乳杆菌与地衣芽孢杆菌融合子制备及性能分析[D]. 太谷:山西农业大学,2013:1-69.
[7]Liu F,Chi Y,Wu S,et al. Simultaneous degradation of cypermethrin and its metabolite,3-phenoxybenzoic acid,by the cooperation ofBacilluslicheniformisB-1 andSphingomonassp. SC-1[J]. Journal of Agricultural and Food Chemistry,2014,62(33):8256-8262.
[8]吴双. 菌株协同降解β-氯氰菊酯特性及可湿性粉剂的研究[D]. 成都:四川大学,2014.
[9]Bianca W,Jens W,Susanne W,et al. Generation of readily transformableBacilluslicheniformismutants[J]. Appliction Microbiol Biotechnol,2008,78:181-188.
[10]袁铸,王忠彦,胡承等. 地衣芽孢杆菌JF-20原生质体的形成及其再生的最佳条件[J]. 四川大学学报 (自然科学版),2001,38(5):723-727.
[11]Dai M,Ziesman S,Ratcliffe T,et al. Visualization of protoplast fusion and quantitation of recombination in fused protoplasts of auxotrophic strains ofEscherichiacoli[J]. Metabolic Engineering,2005,7(1):45-52.
[12]周明明,李晓雁,陈悦,等. 鞘氨醇单胞菌TP-3原生质体制备与再生的研究[J]. 食品工业科技,2016,22:184-188.
[13]周东坡,平文祥. 微生物原生质体融合与基因重排[M]. 北京:中国科学技术出版社,2010:1-421.
[14]余波,吕向云,董风晴,等. 凝结芽孢杆菌原生质体的制备、再生及灭活[J]. 食品科技,2017,42 (4):2-7.
[15]李淼,曾柏全,冯金儒. 高产纤维素酶菌株原生质体制备及再生条件[J]. 中南林业科技大学学报,2013,33 (12):174-180.
[16]周飚. 基于基因组重排技术筛选角蛋白酶高产菌株及发酵动力学研究[D]. 成都:四川大学,2016.

