MLL启动子驱动SST基因转化甜菜的抗旱性分析
梁文洁, 张 丽, 郭新勇, 王爱英, 向本春, 祝建波
(石河子大学生命科学学院/石河子大学农业生物技术重点实验室,新疆石河子 832003)
甜菜是我国及世界的主要糖料作物之一,其产糖量占世界总产糖量的40%左右。近年来,我国甜菜生产的优势区域正在向盐碱、干旱和冷凉地区扩展,因此提高甜菜的抗逆性是保障甜菜生产可持续发展的重要基础[1]。
植物对干旱的敏感性之一,即表现在因水分缺失而导致渗透胁迫。植物在长期的进化过程中产生多种机制来适应这种逆境胁迫,如积累季胺类(甜菜碱)、氨基酸类(脯氨酸)、糖类(海藻糖、果聚糖、山梨糖醇)等[2-3]渗透调节物质。国内外很多研究证明,将微生物中编码高聚合度(degree of polymers,简称DP)果糖的果糖基转移酶基因(SacB基因)转入烟草(Nicotianatobacum)、番茄(LycopersiconesculentumL.)、甜菜(Betavulgaris)、小麦(TriticumaestivumL.)、美丽胡枝子[LespedezaFormosa(Vog.) Koehne.]后,植株的耐旱性和耐盐性[4-9]均得到明显的提高。此外,对菊苣(CichoriumintybusL.)[10]、多年生黑麦草(LoliumperenneL.)[11]和高羊茅(Festucaarundinacea)[12]等植物进行干旱处理可使其合成并积累更多的果聚糖。近年来,有关果糖基转移酶基因(1-SST基因、6-SFT基因)可提高植物的耐冻性研究[13-14]比较多,而由1-SST基因编码的蔗糖:蔗糖-1-果糖基转移酶合成的低聚合度(DP=3)果聚糖对植物抗旱性改良的相关报道较少。李慧娟等将1-SST基因转入模式植物烟草中,使烟草的抗旱性得到了明显的提高[15]。叶兴国等将1-SST基因转入小麦中发现,在水分胁迫处理前15 d内果聚糖积累量较低,水分胁迫21~28 d果聚糖开始积累,随着复水后干旱胁迫解除,果聚糖含量下降,低聚果糖的有效积累可提高小麦的抗旱能力[16]。
本研究将洋葱(Alliumcepa)的蔗糖-果糖基转移酶基因SST与甜菜根部特异性启动子MLL重组,以pBI121为起始载体,构建pBI121-MLL-SST,通过农杆菌介导法转化甜菜品种STFD4,利用聚合酶链式反应(polymerase chain reaction,简称PCR)和逆转录PCR(reverse transcription PCR,简称RT-PCR)技术检测目的基因是否整合到甜菜并进行表达。将获得的转基因甜菜和对照甜菜生根并移栽大田,并将转基因甜菜和野生型甜菜进行干旱胁迫处理,比较二者在形态、叶片相对含水量、丙二醛(malondialdehyde,简称MDA)含量、相对电导率和光系统Ⅱ(photosystemⅡ,简称PSⅡ)相对量子产率等方面的差异,以期为了解SST基因在甜菜根部特异性启动子MLL的驱动下是否具有抗旱性,为今后该基因的研究与应用提供理论基础和试验依据。
1 材料与方法
室内试验于2015年4月至2016年5月在石河子大学农业生物技术重点实验室内完成,田间试验于2016年5月至2016年11月在石河子大学试验场基地完成。
1.1 植物材料与菌株
甜菜(STFD4)的种子是由石河子甜菜研究所选育而成的二倍体甜菜授粉系。大肠杆菌TOP10、根癌农杆菌(Agrobacteriumtumefaciens)GV3101、pGM-T-SST(已克隆洋葱的蔗糖果糖基转移酶基因)、植物表达载体pBI121,均由石河子大学农业生物技术重点实验室构建与保存;TaqDNA聚合酶、植物基因组DNA提取试剂盒、M-MLV反转录试剂盒、内切酶HindⅢ和DraⅢ、T4DNA 连接酶、pGM-T vector及普通琼脂糖凝胶DNA回收试剂盒等均购自北京天根生化科技有限公司;引物合成、序列测定均由北京华大基因科技股份有限公司完成;其他试剂均为分析纯。
1.2 分子生物学试验材料
内切酶、连接酶、Taq酶均购于日本TaKaRa公司;pGEM-T vector试剂盒及PCR产物回收试剂盒均购于美国Promega公司。
1.3 基因组DNA的提取
用十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,简称CTAB)法提取甜菜根部的总DNA[17]。
1.4 引物设计
根据GenBank公布的甜菜组织特异性启动子基因序列(GenBank登录号为AX449164.1),结合软件Primer premier 5.0设计包含酶切位点的MLL引物:P1:5′-AAGCTTGTTTG TTAACTGAACTGAACTGTTAATT-3′,P2:5′-CCCGGGCTTT TGAAAATTTTGAAACGCTCAC-3′,酶切位点分别为HindⅢ和XmaⅠ。反应条件:94 ℃预变性4 min;94 ℃变性1 min,55 ℃ 退火45 s,72 ℃延伸1.5 min,30个循环;72 ℃继续延伸 10 min。SST 引物:P3:5′-CCCGGGCCATGGAATCCAGAG AGATCGAG-3′,P4:5′-GAGCTCTGAGCACCTAACCAAAC AACACA-3′,酶切位点为XmaⅠ和SacⅠ。反应条件:94 ℃预变性4 min,94 ℃ 变性1 min,55 ℃退火30 s,72 ℃延伸 1 min,30个循环;72 ℃继续延伸10 min。
1.5 PCR扩增产物回收、克隆及测序
根据Promega公司提供的WizardTM DNA Clean-up System回收试剂盒和pGEM-T Easy vector试剂盒中提供的说明书对PCR扩增产物进行回收与克隆。将扩增产物克隆到pGEM-T Easy vector中,阳性重组子命名为pGEM-MLL和pGEM-SST。由生工生物工程(上海)股份有限公司完成测序。
1.6 植物表达载体pBI121-MLL-SST构建
用HindⅢ和SacⅠ切下pBI121的35S-Gus,并回收大片段,用HindⅢ和XmaⅠ切下pGEM-MLL中的MLL基因并回收大片段,用XmaⅠ和SacⅠ切下pGEM-SST中的SST基因并回收,然后将大片段与MLL、SST相连,在T4-DNA连接酶的作用下,载体片段与基因片段相连接,即构建成植物表达载体pBI121-MLL-SST,得到重组质粒转化大肠杆菌DH5α[18];挑单克隆培养,对菌液进行PCR检测,提取阳性单克隆质粒进行酶切鉴定,将酶切鉴定为阳性的质粒采用冻融法转化根瘤农杆菌GV3101[18]。
1.7 甜菜的遗传转化
剪取在预培养基(MS+0.5 mg/L 6-BA)培养50~60 d的甜菜叶柄,在预培养基上培养4 d,通过农杆菌介导将pBI121-MLL-SST整合到甜菜基因组中,叶柄侵染后接种于铺有滤纸的共培养基(MS+100 mg/L AS)上暗培养 3 d,之后转接到延迟筛选培养基(MS+1.0 mg/L 6-BA+0.2 mg/L NAA+300 mg/L Cb)中培养4~5 d。然后,在选择培养基(MS+1.0 mg/L 6-BA+0.2 mg/L NAA+300 mg/L Cb+50 mg/L Kan)中进行培养,当出现抗性小苗时,将卡那霉素加至100 mg/L,每隔15 d左右进行继代培养1次。待丛生芽长至2~3 cm时,切取,分别放入生根培养基(1/2 MS+1.0 mg/L NAA+300 mg/L Cb+50 mg/L Kan)中诱导生根,待根系长至2~3 cm 时移栽至花盆。
1.8 转基因甜菜的分子检测
采用CTAB法[11]提取甜菜叶片基因组总DNA,以 pGEM-SST质粒为阳性对照,野生型甜菜的DNA为阴性对照,PCR检测目标基因。用TRNzol法[16]提取阳性植株的总RNA,以pGEM-SST质粒为阳性对照,相应的野生型甜菜为阴性对照,进行RT-PCR检测。
1.9 转pBI121-MLL-SST基因甜菜干旱胁迫试验
选取生长良好、大小一致的转pBI121-MLL-SST基因甜菜和未转化的对照植株各3株,充分浇水后进行干旱胁迫,此后不再供水,逐渐形成干旱环境,1个月后观察试验结果,在干旱胁迫后0、10、20、30 d对其叶片的相对含水量、丙二醛(malondialdehyde,简称MDA)含量、相对电导率、光系统Ⅱ光化学最大量子效率进行检测[19]。
叶片相对含水量的测定:选取同一部位、大小相近的叶片,用直径为1.2 cm的打孔器打孔,称取叶片鲜质量(m1)后,将其放入平皿中加入蒸馏水,平铺一层滤纸,使叶片完全浸于水中12 h,待叶片吸水至饱和。从水中将叶片取出,并用滤纸吸除表面水分后称其质量(m2)。最后将叶片放入80 ℃烘箱中,烘干后称质量(m3)。
叶片相对含水量=[(m1-m3)/(m2-m3)]×100%。
叶片丙二醛含量的测定:选取同一部位、大小相近的叶片,用直径为1.0 cm的打孔器打孔称叶片质量至0.1 g,加入 1.5 mL 的5%三氯乙酸(trichloroacetic acid,简称TCA),充分研磨后12 000 r/min离心10 min;取上清液,加入2 mL 0.067% 硫代巴比妥酸(thiobarbituric acid,简称TBA),充分摇匀后置于100 ℃条件下水浴30 min,分别测定波长为450、532、600 nm处的吸光度。
丙二醛含量(μmol/g)=6.45(D532 nm-D600 nm)-0.56D450 nm。
叶片相对电导率的测定:选取同一部位、大小相近的叶片用纱布拭净,用直径为1.0 cm的打孔器打孔,称叶片质量至 0.1 g,放入带有刻度的试管中,加蒸馏水至10 mL,浸没叶片,静置20 min后用电导仪测定电导率,数值为A;在100 ℃条件下水浴30 min后,放入水中静置20 min,用电导仪测定电导率,数值为B。
叶片相对电导率=A/B×100%。
叶片PSⅡ光化学最大量子效率的测定:选取同一部位、大小相近的野生型和转基因甜菜叶片,使用仪器DUAL-PAM-100对PSⅡ光化学最大量子效率进行测定。其中,有效荧光值为Fv;叶片最大荧光值为Fm;固定荧光值为Fo。
光化学最大量子效率=Fv/Fm=(Fm-Fo)/Fm。
1.10 数据分析
采用Excel 2007和SPSS软件统计分析数据。
2 结果与分析
2.1 PCR扩增及序列比对
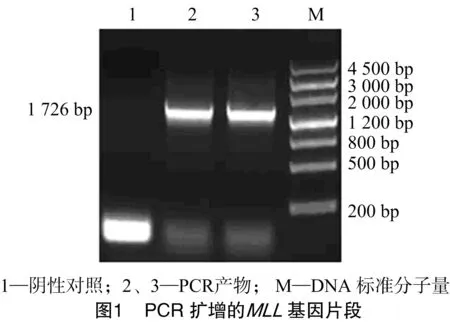
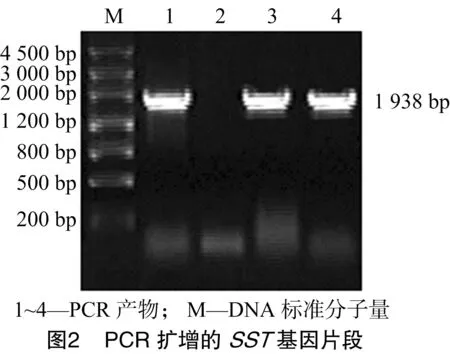
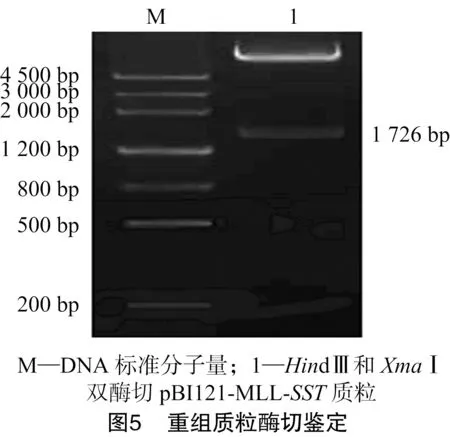
以甜菜基因组DNA为模板对MLL基因进行PCR扩增,产物经10 g/L的琼脂糖凝胶电泳得到大小为1 726 bp特异性扩增带(图1),与预期结果相符。将片段回收纯化后,插入到pGEM-T Easy载体上得到重组质粒pGEM-MLL,经测序后,与GenBank上已公布的甜菜根部特异性启动子序列进行比较,同源性达100%。以由本实验室保存的含有完整的SST基因的质粒为模板进行SST基因的PCR扩增,经电泳得到大小为1 938 bp特异性条带(图2),回收后连接到pGEM-T Easy载体上得到重组质粒pGEM-SST,经测序分析后,将该序列与GenBank上报道的IPT基因序列比较,同源性达100%。
2.2 植物表达载体的构建
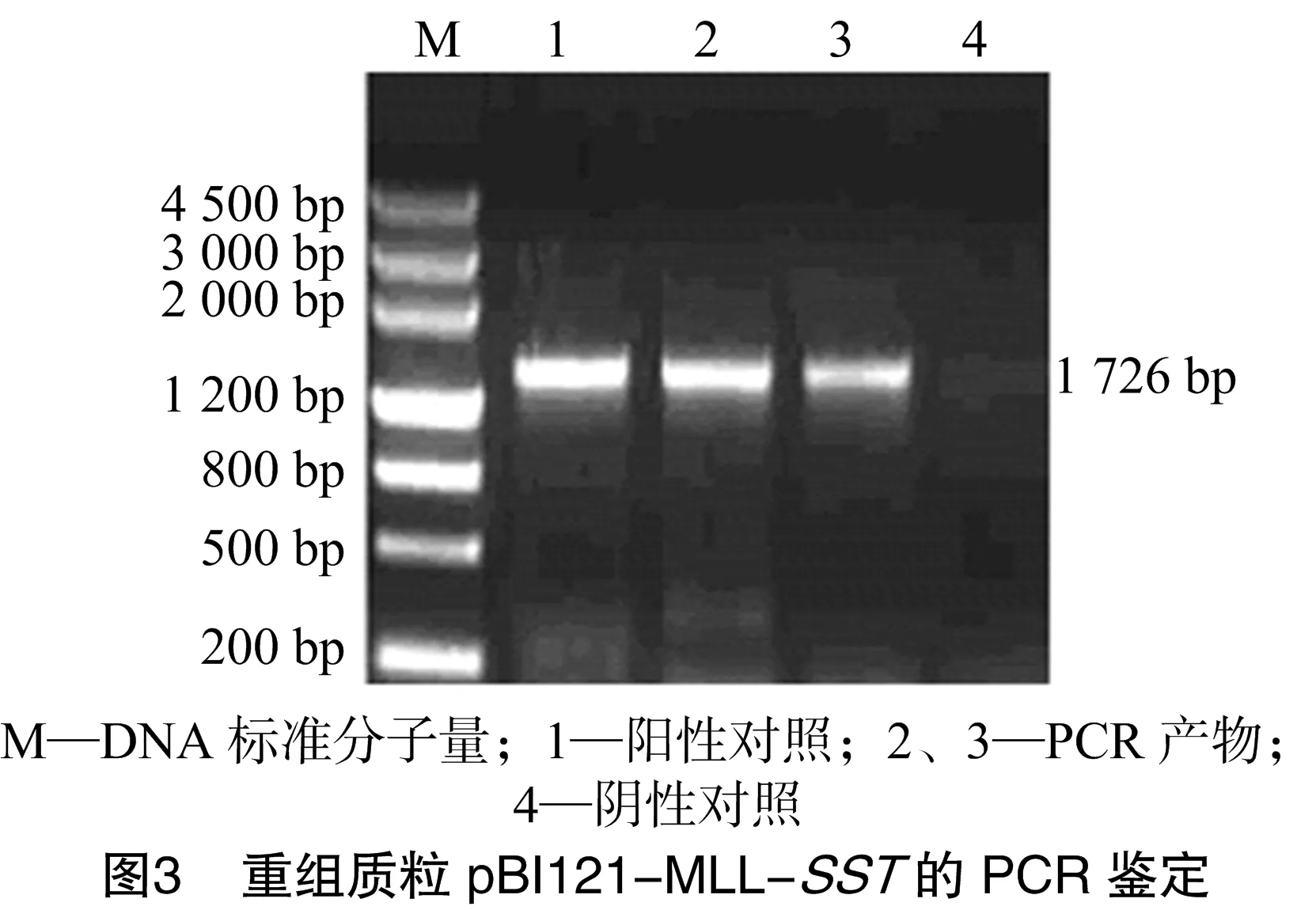
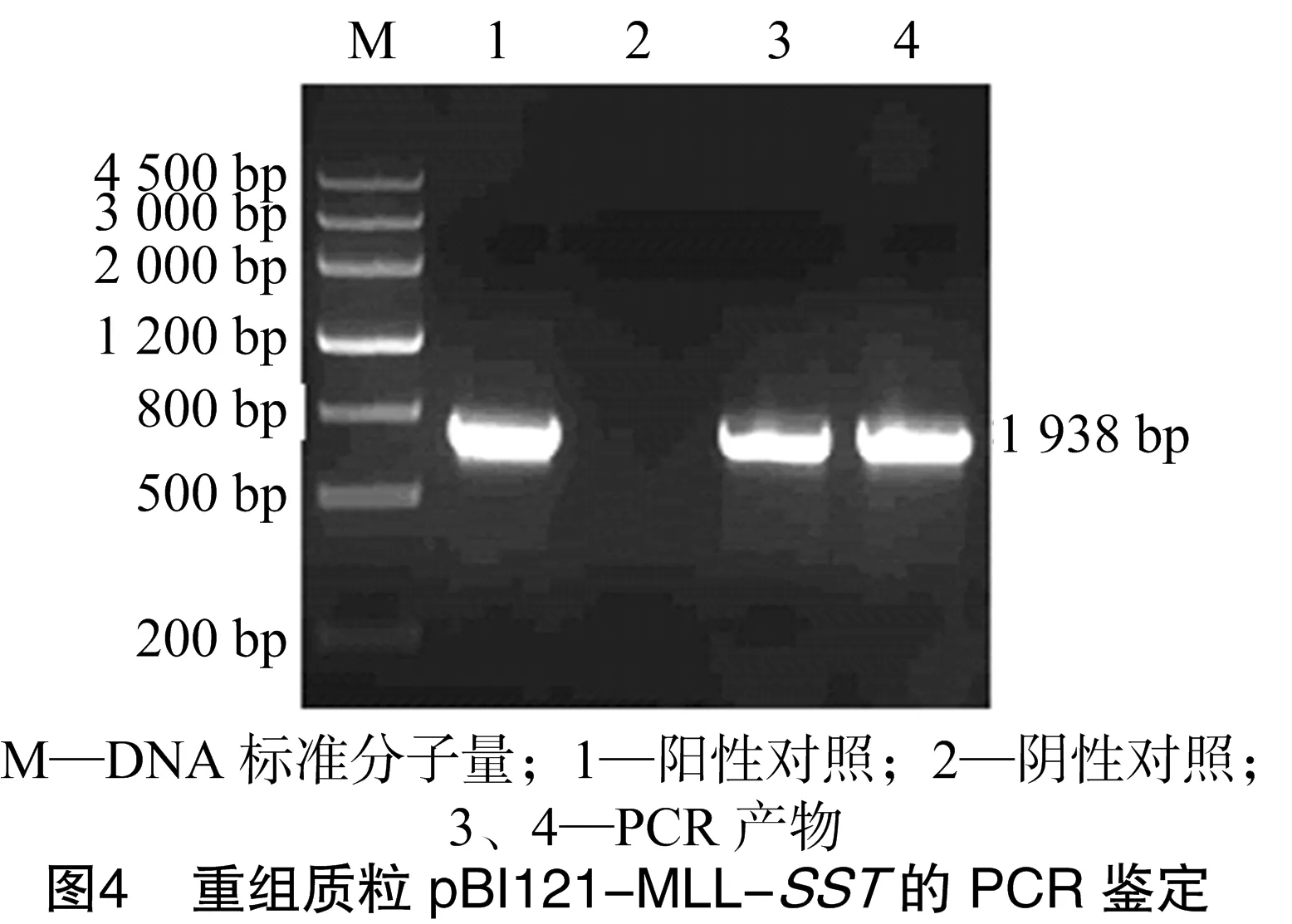
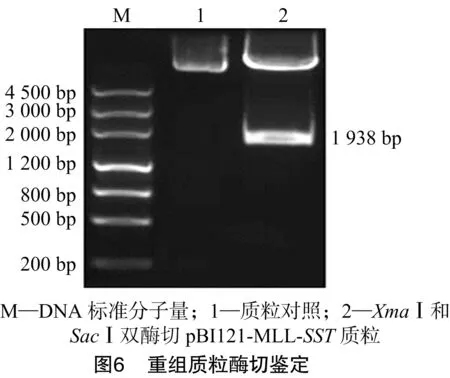
从测序正确的克隆中分别提取pGEM-MLL质粒和pGEM-SST质粒,用HindⅢ和XmaⅠ消化pGEM-MLL质粒产生了大小1 726 bp的小片段;用XmaⅠ和SacⅠ消化pGEM-SST质粒;用HindⅢ和SacⅠ消化pBI121质粒得到了不含35S-Gus的载体大片段。将酶切克隆载体获得的2个小片段和酶切表达载体pBI121获得的大片段用T4-DNA连接酶连接构建了pBI121-MLL-SST植物表达载体,转化大肠杆菌DH5α[18],挑单克隆培养,进行菌液PCR检测(图3、图4),提取阳性单克隆质粒进行酶切鉴定(图5、图6),将酶切鉴定为阳性的质粒采用冻融法转化根瘤农杆菌GV3101[18]。
2.3 转基因甜菜的获得与移栽
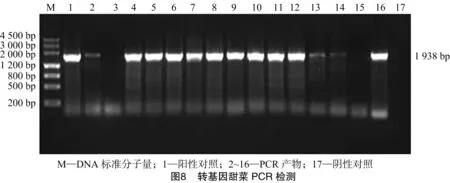
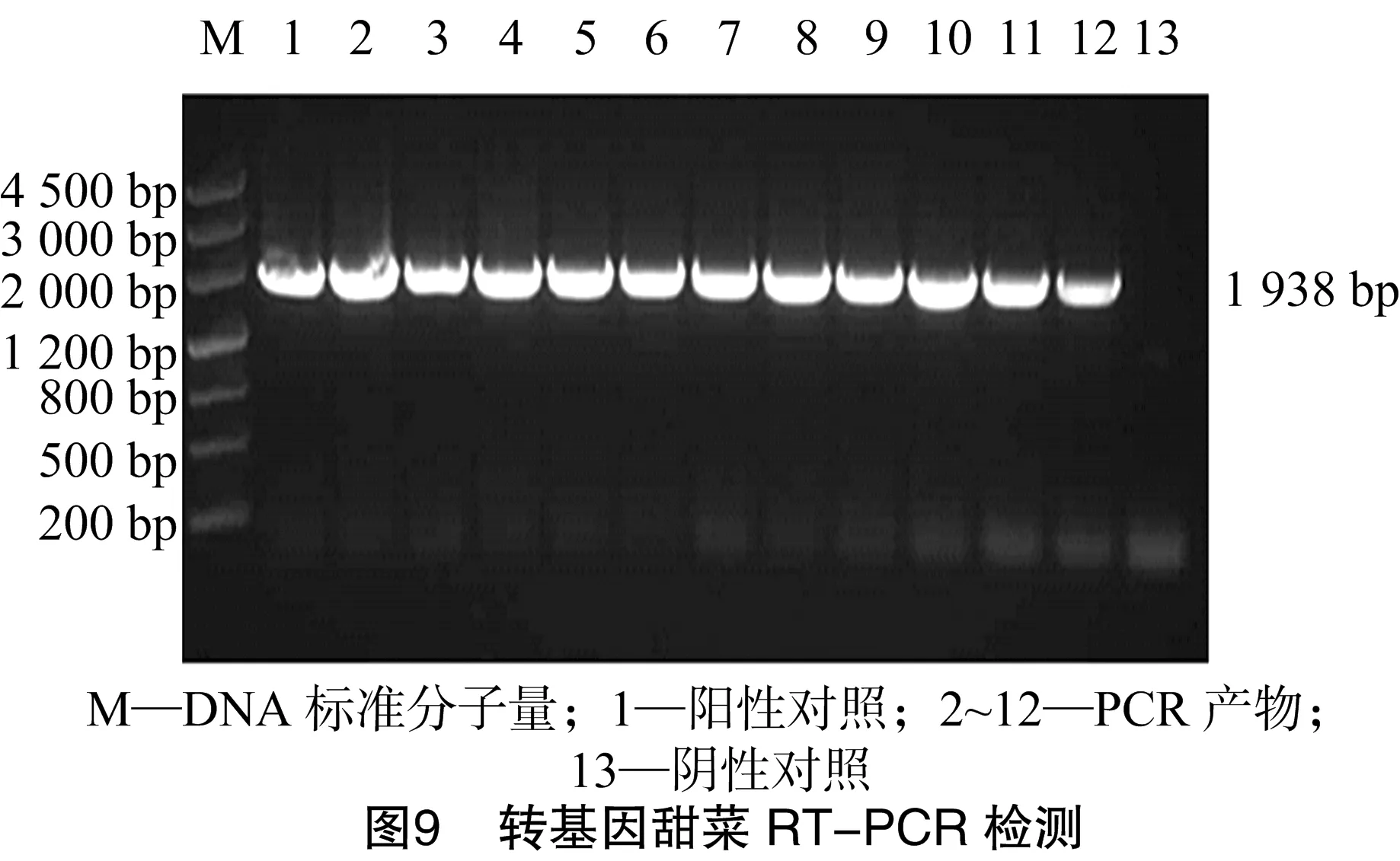
甜菜种子经过10% H2O2和0.1%氯化汞消毒后,接种于1/2 MS固体培养基上(图7-A),在(24±2) ℃条件下暗培养2~3 d后发现,种子消毒干净,没有污染,10 d左右开始发芽,取发芽的较健壮的甜菜苗,剪掉根部,转移至预培养基上培养50~60 d(图7-B)发现,甜菜无菌苗叶片嫩绿,长势良好。剪甜菜的叶柄1 cm左右做外植体进行预培养,培养4 d(图7-C),用农杆菌介导法对甜菜进行转化,在含卡那霉素的选择培养基上初步筛选具有抗性的转化植株(图7-D),待抗性苗长至2~3 cm时,分别转移放入2种生根培养基中诱导生根(图7-E),大约1个月的时间2种生根培养基的甜菜均生根,但形态不同,用吲哚丁酸(indole butyric acid,简称IBA)诱导的根(图7-F)比较长,比较细,而用萘乙酸(1-naphthylacetic acid,简称NAA)诱导的根(图7-E)比较粗,比较短。炼苗后,移栽到花盆中至成活(图7-G),移栽过程中发现,用NAA诱导的较粗、较短,根比较容易移栽成活。对移栽出来的甜菜进行PCR、RT-PCR[18]检测目的基因,检测结果(图8、图9)表明,获得能够正常转录的转基因甜菜植株。将RT-PCR检测为阳性的植株与对照甜菜在5月初共同移栽至大田(图7-H)。
2.4 干旱胁迫对转基因甜菜形态和生理指标的影响
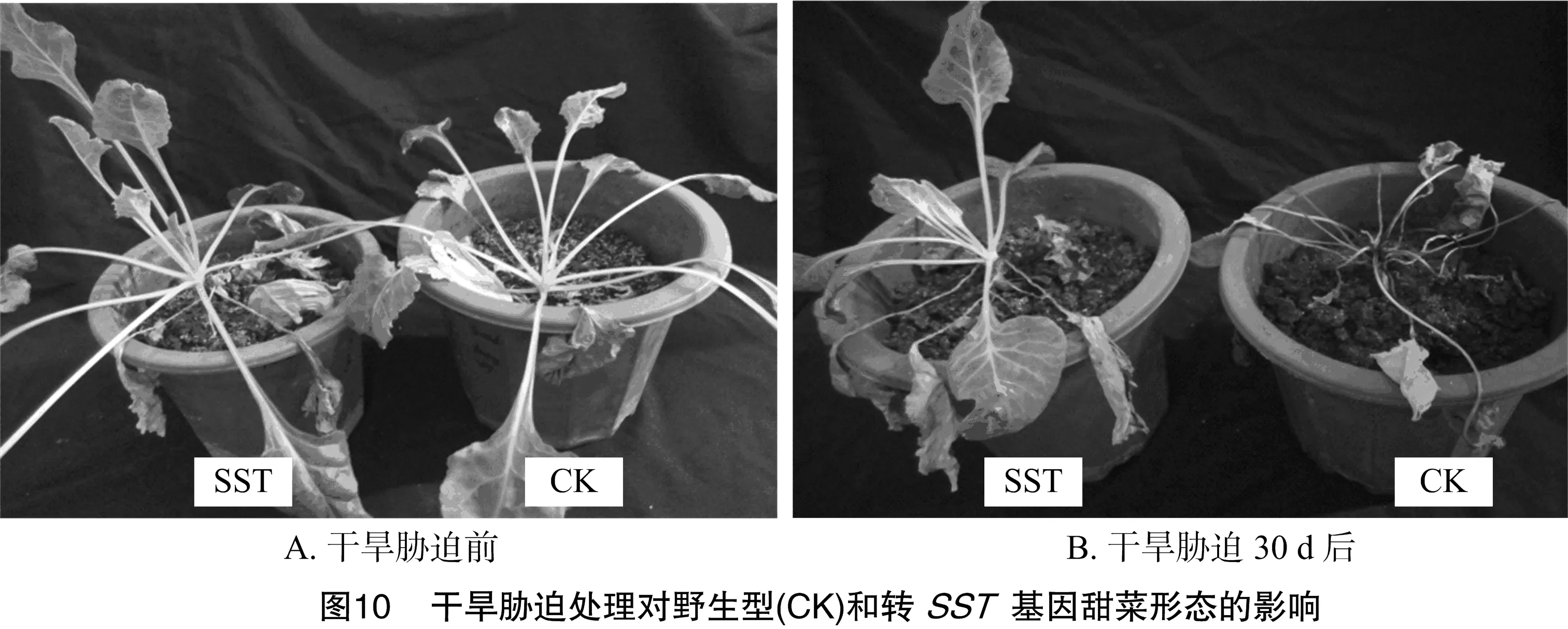
停止浇水后10 d,野生型植株基部开始萎蔫,叶片由下至上开始慢慢变黄;20 d,整株萎蔫;30 d,全部叶片干枯死亡。而转基因植株在停止浇水后15 d,基部开始萎蔫,20 d叶片由下至上开始慢慢变黄;30 d只有部分叶片干枯死亡(图10)。可见,在干旱胁迫试验中转pBI121-MLL-SST基因甜菜植株表现出更强的抗旱性。

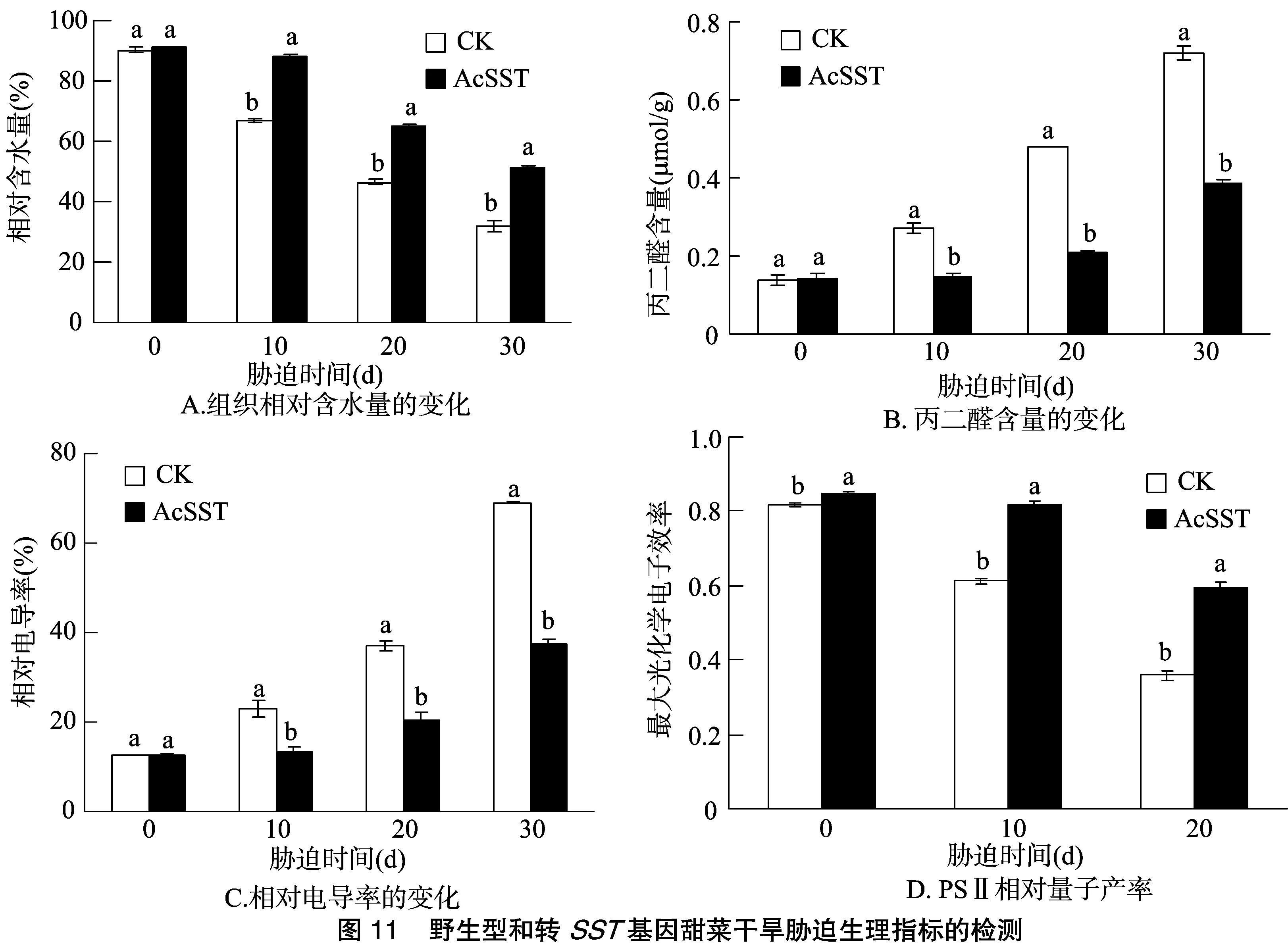
在水分胁迫试验中,随着胁迫时间的延长,野生型和转基因甜菜的叶片相对含水量均有所下降,但野生型甜菜的下降幅度和速度明显大于转基因甜菜(图11-A);野生型和转基因甜菜的叶片MDA含量均呈上升趋势,但野生型甜菜的上升幅度和速度明显大于转基因甜菜(图11-B);野生型和转基因甜菜细胞膜的受伤害率均随时间的延长而上升,但野生型甜菜伤害率的上升幅度和速度明显高于转基因甜菜(图11-C);野生型和转基因甜菜的Fv/Fm值均有所下降,但转基因甜菜的下降幅度显著低于野生型甜菜(图11-D),可见在水分胁迫条件下SST基因的过量表达减轻了甜菜叶片 PSⅡ 受到的逆境伤害。以上生理指标的变化进一步说明,在水分胁迫下转pBI121-MLL-SST基因甜菜的抗旱性优于野生型甜菜。
3 结论与讨论
本研究将参与果聚糖合成的蔗糖-果糖基转移酶基因即SST基因,与根部特异性表达启动子MLL组合,用农杆菌介导法遗传转化导入甜菜中,观察转基因甜菜的抗旱性。结果表明,在干旱胁迫下,未经遗传转化的甜菜植株膜脂可能发生了过氧化作用,加剧活性氧(reactive oxygen species,简称ROS)的产生和富集,这些有毒害作用的分子破坏了膜结构和生物大分子,并且通过受损伤的膜渗透细胞内溶物质,造成质膜的通透性增加,进而导致了大量的电解质外渗[3]。相比之下,转pBI121-MLL-SST基因甜菜植株在一定程度上所受到的伤害较小。果聚糖能维持脂质体在温度变化和干旱条件下相态的改变,脂类相态的改变可提高膜的通透性,修复胁迫对膜的损害[20-21]。SST基因编码的低聚合度果聚糖的积累与转基因甜菜抗旱性的提高有关,这与SacB基因编码的高聚合度果聚糖通过促进根的生长来提高植物抗旱性的试验结果[20,22]相一致。
植物根部在抗旱上有重要的作用。本研究通过根部特异性启动子驱动下的转SST基因甜菜的抗旱性比较试验,证实在干旱条件下,转pBI121-MLL-SST基因各株系与对照相比,更能减少水分的流失,更有效地提高了抗氧化物酶的活性,从而使转pBI121-MLL-SST基因甜菜植株获得更高的抗旱性;根部特异表达启动子MLL驱动下SST基因的转化甜菜的抗旱性得到进一步的提高。说明在缺水条件下,根部特异性表达启动子MLL驱动的转SST基因甜菜在干旱逆境胁迫中更能稳定的顺应以及度过干旱逆境,同时证实了该转基因方法在甜菜新品种培育中具有潜在的应用性。
参考文献:
[1]中国农业科学甜菜研究所. 中国甜菜栽培学[M]. 北京:农业出版社,1982:23-56,72-80,81-114.
[2]Holmberg N,Bülow L. Improving stress tolerance in plants by gene transfer[J]. Trends in Plant Science,1998,3(2):61-66.
[3]Chen T H H,Murata N. Enhancement of tolerance of abiotic stress by metabolic engineering of betaines and other compatible solutes[J]. Current Opinion in Plant Biology,2002,5(3):250-257.
[4]Pilon -Smits E A H,Ebskamp M J M,Paul M J,et al. Improved performance of transgenic fructan-accumulating tobacco under drought stress[J]. Plant Physiology,1995,107(1):125-130.
[5]Pilon-Smits E A H,Terry N,Sears T,et al. Enhanced drought resistance in fructan-producing sugar beet[J]. Plant Physiology and Biochemistry,1999,37(4):313-317.
[6]刘伟华,赵秀振,梁虹,等. 枯草杆菌果聚糖蔗糖酶基因转化小麦的研究[J].中国农业科学,2006,39(2):231-236.
[7]张慧,董伟,周骏马,等. 果聚糖蔗糖转移酶基因的克隆及耐盐转基因烟草的培育[J].生物工程学报,1998,14(2):181-186.
[8]高峰,高强,岳桂东,等. 小盐芥(Thellungiellasalsuginea)CBF1基因的克隆[J].山东大学学报(理学版),2005,40(5):113-118.
[9]杜金友,陈晓阳,张桂荣,等. 转果聚糖蔗糖转移酶基因(SacB)美丽胡枝子的获得[J].生物工程学报,2006,22(6):940-944.
[10]De Roover J,Vandenbranden K,Van Laere A,et al. Drought induces fructan synthesis and 1-SST(sucrose:sucrose fructosyltransferase) in roots and leaves of chicory seedlings (CichoriumintybusL.)[J]. Planta,2000,210(5):808-814.
[11]Amiard V,Morvan-Bertrand A,Billard J P,et al. Fructans,but not the sucrosylgalactosides,raffinose and loliose,areaffectedby drought stress in perennial ryegrass[J]. Plant Physiology,2003,132(4):2218-2229.
[12]Clark G T,Zuther E,Outred H A,et al. Tissue-specific changes in remobilisation of fructan in the xerophytic tussock speciesFestucanovaezelandiaein response to a water deficit[J]. Functional Plant Biology,2004,31(4):377-389.
[13]Kawakami A,Yoshida M. Molecular characterization of sucrose:sucrose 1-fructosyltransferase and sucrose:fructan 6-fructosyltransferase associated with fructan accumulation in winter wheat during cold hardening[J]. Bioscience,Biotechnology,and Biochemistry,2002,66(11):2297-2305.
[14]Tamura K,Sanada Y,Tase K,et al. Comparative study of transgenicBrachypodiumdistachyonexpressing sucrose:fructan 6-fructosyltransferases from wheat and timothy grass with different enzymatic properties[J]. Planta,2014,239(4):783-792.
[15]李慧娟,尹海英,张学成,等. 转蔗糖:蔗糖-1-果糖基转移酶基因提高烟草的耐旱性[J]. 山东大学学报(理学版),2007,42(1):89-94.
[16]叶兴国,高翔,佘茂,等. 小麦中果聚糖合成酶基因与抗旱性关系及其分子生物学研究[C]//全国植物分子育种研讨会摘要集,2009:157-158.
[17]刘巧红,江莉萍,于韵. 甜菜叶片组织快速制备DNA的方法[J]. 中国甜菜糖业,2002(2):6,9.
[18]萨姆布鲁克,拉塞尔. 分子克隆实验指南:第3版[M]. 黄培堂,译. 北京:科学出版社,2002,27-99.
[19]李玲,李娘辉,蒋素梅,等. 植物生理学模块实验指导[M]. 北京:科学出版社,2009,76-100.
[20]Livingston Ⅲ D P,Hincha D K,Heyer A G. Fructan and its relationship to abiotic stress tolerance in plants[J]. Cellular and Molecular Life Sciences,2009,66(13):2007-2 023.
[21]Vereyken I J,Chupin V,Demel R A,et al. Fructans insert between the headgroups of phospholipids[J]. Biochim Biophys Acta,2001,1510(1/2):307-320.
[22]Khanna-Chopra R,Sinha S K. Prospects of success of biotechnological approaches for improving tolerance to drought stress in crop plants[J]. Current Science,1998,74(1):25-34.

