早卵泡期长方案血清LH低的患者添加r-LH的临床结局分析
田莉峰,伍琼芳,谭俊,苏琼,李游,许定飞
(江西省妇幼保健院辅助生殖中心,南昌 330006)
随着辅助生殖技术的发展,临床促排卵方案得以优化,个体化用药越来越受到重视。对于两细胞-两性腺学说的深入研究发现,不同激素在卵母细胞发育成熟的不同阶段发挥不同作用。黄体生成素(LH)可以促进雌激素合成、诱导卵泡发育与成熟、选择主导卵泡,还能在月经中期恢复卵母细胞的减数分裂、诱发排卵。在辅助生殖技术中,使用促性腺激素释放激素激动剂(GnRH-a)进行垂体降调节临床应用广泛,可有效预防LH峰的提前出现,但由于患者对GnRH-a的反应存在个体差异,也可能引起垂体降调节后血清LH水平过度抑制状态。
目前国内外关于添加LH的研究很多,主要集中在GnRH-a黄体期长方案和GnRH拮抗剂(GnRH-ant)方案[1-2],以及高龄妇女中[3]。GnRH-a黄体期长方案和GnRH-ant方案中添加LH的研究结果显示:在降调节后,患者内源性LH会受到过度抑制,并且E2合成受到影响,而添加LH可以减少颗粒细胞凋亡,改善卵母细胞质量、胚胎质量,增加卵母细胞成熟度[1-2]。但目前关于GnRH-a早卵泡期长方案中添加LH的相关研究较少。我中心多年的临床数据显示,早卵泡期长方案与黄体期长方案和拮抗剂方案比较,有提高种植率和临床妊娠率的优势[4-7],因此该方案在我中心广泛使用。因为GnRH-a早卵泡期长方案中的全量GnRH-a有充分的降调节作用,促排卵过程中血清LH值比黄体期长方案和拮抗剂方案中LH值均明显降低,过低的LH可能影响卵母细胞成熟度,所以,理论上补充LH可以增加成熟卵母细胞数量,改善卵母细胞质量、胚胎质量,提高胚胎种植率及临床妊娠率等。为了进一步优化早卵泡期长方案,本研究回顾性分析早卵泡期长方案促排卵过程中对于血清LH值低的患者给予r-LH处理,探讨添加r-LH是否改善患者的临床结局。
资料与方法
一、研究对象及分组
收集2013年1月至2015年12月在本生殖中心行IVF/ICSI-ET,采用早卵泡期长方案的不孕患者为研究对象(共1 331个周期)。纳入标准:(1)不孕年限>1年;(2)年龄20~45岁;(3)基础FSH<12 U/L;(4)促排卵后第8天(D8)血清LH水平≤0.5 U/L。排除标准:(1)存在子宫畸形,如双子宫、双角子宫、单角子宫、子宫纵膈等,合并宫腔粘连、子宫腺肌症、子宫肌瘤[粘膜下肌瘤或子宫肌层肌瘤但直径>4 cm和(或)压迫子宫内膜];(2)夫妇双方任意一方染色体异常;(3)曾有3次及以上复发性流产病史(包括生化妊娠流产)等;(4)合并存在其他辅助生殖禁忌症的患者:如未控制的糖尿病、肝肾功能异常、未控制的高血压、心脏病等,有脑血管意外或深静脉血栓史,合并生殖系统癌症或相关病史,存在未明确诊断的阴道流血等。
按照治疗时是否添加重组人黄体生成素(r-LH)将患者分为观察组和对照组。观察组(689个周期):D8开始添加r-LH至HCG日;对照组(642个周期)则不添加r-LH。
二、研究方法
早卵泡期长方案:患者于月经第2天肌肉注射长效GnRH-a(醋酸曲普瑞林,达菲林,3.75 mg/支,博福-益普生,法国)3.75 mg进行垂体降调节,28~30 d后行B超及内分泌激素检查,达到垂体完全降调节标准(子宫内膜厚度≤5 mm,血清FSH<5 U/L,黄体生成素LH<5 U/L,E2<183 pmol/L)后,每天给予75~225 U重组人卵泡刺激素(r-FSH,果纳芬,75 U/支或450 U/支,默克雪兰诺,德国)启动促排卵周期。并根据患者年龄、体重及卵巢反应情况调整剂量。
观察组(果纳芬+乐芮组)患者D8开始每天添加r-LH(乐芮,75 U/支,默克雪兰诺,德国)1支,至HCG注射日。对照组(果纳芬组)患者则不添加r-LH,继续r-FSH促排卵,直至HCG注射日。
给予Gn 5 d后行阴式B超检查监测卵泡发育大小,同时监测血清LH、E2及孕酮(P)水平,根据卵泡生长发育的速度调整Gn具体用量,直至 HCG 注射日。当至少有1个卵泡直径≥19 mm或2个卵泡直径≥18 mm时于当晚给予HCG(艾泽,250 μg/支,默克雪兰诺,德国)250 μg皮下注射,36 h后在阴道B超引导下取卵。取卵当日给予黄体酮针剂(黄体酮注射液,20 mg/支,浙江仙琚)60 mg/d进行黄体支持。卵母细胞在体外培养3~6 h后进行常规IVF或ICSI,于受精后第3天或第5~6天,选择最优质的胚胎1~2枚在腹部B超引导下进行移植。
优质胚胎:D3细胞数7~9个的Ⅰ、Ⅱ级胚胎;优质囊胚:D5~6囊胚分级≥3级,且其内细胞团为A或B级。
对获卵数≥20个或移植前卵巢直径≥7 cm者,考虑移植后有中重度卵巢过度刺激综合征(OHSS)发生的可能,这类患者行全胚冷冻。移植后改用黄体酮阴道缓释凝胶8%(雪诺酮90 mg/支,默克雪兰诺,德国)1支/d,及地屈孕酮片(达芙通10 mg/片,苏威制药,荷兰)早晚各1片行黄体支持。移植后13 d验尿HCG或查血HCG确定是否生化妊娠,移植后1个月行B超检查见胚芽及胎心搏动者诊断为临床妊娠,并同时确定孕囊数。黄体支持从取卵日开始维持至孕10周。随访孕期及分娩时母婴情况等。
三、观察指标
主要观察指标为抱婴率、临床妊娠率及胚胎种植率;次要观察指标为Gn天数、Gn总量及获卵数、注射HCG日LH、E2和P水平、HCG日内膜厚度、MⅡ卵率、双原核(2PN)受精率、2PN卵裂率、优质胚胎率、早期流产率、全胚冷冻率、OHSS发生率,以及产妇分娩孕周、新生儿出生体重等。
四、统计学处理
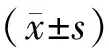
结 果
一、两组患者基本情况比较
两组基本情况比较,年龄、不孕年限、体重指数(BMI)、基础窦卵泡数(AFC)、基础性激素水平等均无统计学意义(P>0.05)(表1)。
二、两组患者促排卵情况比较
两组患者降调节后血FSH、LH、E2水平,HCG日LH水平、HCG日内膜厚度,Gn天数、Gn总量比较均无统计学差异(P>0.05)。观察组患者HCG日P水平、E2水平均显著低于对照组(P<0.01)(表2)。

表1 两组患者基本情况比较(-±s)

表2 两组患者促排卵情况比较(-±s)
注:与对照组比较,*P<0.05
三、两组患者临床结局比较
观察组的获卵数、每周期平均冷冻胚胎数及全胚冷冻率均显著低于对照组(P<0.01)。观察组的MⅡ卵率、种植率、临床妊娠率、每周期抱婴率均略高于对照组,但是无显著性差异(P>0.05)。

表3 两组患者临床结局的比较 [(-±s),%]
注:与对照组比较,*P<0.05;a种植率、临床妊娠率和抱婴率均按每移植周期计算
讨 论
基于两细胞-两性腺学说,LH和FSH在卵泡的生长发育中起着关键及相互协同的作用,卵泡膜细胞和颗粒细胞产生卵巢类固醇激素[8-9]。FSH在卵泡生长发育早期是必不可少的,并且通过芳香化酶将雄激素转化为雌激素,而雄激素的产生是卵泡膜细胞在LH和FSH共同作用下将胆固醇转化为雄激素[10]。虽然在没有LH的情况下,FSH也可以诱导卵泡生长,但是在注射了HCG后,卵泡仍然可能出现生长发育缺陷,说明LH在卵泡发育过程中不仅是为芳香化酶提供雄激素底物,而且直接刺激和调节卵泡形成。值得注意的是,卵泡膜细胞和颗粒细胞产生大量的孕激素可以在LH的影响下转化成雄激素。因此,LH的补充可以引起血清P水平降低。众所周知,过高的P对内膜有不利的影响,导致内膜和胚胎的非同步发育,降低种植率。本研究结果与此一致,观察组HCG日P水平低于对照组,较低的孕激素可能有利于内膜容受性,使观察组临床妊娠率有高于对照组的趋势,虽然无统计学差异。LH在卵泡发育成熟过程中起着必不可少的作用,当卵泡发育至对FSH有反应的阶段,颗粒细胞逐渐表达LH受体,开始接受LH的刺激,LH作用在卵泡膜细胞和颗粒细胞上,发挥FSH的大部分生物活性,包括对芳香化酶系统的刺激。因而,此时受FSH刺激的卵泡内颗粒细胞对FSH和LH可以产生类似的反应,尤其在FSH和LH非饱和剂量的状态下,二者协同作用,反应叠加[11]。另外,公认为卵泡成熟通过颗粒细胞上逐渐表达的LH受体而减少了对FSH的依赖。提示LH可能在卵母细胞的成熟过程中起着关键性决定作用。但是,发育的卵泡暴露在不合适的高浓度LH中可能会干扰卵泡和卵母细胞的成熟,从而对生殖过程带来副作用。GnRH-a降调节药物的使用,能有效抑制促排卵过程中LH峰的提前出现,却增加了LH的过度抑制。因此,促排卵过程中是否应该添加LH,以及添加LH的时机和剂量等成为目前辅助生殖领域学者讨论的热点问题之一。
卵泡发育和成熟需要最低阈值水平的LH,1%的LH受体被利用就足以维持类固醇的合成,但是如果LH低于阈值,则影响卵泡生长和卵母细胞成熟,减少雄激素和雌激素的合成[12]。Gordon等[13]研究认为,降调节后较低的内源性LH对于卵巢的正常反应和E2合成是充足的,但添加外源性LH可以增加胚胎着床率。LH超过发育卵泡的峰值可以终止卵泡发育:LH高于峰值,会抑制颗粒细胞增殖,导致卵泡闭锁、黄素化。增加LH剂量,使LH高于峰值可减少小卵泡数[12]。在本研究中,观察组添加外源性LH后,获卵数减少,导致HCG日雌激素水平较对照组低,降低了OHSS风险,可使观察组患者鲜胚移植概率增高,而观察组因预防OHSS进行全胚冷冻的患者减少,全胚冷冻率降低。观察组在获卵数下降、移植率增高的情况下,每周期冷冻胚胎数目较对照组显著降低。有研究表明,在内源性LH被抑制的IVF周期中,要想获得理想的卵泡发育,血清LH值最好维持在1.2~5.0 U/L之间[14]。
目前国内外对于添加r-LH是否获益,及获卵数、妊娠率等结局指标仍存在争议。这可能和研究设计针对了不同卵巢储备、不同年龄的患者及采用不同的促排卵方案有关。Razi等[15]的一项随机对照试验显示,对于年轻的卵巢功能正常的不孕患者,使用黄体期长方案,添加r-LH对妊娠结局没有改善。Oliveira等[16]进行Meta分析发现,在GnRH-a长方案降调节周期中,促排卵早期(刺激第6天)开始添加r-LH会缩短刺激天数,减少Gn用量,增加HCG日雌激素水平;然而,获卵数、成熟卵数、每取卵周期临床妊娠率、着床率以及流产率无显著性差异。Santi等[17]的另一项Meta分析数据显示,IVF/ICSI-ET助孕治疗中,FSH+LH治疗组有更少的卵母细胞数和更高的妊娠率,MⅡ卵数各组间无统计学差异。添加r-LH或LH活性物质可以减少卵泡募集,但可以提高卵母细胞质量,从而提高妊娠率。李元等[18]对多囊卵巢综合征患者在改良超长方案中添加LH的研究结果显示:促排卵第8天血清LH<0.5 U/L的多囊卵巢综合征患者添加r-LH后,平均获卵数明显下降,着床率、妊娠率、抱婴率等有增高趋势。本研究结果表明,观察组获卵数下降,但临床妊娠率有提高的趋势,与Santi等[17]及李元等[18]的研究结果一致。Ruvolo等[19]对长方案GnRH-a降调节的研究显示,通过对取卵获得的卵丘细胞进行凋亡检测,刺激第8天起添加r-LH组比单纯使用r-FSH促排卵组成熟卵母细胞增多,而且单用r-FSH组颗粒细胞凋亡率比添加r-LH组高。添加了r-LH的卵丘细胞在排卵前可以更好地支持胞核和胞浆成熟。Bosco等[20]证实人类卵母细胞凋亡决定了ICSI后的受精失败。如果卵母细胞的凋亡通过卵丘细胞的缝隙连接分子信号通路调节激活,卵丘细胞的低凋亡率将会预示优质的卵母细胞质量,以及更好的受精率和优质胚胎率。Westergaard等[21]研究发现如果卵巢刺激第8天血清LH≤0.5 U/L,则流产率明显增加(分别是45%和9%)。Fleming等[22]研究发现,若卵泡中期LH≤0.5 U/L,会出现HCG日E2水平降低,导致妊娠结局不良。李颂军等[23]在一项改良超长方案中添加r-LH的研究中发现,使用改良超长方案降调节后,对于LH抑制较深者早期添加r-LH可获得满意的临床结局,种植率及临床妊娠率均显著提高。目前认为衡量垂体-卵巢轴降调节过度的标准为卵泡中期血清LH水平≤0.5 U/L。由此,在本研究中,对早卵泡期长方案患者在卵巢刺激第8天进行LH水平测定。观察组中r-LH的及时添加,改善了卵母细胞质量,MⅡ卵率增加,妊娠率相对较高,但未表现出统计学差异,可能和样本量较小及添加r-LH的剂量不足或者添加时间较短有关。
综上,临床控制性卵巢刺激药物各种各样,不同的药物会使不同的患者获益。对于早卵泡期长方案的卵巢刺激过程中LH水平过度抑制(LH≤0.5 U/L)的患者,添加r-LH可能有利于改善IVF/ICSI-ET妊娠结局,FSH+r-LH促排卵方案有提高临床妊娠率的趋势。后续需要开展更大样本量的前瞻性研究以进一步探讨其对临床妊娠结局的影响,并探索其个体化用药的时间和剂量等。
【参考文献】
[1]Barberi M,Ermini B,Morelli MB,et al. Follicular fluid hormonal profile and cumulus cell gene expression in controlled ovarian hyperstimulation with recombinant FSH:effects of recombinant LH administration[J].J Assist Reprod Genet,2012,29:1381-1391.
[2]Xiong Y,Bu Z,Dai W,et al. Recombinant luteinizing hormone supplementation in women undergoing in vitro fertilization/intracytoplasmic sperm injection with gonadotropin releasing hormone antagonist protocol:a systematic review and meta-analysis[J].Reprod Biol Endocrinol,2014,12:109.
[3]田莉峰,伍琼芳,苏琼,等.卵巢低反应不孕患者行IVF助孕不同促排卵方案妊娠结局的比较[J].江西医药,2013,48:479-482.
[4]李游,伍琼芳,易迎春.超长方案降调节对多囊卵巢综合症不孕患者行IVF结局的影响[J].江西医药,2014,49:117-120.
[5]许定飞,伍琼芳.超长方案和拮抗剂方案在PCOS患者行体外受精-胚胎移植(IVF-ET)治疗中的应用比较[J].江西医药,2015,50:13-15.
[6]胡毅娜,丁涛,赵琰,等.两种降调节方案体外受精 胚胎移植出生结局的比较[J].中国妇幼保健,2017,32:808-810.
[7]Lehert P,Kolibianakis EM,Venetis CA,et al. Recombinant human follicle-stimulating hormone(r-hFSH)plus recombinant luteinizing hormone versus r-hFSH alone for ovarian stimulation during assisted reproductive technology:systematic review and meta-analysis[J].Reprod Biol Endocrinol,2014,12:17.
[8]Chung K,Krey L,Katz J,et al. Evaluating the role of exogenous luteinizing hormone in poor responders undergoing in vitro fertilization with gonadotropin-releasing hormone antagonists[J].Fertil Steril,2005,84:313-318.
[9]Humaidan P,Bungum L,Bungum M,et al. Ovarian response and pregnancy outcome related to mid-follicular LH levels in women undergoing assisted reproduction with GnRH agonist down-regulation and recombinant FSH stimulation[J].Hum Reprod,2002,17:2016-2021.
[10]Hill MJ,Levy G,Levens ED. Does exogenous LH in ovarian stimulation improve assisted reproduction success?An appraisal of the literature[J/OL].Reprod Biomed Online,2012,24:261-271.
[11]Chappel SC,Howles C. Reevaluation of the roles of luteinizing hormone and follicle stimulating hormone in the ovulatory process[J].Hum Reprod,1991,6:1206-1212.
[12]Raju GA,Chavan R,Deenadayal M,et al. Luteinizing hormone and follicle stimulating hormone synergy:A review of role in controlled ovarian hyper-stimulation[J].J Hum Reprod Sci,2013,6:227-234.
[13]Gordon UD,Harrison RF,Fawzy M,et al. A randomized prospective assessor-blind evaluation of luteinizing hormone dosage and in vitro fertilization outcome[J].Fertil Steril,2001,75:324-331.
[14]O’Dea L,O’Brien F,Currie K,et al. Follicular development induced by recombinant luteinizing hormone(LH)and follicle-stimulating hormone(FSH)in anovulatory women with LH and FSH deficiency:evidence of a threshold effect[J].Curr Med Res Opin,2008,24:2785-2793.
[15]Razi MH,Mohseni F,Dehghani Firouzabadi R,et al. Results from adding recombinant LH for assisted reproductive technology treatment:A randomized control trial[J].Iran J Reprod Med,2014,12:111-116.
[16]Oliveira JB,Mauri AL,Petersen CG,et al. Recombinant luteinizing hormone supplementation to recombinant follicle-stimulation hormone during induced ovarian stimulation in the GnRH-agonist protocol:a meta-analysis[J].J Assist Reprod Genet,2007,24:67-75.
[17]Santi D,Casarini L,Alviggi C,et al. Efficacy of follicle-stimulating hormone(FSH)alone,FSH + luteinizing hormone,human menopausal gonadotropin or FSH + human chorionic gonadotropin on assisted reproductive technology outcomes in the “personalized” medicine era:a meta-analysis[J].Front Endocrinol(Lausanne),2017,8:114.
[18]李元,龚斐.重组人黄体生成素能改善改良超长方案多囊卵巢综合征患者IVF/ICSI妊娠结局[J].生殖医学杂志,2015,24:21-25.
[19]Ruvolo G,Bosco L,Pane A,et al. Lower apoptosis rate in human cumulus cells after administration of recombinant luteinizing hormone to women undergoing ovarian stimulation for in vitro fertilization procedures[J].Fertil Steril,2007,87:542-546.
[20]Bosco L,Ruvolo G,Morici G,et al. Apoptosis in human unfertilized oocytes after intracytoplasmic sperm injection[J].Fertil Steril,2005,84:1417-1423.
[21]Westergaard LG,Laursen SB,Andersen CY. Increased risk of early pregnancy loss by profound suppression of luteinizing hormone during ovarian stimulation in normogonadotrophic women undergoing assisted reproduction[J].Hum Reprod,2000,15:1003-1008.
[22]Fleming R,Rehka P,Deshpande N,et al. Suppression of LH during ovarian stimulation:effects differ in cycles stimulated with purified urinary FSH and recombinant FSH[J].Hum Reprod,2000,15:1440-1445.
[23]李颂军,沈秀,周睿琼,等.重组人黄体生成素添加时机对改良超长方案IVF/ICSI结局的影响[J].生殖医学杂志,2016,25:977-982.

