大鼠肝内淋巴细胞的分离与培养
张曼卡,马慧敏,张 健,李玉凤,叶小慧,李 鑫,
1.北京大学地坛医院教学医院中西医结合中心,北京 100015;2.首都医科大学附属北京地坛医院中西医结合中心;3.首都医科大学附属北京地坛医院传染病研究所;4.北京大学地坛医院教学医院传染病研究所
自身免疫性肝炎是一种病因未明、病理机制十分复杂的慢性肝脏炎症性疾病,其主要表现是肝功能异常、免疫球蛋白升高、自身抗体阳性及特异的肝脏组织病理学异常改变[1-3]。其发病机制被认为是肝脏的促炎和抗炎机制的失衡所致。它是由于环境触发作用于遗传上的易感人群,导致T细胞介导的免疫应答直接作用于肝脏细胞的抗原[4]。因此,能够对肝内淋巴细胞亚群进行分析对阐释这一疾病的复杂病理机制显得至关重要。然而,目前尚未有专门的肝内淋巴细胞分离培养方法。因此,本研究旨在通过建立一种较为简便且具有很高重复性的提取大鼠肝内淋巴细胞的方法,为进一步研究肝脏免疫疾病奠定实验工作基础。
1 材料与方法
1.1材料无特殊病原体级大鼠,体质量250~350 g, 雌雄不限,由北京华阜康生物科技股份有限公司提供。大鼠实验前12 h禁食、不禁水。本研究在北京地坛医院动物实验伦理委员会批准下进行。1640培养基(Gibco,1868632)、胎牛血清(Biology Industries,1616316)、L型-谷氨酰胺 (Amresco生物公司)、淋巴细胞分离液(Lymphoprep公司,12GES16)、Cell Strainer(BD公司)、一次性留置针(金环,29S0301)、PERCP标记抗大鼠CD3抗体(ebioscience,4289855),蔡司(ZEISS)倒置荧光显微镜、Eppendorf高速冷冻离心机。
1.2方法
1.2.1 大鼠原代肝淋巴细胞的分离与培养: 主要包括灌肝、研磨、纯化及培养等步骤, (1)灌肝: 取体质量为345 g的无特殊病原体级SD大鼠1只, 术前12 h禁食、不禁水;用质量浓度为40 g/L的戊巴比妥那将大鼠麻醉后, 用大头针将大鼠呈仰卧位置固定于泡沫板;之后,将质量浓度为750 g/L的乙醇喷洒于大鼠皮肤以进行体外消毒;5 min后以U形切口剪开皮层,再次消毒之后剪开肌层,切口上至剑突,下至耻骨联合,左右至腋后线;将剪开的皮瓣固定;暴露腹腔后,将静脉留置针置入肝门静脉中,拔出针芯,将预冷的磷酸盐缓冲液作为灌注液冲出肝脏内血液,用眼科剪剪断下腔静脉使灌流液流出,整个过程速度适中,时间控制在5 min左右;待肉眼观察灌流液颜色清亮时,小心剥离肝脏周边黏连组织或结缔组织,摘除肝脏,将其放入盛有预冷磷酸盐缓冲液的培养皿中。(2)研磨:将剥离的肝脏置入超净台中进行下一步操作。先用磷酸盐缓冲液冲洗肝脏2遍以冲洗表面的血污水,倒掉漂洗液后再用眼科剪将肝脏剪成约10 mm×10 mm的小块,使用Cell Strainer配合10 ml注射器针芯将肝脏研磨至细胞悬液。(3)纯化与培养:收集细胞悬液后以50×g的速度,离心3 min,将上清收入离心管中放冰上待用,再将离心沉淀加入磷酸盐缓冲液重悬,重复离心取上清2次;将3次收集的上清1 200×g,5 min离心,将沉淀用8 ml磷酸盐缓冲液重悬,将8 ml细胞悬液缓慢铺层于4 ml淋巴细胞分离液上,450×g,升9降1,离心20 min,之后吸取中间白膜层于8 ml预冷的磷酸盐缓冲液中,1 500×g,10 min离心,弃上清;1 200×g,5 min离心,弃上清。计数后,以1×106密度培养于24孔板中,培养基为1640培养基。然后置入体积分数为5%的CO2的培养箱中培养,每天观察1次细胞形态及培养液状况。
1.2.2 大鼠肝内淋巴细胞的形态学观察:采用蔡司倒置显微镜, 观察肝内淋巴细胞的形态结构, 主要包括细胞的大小形态及细胞表面光滑度等。
1.2.3 流式细胞术鉴定大鼠肝内T淋巴细胞:将提取的细胞吸取转移至流式管中,以1 200×g的转速离心5 min,弃上清; 每管染T细胞特性的标记CD3抗体1 μl,涡旋混匀,4 ℃ 避光染色 15 min;加 2 ml PBEB 涡旋,以 1200 r/min,离心5 min洗涤细胞,弃上清;向流式管中加入 200 μl PBS,流式上机收取细胞105个后使用流式数据分析软件Flowjo进行分析。
2 结果
2.1肝内淋巴细胞的形态学观察细胞培养时,观察到细胞为规则的圆形,细胞表面较为平滑,胞质透明清亮,中间略隆起,直径为6~7 μm,呈典型的淋巴细胞形态(见图1)。
2.2流式细胞仪检测我们采用流式细胞仪进行T淋巴细胞特异性表位CD3进行染色,上机收取105个细胞,Flowjo软件分析显示,T淋巴细胞比例为51.2%(见图2)。

图1 淋巴细胞形态学观察(200×) A:细胞培养0 h; B:细胞培养24 h;C:细胞培养48 hFig 1 The morphological observation of lymphocytes (200×) A: cells were cultured for 0 hour; B: cells were
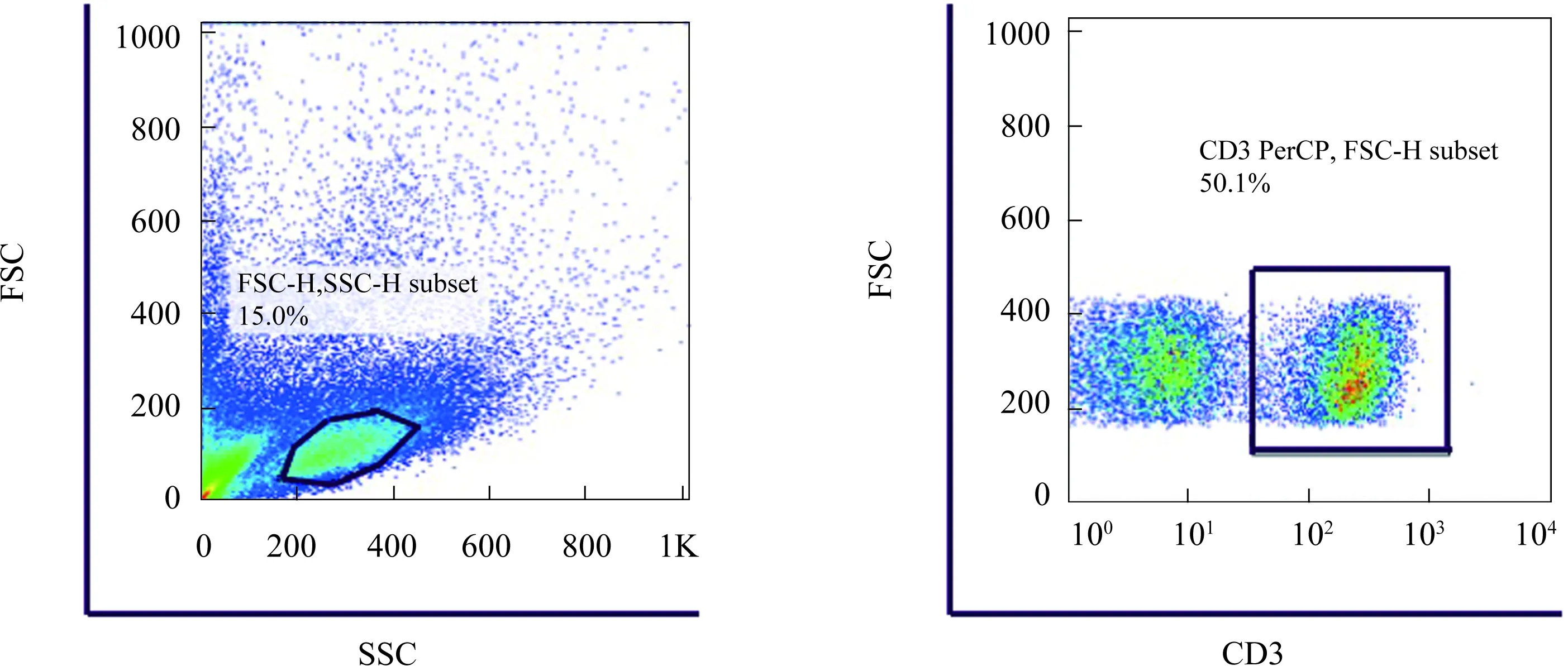
图2 淋巴细胞流式画门策略及T淋巴细胞鉴定Fig 2 The gating strategy for intrahepatic T cells and the identification of T lymphocytes
3 讨论
肝脏是机体重要的免疫器官,在机体的免疫中占重要的地位。研究[5-7]发现,淋巴细胞及其亚群的变化参与了一些肝脏疾病的发病过程,如乙型肝炎、丙型肝炎、戊型肝炎、自身免疫性肝病等。因此,能够对淋巴细胞亚群进行精准的分析就显得尤为重要。而此项工作的重要基础是对肝内淋巴细胞进行分离与纯化。
然而,目前仍未有一种可被广泛接受的分离提取原代肝内淋巴细胞的方法。本实验首先利用淋巴细胞与肝实质细胞密度的不同,先利用离心法去除肝实质细胞的影响。而后,由于淋巴细胞的体积、形态和密度与其他细胞不同,而淋巴细胞分离液是一种密度为1.075~1.090近似于等渗的溶液,故而我们使用它进行密度梯度离心,从而将肝内淋巴细胞分离出来,同时利用流式细胞仪的定量分析,客观、简单地对肝内淋巴细胞亚群进行鉴定检测[8-11]。
由于淋巴细胞分类较多,表型不同,故现在仍缺乏一种鉴定全部淋巴细胞的可靠方法。本实验选取其中的T淋巴细胞亚群进行鉴定分析。成功分离纯化淋巴细胞后,还可以借助磁珠将感兴趣的亚群进一步分选以便进一步实验分析[12-14]。
原代细胞的培养是指直接从机体取下细胞、组织和器官后立即进行培养。此时的细胞保持原有细胞的基本性质,原代肝内淋巴细胞可以很好地模拟体内肝脏的免疫环境,可以作为病理机制阐明及药物实验的可靠模型。
总之, 本实验运用大鼠正常的肝脏组织,采用原位灌注及密度梯度离心法相结合成功分离和培养了大鼠肝内淋巴细胞,这种方法操作较简单, 重复性比较性好,成功率较高,解决了肝内淋巴细胞分离培养的问题,为进一步开展肝脏的免疫学研究提供了非常好的体外细胞模型。
[1] 张红梅, 张明, 郜志美. 自身免疫性肝炎患者外周血淋巴细胞亚群的变化[J]. 实用肝脏病杂志, 2015, 18(1): 76-77. DOI: 10.3969/j.issn.1672-5069.2015.01.020.
ZHANG H M, ZHANG M, GAO Z M. Changes of peripheral lymphocyte subsets in patients with autoimmune hepatitis [J]. J Prac Hepatol, 2015, 18(1): 76-77. DOI: 10.3969/j.issn.1672-5069.2015.01.020.
[2] DESWAL S, SRIVASTAVA A. Role of allopurinol in optimizing thiopurine therapy in patients with autoimmune hepatitis: a review [J]. J Clin Exp Hepatol, 2017, 7(1): 55-62. DOI: 10.1016/j.jceh.2017.01.115.
[3] CZAJA A J, CARPENTER H A. Autoimmune hepatitis overlap syndromes and liver pathology [J]. Gastroenterol Clin North Am, 2017, 46(2): 345-364. DOI: 10.1016/j.gtc.2017.01.008.
[4] 李英仆. 自身免疫性肝病的发病机制与研究进展[J]. 深圳中西医结合杂志, 2015, 25(3): 190-191. DOI: 10.16458/j.cnki.1007-0893.2015.03.126.
[5] 李玲, 顾长海, 王雅凡. 慢性重型乙型肝炎肝内淋巴细胞AICD现象的探测[J]. 第三军医大学学报, 2002, 24(5): 597-599. DOI:10.3321/j.issn:1000-5404.2002.05.030.
LI L, GU C H, WANG Y F. Activation-induced cell death happened in infiltrating lymphocytes in liver of patients with chronic severe hepatitis B [J]. Acta Academiae Medicinae Militaris Tertiae, 2002, 24(5): 597-599. DOI: 10.3321/j.issn:1000-5404.2002.05.030.
[6] 郑德明, 郭彦宏, 郑斐. 慢性乙型肝炎肝内淋巴细胞亚群的流式细胞仪分析[J]. 现代医药卫生, 2012, 28(1): 102-104.
[7] 杨光. 慢性丙型肝炎肝内及周围血淋巴细胞亚群表型分析[J]. 胃肠病学和肝病学杂志, 1998, 7(2): 123-127.
YANG G. Analysis of intrahepatic and peripheral blood lymphocyte subpopulations in chronic hepatitis C by three-colour flow cytometry [J]. Chin J Gastroenterol Hepatol, 1998, 7(2): 123-127.
[8] 刘怡敏, 郝礼森. CD4+T细胞与肝脏疾病研究进展[J]. 承德医学院学报, 2015, 32(6): 524-528. DOI: 10.15921/j.cnki.cyxb.2015.06.034.
[9] 裘宇容, 曾方银, 杨春莉. 流式细胞仪对4种癌症病人T淋巴细胞亚群的检测[J]. 第一军医大学学报, 1998, 18(2): 151.
[10] 施文钧, 陈小平, 高凯, 等. 流式细胞仪术检测健康人淋巴细胞亚群和表型研究的探讨[J]. 中国卫生检验杂志, 2001, 11(3): 263-265. DOI: 10.3969/j.issn.1004-8685.2001.03.004.
SHI W J, CHEN X P, GAO K, et al. Study of lymphocyte subsets and phenotypes in healthy individuals measured by flow cytometry [J]. Chinese Journal of Health Laboratory Technology, 2001, 11(3): 263-265. DOI: 10.3969/j.issn.1004-8685.2001.03.004.
[11] 许艳丽, 杜庆华. 流式细胞仪检测健康儿童T淋巴细胞亚群及其绝对计数的研究[J]. 中华现代儿科学杂志, 2005, 2(7): 591-592.
XU Y L, DU Q H. Detection of T lymphocyte subsets and its absolute count in healthy children by flow cytometry [J]. Journal of Chinese Modern Pediatrics, 2005, 2(7): 591-592.
[12] 任秀宝, 于津浦, 刘虹, 等. 磁珠分选系统和胞内染色法联合分析细胞因子诱导杀伤细胞中Th1/Th2细胞亚群分布特点[J]. 中华检验医学杂志, 2005, 28(5): 486-488.
REN X B, YV J P, LIU H, et al. Analysis of Th1/Th2 subsets distribution in CIKs by intracellular cytokine staining method combined with magnetic beads separation system [J]. Chin J Lab Med, 2005, 28(5): 486-488.
[13] 许先国, 章伟, 陈舒, 等. 基于免疫分选的T淋巴细胞亚群嵌合性定量分析[J]. 中国卫生检验杂志, 2011, 21(1): 101-102.
XU X G, ZHANG W, CHEN S, et al. Quantitative analysis of the chimerism of T lymphocyte subsets based on immune sorting [J]. Chinese Journal of Health Laboratory Technology, 2011, 21(1): 101-102.
[14] 莫雪安, 周礼圆, 秦超, 等. 免疫磁珠法在分离纯化外周血CD4+和CD8+T淋巴细胞亚群中的应用[J]. 广西医科大学学报, 2012, 29(5): 679-681. DOI: 10.16190/j.cnki.45-1211/r.2012.05.007.
MO X A, ZHOU L Y, QIN C, et al. The Application of magnetic activared cell sorting for separation and purification of CD4+T cell and CD8+T cell subpopulations of peripheral blood [J]. Journal of Guangxi Medical University, 2012, 29(5): 679-681. DOI:10.16190/j.cnki.45-1211/r.2012.05.007.

