266例胃肠胰神经内分泌肿瘤临床特征及预后分析
弋东敏, 肖 伟, 周胜理, 李杜鹃, 张炳勇, 李 健
河南省人民医院 1.消化内科; 2.病理科,河南 郑州 450003
神经内分泌肿瘤(neuroendocrine neoplasms, NENs)是一类少见的、起源于干细胞且具有神经内分泌标记物,能够产生生物活性胺和/或多肽激素的异质性肿瘤。美国国立癌症研究所监测、流行病学和结果数据库(SEER)数据显示[1],相比其他恶性肿瘤,NENs发病率在近40年明显上升约6.4倍,其中胃肠胰神经内分泌肿瘤(gastroenteropancreatic neuroendocrine neoplasms, GEP-NENs)占65%~75%[2]。近年来,国内对GEP-NENs报道逐渐增多,数据显示,GEP-NENs发病率呈逐渐上升趋势[3],但目前仍缺乏全面的系统性调查及研究数据。GEP-NENs临床表现复杂多样,加上临床医师对本病认识不充分,导致本病误诊率高。本文回顾性分析266例GEP-NENs患者临床资料,筛选出影响肿瘤转移和预后的危险因素,旨在进一步提高对本病认识及早期诊断率。
1 资料与方法
1.1一般资料选取2012年3月至2017年4月河南省人民医院收治且病理确诊为GEP-NENs的266例患者作为研究对象,收集其临床资料。男165例,女101例,男女比例为1.6∶1,发病年龄(54.9±13.8)岁(23~91岁)。本研究经河南省人民医院伦理委员会审核批准。
1.2研究方法根据2010年WHO制定的NENs命名、分类标准[4],回顾性分析患者性别、年龄、发病部位、临床表现、辅助检查、病理及治疗措施。根据病理组织学Ki-67阳性指数进行肿瘤分级(G1:≤2%,G2:3%~20%,G3:>20%)。制定随访表,电话随访并记录患者的生活质量及生存状态(复发、转移或死亡),并对数据进行统计,截止日期为2017年11月,随访间隔时间为3个月。

2 结果
2.1临床表现266例GEP-NENs患者中无功能性NENs最多,共234例(88.0%),临床表现复杂多样,且无特异性,肿瘤的原发部位及管壁浸润深度各不相同。腹痛、腹胀(114例,42.9%)最常见,其次为大便习惯改变(36例,13.5%)、消化不良(21例,7.9%)、吞咽不适或困难(19例,7.1%)、黄疸(13例,4.9%)、消化道出血(7例,2.6%)。24例于常规体检中发现。32例(12.0%)为功能性NENs,均无类癌综合征表现,为发生于胰腺的胰岛素瘤,临床可见典型的低血糖症状。
2.2辅助检查消化内镜和超声内镜是发现胃肠NENs病变的主要检查手段。消化内镜检出率为98.3%(171/174),表现为黏膜溃疡、息肉、隆起等。超声内镜82例,均表现为椭圆形低回声区,边界欠清,与黏膜深层和/或黏膜下层连续,表面黏膜同周边。腹部超声主要用于肝胆胰腺病变检查,检出率为77.4%(48/62),其中胰腺病变检出率53.2%(33/62),表现为类圆形低回声团块。上消化道造影31例,病变检出率为83.9%(26/31),表现为黏膜充盈缺损或隆起。CT、MRI表现为局部占位、壁增厚,增强后动脉期可见强化,其检出率分别为84.9%(163/192)和88.4%(38/43)。4例行PET-CT,其中3例检出病变,表现为代谢率异常升高(见表1)。
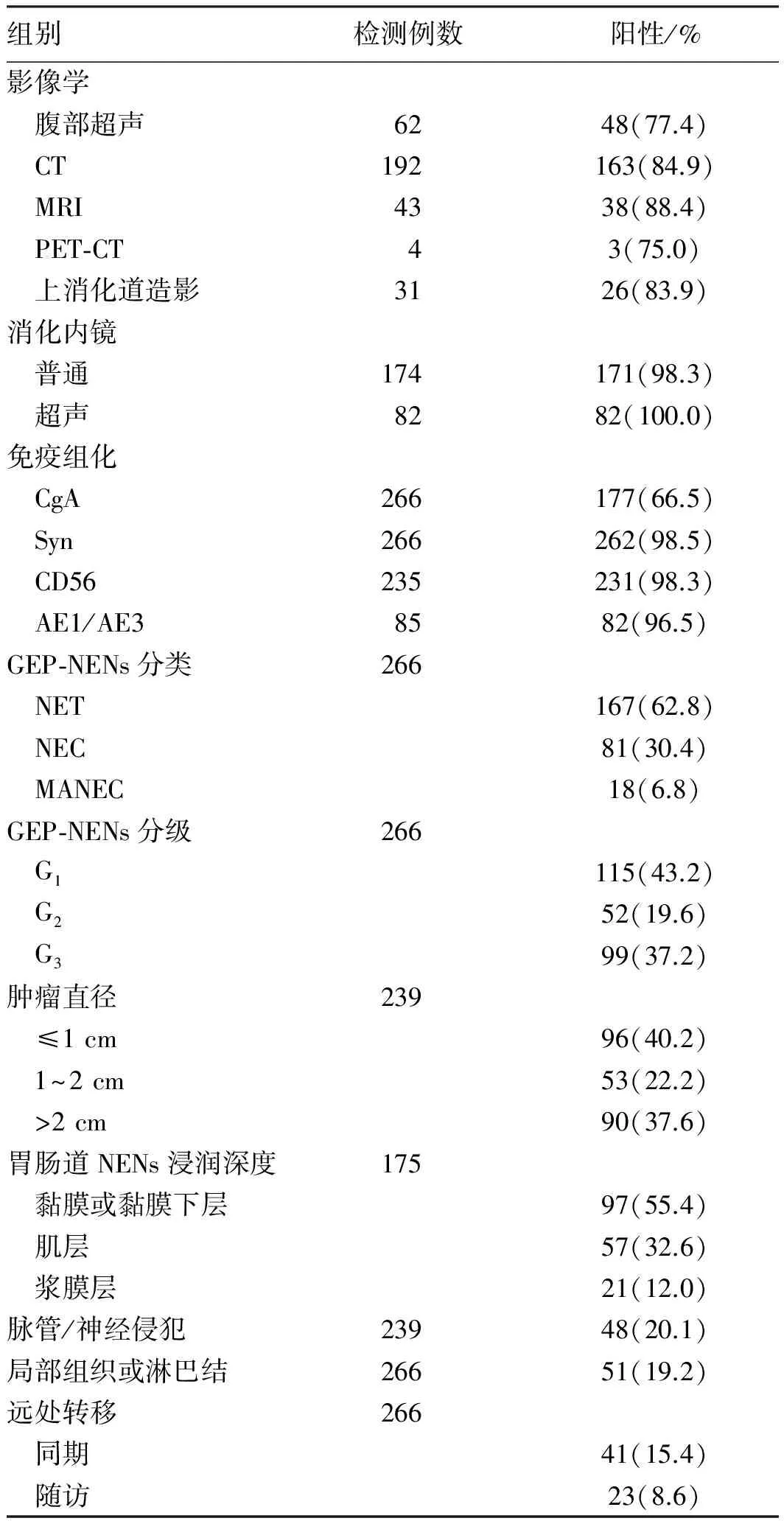
表1 266例GEP-NENs患者影像学、内镜及免疫组化特征Tab 1 Characteristics of image, endoscopy and immunohisto-chemistry in 266 patients with GEP-NENs
注:NET:神经内分泌瘤(neumendocrine tumor);NEC:神经内分泌癌(neuroendocrine carcinoma);MANEC:混合性腺神经内分泌癌(mixed adenoneuroendocrine carcinoma)。
2.3病理特征266例患者均经手术或活检获得组织病理学诊断。病灶的原发部位见图1,胰腺(71例,26.7%)是最常见的发病部位,其次为直肠65例(24.4%)和胃65例(24.4%)。病理报告内容包括GEP-NENs的分类、分级(见图2A~2C)、免疫组化(见图2D~2F)、肿瘤直径、浸润深度、局部淋巴结转移及周围组织侵犯情况等(见表1)。239例记录了肿瘤的大小,直径为0.2~9.0 cm。266例患者中,发生同期远处转移者41例(15.4%),其中肝27例、腹腔3例,胰腺3例,门静脉2例,脾1例,肝、腹腔2例,肝、肺1例,肝、骨1例,纵隔、腹腔和肺多处转移1例。随访期间出现远处转移23例(8.6%),其中肝11例,肝、腹腔3例,骨3例,腹腔2例,胰腺1例,肺、纵膈1例,肝、腹腔、骨多处转移1例,肝、脑、腹腔多处转移1例。肝脏(47例,17.7%)是最常见的远处转移部位,其次是腹腔(13例,4.9%)。
266例GEP-NENs患者中,不同的原发部位其病理分级分布有所不同(见图3),其中21例食管和10例胆道NENs均为G3级,大多数胃NENs(67.7%,44/65)为G3级;大多数胰腺(84.5%,60/71)、直肠(96.9%,63/65)、十二指肠(71.4%,15/21)及阑尾(75.0%,3/4)为NET G1或G2级。
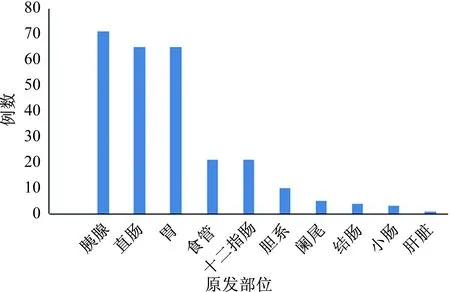
图1 266例GEP-NENs患者的原发部位分布Fig 1 Distribution of the primary anatomic sites of patients with GEP-NENs

图2 不同病理分级的镜下特点(A、B、C)(HE 100×)及免疫组织化学染色(D、E、F)(100×)A:G1;B:G2;C:G3;D:CgA(+);E:Syn(+);F:AE1/AE3(+) Fig 2 Microscopic features of different pathological grades (A, B, C) (HE staining, 100×) and immunohistochemical staining (D, E, F)A: G1; B: G2; C: G3; D: CgA(+); E: Syn(+); F: AE1/AE3(+)
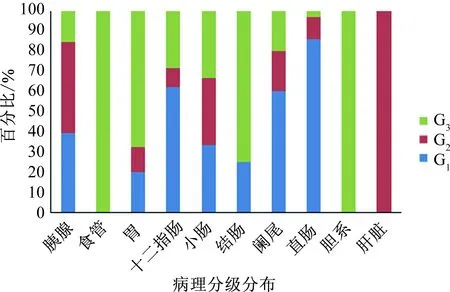
图3 266例GEP-NENs患者的病理分级分布Fig 3 Distribution of pathological grades of patients with GEP-NENs
单因素Logistic分析显示,除发病部位以外,患者性别、年龄及肿瘤大小、分级和分类与转移相关(P<0.05)(见表2)。多因素Logistic回归分析进一步显示,肿瘤的分级、分类及肿瘤直径是预测肿瘤发生转移的独立危险因素(P<0.05)(见表3)。
2.4治疗266例GEP-NENs患者中,外科手术治疗159例(59.8%,159/266),其中根治性手术155例,姑息性手术4例。内镜下微创手术80例(30.1%,80/266),包括ESD和EMR,其中直肠56例(70.0%,56/80)、胃14例(17.5%,14/80)、十二指肠10例(12.5%,10/80)。35例外科手术后和16例晚期未行手术的患者接受化疗,以顺铂联合依托泊苷或多西他赛为主。23例于术中或单纯碘粒子植入治疗。6例因经济原因仅给予支持治疗。1例胰腺伴肝转移行肝动脉栓塞术。
2.5随访及预后235例(88.3%,235/266)GEP-NENs患者成功随访,随访时间为疾病确诊至2017年11月,为6~67个月。随访期间,235例患者中,共44例死亡,其中G1级无死亡,G2级死亡4例(1例因术中大量失血死亡,3例因发生远处转移死亡),G3级死亡40例,且均死于本病恶化或复发转移。由于随访时间短及NET死亡数极少,无法准确获得总体的中位生存时间。Kaplan-Meier法评估266例GEP-NENs患者的1、3、5年总体累积生存率分别为87.4%、79.7%、65.2%。单因素Log-rank检验分析显示,患者的年龄、肿瘤发病部位、大小、分级、脉管/神经侵犯、远处转移与GEP-NENs患者预后显著相关(P<0.05);性别与GEP-NENs患者预后无明显相关性(P=0.054)(见表4)。进一步COX回归分析,年龄(HR=4.170,95%CI:1.253~13.874)及转移(HR=12.014,95%CI:1.155~124.961)是评估GEP-NENs患者预后的独立危险因素(见表5)。
3 讨论
GEP-NENs在临床上虽然少见,但在消化系统肿瘤中位居第二,且发病率在近年来呈逐渐上升趋势[1,5]。目前国内关于GEP-NENs的报道多为小样本研究,缺乏大型的流行病学调查。本研究266例GEP-NENs患者中,男女比例为1.6∶1,男性多见,与国内文献报道基本一致[3],但来自美国SEER的流行病学数据显示[1],女性发病高于男性,这可能与地区、种族以及本研究样本量小有关,有待国内学者扩大样本量进一步研究。GEP-NENs可发生于消化系统的任何部位,但其最常见的发病部位,不同国家的数据报道存在差异。欧美国家以小肠、直肠、胰腺最常见[1,6],而来自韩国、日本及国内研究数据显示[7-9],直肠和胰腺为最常见发病部位,而小肠所占比例<10.0%。本研究266例患者中,排在前3位的是胰腺、直肠和胃,分别占26.7%、24.4%和24.4%,而小肠所占比例很低(1.1%),与亚太地区的报道基本相符,与西方的数据明显不同,这可能与种族、地区有关。
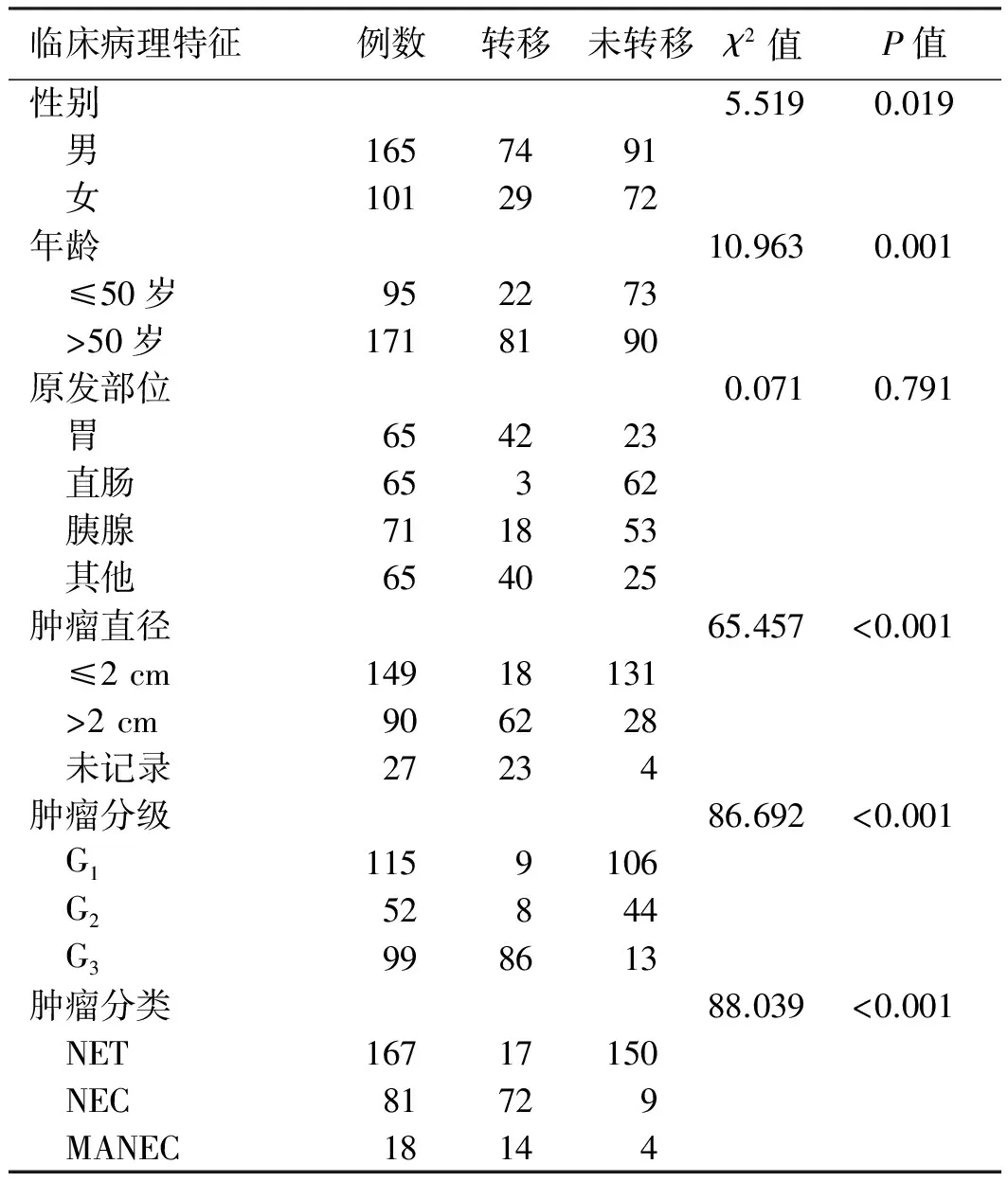
表2 影响266例GEP-NENs患者转移的单因素分析
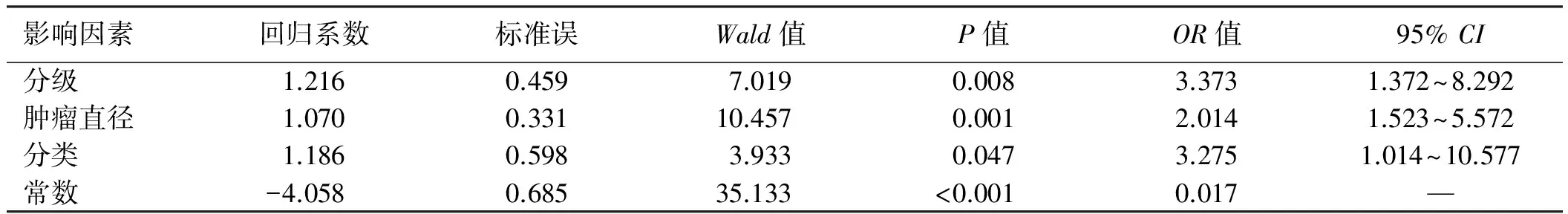
表3 影响266例GEP-NENs患者转移的多因素Logistic回归分析Tab 3 Multivariate logistic regression analysis of metastasis-related risk factors for 266 patients with GEP-NENs
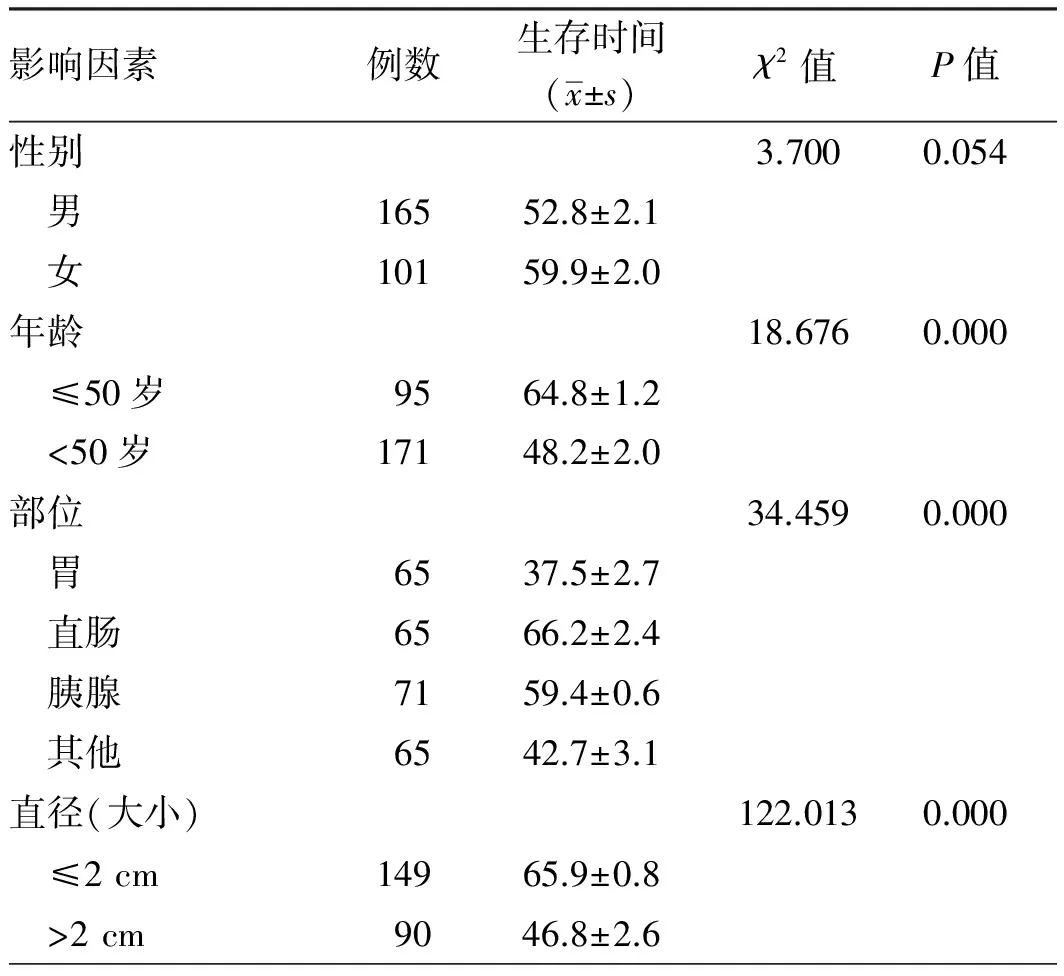
表4 影响266例GEP-NENs患者生存时间的单因素分析
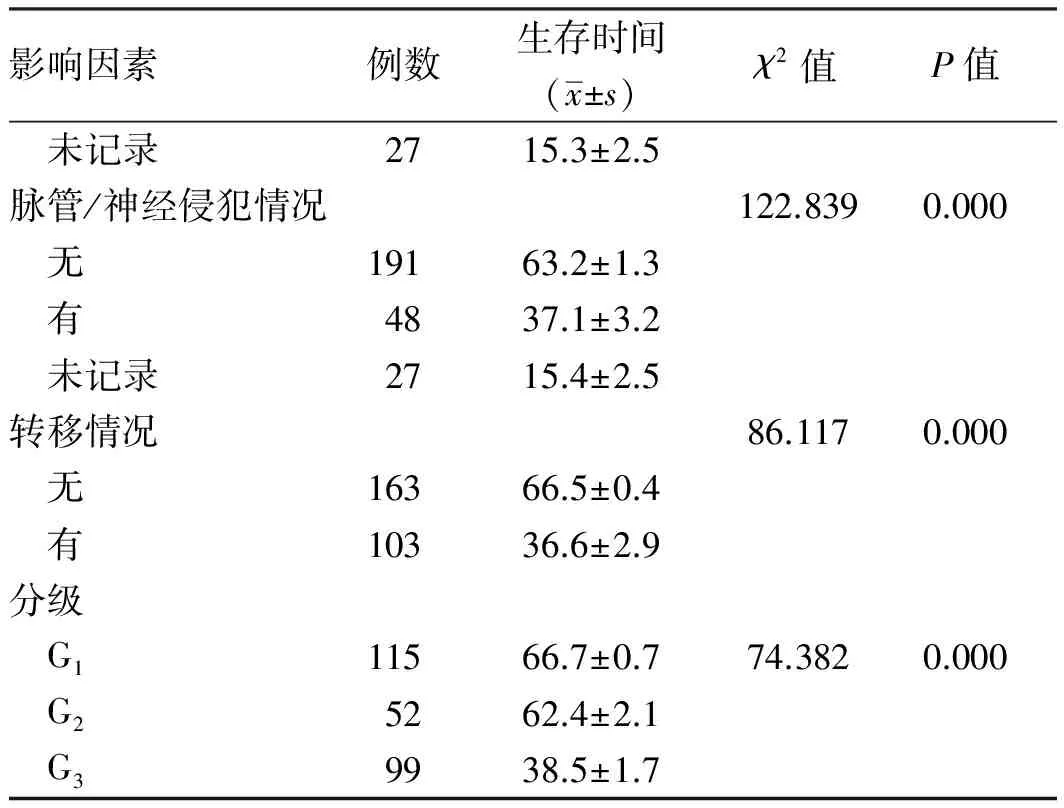
续表4

表5 影响266例GEP-NENs患者预后的COX比例风险模型分析
GEP-NENs根据肿瘤有无特异性激素分泌及引起的相关临床特征性表现,可分为功能性和无功能性[10]。本研究中,无功能性GEP-NENs占多数,临床表现多样且无特异性,可误诊或延长本病诊治时间。功能性GEP-NENs共32例,均为胰岛细胞瘤,表现为低血糖相关症状。本研究中无1例表现为类癌综合征,此与国内数据报道一致[11-12];而西方国家报道类癌的发生率为23%~40%[13],可能与西方国家GEP-NENs好发于空回肠有关。上述数据表明,功能性GEP-NENs主要发生于胰腺,无功能性仍以胃肠道为主。
早期无功能性GEP-NENs临床表现缺乏特异性,影像学和内镜检查是主要的诊断手段。CT、MRI、B超和EUS等可提供67.9%~89.2%的病灶检出率[14],但特异性相对较差,常用于疾病的鉴别、进展情况和预后的评估。胃肠道NENs内镜下缺乏特异性表现,但通过内镜可获得直观的占位性病变,本研究中经内镜检出胃肠道NENs占98.3%。EUS可判断肿瘤浸润深度,以及与周围组织、邻近血管的关系,评估内镜下微创手术的可行性。生长抑素受体显像和PET-CT均具有较高灵敏度和特异度,但生长抑素受体显像对于直径<1 cm肿瘤的漏诊率达50%,18F-FDG标记的PET-CT对分化好的肿瘤敏感性低[15]。因此,需要联合应用上述检查以协助诊疗。GEP-NENs的确诊依赖于病理。CgA、Syn是最常用的肿瘤标记物,有文献[16]报道,CgA阳性率70.6%,Syn阳性率94.1%,70%~90%的GEP-NENs可出现CgA、Syn的升高。本研究中CgA阳性率66.5%、Syn阳性率98.5%,与文献报道一致。
文献[17]显示,GEP-NENs的发病部位与病理分级存在一定的关联。大部分原发于食管及胆囊的肿瘤为分化差的NEC,而原发于胃、肠和胰腺的多为分化良好的NET(G1或G2)[18-21]。但是相比其他胃肠道部位,结肠NENs中分化差的NEC更常见。本研究中,原发于胆系和食管NENs均为分化差的NEC,原发于胰腺和直肠多为分化良好的NET。
本研究中,GEP-NENs远处转移发生率为24.0%,与国内数据报道(10.4%~23.0%)基本一致[22-24],但低于欧美国家报道的数据,其发生率高达44.0%[25-26]。肝脏是转移性肿瘤最常见的部位,在临床上发现肝占位病变时需警惕GEP-NENs可能。单因素分析显示,GEP-NENs是否转移与患者的性别、年龄、肿瘤原发部位、肿瘤大小、分级和分类均有关。进一步多因素Logistic回归分析显示,肿瘤大小、分级和分类是评估肿瘤发生转移的独立预测因子。另外,本研究中胰腺NENs的转移率为25.3%,明显低于国外的数据报道(69.2%)[27]。这可能与以下两方面有关:第一,无功能性胰腺NENs缺乏特异性症状导致早期诊断率低和部分漏诊;第二,样本量差异所致。
目前,国内关于GEP-NENs治疗方案的选择仍然存在很多争议。手术切除是GEP-NENs治疗的首选方法,即使发生淋巴结或远处转移,也应尽可能切除原发灶、转移灶及清扫淋巴结。本研究中共239例行手术治疗,手术方式包括根治术手术、姑息手术和微创内镜。化疗是不能手术、低分化或转移性GEP-NENs的首选治疗选择。顺铂联合依托泊苷是目前GEP-NENs使用最广泛的化疗方案[28]。其他治疗方法包括生物治疗、靶向治疗和肽受体放射性同位素治疗,可延长患者的生存时间[16]。本研究中共51例接受了化疗,主要化疗方案为顺铂联合依托泊苷或多西他赛。GEP-NENs具有潜在的恶性可能,应长期随访[16]。本研究中患者5年累积生存率为65.2%,与欧美统计数据一致(50%~75%)[25,29]。单因素分析发现,年龄>55岁、肿瘤直径>2 cm、病理分级G3、胃NENs、肿瘤转移及脉管/神经侵犯与GEP-NENs患者预后显著相关。多因素COX回归分析发现,年龄及转移是GEP-NENs预后差的独立危险因素。
综上所述,GEP-NENs以胰腺NENs最为常见,且功能性以胰岛细胞瘤多见。无功能性GEP-NENs早期症状隐匿,易造成漏诊、误诊,延长确诊周期。食管和胆系NENs多为G3级、肿瘤分级和肿瘤大小是预测转移的独立危险因素,年龄>50岁及发生转移可明显缩短患者的生存时间。因此,提高临床医师对本病临床特征、影像学以及消化内镜作为胃肠NENs早期筛查手段的进一步认识,有助于早期诊断,改善患者的预后。
[1] DASARI A, SHEN C, HALPERIN D, et al. Trends in the incidence,prevalence,and survival outcomes in patients with neuroendocrine tumors in the United States [J]. JAMA Oncol, 2017, 3(10): 1335-1342. DOI: 10.1001/jamaoncol.2017.0589.
[2] MODLIN I M, LYE K D, KIDD M. A 5-decade analysis of 13,715 carcinoid tumors [J]. Cancer, 2003, 97(4): 934-959. DOI: 10.1002/cncr.11105.
[3] GUO L J, WANG C H, TANG C W. Epidemiological features of gastroenteropancreatic neuroendocrine tumors in Chengdu city with a population of 14 million based on data from a single institution [J]. Asia Pac J Clin Oncol, 2016, 12(3): 284-288. DOI: 10.1111/ajco.12498.
[4] BOSMAN F T, CARNEIRO F, HRUBAN R H, et al. WHO classification of tumours of the digestive system [M]. Lyon: IARC press, 2010: 13-14.
[5] FRAENKEL M, KIM M, FAGGIANO A, et al. Incidence of gastroenteropancreatic neuroendocrine tumours:a systematic review of the literature [J]. Endocr Relat Cancer, 2014, 21(3): R153-R163. DOI: 10.1530/ERC-13-0125.
[6] HAUSO O, GUSTAFSSON B I, KIDD M, et al. Neuroendocrine tumor epidemiology [J]. Cancer, 2008, 113(10): 2655-2664. DOI: 10.1002/cncr.23883.
[7] FANG C, WANG W, ZHANG Y, et al. Clinicopathologic characteristics and prognosis of gastroenteropancreatic neuroendocrine neoplasms: a multicenter study in South China [J]. Chin J Cancer, 2017, 36(1): 51. DOI: 10.1186/s40880-017-0218-3.
[8] LIM C H, LEE I S, JUN B Y, et al. Incidence and clinical characteristics of gastroenteropancreatic neuroendocrine tumor in Korea: a single-center experience [J]. Korean J Intern Med, 2017, 32(3): 452. DOI: 10.3904/kjim.2015.232.
[9] ITO T, SASANO H, TANAKA M, et al. Epidemiological study of gastroenteropancreatic neuroendocrine tumors in Japan [J]. J Gastroenterol, 2010, 45(2): 234-243. DOI: 10.1007/s00535-009-0194-8.
[10] ITO T, IGARASHI H, NAKAMURA K, et al. Epidemiological trends of pancreatic and gastrointestinal neuroendocrine tumors in Japan:a nationwide survey analysis [J]. J Gastroenterol, 2015, 50(1): 58-64. DOI: 10.1007/s00535-014-0934-2.
[11] ZHANG X, MA L, BAO H, et al. Clinical, pathological and prognostic characteristics of gastroenteropancreatic neuroendocrine neoplasms in China:a retrospective study [J]. BMC Endocr Disord, 2014, 14(1): 54. DOI: 10.1186/1472-6823-14-54.
[12] JIAO X, LI Y, WANG H, et al. Clinicopathological features and survival analysis of gastroenteropancreatic neuroendocrine neoplasms: a retrospective study in a single center of China [J]. Chin J Cancer Res, 2015, 27(3): 258-266. DOI: 10.3978/j.issn.1000-9604.2015.06.04.
[13] PLOECKINGER U, KLOEPPEL G, WIEDENMANN B, et al. The German NET-Registry: an audit on the diagnosis and therapy of neuroendocrine tumors [J]. Neuroendocrinology, 2009, 90(4): 349-363. DOI: 10.1159/000242109.
[14] SCHOTT M, KLOPPEL G, RAFFEL A, et al. Neuroendocrine neoplasms of the gastrointestinal tract [J]. Dtsch Arztebl Int, 2011, 108(18): 305-312. DOI: 10.3238/arztebl.2011.0305.
[15] 徐建明, 梁后杰, 秦叔逵, 等. 中国胃肠胰神经内分泌肿瘤专家共识(2016年版)[J]. 临床肿瘤学杂志, 2016, 21(10): 927-946.
[16] 王沧海. 消化系神经内分泌肿瘤的临床特点[J]. 世界华人消化杂志, 2008, 16(24): 2788-2791.
WANG C H. Clinical features of neuroendocrine tumors in digestive system [J]. Word Chinese Journal of Digestology, 2008, 16(24): 2788-2791.
[17] FITZGERALD T L, MOSQUERA C, LEA C S, et al. Primary site predicts grade for gastroenteropancreatic neuroendocrine tumors [J]. Am Surg, 2017, 83(7): 799-803.
[18] LEE K J, CHO J H, LEE S H, et al. Clinicopathological characteristics of biliary neuroendocrine neoplasms: a multicenter study [J]. Scand J Gastroenterol, 2017, 52(4): 437-441. DOI: 10.1080/00365521.2016.1261938.
[19] TUSTUMI F, TAKEDAF R, UEMAR H, et al. Primary neuroendocrine neoplasm of the esophagus-Report of 14 cases from a single institute and review of the literature [J]. Arq Gastroenterol, 2017, 54(1): 4-10. DOI: 10.1590/S0004-2803.2017v54n1-01.
[20] ELTAWIL K M, GUSTAFSSON B I, KIDD M, et al. Neuroendocrine tumors of the gallbladder: an evaluation and reassessment of management strategy [J]. J Clin Gastroenterol, 2010, 44(10): 687-695. DOI: 10.1097/MCG.0b013e3181d7a6d4.
[21] 邱旭东, 刘猛, 刘青, 等. 903例神经内分泌肿瘤发病部位与病理特征分析[J]. 中华胃肠外科杂志, 2017, 20(9): 993-996. DOI: 10.3760/cma.j.issn.1671-0274.2017.09.008.
QIU X D, LIU M, LIU Q, et al. Analysis of primary site and pathology on 903 patients with neuroendocrine neoplasms [J]. Chin J Gastrointest Surg, 2017, 20(9): 993-996. DOI: 10.3760/cma.j.issn.1671-0274.2017.09.008.
[22] WANG Y, LIN Y, XUE L, et al. Relationship between clinical characteristics and survival of gastroenteropancreatic neuroendocrine neoplasms: A single-institution analysis (1995-2012) in South China [J]. BMC Endocr Disord, 2012, 12(1): 30. DOI: 10.1186/1472-6823-12-30.
[23] JIAO X, LI Y, WANG H, et al. Clinicopathological features and survival analysis of gastroenteropancreatic neuroendocrine neoplasms:a retrospective study in a single center of China [J]. Chin J Cancer Res, 2015, 27(3): 258-266. DOI: 10.3978/j.issn.1000-9604.2015.06.04.
[24] ZENG Y J, LIU L, WU H, et al. Clinicopathological features and prognosis of gastroenteropancreatic neuroendocrine tumors:analysis from a single-institution [J]. Asian Pac J Cancer Prev, 2013, 14(10): 5775-5781.
[25] GARCIA-CARBONERO R, CAPDEVILA J, CRESPO-HERRERO G, et al. Incidence, patterns of care and prognostic factors for outcome of gastroenteropancreatic neuroendocrine tumors (GEP-NETs):results from the National Cancer Registry of Spain (RGETNE) [J]. Ann Oncol, 2010, 21(9): 1794-1803. DOI: 10.1093/annonc/mdq022.
[26] CETINKAYA R B, AAGNERS B, THIIS-EVENSEN E, et al. Trends in incidence of neuroendocrine neoplasms in Norway: a report of 16 075 cases from 1993 through 2010 [J]. Neuroendocrinology, 2017, 104(1): 1-10. DOI: 10.1159/000442207.
[27] PANZUTO F, NASONI S, FALCONI M, et al. Prognostic factors and survival in endocrine tumor patients:comparison between gastrointestinal and pancreatic localization [J]. Endocr Relat Cancer, 2005, 12(4): 1083-1092. DOI: 10.1677/erc.1.01017.
[28] GARCIA-CARBONERO R, JIMENEZ-FONSECA P, TEULE A, et al. SEOM clinical guidelines for the diagnosis and treatment of gastroenteropancreatic neuroendocrine neoplasms (GEP-NENs) 2014 [J]. Clin Transl Oncol, 2014, 16(12): 1025-1034. DOI: 10.1007/s12094-014-1214-6.
[29] YAO J C, HASSAN M, PHAN A, et al. One hundred years after “carcinoid”:epidemiology of and prognostic factors for neuroendocrine tumors in 35, 825 cases in the United States [J]. J Clin Oncol, 2008, 26(18): 3063-3072. DOI: 10.1200/JCO.2007.15.4377.

