美丽马醉木种质资源遗传多样性的RAPD分析
陈海云,吴涛,周筑,白平,李红,张学星
(云南省林业科学院,云南 昆明650201)
美丽马醉木(Pierisformosa)为杜鹃花科(Ericaceae)马醉木属(Pieris)常绿灌木或小乔木,生于海拔1 500-2 800m的常绿阔叶林下、松林或林缘灌丛中,其株形优美,叶色多彩,花序绚丽多姿,十分迷人。在欧洲、日本广泛用于室内盆栽和小庭院观赏。此物种耐寒、抗风、抗污染,萌发力强,为园林绿化极佳的观叶性常绿灌木,目前正被引种驯化并在园林绿化中进行推广应用[1-3]。随着人们欣赏水平的提高,如何选育出叶型、色彩等异质类型(品种),以满足园林绿化市场需求,将是园林植物选育的发展趋势。因此,开展美丽马醉木种质资源的遗传多样性研究,将有助于美丽马醉木特异种质资源的选择和定向培育。
分子标记是种质资源和遗传育种研究中一种有效的研究方法和辅助育种手段。利用分子标记技术研究物种的遗传多样性、确定亲缘关系远近及鉴定品种等工作已相当成熟,目前得到广泛应用[4-5]。随机扩增多态性(Randomly amplified polymorphic DNA,RAPD)分子标记手段是种质资源和遗传育种研究中一个简便而有效的工具,其技术程序简单快捷,且无需事先知晓基因(组)核酸序列信息,无种属特异性,有海量的引物可供利用,能产生足够的多态性,可以鉴别物种之间和种群之间的基因组差异,也可区分个体之间的差异[6-8]。美丽马醉木DNA水平的遗传多样性研究尚未见报道,鉴于其核酸序列信息匮乏的现状,本项研究旨在应用无需进行引物设计的RAPD方法,通过对美丽马醉木混合种源实生播种的不同单株个体间的RAPD分析,以期获得稳定高效的引物系列,了解其物种水平上的遗传多样性水平,为进一步人工杂交育种和新品种选育提供分子标记方面的数据和技术方法。
1 材料与方法
1.1 试验材料
供试材料为64棵美丽马醉木的单株叶样,其来源于云南楚雄、兰坪、师宗等地采集的混合种子并于云南省楚雄州禄丰县仁兴镇大平坝基地所培育的实生播种苗,株龄为3年生。2016年11月采集其生长正常、无病虫害的当年生枝条上的叶片,置于采样袋中带回实验室。供试材料的叶片大小、叶色及花序颜色等具体信息见表1。
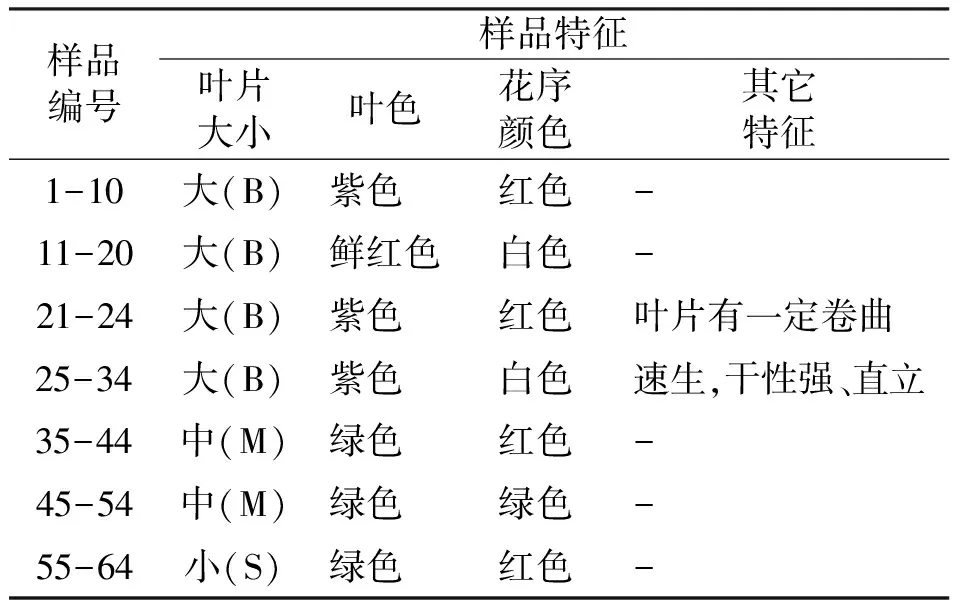
表1 64份美丽马醉木样品的基本信息Tab.1 Sample information of 64 individuals in Pieris formosa
1.2 研究方法
1.2.1 总DNA制备
采用植物基因组DNA提取试剂盒(天更公司生产)进行美丽马醉木叶片中的总DNA提取。称取0.1g鲜叶样品,置于1.5mL离心管中,加入直径为5mm钢珠,液氮冷冻后用球磨仪振荡研磨1.5min;在离心管中加入400μL缓冲液LP1和5μL的RNaseA,旋涡震荡1min,室温静置10min;加入130μL的缓冲液LP2,充分混匀,旋涡震荡1min;12 000rpm离心5min,将上清液移至新的离心管中;加入900μL的缓冲液LP3,充分震荡混匀15s;将所得溶液加入吸附柱中后过滤并舍弃;加入600μL的漂洗液PW对吸附柱进行漂洗,12 000rpm离心30s,倒掉废液,漂洗2次;将吸附柱放回收集管中,12 000rpm离心2min,倒掉废液,将吸附柱置于室温或超净工作台放置30min,以彻底晾干吸附柱中残余的漂洗液;将吸附柱加入1个干净的离心管中,向吸附柱中间位置悬空滴加80μL的洗脱缓冲液TE,室温放置5min,12 000rpm离心2min,将溶液收集到离心管中。取3μL经0.8%琼脂糖凝胶电泳检测,稀释成浓度为20ng/μL的工作液,放入-20℃冰箱保存。
1.2.2 RAPD引物筛选
RAPD引物由生工(北京)合成。用Biometra PCR扩增仪进行扩增,扩增产物用2.0%的琼脂糖凝胶电泳,以D2000为标记,EB染色10min,用百晶凝胶成像仪进行拍照和分析。RAPD引物分别为A、B、C、D、E、F、G、H、M、N共10套,每套20条,共200条。随机挑选8份样品的DNA,分别取30μL混合为引物筛选所用的DNA模板。首先用混合DNA模板对200条RAPD引物进行筛选,选出扩增结果稳定、条带清晰的引物;然后随机选取12个样品单株的DNA,检测初筛出的引物的多态性,以具有多态性的引物用于后续64份样品的遗传多样性分析。
1.2.3 PCR反应体系及程序
20μL的PCR反应体系中,含10μL的2×Es Taq MasterMix(康为世纪,含染料),9μL的引物(5μmol/L),1μL的DNA模板。PCR扩增程序为:94℃预变性2min;94℃变性30s,40℃退火30s,72℃延伸30s,10个循环,每个循环退火温度下降1℃;94℃变性30s,40℃退火30s,72℃延伸30s,30个循环;72℃完全延伸5min,4℃保存。PCR扩增产物在2%的琼脂糖凝胶上电泳分离,经溴化乙锭(EB)染色,通过凝胶成像仪(百晶)拍摄图像并保存。
1.2.4 数据处理与统计分析
根据RAPD-PCR扩增产物电泳图谱同一位置上条带的有无进行统计,有带(包括弱带)的记为“1”,无带的记为“0”,得到所有位点的二元数据构成的数据矩阵用于分析。采用POPGENE 1.32软件[9]分析遗传变异各项参数,包括美丽马醉木物种水平的多态位百分率(PPB)、Shannon多样性信息指数(I)、Nei’S基因多样度指数(H)、平均每个位点上的观察等位基因数(Na)、平均每个位点的有效等位基因数(Ne)。根据64个样本间的遗传相似性系数,用NTSYSpc-2.11e软件,按不加权成对算术平均法(UPGMA)建立亲缘关系聚类分枝树状图。
2 结果与分析
2.1 RAPD引物筛选结果
共选用200条RAPD随机引物,用混合DNA模板初筛后获得扩增结果稳定、产物条带清晰的引物47条。图1展示了混合DNA模板对24条引物的RAPD-PCR扩增产物电泳结果;经12份样品的DNA模板复筛后,其中16条引物具有多态性(表2),用于后续64份美丽马醉木样品的PCR扩增和分析。图2展示了引物A19对30份美丽马醉木样品的RAPD-PCR扩增产物电泳结果。
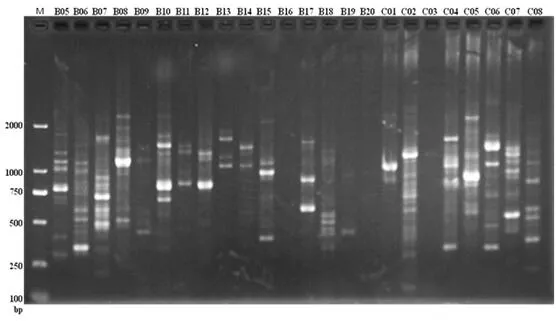
图1 混合DNA模板对24条引物的RAPD-PCR扩增产物电泳结果Fig.1 RAPD-PCR patterns of 24 primers in mixed DNA template
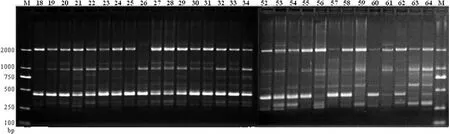
图2 引物A19对部分美丽马醉木样品的扩增产物电泳结果Fig.2 Electrophoresis results of PCR products from 30 individuals of Pieris formosa with primer A19
2.2 RAPD-PCR扩增条带的多态性分析
利用筛选出的16条RAPD引物对美丽马醉木64份单株样品进行PCR扩增,所得片段大小在150-2 100bp,每个引物的扩增条带数和多态性条带数见表2。扩增条带总数为221条,其中多态性位点192个,平均每个引物可扩增13.8条带,其中多态性带平均为12.0条。多态性位点百分率(PPB)为86.88%。其中,引物A11、A19、B10、N10所获得的条带均为多态性条带,多态性比例为100%;引物N09所获得的条带多态性比例最低,为63.64%;引物A11、N10所获得的总条带数最多,均为18条带;引物B15获得的总条带数最少,为7条。
2.3 美丽马醉木的遗传多样性和样品间的聚类
分析
美丽马醉木大、中、小叶型资源间,中叶型资源的多态性位点百分率(PPB)最高(68.33%),其次为大叶(59.73%),小叶资源的PPB最低(42.53%)。在物种水平上,多态性位点百分率(PPB)为86.88%,平均每个位点的有效等位基因数(Ne)为1.434 2,Nei’s基因多样度(H)为0.259 1,总的基因多样度(Ht)为0.256 6,Shannon’s信息指数(I)为0.395 4,大、中、小叶型资源间的基因流(Nm)为1.315 5。
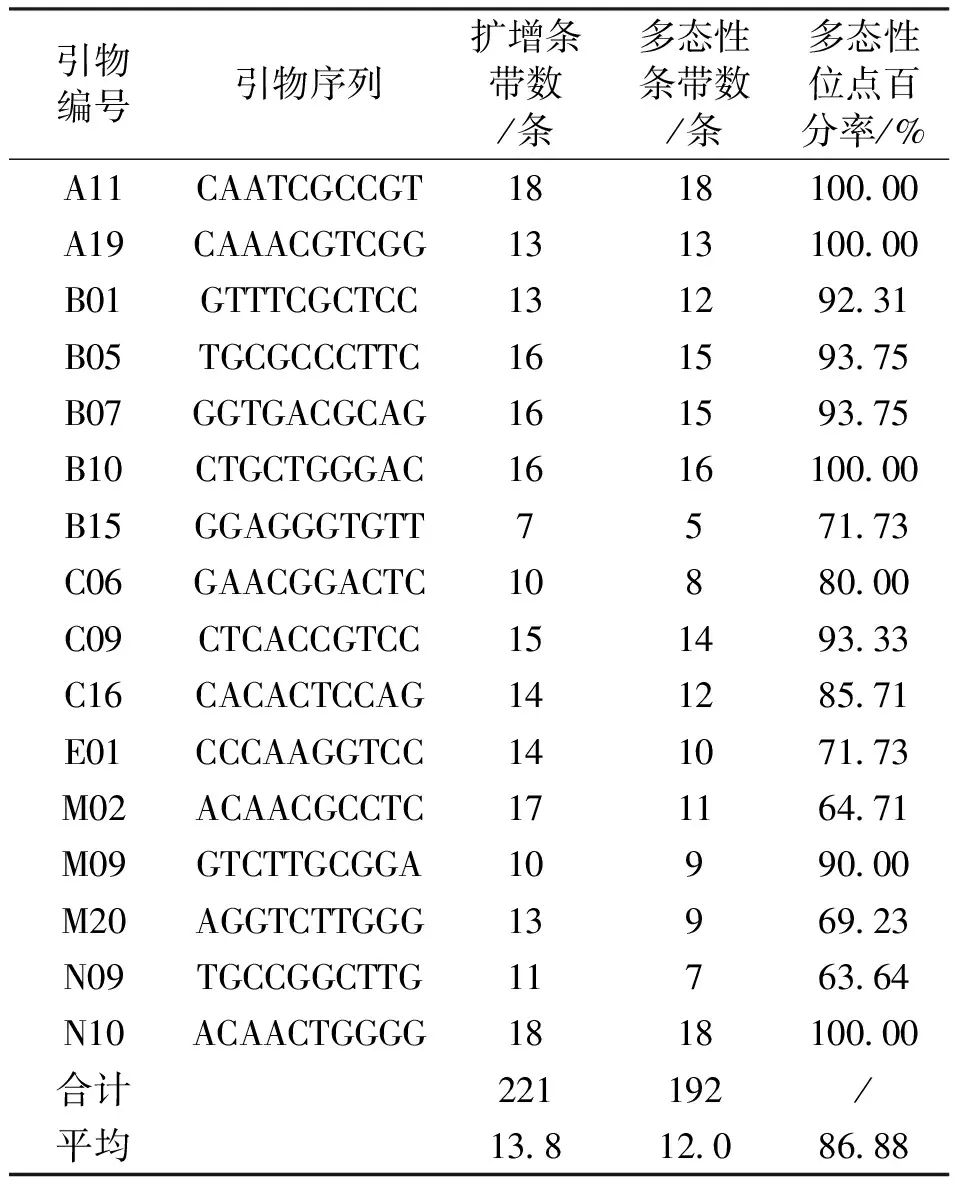
表2 RAPD引物信息及其扩增结果Tab.2 The summary of RAPD primer sequences and their amplification results
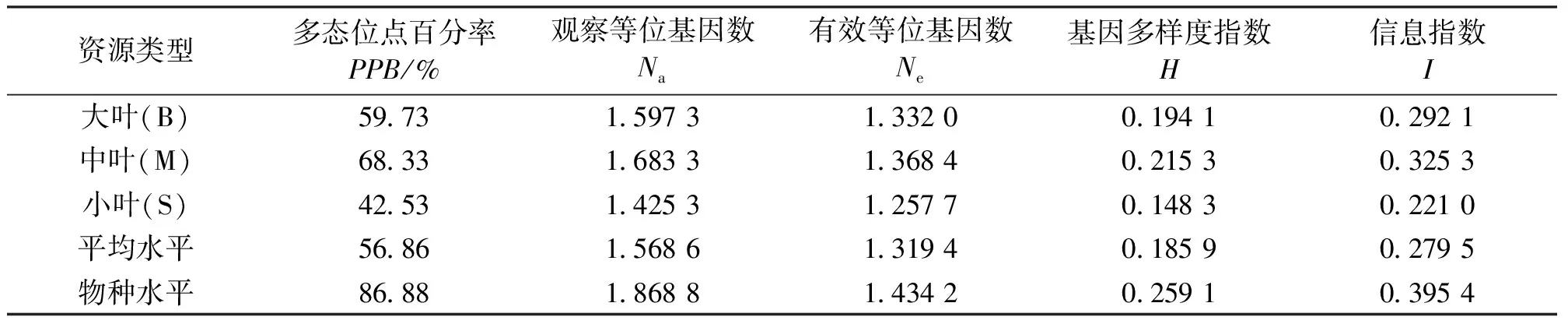
表3 RAPD标记的大、中、小叶美丽马醉木资源的遗传多样性参数Tab.3 Statistical analysis of genetic variation by RAPD markers from big,middle and small leaf-type individuals in Pieris formosa
供试样品个体间RAPD片段的共享性(即遗传一致度或遗传相似系数)能够在一定程度上反映个体间DNA水平的差异,根据16条引物在64个样品中的扩增结果,算出各样品间的遗传相似系数,结果表明,64个美丽马醉木样品间的遗传相似系数为0.36-0.92,平均为0.64。其中,27号和28号均为大叶样本,两者之间的遗传相似系数最大,表明其在64份资源之间的亲缘关系最近;26号(大叶)和52号(小叶)之间的遗传相似系数最小,表明其在64份资源之间的亲缘关系最远。应用NTSYSpc-2.11e软件对原始数据矩阵分析后获得相似系数矩阵,用UPGMA法进行遗传相似性聚类分析,得到美丽马醉木64份供试样本的遗传相似性聚类分析树状图(图3)。
供试材料中,1-34号样本全部为大叶片,35-54号为中叶片,55-64号为小叶片。从聚类图中可以看出,供试样本的相似系数在0.36-0.92之间。当相似系数的阈值为0.36时,可将64个供试样本分为2个类群:一个类群(简称类群1)包含1-34号的全部样本,即大叶片的样本全部分在一个类群里;另一个类群(简称类群2)包含35-64号的全部样本,即中叶片和小叶片的样本全部分在一个类群里。当阈值为0.58时,可将类群1分为2个组(标记为Ⅰ和Ⅱ),其中Ⅱ组里只包含样本16号。类群2分为3个组(分别标记为Ⅲ、Ⅳ、Ⅴ),其中Ⅳ组里只包含样本51号;Ⅲ组里包含中叶片的35-50号;Ⅴ组里包含全部小叶片供试样本55-64号,另外还包含中叶片的52号、53号和54号。
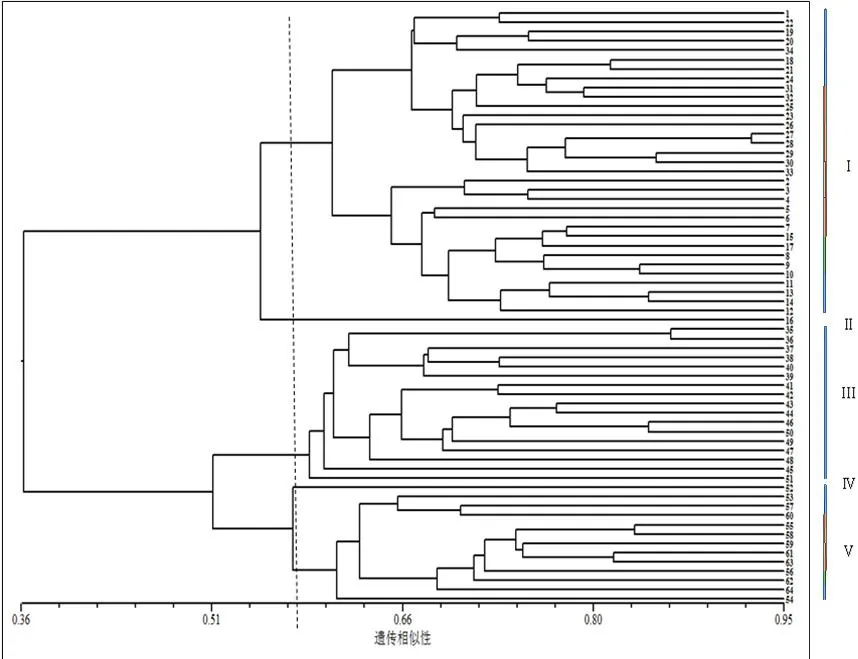
图3 美丽马醉木64份样品的遗传相似性系数的聚类结果Fig.3 Dendrogram of 64 individuals in Pieris formosa based genetic similarity coefficient
3 结论与讨论
运用DNA分子标记技术在内的分子生物学方法探讨动植物的遗传多样性,在近20年来已经得到广泛应用[10]。由于RAPD技术具有可供选择的标记数量多、无器官和发育时期的特异性,可客观地揭示实验材料之间的真实差异等优点,已被广泛应用于生物的系统进化研究[11]。汪小全等[12]认为,在属、种内和群体内,特定大小的RAPD片段具有序列同源和遗传相似性的假设是普遍有效的,RAPD技术在植物种属间关系的研究方面也显示出一定的潜力。刘春林等[13]认为,为了增加实验结果的可靠性,从DNA提取到RAPD-PCR的扩增实验尽量是同一个人员来操作,并且对实验过程采用同一反应条件并不断进行重复,直至结果稳定。
研究筛选得到的16条引物中,引物A11、B10、N10的扩增条带分别为18条、16条和18条,且多态性较好,这说明研究材料具有较高的遗传多样性和丰富的遗传基础,也表明这3个引物的筛选效率较高。黄雯等[14]在枳椇(Hoveniaacerba)种质资源的RAPD研究中也获得类似结果。在物种水平上,美丽马醉木的多态性位点百分率(PPB)为86.88%,与杜鹃花科的大字杜鹃(Rhododendronschlippenbachin,PPB=86.93%)[15]相近,高于都支杜鹃(R.shanii,PPB=52.17%)[16]和牛皮杜鹃(R.chrysanthum,PPB=42.7%)[17],说明美丽马醉木和杜鹃花科杜鹃属的其它物种的遗传多样性的丰富程度相当。
从聚类结果可以看出,供试样本中的大叶片与小叶片之间的遗传相似系数最小,即亲缘关系最远;供试样本中的中叶片与小叶片之间的遗传相似系数最大,即亲缘关系最近;大叶片和中、小叶片的样本分别聚在不同的类群中,说明它们不仅表型上存在着较大的差异,基因组水平上也可检测出较大的差异。供试样本的遗传相似系数在0.36-0.92之间,说明美丽马醉木的遗传基础较为丰富,具有较为丰富的遗传变异,从而进一步佐证了按照表型对美丽马醉木种质资源进行分类的可行性以及用RAPD技术鉴别美丽马醉木植物亲缘关系的可行性。杨向晖等[18]对枇杷属(Eriobotrya)植物及其近缘属植物亲缘关系的RAPD分析结果也与传统的形态分类学基本一致。
美丽马醉木是一种优良的观叶植物,在云南省有着较为广泛的分布。为了达到更佳的园林景观效果,需要对美丽马醉木的不同类型进行筛选,选出景观效果更佳、品种特性更加稳定的优良特异种质。项目组先从表型上对美丽马醉木表现出来的优异特性进行观测和分析,用叶片的大小把美丽马醉木分为3种类型,又通过RAPD-PCR技术对基因组的总DNA水平进行检测分析,研究结果说明美丽马醉木的遗传基础较为丰富,有着丰富的遗传变异,能够为园林生产上提供更多的优异种质和选择方向。本次实验采用RAPD技术,首次用16条引物对混合种源播种的64个美丽马醉木样本进行了基因组DNA水平上的检测,共获得了192条多态性条带,多态性百分率达86.88%,说明美丽马醉木的供试样本之间遗传基础较广,具有丰富的遗传多样性。遗传相似性聚类结果可将大叶片和中、小叶片两种类型的美丽马醉木样本划分为2个不同的类群。通过对美丽马醉木混合种源实生苗的遗传多样性分析和亲缘关系的确立,有望为进一步优异种质选育工作提供理论依据。
参考文献:
[1]李兴泰.马醉木的种植与养护[J].花木盆景,2011(9):25.
[2]叶香娟,项美淑,周雪飞,等.‘波利乐’马醉木繁殖与管理[J].中国花卉园艺,2011(22):36-38.
[3]陈海云,张学星,白平,等.不同温度对美丽马醉木种子发芽的影响[J].福建林业科技,2015,42(3):119-120.
[4]Sucher N J,Hennel J R,Carles M C.Plant DNA fingerprinting and barcoding - Methods in Molecular Biology[M].New York:Humana Press,2012.
[5]李元龙,王中华.分子标记技术在作物育种中的应用与展望[J].河南师范大学学报(自然科学版),2016,44(3):140-145.
[6]李言,刘延岭,崔翠菊,等.海带种质资源遗传多样性的RAPD分析[J].生物技术通报,2016,32(4):151-158.
[7]李敏,黄龙妹,陈强.RAPD技术筛选麦冬分子鉴定标记的研究[J].浙江工业大学学报,2014,42(5):504-508.
[8]陈海云,宁德鲁,陈少瑜,等.基于RAPD标记的云南23个八角优良无性系的聚类和遗传多样性分析[J].西部林业科学,2013,42(1):53-57.
[9]Yeh F C,Boyle T.Population genetic analysis of co-dominant and dominant markers and quantitative traits[J].Belgian Journal of Botany,1997,129:157.
[10]周延清.DNA分子标记技术在植物研究中的应用[M].北京:化学工业出版社,2005.
[11]汪永庆,徐来祥,张知彬.RAPD技术的标准化问题[J].动物学杂志,2000,35(4):57-60.
[12]汪小全,邹喻苹,张大明,等.RAPD应用于遗传多样性和系统学研究中的问题[J].植物学报,1996,38(12):954-962.
[13]刘春林,官春云,李恂.植物RAPD标记的可靠性研究[J].生物技术通报,1999,15(2):31-34.
[14]黄雯,胡应平,李阿池,等.福建省枳椇种质资源遗传多样性RAPD分析[J].亚热带植物科学,2016,45(3):242-247.
[15]姬文秀,金东淳,李虎林.大字杜鹃种质资源遗传多样性与亲缘关系的RAPD分析[J].东北农业大学学报,2010,41(12):30-33.
[16]赵凯,王德元,张文娟,等.都支杜鹃遗传多样性的ISSR分析[J].植物分类与资源学报,2013,35(5):578-584.
[17]张春影,赵海佟,李美善,等.不同海拔牛皮杜鹃种群遗传多样性的RAPD分析[J].延边大学农学学报,2012,34(1):46-50.
[18]杨向晖,李平,刘成明,等.枇杷属植物及其近缘属植物亲缘关系的RAPD分析[J].果树学报,2009,26(1):55-59.

