不同治疗时期肺结核患者T淋巴细胞亚群的动态变化及临床意义
庞 增 何日东 陈勇军 陈木春
肺结核(pulmonary tuberculosis TB)是目前对人类仍极具挑战性与重大危害性的肺部传染性疾病,长期由结核分枝杆菌引起的肺部感染。WHO估算我国2014年的新发肺结核人数位居全球第三位,仅次于印度和印度尼西亚[1]。随着肺结核新发患者数量逐年增加,对肺结核的预防控制和治疗受到广为关注。研究发现,肺结核的发病机制尚未明确,但免疫低下的人群发病率显著上升,认为机体免疫力与结核病的发生、发展存在极为密切的联系[2]。此外,杜光明[3]的研究发现,结核病的发生、发展和转归与结核菌的数量与毒力有一定关系,同时与宿主细胞的免疫功能有着密不可分的关联。因此,本项目旨在发现的不同治疗期间患者的 T 淋巴细胞亚群变化规律,并对比结核患者与正常健康人群外周血淋巴细胞亚群的差异,从而将这一规律用于患者治疗过程中进行疗效检测以及T淋巴细胞的动态变化,为TB的诊断与治疗提供临床参考依据。
1 资料和方法
1.1 一般资料
选取2016年1月-2017年12月在本院治疗的肺结核患者(实验组)100例,实验组所有患者均经过临床症状,体征,PPD试验,痰抗酸杆菌涂片,痰结核菌培养,影像学等资料结果确定,诊断依据为《肺结核诊断和治疗指南》[4]。经2HRZE/4HR标准治疗后,进一步将其分为有效组和无效组、痰菌阴性组和痰菌阳性组。入选患者中男60例,女40例,年龄20~60岁,平均(42.16±7.91)岁。选取同期健康体检未患肺结核志愿者30 例(对照组),其中男20 例,女10 例,年龄20~60岁,平均(41.47±9.47)岁。实验组与对照组的年龄、性别比较差异无统计学意义(P>0.05)。本研究经医院伦理委员会审核批准,所有患者均对本组研究知情,并签署知情同意书。
1.2 入选标准和排除标准
入选标准:①PPD 实验阳性,结核菌素皮试采用5个国际单位结核菌纯蛋白衍生物,硬结≥10 mm 判断为阳性;并通过影像学检测提示肺结核患者;②痰图片阳性者;③初、复治肺结核的诊断参照《肺结核诊断和治疗指南》;④非孕期,未接受激素或者免疫抑制剂治疗;⑤无心肝肾耳疾病及肺外结核、糖尿病、精神病史者。
排除标准:①患有肺外结核者;②因患有其他疾病,不能耐受一线或二线抗结核药物治疗的患者;③长期服用激素或者近 1年内曾用免疫抑制剂者;④未能足疗程治疗者或者治疗不规范者;⑤治疗未足6个月但失访者。
1.3 方法
实验组患者在抗结核治疗前和治疗2个月、6个月后及对照组体检时均于清晨空腹采集肘正中静脉血4ml,标本为肝素抗凝血,于24 h内采用BD FACScalibur流式细胞仪直接免疫荧光标记法检测T淋巴细胞亚群CD3+、CD4+、CD8+的百分比数值,计算CD4+/ CD8+比值。此外,治疗组细菌学检测:每次患者留取3份痰标本(清晨、夜间及随机)送检,以连续3次痰涂片抗酸染色阴性为标准。
1.4 疗效评估
评估临床疗效标准[5]:参照标准将疗效分为总有效(显效、有效)和无效,临床症状及体征消失,反复3次痰培养试验呈阴性,胸部X线的结果提示结核病灶完全吸收及空洞闭合完全为显效;痰培养试验明显改善或呈阴性,但临床症状及体征有一定缓解而尚未完全消失,胸部X线平片的结果提示结核病灶明显缓解为有效;临床症状及体征无改变甚至加重,反复痰培养试验呈阳性,X线的结果提示结核病灶无改变或进展为无效。总有效率=(临床治愈例数+显效例数)/总例数×100%。
1.5 统计方法
采用 SPSS 19.0 统计软件,两样本计量资料均数的比较用 t 检验,多个样本均数的比较用单因素方差分析,多个样本均数间的两两比较采用 LSD 法;两种属性的关联性检验用(2检验;P<0.05 差异有统计学意义。
2 结果
2.1 实验组治疗前和对照组T淋巴细胞亚群的表达比较
实验组治疗前T淋巴细胞亚群CD3+、CD4+T细胞比例及CD4+/CD8+比值较对照组下降(P<0.05),而CD8+T细胞比例较对照组升高,差异有统计学意义(P<0.05),如表1,上述实验重复检测3次。
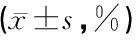

组别例数CD3+CD4+CD8+CD4+/CD8+实验组10064.32±3.441)33.88±3.151)28.75±5.711)1.22±0.241)对照组3071.22±4.3640.69±3.1325.89±2.761.59±0.24T值-9.03-10.402.65-7.46P值<0.05<0.05<0.05<0.05
注:1)对照组比较有显著差异,P<0.05
2.2 实验组治疗前、治疗2个月和治疗6个月后T淋巴细胞亚群的表达比较
实验组治疗6个月后复查T淋巴细胞亚群CD3+、CD4+T细胞比例及CD4+/CD8+比值均高于治疗前、治疗2个月,而CD8+T细胞比例下降,差异有明显统计学意义(P<0.01)。此外,治疗2个月后CD8+T细胞比例较对照组下降,同时CD4+/CD8+比值较对照组升高,差异有显著统计学意义(P<0.01),但两组CD3+、CD4+T细胞比例差异无显著性(P>0.05),如表2,上述实验重复检测3次。
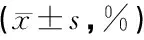
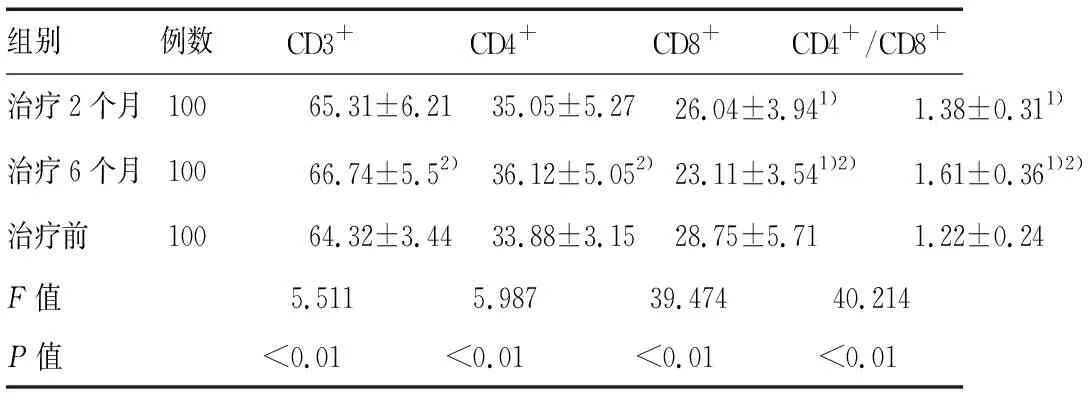
组别例数CD3+CD4+CD8+CD4+/CD8+治疗2个月10065.31±6.2135.05±5.2726.04±3.941)1.38±0.311)治疗6个月10066.74±5.52)36.12±5.052)23.11±3.541)2)1.61±0.361)2)治疗前10064.32±3.4433.88±3.1528.75±5.711.22±0.24F值5.5115.98739.47440.214P值<0.01<0.01<0.01<0.01
注:1)治疗2个月较治疗前有极显著差异,1)P<0.01 ;2)治疗6个月较治疗前有极显著差异,2)P<0.01
2.3 实验组治疗2个月和治疗6个月后的痰转阴和疗效情况比较
实验组治疗6个月后患者的总有效率(85%)和痰菌转阴率(89%)均高于治疗2个月,差异有显著统计学意义(P<0.01),见表3、表4。
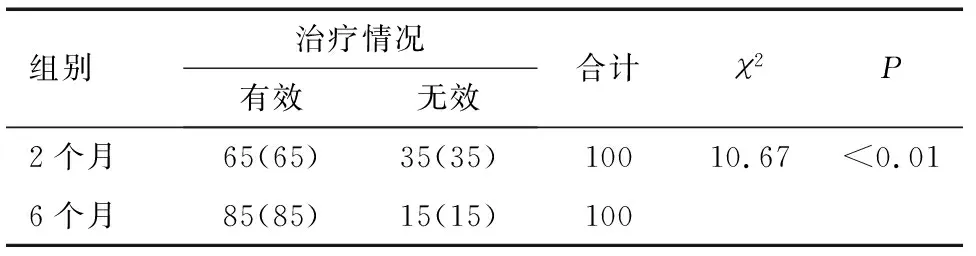
表3 治疗2个月和治疗6个月后的治疗情况比较 n(%)
注:治疗6个月较治疗2个月显著差异,P<0.01

表4 治疗2个月和治疗6个月后的痰改变情况比较 n(%)
注:治疗6个月较治疗2个月显著差异,P<0.01
3 讨论
在全球范围内,结核病是单种病原体致死人数最多的疾病之一。根据WHO报道,我国的肺结核疫情改善显著,但仍是全球结核病流行严重的国家之一[6]。而结核病的发生、发展及转归情况,除了与入侵结核菌的数量、毒力有关,还与机体的免疫力及变态反应的高低密切相关。研究显示,罹患结核病时机体内的不同类型的 T 淋巴细胞的数量和功能对于疾病的转归有重要的影响[7]。近年来,国内外越来越多的研究,从分子水平到基因水平,探索于 T 淋巴细胞与结核病的关系,希望找到行之有效的检测手段,早发现、早治疗,减少耐药和其他副作用的产生[8-10]。
机体抗结核菌的免疫保护机制主要是T淋巴细胞介导的细胞免疫,特别是T淋巴细胞亚群(CD3+、CD4+、CD8+)在结核病发生、发展中产生重要作用,而体液免疫无明显影响[11-12]。在T淋巴细胞亚群之中,CD3+主要通过信号转导作用,激活淋巴细胞,诱导启动细胞免疫,但不直接参与抗原识别[3][13]。彭德虎[14]等研究认为,CD3+T淋巴细胞计数低于正常参考范围,提示肺结核发生时期患者的细胞免疫功能降低。而本研究结果发现,CD3+T细胞计数比例(64.32±3.44)低于健康人群(71.22±4.36)(P<0.05),验证了上述研究结果。同时,辅助性T淋巴细胞亚群(CD4+)能够分不同的细胞活化因子,促进T淋巴细胞、B淋巴细胞的增值分化,放大细胞免疫反应,从而抑制结核杆菌的生长,在肺结核免疫机制中占据重要地位,其表达量降低提示结核病可能恶化[15-17]。此外,CD8+T细胞可通过免疫调控作用抑制细胞免疫和体液免疫,还可通过细胞毒性作用,直接发挥特异性杀伤靶细胞,引起细胞凋亡,从而引起结核杆菌重新释放和扩散,加剧疾病的发生和发展,最终导致治疗难度增加和周期延长[18-19]。近期研究证实,CD4 与 CD8 在机体内维持一定的动态变化,反应了机体的免疫状态和免疫反应水平,一旦该平衡被打破,会导致机体免疫防御能力降低,容易受到病菌的侵袭[20]。
本研究结果显示,肺结核患者外周血中CD3+T、CD4+T细胞比例较健康人偏低,而CD8+T细胞比例偏高(P<0.05),这提示肺结核患者未治疗时的细胞免疫功能低下。经过2HRZE标准治疗2个月后,CD3+T、CD4+T细胞比例未见明显升高(P>0.05),但经过2HRZE/4HR规范化治疗后,患者CD3+T、CD4+T细胞比例明显升高(P<0.01),这提示CD3+T、CD4+T淋巴细胞与肺结核的发生、发展和转归有着重要的相关性。同时,经过2HRZE/4HR治疗后,CD8+T淋巴细胞比例逐渐下降,而CD4+/CD8+比值不断升高,差异具有显著统计学意义(P<0.01)。另外,患者临床症状和体征均有明显改善,痰液结核菌培养转阴率不断增加(74%增加至89%)(P<0.05),进一步表明,CD4+T、CD8+T淋巴细胞在结核病免疫防护中起重要作用,对 CD4+/CD8+ 比值检测有助于临床判断疗效及了解预后。
综上所述, T细胞亚群在肺结核患者中发挥着十分重要的作用,其动态变化可有效提示患者免疫功能受损程度、病情严重程度和治疗是否有效,对于判断肺结核患者病情变化、评估预后都具有非常重要的临床价值和远期意义。
[1] ORGANIZATION W H. Global tuberculosis report-2014.[J]. Australas Med J, 2014, 6(2).
[2] ZHANG M, WANG Z, GRANERM W, et al. B cell infiltration is associated with the increased IL-17 and IL-22 expression in the lungs of patients with tuberculosis.[J]. Cell Immunol, 2011, 270(2):217-223.
[3] 杜光明. 肺结核和肺外结核患者外周血淋巴细胞亚群的检测意义探讨[J]. 临床肺科杂志, 2014, 19(4):693-695.
[4] 结核病临床诊治进展年度报告(2012年)(第二部分 结核病临床治疗)[J].中国防痨杂志,2013,35(07):488-510.
[5] METERSKY M L, SCHLUGER N W. New Guidelines for the Treatment of Drug-susceptible Tuberculosis from the American Thoracic Society, Centers for Disease Control and the Infectious Disease Society of America: Now Comes the Hard Part[J]. Am J Respir Crit Care Med, 2016, 194(7):791.
[6] ORGANIZATION W H. WHO Report 2011 Global Tuberbulosis Report[J]. Global Tuberculosis Report, 2012, 6(2).
[7] 谢 青, 张亚楠, 李艳静,等. 抗结核药物联合胸腺五肽对结核性脑膜炎患者外周血中T淋巴细胞亚群的影响[J]. 中国实用神经疾病杂志, 2014(12):61-62.
[8] PASULA R, KESAVALU B R, ABDALLA M Y, et al. Passive transfer of interferon-γ over-expressing macrophages enhances resistance of SCID mice to Mycobacterium tuberculosis infection[J]. Cytokine, 2017, 95:70-79.
[9] MOLICOTTI P, BUA A, CUBEDDU M, et al. Could inducible protein-10 and heparin-binding hemagglutinin improve the detection of Mycobacterium tuberculosis-infected subjects in a country with low incidence of tuberculosis ?[J]. Infectious Diseases, 2015, 47(8):1-5.
[10] SINGHA, GUPTA A K, GOPINATHK, et al. Evaluation of 5 Novel protein biomarkers for the rapid diagnosis of pulmonary and extra-pulmonary tuberculosis: preliminary results:[J]. Sci Rep, 2017, 7.
[11] YING W M, BRUFFAERTS N, LIANG Y, et al. Lymph node targeting of BCG vaccines amplifies CD4 and CD8 T-cell responses and protection against Mycobacterium tuberculosis[J]. Vaccine, 2013, 31(7):1057-1064.
[12] 汪清雅, 张 舜, 刘 英,等. 在社区糖尿病患者中开展结核病健康教育的效果评价[J]. 实用预防医学, 2016, 23(1):66-68.
[13] 汪新龙, 刘朝晖. 炎性因子在慢性阻塞性肺疾病气道炎症中的作用[J]. 国际呼吸杂志, 2014, 34(9):687-692.
[14] 彭德虎, 谢 贝, 孟繁荣,等. 初治肺结核患者CD3+、CD4+、CD8+T淋巴细胞计数分析[J]. 现代医院, 2011, 11(7):10-13.
[15] REILEY W W, SHAFIANI S, WITTMER S T, et al. Distinct functions of antigen-specific CD4 T cells during murine Mycobacterium tuberculosis infection[J]. P NATL ACAD SCI USA,2010, 107(45):19408-13.
[16] 周 芬, 杨玉婷, 华彦珺,等. CD^4+T细胞对肺结核诊断的ROC曲线分析[J]. 中国卫生检验杂志, 2015(19):3280-3282.
[17] ALEXANDRE H, VIRGINIE R, FELICITAS B E, et al. Dominant TNF-[alpha]+ Mycobacterium tuberculosis-specific CD4+ T cell responses discriminate between latent infection and active disease[J]. Nat Med, 2011, 17(3):372-6.
[18] 赵 晖. 老年肺结核患者细胞和体液免疫状况及免疫干预治疗对其的影响[J]. 中国老年学, 2014(15):4186-4188.
[19] KATTI M K. Assessment of serum IL-1, IL-2 and IFN-γ levels in untreated pulmonary tuberculosis patients: role in pathogenesis[J]. Arch Med Res, 2011, 42(3):199.
[20] 夏 宁, 张 宇, 侯志波,等. 肺结核患者T细胞亚群比例和相关细胞因子的动态变化及临床意义[J]. 江苏医药, 2015, 41(22):2684-2687.

