TGF-β2对人晶状体上皮细胞SPARC表达的影响
郭 瑞
晶状体上皮细胞发生上皮间质转化(epithelial mesenchymal transition, EMT)是多种类型白内障(如后发性白内障)发生的细胞学机制[1-3],具体的分子机制尚不明确。我们前期研究表明,TGF-β2能够诱导人晶状体上皮细胞发生上皮间质转化,使人晶状体上皮细胞丧失上皮细胞极性,获得间质特性,成功建立了人晶状体上皮细胞上皮间质转化细胞模型[4-5]。富含半胱氨酸的酸性分泌蛋白(SPARC)是一个与白内障密切相关的基因,敲除SPARC基因的小鼠,白内障发病率为100%[6]。SPARC基因位于人9号染色体、鼠11号染色体,对人和鼠的SPARC基因系列分析结果显示具有高度的相似性。本研究拟在前期研究工作的基础上,进一步探讨TGF-β2对人晶状体上皮细胞SPARC表达的影响,以期为白内障的发病机制提供确切的理论依据,为晶状体相关疾病的防治提供新的思路和方法。
1 材料和方法
1.1 试剂材料
HLECs-B3细胞株(美国ATCC公司);人源TGF-β2(美国Pepro Tech公司);胰蛋白酶、DMEM低糖细胞培养液、胎牛血清(美国Gibco公司);细胞计数试剂盒-8(cell counting kit-8,CCK-8)(日本同仁化学研究所);BCA蛋白定量试剂盒(德国Merk 公司);兔抗人SPARC抗体(15274-1-AP,美国Proteintech公司);小鼠抗人GAPDH抗体 (#M20006)(上海Abmart公司);HRP标记山羊抗鼠IgG二抗(BAl050)、HRP标记山羊抗兔IgG二抗(BAl054)(武汉博士德公司)。
1.2 方法
1.2.1 HLECs-B3细胞株的培养及分组 培养HLECs-B3细胞,采用体积分数10%胎牛血清的DMEM低糖培养基,于37℃ 、体积分数5%的CO2、饱和湿度的细胞培养箱内培养,取对数生长期细胞用于实验。当细胞达到80%~90%融合时,加入10 ng/ml的TGF-β2,在无血清培养基中连续培养0 h、6 h、16 h、24 h,收集各组细胞,进行免疫荧光试验和western blot分析。0h细胞为对照组,6 h、16 h和24 h细胞为实验组。
1.2.2 共聚焦细胞免疫荧光:使用体积分数4%的甲醛室温固定细胞30 min;PBS洗3次,每次5 min;体积分数0.2%Triton X-100透化3 min;PBS洗3次,每次5 min;质量分数5%BSA室温封闭30 min;加用3%BSA稀释的一抗(1∶50)后放人湿盒里,4℃孵育过夜;取出湿盒至常温复温1 h,PBS洗3次,每次5 min;常温、避光条件下用荧光二抗孵育1 h(1∶500);PBS洗3次,每次5 min;常温、避光条件下孵育DAPI 5 min;PBS洗3次,每次5 min;抗荧光淬灭封片剂封片;激光扫描共焦显微镜下观察并拍照。
1.2.3 Western blotting 使用RIPA蛋白裂解液提取总蛋白,BCA蛋白质测定试剂盒进行蛋白定量,并调整蛋白浓度,通过SDS-PAGE凝胶进行分离,然后电泳转移至PVDF膜上。用5%脱脂奶粉室温下封膜3小时,用含有0.1%吐温20(TBST)的Tris缓冲液洗涤3次,每次5分钟。随后在4℃以下将膜孵育一抗过夜:兔抗人多克隆抗体SPARC(1∶500)和小鼠抗人单克隆抗体GAPDH(1∶5000)。然后将膜孵育二抗1小时,使用山羊抗兔二抗或山羊抗小鼠二抗,二抗使用TBST稀释5000倍。用TBST将膜洗涤三次,每次5分钟。使用增强化学发光(ECL)检测试剂和胶片检测所述免疫反应的蛋白条带。扫描胶片,使用GEL-PRO Analyzer软件4.0进行分析。
1.2.4 统计方法 采用SPSS13.0统计学软件对数据进行统计学分析。TGF-β2不同培养时间细胞中SPARC的平均灰度值的比较采用单因素方差分析,各组间的两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 共聚焦细胞免疫荧光实验结果
为了研究TGF-β2对人晶状体上皮细胞SPARC表达的影响,本实验首先采用共聚焦细胞免疫荧光法,观察使用TGF-β2培养HLECs-B3细胞前后细胞内SPARC的分布及表达变化,实验组取了6 h、16 h和24 h这3个时间点来观察,0 h为对照组。结果如图1所示,在第一列图中SPARC蛋白显示为金色荧光,在第二列图中细胞核显示为蓝色荧光,第三列合图中SPARC蛋白显示为红色荧光、细胞核显示为蓝色荧光。根据SPARC荧光在细胞内的分布和荧光强弱来判断,SPARC蛋白在细胞内的定位和表达变化。共聚焦细胞免疫荧光实验检测结果显示,随着TGF-β2培养细胞时间的延长,SPARC蛋白表达的荧光逐渐增多增强,各实验组细胞SPARC表达的荧光均较对照组增多增强。
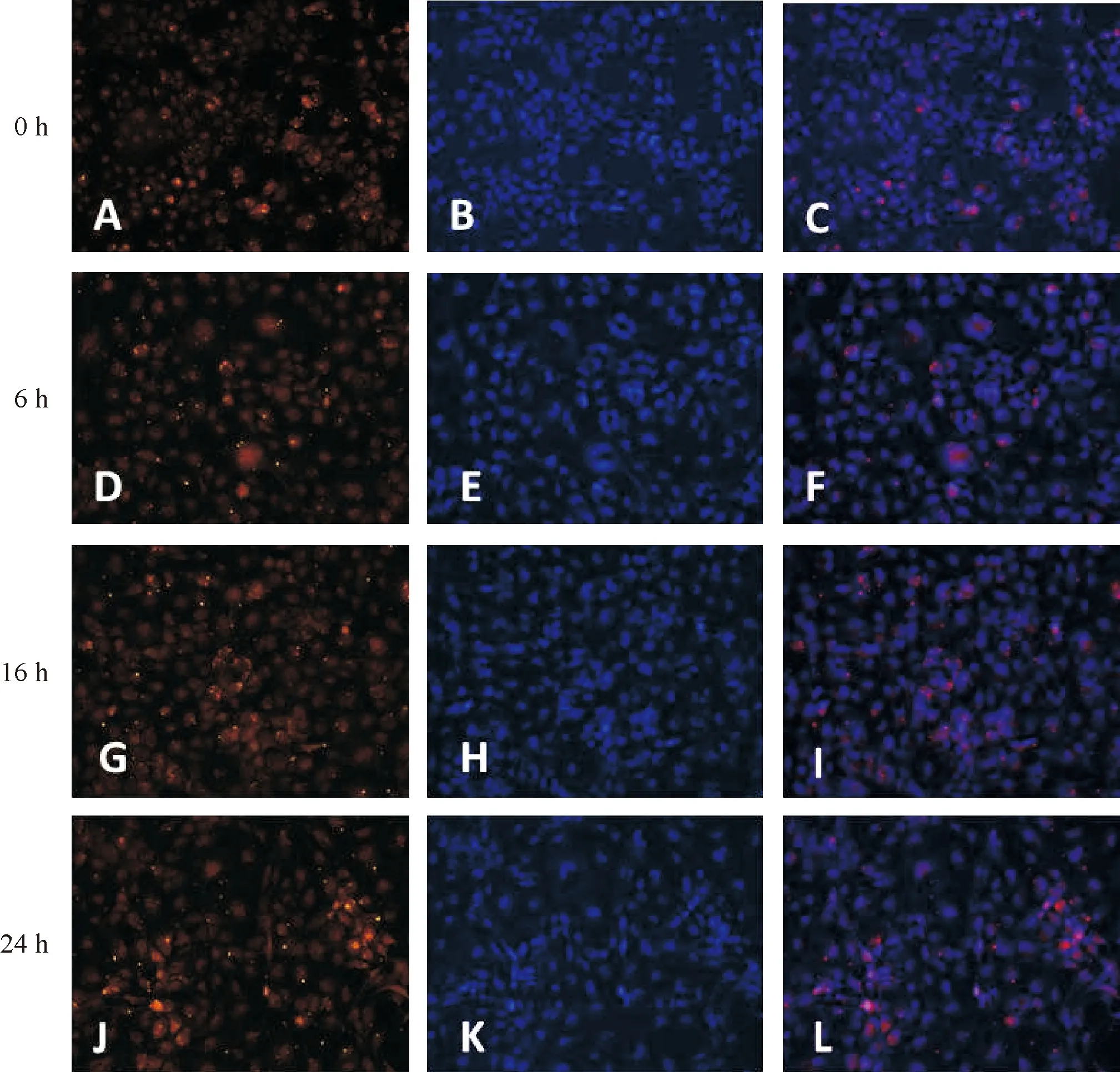
图A、D、G、J:各组细胞SPARC的表达显示为金色荧光,图B、E、H、K:各组细胞核显示为蓝色荧光,图C、F、I、L:合成图,SPARC蛋白显示为红色荧光、细胞核显示为蓝色荧光。随着TGF-β2培养细胞时间的延长,SPARC蛋白表达的荧光明显增多增强。
图1细胞免疫荧光法检测SPARC在细胞内的表达(×400)
2.2 Western blotting实验结果
免疫荧光不能定量,本实验进一步用Western blotting法进行客观定量检测。Western blot法检测结果显示,随着TGF-β2培养细胞时间的延长,SPARC表达量增加,各实验组细胞SPARC表达量均较对照组明显增加,差异均具有统计学意义 (P均<0.05)。实验组中,16 h组较6 h组SPARC表达量明显增加,其差异具有统计学意义 (P<0.05);24 h组较6 h组SPARC表达量明显增加,其差异具有统计学意义 (P<0.05);24 h组较16 h组细胞SPARC表达量无明显增加,其差异不具有统计学意义 (P>0.05)。
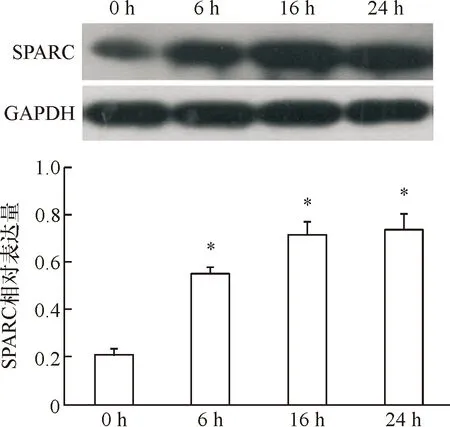
A:SPARC表达的电泳图 B:各组SPARC表达的量化比较
*表示:与对照组(0h)比较P<0.05
图2 Western blot法检测SPARC的表达水平
3 讨论
白内障是人类首位致盲性眼病,后发性白内障是白内障术后最常见的并发症。据统计,后囊膜混浊在术后1~5年的发生率成人为11%~50%,儿童由于晶状体上皮细胞强大的增殖能力,后囊膜混浊发生率可达100%[7-8]。老年白内障术后1天、1周、1个月及3个月低视力发生率依次为18.78%、12.96%、11.64%、10.58%[9]。白内障的基础研究具有很高的社会经济价值和科研价值,其不仅仅是为了解决该疾病的治疗问题,对于晶状体发生发育,眼球的发生发育及其与各种眼部疾病之间的联系的深入认识均具有深刻的意义。
转化生长因子-β(transforming growth factor-β, TGF-β)是晶状体在各种生理和病理状态下重要的调节因子,与后发性白内障的形成有密切关系[10]。哺乳动物中存在TGF-β1、TGF-β2和TGF-β3三种TGF-β同源异构体,其中TGF-β2在眼内房水及玻璃体内的含量及活性最高,是参与调节晶状体上皮细胞最强的细胞因子之一。TGF-β2能够诱导人晶状体上皮细胞发生上皮间质转化,使人晶状体上皮细胞丧失上皮细胞极性,获得较强的迁移、侵袭、抗凋亡能力等间质特性,从而具有类肌纤维母细胞样的特征,目前已成为白内障(包括前囊膜下和后囊膜混浊)形成的细胞模型而被用于基础科学研究。
富含半胱氨酸的酸性分泌蛋白SPARC,又称BM-40或骨粘连蛋白,是一种细胞外基质糖蛋白,结合细胞外基质成分,改变基质金属蛋白酶的表达,具有抗粘附和抗血管生成的作用,调节细胞的增殖、分化、粘附及移行[11-12]。本研究表明,在使用TGF-β2诱导人晶状体上皮细胞上皮间质转化、构建白内障细胞模型的过程中,SPARC蛋白的表达量明显增加。一项研究表明,与正常人的晶状体前囊膜相比,白内障患者的晶状体前囊膜较正常人的SPARC蛋白表达量高,后囊下型和核型白内障的晶状体较正常人的SPARC转录增加[13]。另一项研究表明,白内障患者的晶状体前囊膜较正常人的SPARC蛋白表达量高,并有随着年龄增长表达增加的趋势;氧化损伤、热应激处理均可使人晶状体上皮细胞SPARC表达上调[14]。这些研究均表明,SPARC与白内障的发生发展密切相关。
我们前期研究结果表明,用终浓度为10ng/ml的TGF-β2培养HLECs-B3细胞24小时,能够使HLECs-B3细胞发生上皮间质转化。本研究在前期研究的基础上,采用终浓度为10ng/ml的TGF-β2培养HLECs-B3细胞0~24小时,细胞免疫荧光法观察SPARC表达水平变化, Western blotting法进行定量检测,进一步验证了在使用TGF-β2诱导人晶状体上皮细胞上皮间质转化、构建白内障细胞模型的过程中,SPARC蛋白的表达量明显增加。
TGF-β和SPARC的生物学作用有很多交叉,而且能够诱导对方表达,但目前TGF-β和SPARC在调控上皮细胞生物学特性中的相互关系尚不明确。一项研究表明,SPARC影响TGF诱导的晶状体上皮细胞的迁徙和增殖,提示SPARC和TGF诱导的信号通路有交叉[15]。本研究表明,TGF-β2能够诱导人晶状体上皮细胞SPARC表达量的增加。除晶状体上皮细胞外,SPARC和TGF-β互相作用调控多种细胞的生物学行为,例如,在肾小球系膜细胞SPARC诱导TGF-β表达[16-17],而在另外很多类型的细胞(包括内皮细胞、成纤维细胞、平滑肌细胞等)TGF-β刺激SPARC的表达[18-21]。这些研究均论证了TGF-β和SPARC之间的相互作用及影响。
本研究证实了TGF-β2能够诱导人晶状体上皮细胞SPARC表达量的增加,提示SPARC可能在人晶状体上皮细胞间质转化的过程中发挥重要作用,对其作用机制的深入探讨将有助于阐明SPARC对白内障发生及发展的影响。
[1] WORMSTONE I M, ELDRED J A. Experimental models for posterior capsule opacification research[J]. Exp Eye Res,2016,142:2-12.
[2] CHANDLER H L, GERVAIS K J, LUTZ E A, et al. Cyclosporine A prevents ex vivo PCO formation through induction of autophagy-mediated cell death[J]. Exp Eye Res,2015,134:63-72.
[3] KUBO E, SHIBATA S, SHIBATA T, et al. FGF2 antagonizes aberrant TGFβ regulation of tropomyosin: role for posterior capsule opacity[J]. J Cell Mol Med,2017,21(5):916-928.
[4] MENG Q, GUO H, XIAO L, et al. mTOR regulates TGF-β-induced epithelial-mesenchymal transition in cultured human lens epithelial cells[J]. Graefes Arch Clin Exp Ophthalmol, 2013,251(10):2363-70.
[5] RUI GUO, QIANLI MENG, HAIKE GUO, et al. TGF-β2induces epithelial-mesenchymal transition in cultured human lens epithelial cells through activation of the PI3K/Akt/mTOR signaling pathway[J]. Mol Med Rep,2016,13(2):1105-1110.
[6] BRADSHAW A D, PUOLAKKAINEN P, DASGUPTA J, et al. SPARC-null mice display abnormalities in the dermis characterized by decreased collagen fibril diameter and reduced tensile strength[J]. J Invest Dermatol,2003,120(6):949-955.
[7] JOSHI R S. Primary posterior capsular opacification in Indian rural population undergoing cataract surgery for hypermature senile cataract[J]. Clin Ophthalmol,2013,7:1605-1608.
[8] BATUR M, GÜL A, SEVEN E, et al. Posterior Capsular Opacification in Preschool-and School-Age Patients after Pediatric Cataract Surgery without Posterior Capsulotomy[J]. Turk J Ophthalmol,2016,46(5):205-208.
[9] 陈利荣, 姚军平, 高 波, 等. 老年性白内障超声乳化人工晶体植入术后低视力的原因分析及防治措施[J]. 现代医院,2016,16(12):1740-1745.
[10] SHAO D W, ZHU X Q, HUO L, et al. The significance of Akt/NF-κb signaling pathway in the posterior cataract animal model[J]. Bratisl Lek Listy,2017,118(7):423-426.
[11] SCAVELLI K, CHATTERJEE A, RHEE D J. Secreted Protein Acidic and Rich in Cysteine in Ocular Tissue[J]. J Ocul Pharmacol Ther,2015,31(7): 396-405.
[12] WONG S L, SUKKAR M B. The SPARC protein: an overview of its role in lung cancer and pulmonary fibrosis and its potential role in chronic airways disease[J]. Br J Pharmacol,2017, 174(1):3-14.
[13] KANTOROW M, HUANG Q, YANG X J, et al. Increased expression of osteonectin/SPARC mRNA and protein in age-related human cataracts and spatial expression in the normal human lens[J]. Mol Vis,2000,6:24-29.
[14] 白 晶, 张劲松, 夏 泉, 等. 晶状体上皮细胞中骨连蛋白的研究[J]. 眼科研究,2009, 27(2):149-152.
[15] GOTOH N, PERDUE N R, MATSUSHIMA H, et al. An in vitro model of posterior capsular opacity: SPARC and TGF-beta2 minimize epithelial-to-mesenchymal transition in lens epithelium[J]. Invest Ophthalmol Vis Sci,2007, 48(10):4679-4687.
[16] FRANCKI A, BRADSHAW A D, BASSUK J A, et al. SPARC regulates the expression of collagen type I and transforming growth factor-beta1 in mesangial cells[J]. J Biol Chem,1999,274(45): 32145-32152.
[17] SHIBATA S, ISHIYAMA J. Secreted protein acidic and rich in cysteine (SPARC) is upregulated by transforming growth factor (TGF)-β and is required for TGF-β-induced hydrogen peroxide production in fibroblasts[J]. Fibrogenesis Tissue Repair,2013,6(1):6.
[18] KAMIO K, AZUMA A, USUKI J,et al. XPLN is modulated by HDAC inhibitors and negatively regulates SPARC expression by targeting mTORC2 in human lung fibroblasts[J]. Pulm Pharmacol Ther,2017,44:61-69.
[19] MIAO L, WANG Y, XIA H,et al. SPOCK1 is a novel transforming growth factor-β target gene that regulates lung cancer cell epithelial-mesenchymal transition[J]. Biochem Biophys Res Commun,2013,440(4):792-797.
[20] CHAWLA S, GHOSH S. Regulation of fibrotic changes by the synergistic effects of cytokines, dimensionality and matrix: Towards the development of an in vitro human dermal hypertrophic scar model[J]. Acta Biomater,2018,69:131-145.
[21] SHANKER G, OLSON D, BONE R, et al. Regulation of extracellular matrix proteins by transforming growth factor beta1 in cultured pulmonary endothelial cells[J]. Cell Biol Int, 1999, 23(1):61-72.

