异裂菊属根际微生物群落结构及功能多样性
史艳财 邹蓉 唐健民 熊忠臣 蒋运生 韦霄 邓涛
摘 要: 異裂菊属是广西喀斯特石山区典型的特有属,根际微生物是其能否有效吸收、有效利用土壤养分和适应石山恶劣土壤环境的最直接表征之一。该研究采用DGGE和Biolog两种方法对异裂菊属植物根际和非根际微生物多样性进行了研究。结果表明:(1)异裂菊属5个种根际pH、碱解氮等9个养分含量都高于非根际。(2)5个种的根际、非根际存在2个共有细菌类群,但在数量上存在差异,3个种的根际条带小于非根际;5个种的根际、非根际微生物群落较为相似,较易聚在一起。(3)绢叶异裂菊根际微生物对碳源利用能力最强,凹脉异裂菊非根际最弱,其他对碳源的利用能力较接近;异裂菊属种根际微生物利用碳源的能力都高于非根际,根际微生物多样性指数均高于非根际,优势度指数与非根际基本相同或略高于非根际,丰富度和均匀度指数与优势度指数规律相似;异裂菊属根际、非根际微生物利用的碳源主要是糖类、羧酸类和氨基酸类化合物,4个种根际微生物利用碳源的能力高于非根际。(4)阳离子交换量、黏粒含量百分率和碱解氮是影响异裂菊属根际微生物碳源利用模式的最重要因子。总体来说,土壤理化性质对异裂菊属植物根际微生物群落多样性具有重要影响,异裂菊属通过分泌羧酸、糖等多类化合物提高了根际微生物的活性,进而有效地提高了根际肥力水平。
关键词: 喀斯特石山区, 特有属, 根际微生物, PCR-DGGE, Biolog微平板法
中图分类号: Q948.15, Q938
文献标识码: A
文章编号: 1000-3142(2018)01-0001-10
Structural and functional diversity of rhizosphere microbial community of Heteroplex
SHI Yancai, ZOU Rong*, TANG Jianmin, XIONG Zhongchen, JIANG Yunsheng, WEI Xiao, DENG Tao
( Guangxi Institute of Botany, Guangxi Zhuang Autonomous Region and Chinese Academy of Sciences, Guilin 541006, Guangxi, China )
Abstract: Heteroplex is a typical endemic genus of karst rocky mountainous area in Guangxi, and rhizosphere microorganism is one of the most direct representations of its ability to absorb and utilize soil nutrients and adapt to the harsh soil environment. In this study, DGGE and Biolog methods were used to study the rhizosphere and non-rhizosphere microbial diversity of Heteroplex. The results showed that the values of pH and alkali nitrogen content in the rhizosphere were hi-gher than those in the non-rhizosphere. The results of DGGE showed that two common bacterial groups were same in the rhizosphere and non-rhizosphere of Heteroplex, but the numbers were different. The bands in DGGE profile of the three species were less than non-rhizosphere. Rhizosphere and non-rhizosphere microbial community of each species were similar. The results of Biolog showed that the rhizosphere microorganisms of H. sericophylla had the strongest ability to use carbon source, and the non-rhizosphere of H. impressinervia was the weakest, and the ability of utilize carbon source of other rhizosphere and non-rhizosphere microbial community was close. The microbial diversity index of rhizosphere microorganisms was higher than that of non-rhizosphere, and the dominance index was the same as that of non-rhizosphere, the richness and evenness index are similar to the dominance index. The carbon sources used in non-rhizosphere microbes were mainly sugars, carboxylic acids and amino acids. The ability of utilize carbon source of four rhizosphere microorganisms were higher than non-rhizosphere. Cation exchange capacity, clay content and alkali nitrogen were the most important factors affecting the microbial carbon source utilization model of rhizosphere microorganisms. In general, the soil physical and chemical properties have an important effect on rhizosphere microbial community diversity of Heteroplex, and the activity of the rhizosphere microorganisms and fertility level were improved by secreting compounds such as carboxylic acid and sugar.
Key words: karst limestone regions, endemic genus, rhizosphere microbial community, PCR-DGGE, Biolog-Eco
菊科异裂菊属(Heteroplex)为广西稀有的特有属,该属5个种全部为中国特有种(覃海宁和刘演, 2010)。异裂菊属地理分布范围十分狭小,仅分布于广西少数县石灰岩石山中上部的狭小区域,其种群个体数量5~60株。小花异裂菊对菊科分类、演化等研究具有重要科学价值,已被列为国家二级保护植物(付立国, 1992)。近年来,由于自然生态环境和植被遭受破坏,该属的野生植株逐年减少,小花异裂菊模式标本采集地的种群现已绝迹(史艳财等, 2017)。大力开展异裂菊属保育生物学研究,摸清其濒危机制势在必行。
根际(rhizosphere)是指受植物根系影响的根—土界面的一个区域,是植物—土壤—微生物与其环境条件相互作用最为活跃的场所(Haremann et al, 2008)。根际微生物直接参与土壤中氮、磷、硫等养分的循环和转化(Eisenhauer et al, 2012)。其分泌的有机酸(Pii et al, 2015)、土壤酶可提高植物对根际土壤养分的吸收能力和植物对土壤的适应性(苏春沦等, 2016)。植物根际微生物对植物的定植、生长、繁殖和群落演替至关重要。近年来,国内外研究表明,高山、荒漠等生境中植物根际微生物是影响其生态适应力的关键因子(Jorge et al, 2016)。易思荣等(2012)研究发现塔里木河下游7种典型优势荒漠植物增加了根际微生物的数量及活性,促进了土壤养分的积累和转化。银杉根际微生物类群数量和个体总量低可能是其退化和生长不良的主要原因之一。小花异裂菊分布的石山中上部土壤具有土层浅、保水能力差、盐分含量高、养分贫瘠等特点,根际微生物是其能否有效吸收、利用土壤养分和适应恶劣土壤环境的最直接表征之一(Wang et al, 2016)。本文通过研究异裂菊属根际微生物的结构和功能多样性及其对植物适应力的影响,阐明异裂菊属的生态适应机制,为异裂菊属的保护以及揭示其他石山特有植物的濒危机制奠定基础。
1 材料與方法
1.1 研究区概况
异裂菊属植物仅分布在广西少数的几个县,具体为小花异裂菊仅分布于广西阳朔、融安县,绢叶异裂菊分布于阳朔县,柳州异裂菊分布于柳州市,凹脉异裂菊和异裂菊分布于马山、宁明、龙州县。异裂菊属植物分布在这些县的石灰岩石山中上部的灌丛或者向阳处,种群个体数量在5~20株之间。分布区土壤为石灰岩土,偏碱,pH值6.5~8.0,土层在5~15 cm,保水能力差,土壤含水量低。分布区光照强,昼夜温差大,夏季温度可达40 ℃以上。植被主要以灌木为主,包括有檵木(Loropetalum chinense)、朴树(Celtis sinensis)、黄连木(Pistacia chinensis)、化香树(Platycarya strobilacea)、园叶乌桕(Saptum rotundifolium)、石班木(Photinia consimilis)等。
1.2 采样方法
于2016年8月在广西的阳朔县(采集小花异裂菊XH、绢叶异裂菊JM)、龙州县(异裂菊YL)、马山县(凹脉异裂菊AM)及柳州市(柳州异裂菊LZ)进行样品采集(表1)。在异裂菊属植物种群分布集中的位置均匀选取3个样点,每个样点采用5点采样法采集。将异裂菊属植物连根挖起(根系尽量完整),抖落根系外围大块的土,取紧贴在根系表面的土壤作为根际土(R)。在植株附近未生长植物的位置取0~20 cm的土壤样品作为非根际土壤(N)。装于封口袋后置于便携式冰盒中带回实验室。用于提取微生物DNA的土壤样品于-80 ℃冰箱保存。Biolog实验于土壤样品采回后立即进行。
1.3 研究方法
1.3.1 土壤理化性质测定 土壤pH、电导率采用pH计、电导率仪测定;土壤交换性阳离子(CEC)测定采用中性乙酸铵法;交换性钾和钠的测定采用乙酸铵交换—火焰光度法;交换性钙和镁采用乙酸铵—原子吸收分光光度法;机械组成采用吸管法测定;全氮采用高氯酸—硫酸消化法;速效氮采用碱解蒸馏法;全磷、速效磷用0.5 mmol·L-1 NaHCO3浸提—钼锑抗比色法;全钾采用氢氟酸—高氯酸消煮法;速效钾用NH4OAc浸提—火焰光度法;有机质采用高温外热重铬酸钾氧化—容量法。
1.3.2 群落结构多样性DGGE测定 称取约0.5 g冷冻土壤样品,按试剂盒(OMEGA N.A.TM Soil DNA Kit)操作说明提取土壤微生物总DNA。采用Nanodrop和1%琼脂糖凝胶电泳法检测微生物DNA浓度和完整度。保存于-20 ℃冰箱中备用。
PCR扩增体系: 2×Taq PCR MasterMix 25 μL,上下游引物(10 μmol·L-1)2.5 μL,1 μL DNA(约30 ng),超纯水补至50 μL。PCR扩增引物采用细菌通用引物,即338F(5′-GACTCCTACGGGAGGCAGCAG-3′)和518R(GTGCCAGCMGCCGCGG)。
PCR扩增程序:95 ℃ 5 min;95 ℃ 40 s,55 ℃ 35 s,72 ℃ 3 min,32个循环;72 ℃ 10 min;4 ℃ 30 min。
PCR产物经1.5%琼脂糖凝胶电泳检测后用EB液(0.5 μg·mL-1)染色20 min,凝胶成像仪照相。
PCR扩增产物的变性梯度凝胶电泳所用聚丙烯酰胺胶浓度为8%(w/v),变性梯度为40%~60%。60 V电压、60 ℃恒温条件下电泳14 h。电泳结束后采用银染方法染色,用凝胶成像仪照相,用Quantity One软件对凝胶图象进行分析。
1.3.3 群落功能多样性测定 称取相当于10 g烘干土样的新鲜土壤加入到装有100 mL灭菌水的250 mL三角瓶中;在摇床上以200 r·min-1转速震荡30 min后,取出放入超净工作台,吸取之前摇一摇,静置大概40 s,待土和根等稍微下沉后,取3 mL加入到提前加好27 mL水的培养皿中稀释,混匀,再进行下一梯度稀释,重复此步骤,用八孔枪将稀释1 000倍后的菌液加入Biolog板中,每孔加150 μL;每个样品重复3次。将接种的微平板在30 ℃培养箱培养,分别于0、24、48、72、96、120、144 h用酶标仪读取590 nm下的吸光值。
AWCD= [∑(C-R)]/n
式中,C是所测的反应孔的吸光值,R是对照孔的吸光值,n是反应孔数,n=31。
优势度指数(D): D=1-∑Pi2。
Shannon-Wiener多样性指数(H):H=-∑PilnPi。式中,Pi为第i孔相对吸光值(C-R)与整个微平板相对吸光值综合的比率。
丰富度指数(S):代谢剖面反应孔颜色变化的数目(AWCD>0.2)。
均匀度指数(E):E=H/lnS。式中,H为Shannon-Wiener多样性指数,S为丰富度指数。
1.4 数据处理方法
用Bio-Rad公司的Quantity One 4.6.5软件对DGGE图谱进行条带分析,用非加权成对算术平均
2 结果与分析
2.1 异裂菊属植物根际与非根际土壤理化性质
异裂菊属植物根际、非根际土壤理化性质如表2所示。由表2可知,异裂菊属5个种根际pH、碱解氮、速效磷、全磷、速效钾、交换性钾、交换性钙、交换性镁、全氮含量都高于非根际土壤。其余指标无明显的规律性。
2.2 异裂菊属植物根际与非根际微生物DGGE结果分析
2.2.1 异裂菊属植物根际与非根际微生物DGGE结果 对异裂菊属5种植物根际、非根际土壤细菌群落多样性进行了DGGE分析(图1)。图1结果表明,5个种的DGGE条带数、强度和均匀度都存在较大差异。5个种的根际、非根际存在2个共有的细菌类群,但其条带的亮度存在差异,说明其在细菌物种的数量上存在差异。5个种中除小花异裂菊(XH)的根际、非根际条带基本相同,柳州异裂菊(LZ)根际条带大于非根际,其余3个种的根际条带小于非根际。
2.2.2 异裂菊属植物根际与非根际土壤微生物群落结构多样性 根据异裂菊属5种植物根际、非根际土壤细菌群落DGGE条带计算其多样性指数(表3)。表3结果表明,除绢叶异裂菊的根际细菌多样性低于非根际外,其余4个种的根际细菌群落丰富度指数都高于非根际。5个种根际、非根际细菌群落的均匀度指数基本相同。5个种中除小花异裂菊的根际、非根际细菌群落丰富度指数基本相同,柳州异裂菊根际丰富度指数大于非根际,其余3个种的根际丰富度指数小于非根际。
2.2.3 异裂菊属植物根际与非根际土壤微生物DGGE聚类分析 采用Quantity One 软件计算出不同物种根际、非根际微生物的遗传距离,然后进行了聚类分析(UPGMA)。图2结果表明,与其他种的根际、非根际微生物群落相比,每個种的根际、非根际微生物群落较为相似,较易聚在一起。小花异裂菊与其他4个种的关系最远;异裂菊和其他3个种的关系相对较远;绢叶异裂菊和其他两个种关系相对较近;柳州异裂菊和凹脉异裂菊的关系最近。
2.3 Biolog微平板结果分析
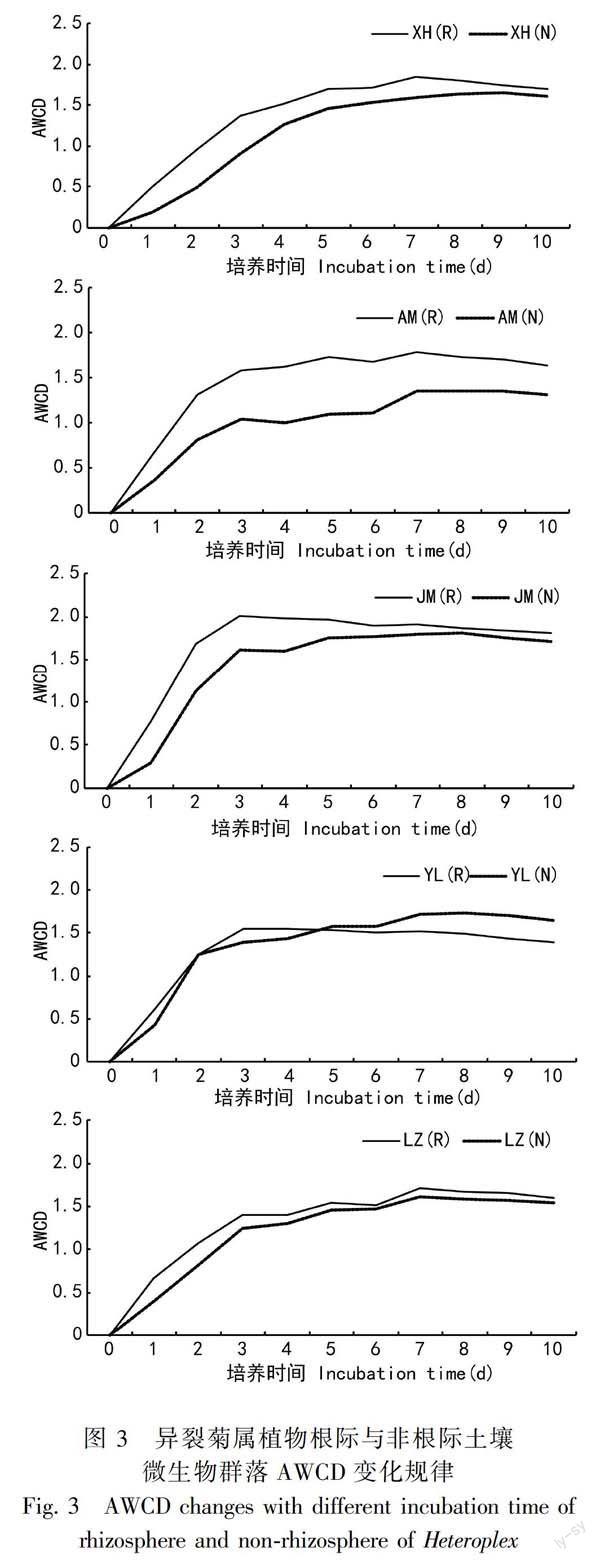
2.3.1 异裂菊属植物根际与非根际微生物群落AWCD变化规律 对异裂菊属5个物种的根际、非根际土壤微生物进行了Biolog平板分析(图3)。
AWCD可反映出细菌在Biolog平板上的生长情况,曲线变化大的样品其细菌碳源利用能力越强,其丰富度也越高。结果表明,随着培养时间延长,微生物活性逐渐升高,从24 h起AWCD值迅速升高,144 h后趋于稳定。绢叶异裂菊根际微生物对碳源利用能力最强,凹脉异裂菊非根际微生物对碳源的利用能力最弱,其他对碳源的利用能力比较接近。5个物种根际微生物利用碳源的能力都高于非根际。
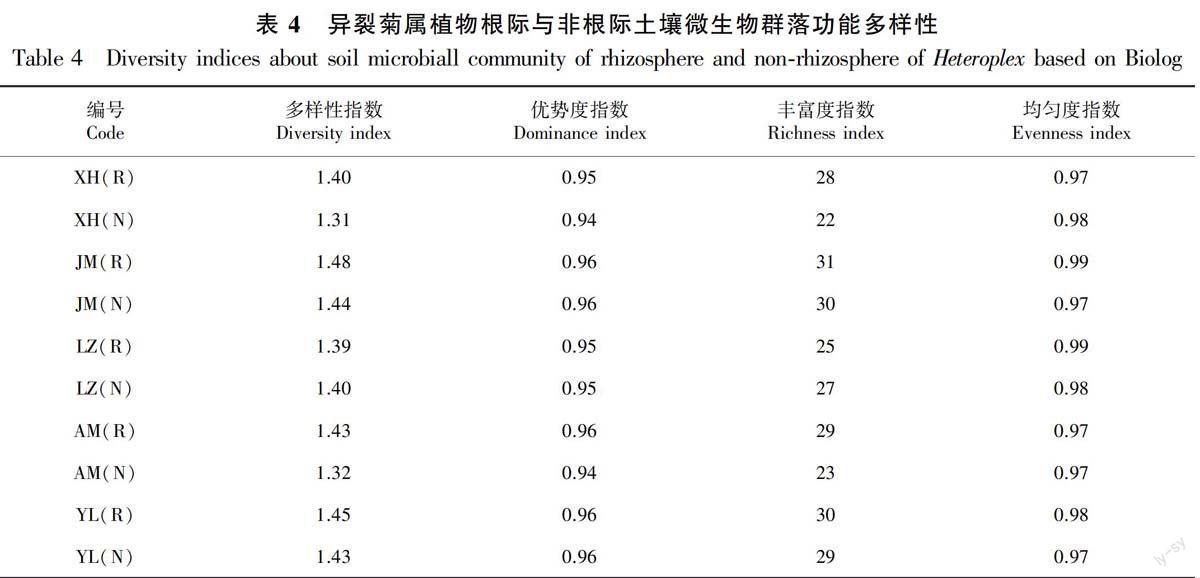
2.3.2 异裂菊属植物根际与非根际微生物群落代谢多样性分析 对异裂菊属5个种根际、非根际微生物培养72 h的多样性指数进行了分析(表4)。由表4可知,5个种的根际微生物多样性性指数均高于非根际,根际微生物的优势度与非根际基本相同或略高于非根际,丰富度指数和均匀度指数表现与优势度指数相似的规律。
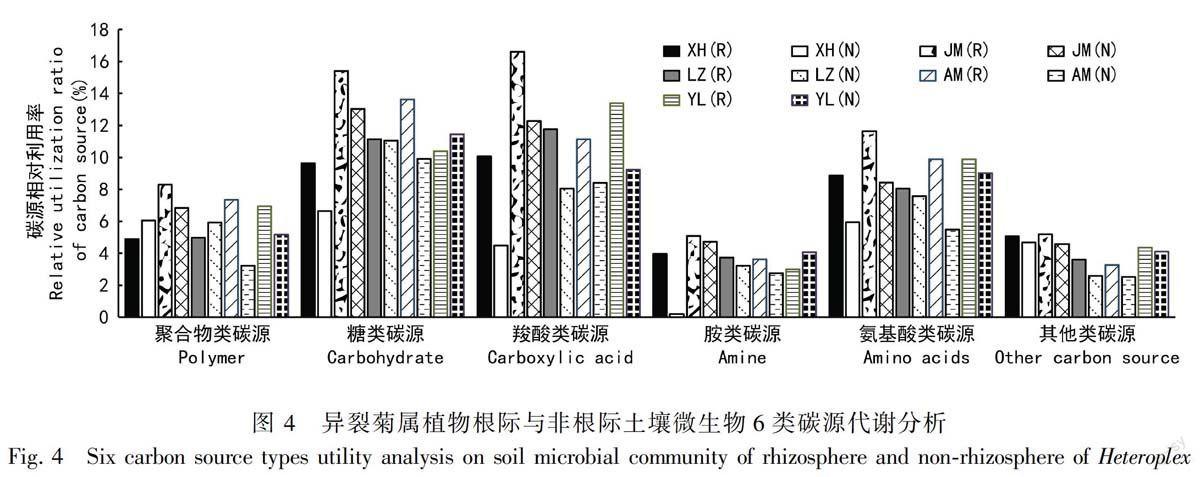
2.3.3 异裂菊属植物根际与非根际微生物利用碳源的类型 Biolog板上的31种碳源可分为糖类、氨基酸类、 羧酸类、 聚合物类、胺类和其他类六大类。由图4可知, 异裂菊属植物对各类碳源的利
用能力存在明显的差异。异裂菊属植物根际、非根际微生物利用的碳源主要是糖类和羧酸类,对胺类和其他类碳源的利用能力相对较低。除异裂菊根际微生物利用糖类的能力低于非根际外,其他4个种的根际微生物利用碳源的能力均高于非根际。异裂菊属5个种根际微生物利用羧酸类碳源的能力均高于非根际。此外,异裂菊属5个种根际微生物利用氨基酸类碳源、其他类碳源的能力也高于非根际。绢叶异裂菊(JM)根际微生物利用碳源的能力相对高于其余4个种。
2.4 异裂菊属植物根际与非根际微生物碳源利用多样性的主成分分析
对72 h时各碳源的AWCD值进行主成分分析(图5),在31种碳源因子中提取前5个因子的贡献率可达86.40%,第1、2主成分得分贡献率分别为36.88%、24.63%,两者累积贡献率达61.51%,因此将前两个主成分得分作图来表征微生物群落碳源代谢特征。主成分分析图中样品间距离越近表示其碳源利用能力相似度越高。由图5可知,在第一主成分上可将5个种的根际、非根际利用碳源的能力分开,其根际利用碳源的能力强于非根际。在第二主成分上5个种根际、非根际微生物利用碳源的能力区别也较为明显,其根际强于非根际。
2.5 异裂菊属植物根际与非根际微生物碳源与土壤因子的冗余分析
冗余分析可确定土壤理化性质对土壤微生物碳源利用模式的影响。土壤理化性质与碳源之间关系二维排序图如图6所示。由图6可知,阳离子交换量、黏粒含量百分率和碱解氮的箭头连线最长,这3个指标对微生物碳源利用模式起到很好的解释,是影响碳源利用模式的最重要因子。影响异裂菊属5个物种根际、非根际微生物碳源利用模式的土壤因素不同。
3 讨论与结论
根际和土壤微生物可影响土壤中物质转化、能量流动反应的生态过程,如有机化合物、高等植物和微生物残体的水解、生物固氮、磷、硫、铁及其他元素转化等(王茹华等,2007)。异裂菊属植物在石山上的分布区域未受人为干扰,采集的植物根际土壤和非根际土壤位于同一区域,根际土壤肥力及其影响因子与非根际相同,但增加了植株的影响。本研究发现异裂菊属5个物种根际土壤pH、碱解氮、速效磷、全磷、速效钾、交换性钾、交换性钙、交换性镁、全氮含量都高于非根际土壤,说明异裂菊属植物根际肥力均有不同程度提高,该区域土壤的保肥和补给能力增强,有利于植物生长。这与何滕兵等(2000)研究结果一致。
植物根际环境非常利于微生物生存,很多植物物种的根系对土壤微生物群落有显著的影响,可使其群落结构发生较大改变。本研究中,异裂菊属根际微生物群落利用碳源的能力高于非根际也证明了这一点。与此同时,本研究结果表明同一属的植物根际微生物群落对碳源的代谢特征较相似,但不同物种的代谢强度存在差异,绢叶异裂菊根际微生物对碳源利用能力最强,凹脉异裂菊非根际微生物对碳源的利用能力最弱,其他队碳源的利用能力比较接近。
在六类碳源中,糖类、羧酸类和氨基酸类化合物是异裂菊属5个种土壤微生物的主要碳源,其次是聚合物类、胺类和其他类型的碳源化合物。主成分分析表明,对PC1和PC2起分异作用的主要碳源分别为羧酸类化合物类和糖类化合物。说明羧酸类化合物类和糖酸类是5种植物群落的微生物群落变化的敏感碳源。本研究结果表明不同植物根际微生物对各碳源具有不同的利用能力,因为这些植物可通过分泌不同的分泌物来影响微生物群落中利用此类碳源微生物的生长。羧酸类化合物类和糖类化合物是5种植物根际微生物的主要碳源,说明这两种化合物是土壤中广泛存在且能被各种微生物很好利用的碳源种类。
据报道,根系分泌物中糖类化合物占可溶性组分的65%,有机酸占33%,其他2%为氨基酸、脂肪酸等。可溶性糖、氨基酸、有机酸等小分子可溶有机物具有络合、螯合能力,可为根际微生物提供有效的碳源和氮源,影响土壤微生物种群的分布。目前这方面的研究已较为全面。异裂菊属根际微生物利用羧酸类化合物碳源的能力最强,说明该类化合物在根际土壤中含量较高或较为普遍。这可能是由于异裂菊属植物分布地土壤呈碱性,盐基离子含量高。异裂菊属分泌的α-酮丁酸等羧酸类化合物不但可以为金属离子提供配位体,影响其生物有效性,还可以酸化土壤微环境。
Kaufmann et al(2004)认为,在营养贫瘠的土壤中,微生物群落功能多样性主要受自然条件、土壤理化性质的影响。本研究中,阳离子交换量、黏粒含量百分率和碱解氮是影响碳源利用模式的最重要因子。这是由于土壤阳离子交换量是反映土壤保肥、供肥和缓冲能力的重要指标(刘世全等,2004),代表土壤肥力水平,肥力高的土壤可提供的生物有效碳源多,能維持较高的微生物活性并激发微生物生长发育(Macci et al, 2016)。土壤团聚体是构成土壤的结构单元,对土壤结构和土壤肥力的形成具有重要作用(文倩等,2014)。森林土壤中碳含量远高于氮,碱解氮含量较低,碱解氮成为土壤中微生物生长繁殖的限制因素。
DGGE技术对微生物群落中数量小于1%的种群检测敏感度较低。两种微生物16S rRNA的GC含量相同,但序列组成却不同,如从DGGE图谱上看它们是同一个条带,这就导致不能准确的判定微生物群落的多样性,分析结果会产生一定的误差。Biolog实验得到的数据量很大,但从微生物代谢功能信息中得到的群落结构的详细信息还很有限,必须结合其他方法深入研究微生物群落结构与功能及其相互关系。
参考文献:
EISENHAUER N, SCHEU S, JOUSSET A, 2012. Bacterial Diversity stabilizes community productivity [J]. PLoS ONE, 7(e345173).
FU LG, 1992. Chinese plant red book [M]. Beijing:Science Press. [付立国, 1992. 中国红皮书——稀有濒危植物 [M]. 北京:科学出版社.]
HAREMANN A, ROTHBALLER M, SCHMID M, 2008. Lorenz Hiltner, a pioneer in rhizosphere microbial ecology and soil bacteriology research [J]. Plant Soil, 312: 7-14.
HE TB, LIU YS, LI TZ, et al, 2000. Soil characteristics of Zanthoxylum Bungeanum with soil and water conservation benefits in karst valley of Guizhou Province [J]. J Soil Water Conserv, 14(2):55-59. [何滕兵, 刘元生, 李天智, 等, 2000. 贵州喀斯特峡谷水保经济植物花椒土壤特性研究 [J]. 水土保持学报, 14(2): 55-59.]
JORGE RO, AXEL DE Z, TON B, et al, 2016. Bacterial rhizosphere biodiversity from several pioneer desert sand plants near Jizan, Saudi Arabia [J]. Open Conf Proc J, (1):71-79.
KAUFMANN K, CHRISTOPHERSEN M, BUTTLER A, et al, 2004. Microbial community response to petroleum hydrocarbon contamination in the unsaturated zone at the experimental
field site Vaerlose, Denmark [J]. Fems Microbiol Ecol, 48(3):387-399.
LIU SQ, PU YL, ZHANG SR, et al, 2004. Spatial change and affecting factors of soilcation exchange capacity in Tibet [J]. J Soil Water Conserv, 18(5):1-5. [劉世全,蒲玉琳,张世熔, 2004. 西藏土壤阳离子交换量的空间变化和影响因素研究 [J]. 水土保持学报,18(5):1-5.]
MACCI C, DONI S, PERUZZI E, et al, 2016. Biostimulation of soil microbial activity through organic fertilizer and almond tree association [J]. Land Degrad Dev, 27(2):335-345.
PII Y, MIMMO T, TOMASI N, et al, 2015. Microbial interactions in the rhizosphere: beneficial influences of plant growth-promoting rhizobacteria on nutrient acquisition process [J]. Biol Fert Soils, 51(4): 403-415.
QIN HN, LIU Y, 2010. A checklist of vascular plants of Guangxi [M]. Beijing: Science Press. [覃海宁, 刘演, 2010. 广西植物名录 [M]. 北京:科学出版社.]
SHI YC, TANG JM, CHAI SF, et al, 2017. Genetic diversity and relationship of endangered plant Heteroplexis microcephala assessed with ISSR polymorphisms [J]. Guihaia, 37(1):9-14. [史艳财, 唐健民, 柴胜丰, 2017. 广西特有珍稀濒危植物小花异裂菊遗传多样性分析 [J]. 广西植物, 37(1): 9-14.]
SU CL, WANG HW, XIE XG, et al, 2016. Effects ofendophytic fungi and Atractylodes lancea powder on rhizosphere microflora and trace elements during continuous peanut cropping [J]. Acta Ecol Sin, 36(7):2053-2065. [苏春沦, 王宏伟, 谢星光, 等, 2016. 内生真菌与苍术粉对连作花生根际微生物区系和微量元素的影响 [J]. 生态学报, 36(7):2053-2065.]
WANG PC, MO BT, CHEN Y, et al, 2016. Effect of karst rocky desertification on soil fungal communities in southwest China [J]. Genet Mol Res, 15(3):1-12.
WANG RH, ZHANG QF, ZHOU BL, et al, 2007. Analysis on the interaction between root exudates andrhizosphere microbes [J]. Chin J Soil Sci, 38(1): 167-172. [王茹华,张启发,周宝利,等, 2007. 浅析植物根分泌物与根际微生物的相互作用关系 [J]. 土壤通报, 38(1): 167-172.]
WEN Q, LI PP, LIN QM, et al, 2014. Characteristics of microbial biomass attributes in soil dry aggregates from lands of different uses in the semi-arid area [J]. Acta Ecol Sin, 34(24): 7403-7410. [文倩,李培培,林启美,等, 2014. 半干旱地区不同土地利用方式下土壤团聚体的微生物量属性 [J]. 生态学报, 34(24): 7403-7410.]
YI SR, HUANG Y, XIAO B, et al, 2012. A preliminary study of the dynamic variation of rhizosphere microorganism communities of the endangered plant Cathaya argyrophylla [J]. J SW Univ (Nat Sci Ed), 34(9): 48-53. [易思荣, 黄娅, 肖波, 2012. 濒危植物银杉根际微生物群落动态变化研究 [J]. 西南大学学报(自然科学版), 34(9): 48-53.]

