福尔马林防治大黄鱼刺激隐核虫病的研究
江 飚,王 晶,罗恒利,陈 佳,李国清,李安兴
( 1.中山大学 生命科学学院,广东 广州 510275; 2.华南农业大学 兽医学院,广东 广州 510642;3.宁德富发水产有限公司,福建 宁德 352002 )
刺激隐核虫(Crytocaryonirritans)寄生于热带、亚热带海水硬骨鱼类的皮肤、鳍、鳃、眼角膜等处,形成大量小白点,可造成鱼的鳃和皮肤损伤及功能障碍[1-2]。其生活史包括4个阶段:滋养体、包囊前体、包囊和幼虫。在水温24~27 ℃时,滋养体生长期为3~7 d,成熟后脱离宿主,形成包囊前体;包囊前体沉于水底后黏附于附着物上,逐渐形成厚的囊壁进入包囊阶段;包囊经历一系列的不对称二分裂,每个包囊可分裂成200~300个子代幼虫;发育成熟的幼虫从包囊逸出,在水中快速游动,寻找和感染宿主进入下一个生活周期[2-3]。刺激隐核虫世代周期短,繁殖率高,大规模爆发时可导致海水养殖鱼类的大量死亡,造成严重的经济损失[4]。
大黄鱼 (Pseudosciaenacrocea) 是我国东南沿海海域主要的经济养殖鱼类[5-6],近年来随着海水渔业集约化程度和养殖面积的提高,海区的养殖密度增大,造成大黄鱼刺激隐核虫病频发,给大黄鱼养殖业的健康发展带来很大的困扰[7]。目前,在大水体的开放型养殖渔场中,暂无有效防治刺激隐核虫病的方法,而在小范围养殖中,多采用物理和化学方法防治刺激隐核虫病,如用淡水浸泡、轮换养殖、紫外线、臭氧、化学药物等方法处理养殖水体中的寄生虫进行防治[8-11]。利用免疫方法预防刺激隐核虫病是一个理想的方法,可以使鱼获得较好的免疫保护,但因为疫苗所用的幼虫不能体外培养,难以大量获得,这种方法现在还难以大规模应用[12]。基于成本和治疗效果,室内大黄鱼育种和暂养过程中爆发刺激隐核虫病,主要通过福尔马林浸泡治疗。
福尔马林具有防腐杀菌性能,其发挥作用主要通过与蛋白质的氨基结合而使蛋白凝固[13]。在水产养殖系统中,福尔马林因能够通过水生生物代谢,保持低生物累积,常用于水体消毒和治疗一些鱼类的疾病[14-15]。然而使用福尔马林不合理不仅不能有效控制刺激隐核虫病还会带来诸多的副作用,如使用福尔马林后鱼的病程暂时得到控制,但易在7~14 d二次爆发;福尔马林会降低水中的溶解氧,导致鱼缺氧死亡[16];Buchmann等[17]研究发现福尔马林会抑制虹鳟(Oncorhynchusmykiss)分泌黏液,使其更易遭受水霉和细菌的继发性感染;此外,过量使用福尔马林可能会影响水产品的进出口贸易[18]。因此,在安全有效的杀虫药物出现之前,研究如何科学合理的使用福尔马林,减少其对水生生物的副作用具有重要意义。笔者对刺激隐核虫和大黄鱼幼鱼进行不同时间、不同质量浓度福尔马林的药浴处理,研究了福尔马林的毒性作用,并根据刺激隐核虫生活史规律,采用不同质量浓度的福尔马林对感染刺激隐核虫的大黄鱼进行药浴治疗试验,探讨使用福尔马林的最佳用量和时间,以期为大黄鱼室内养殖过程中能够合理使用福尔马林防治刺激隐核虫病提供理论依据。
1 材料与方法
1.1 试验药物和刺激隐核虫
福尔马林:分析纯,37%~40%甲醛(浙江巨化集团公司试剂厂)。
刺激隐核虫分离于大黄鱼,参考文献[19]的方法,以大黄鱼作为动物模型,使用亚致死剂量的幼虫感染大黄鱼3~4 d后,将鱼转移到新的容器中饲养,并将黏附于桶底的刺激隐核虫包囊收集于烧杯中,在27 ℃灭菌海水中孵化并收集幼虫进行下一轮感染,建立本试验虫株的传代系统,随时可以获得足够的寄生虫用于试验。
1.2 试验鱼与饲养
大黄鱼[(3.00±0.78) g,(21.00±2.39) g]购于福建省宁德市三都澳大湾鱼排。随机抽取10尾鱼,采集鱼的鳃和刮取皮肤黏液进行镜检,未发现刺激隐核虫。试验鱼在容积为1000 L圆形塑料桶中暂养2周,每日用商品颗粒饲料投喂2次并在投喂前吸除粪便,日投喂量为鱼体质量的2%~3%。养殖用水采用沙滤海水,盐度29~31,温度 (27±1) ℃,溶解氧≥5.0 mg/L,亚硝酸盐<0.2 mg/L,微流水饲养,流速为100 L/h。
1.3 幼虫试验
根据文献[19]的方法,略作修改:幼虫脱包达到高峰期,收集2 h内孵化的虫液,小心混匀后吸取10份(每份10 μL)虫液于载玻片,每份加1 μL福尔马林杀死幼虫,光学显微镜(40×)下计数,计算出幼虫的密度,用灭菌海水将虫液密度调成2500 个/mL。
将福尔马林用灭菌海水配成1000 mg/L,96孔板中加入120 μL灭菌海水,在第1和第2个孔中加入120 μL配好的药液,从第2个孔等比稀释至第12孔。然后每孔加入120 μL(约300个幼虫)虫液,轻轻地混匀,室温下孵育,以海水为对照组,于10、30、60、120 min观察结果,能引起100%幼虫死亡被认为是最终有效质量浓度。试验重复3次。
1.4 包囊试验
收集未分裂包囊,经多次洗涤至干净无杂质后,挑入24孔细胞培养板中,每孔约100个。加入不同比例福尔马林和灭菌海水,使每孔液体总体积为2 mL,同时药物质量浓度分别为200、150、125、100、75、50 mg/L,以灭菌海水为对照组,每组药物质量浓度分别处理1、2、4 h后,用灭菌海水多次洗涤彻底除去药物并加入2 mL新的灭菌海水。置于27 ℃恒温培养箱中培养,每日更换1次灭菌海水。试验开始时置于倒置显微镜(40×)下统计每孔包囊数,168 h后统计未孵化包囊数,本试验重复3次。包囊死亡率按下式计算:
包囊死亡率/%=未孵化的包囊/包囊总数×100%
1.5 急性毒性试验
预试验:为确定试验所需的质量浓度,先选择较大的质量浓度系列100、200、400、600、800 mg/L进行试验。每质量浓度放入5尾鱼[(3.00±0.78) g ],不设平行组,试验持续96 h,每日记录各质量浓度组的死亡鱼数,并及时取出死鱼,统计出24 h 100%死亡的最低质量浓度为600 mg/L和96 h全部存活的最高质量浓度为200 mg/L。
根据预试验结果,在药物质量浓度能在24 h内使鱼全部死亡的最低质量浓度和96 h鱼全部存活最高质量浓度之间,以1.2间隔系数设7个质量浓度梯度,分别是200、240、288、346、415、498、598 mg/L 7个试验组,以海水为对照组,每组设2个平行组,每平行组10尾大黄鱼[(3.00±0.78) g],水温(27±1) ℃。记录24、48、72、96 h内每组鱼的死亡数。
半致死质量浓度(LC50)采用Reed-munch方法,分别计算在12、24、48、96 h的半致死质量浓度,即中间忍受限(TLm):
TLm=C1+P1-(P1-50%)/(P1-P2)×(C2-C1)
式中,C1、C2分别为存活率接近50%的低端质量浓度和高端质量浓度,P1、P2分别为相应的存活率。
安全质量浓度(SC):
SC=0.3×TLm48/(TLm24/TLm48)2
式中,TLm24、TLm48分别为24、48 h的半致死质量浓度。
1.6 治疗试验
采用2种不同福尔马林质量浓度治疗刺激隐核虫病,分别为125、75 mg/L,以灭菌海水为对照组。每组设2个重复,每重复组20尾大黄鱼 [(21.0±2.39) g],水温 (27±1) ℃。试验前对试验鱼进行人工发病,按文献[19]的方法收集孵化2 h内的活跃幼虫并计算出密度,以3000 个/鱼进行人工感染,海水用量为5 L/鱼,感染2 h后开启流水。人工发病第3 d,每组以对应的福尔马林治疗用量药浴2 h,之后进行100%换水,恢复微流水饲养,每3 d药浴1次,共3次。每日记录每组鱼的死亡数,并及时取出死鱼,共记录14 d。
1.7 数据处理
所得数据用SPSS 11.0和Microsoft Excel软件分析处理,采用单方差因素分析显著性(P<0.05或P<0.01)。并使用GraphPad Prism 5软件作图。
2 结 果
2.1 幼虫对福尔马林的敏感性
试验结果表明,福尔马林对刺激隐核虫幼虫表现出较强的杀灭作用。在福尔马林稀释液中药浴分别处理10、30、60、120 min,杀死全部幼虫所需要的福尔马林质量浓度分别为62.5、62.5、31.3、15.6 mg/L(表1)。
2.2 包囊对福尔马林的敏感性
结果显示,包囊存活率与福尔马林质量浓度、处理时间成负相关。当福尔马林质量浓度为50~125 mg/L时,随着福尔马林质量浓度增加,杀灭作用随之增强;当福尔马林质量浓度为125~200 mg/L,处理时间1 h及以上,对包囊的杀灭作用均为100%。50 mg/L的福尔马林对包囊的存活率具有一定的影响,且包囊存活率随药浴处理时间的延长而降低,但处理4 h尚不能杀死全部包囊。
处理1 h可以100%杀灭包囊所需福尔马林质量浓度为100~125 mg/L,处理2、4 h完全杀灭包囊的福尔马林质量浓度为50~75 mg/L(表2)。被福尔马林处理过的包囊不能够进行分裂,包囊逐渐呈暗黄,内部结构瓦解,而未处理包囊能正常发育,幼虫逸出后形成透明空壳(图1)。
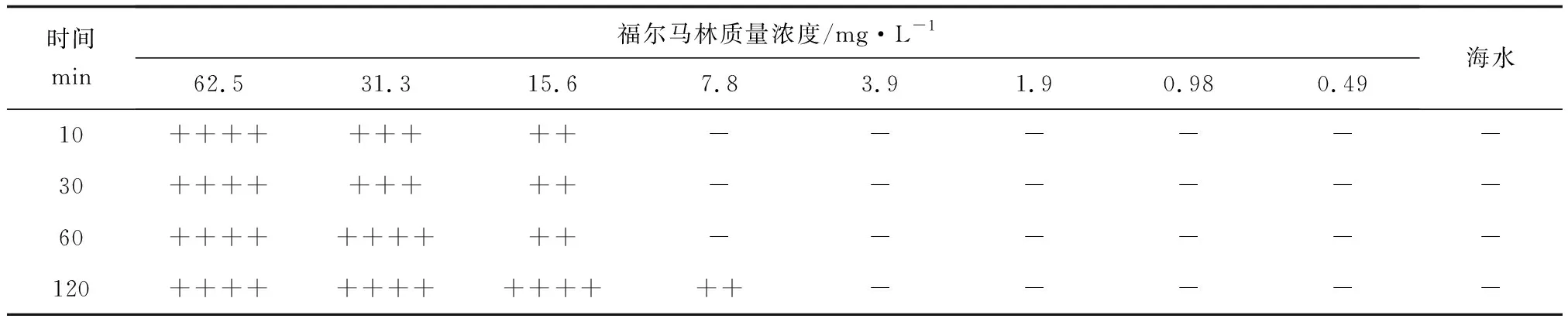
表1 福尔马林杀灭刺激隐核虫幼虫的效果
注:“++++”、“+++”、“++”、“+”、“-”分别代表能引起100%、75%、50%、25%、0%幼虫死亡.

图1 福尔马林处理刺激隐核虫包囊的显微镜观察(40×)a:未分裂包囊;b:75 mg/L福尔马林处理2 h包囊168 h的形态;c:未处理的包囊168 h的形态.
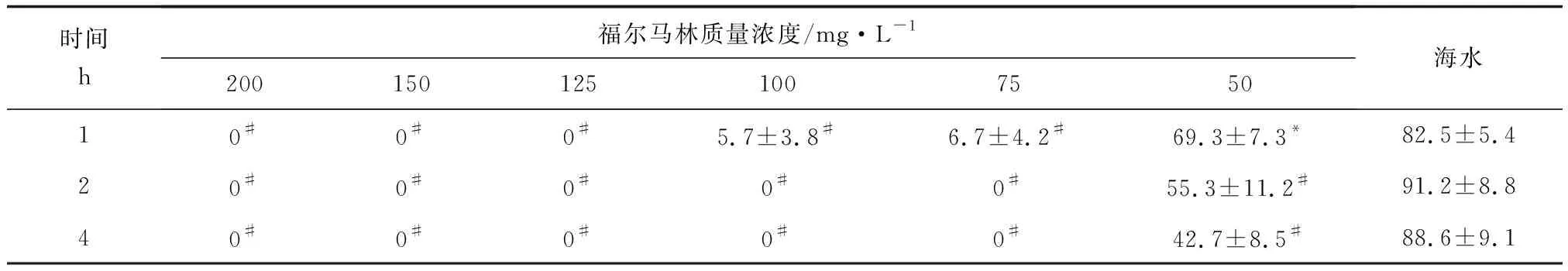
%
注:表中代表包囊存活的百分比, *示与对照组差异显著(P<0.05);#示与对照组差异极显著(P<0.01).
2.3 大黄鱼幼鱼药物安全性
幼鱼对福尔马林表现出一定的耐受力,结果见表3,随着福尔马林质量浓度的增加,大黄鱼死亡逐步升高,而较低质量浓度下(≤200 mg/L)不会造成死亡,当福尔马林质量浓度为240 mg/L时,12 h内出现死亡,死亡率为5%;当质量浓度达到498 mg/L时,大黄鱼幼鱼12 h内的死亡率达到95%;12、24、48、96 h的半致死质量浓度分别为394.7、365.3、334.4、322.8 mg/L (表4);计算可知,体质量(3.00±0.78) g的大黄鱼安全质量浓度为119.57 mg/L。
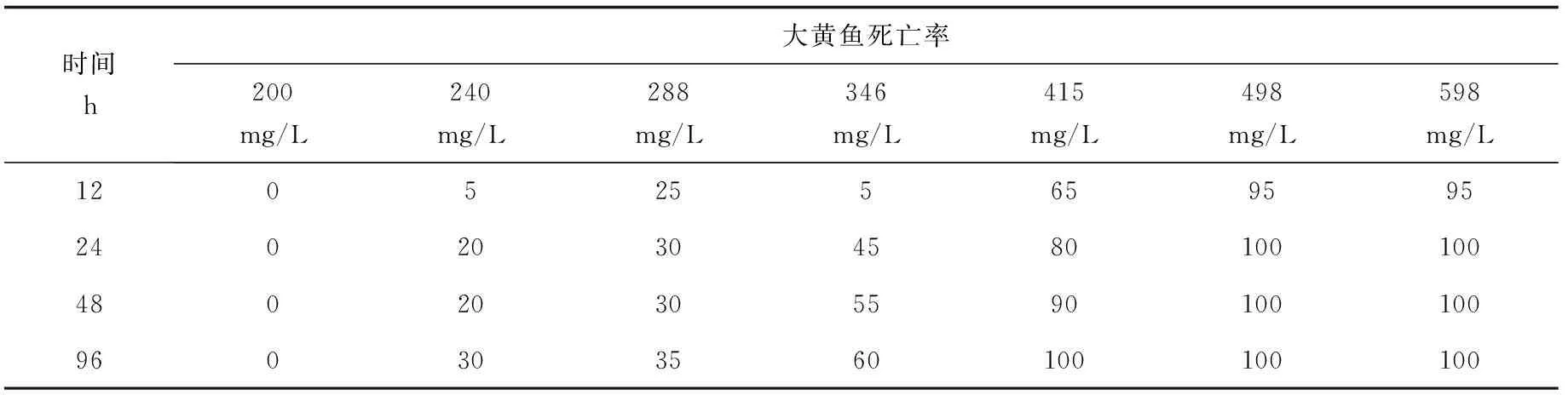
表3 大黄鱼幼鱼对福尔马林的耐受力 %
注:表中为大黄鱼(3.00±0.78) g幼鱼在不同福尔马林质量浓度处理后12、24、48、96 h的死亡率.

表4 福尔马林对大黄鱼幼鱼的半致死质量浓度
2.4 治疗效果
根据福尔马林杀灭包囊的质量浓度设置了75、125 mg/L两个质量浓度梯度,结果见图1,对照组和75 mg/L组在第6 d开始出现大量死亡,其中对照组在第8 d全部死亡,75 mg/L在第12 d全部死亡,而125 mg/L组的死亡率显著低于对照组和75 mg/L组(P<0.01),存活率为87.5%。

图2 不同处理组大黄鱼的死亡率
3 讨 论
福尔马林在生产上,被广泛用于水体消毒和防治鱼类疾病[13],对鱼类体外寄生虫病的防治效果尤为明显。在水产上常用的3种药物中,福尔马林对多子扇形游仆虫(Euplotesvannus)和寡毛双眉虫(Diophrysoligothrix)的杀灭效果优于鲁哥氏液、高锰酸钾[20-21];Shinn 等[22]研究表明,水体中合理的福尔马林含量,可有效防控多子小瓜虫(Ichthyophthiriusmultifiliis)病的爆发;闫茂仓等[14]研究也发现,全池泼洒20~80 mg/L的福尔马林可有效防治刺激隐核虫病。
由本试验结果可知,刺激隐核虫对福尔马林耐受力较低,当福尔马林质量浓度为62.5 mg/L药浴处理 10 min或福尔马林质量浓度为15.6 mg/L处理2 h均可100%杀死刺激隐核虫幼虫;当质量浓度为75 mg/L处理2 h可以完全杀灭包囊。因此,在试验条件下,使用质量浓度为75 mg/L的福尔马林,处理2 h可以完全杀灭体外刺激隐核虫。而利用125、75 mg/L两种剂量的福尔马林,每3 d药浴处理感染刺激隐核虫的大黄鱼的研究结果表明,在实际生产中,质量浓度75 mg/L福尔马林不能完全杀灭水体中刺激隐核虫包囊,还会造成刺激隐核虫对宿主的重复感染;而当药浴福尔马林质量浓度达到125 mg/L以上时,可杀灭水体中所有自由生活阶段刺激隐核虫。生产中,利用质量浓度125 mg/L福尔马林药浴一次感染刺激隐核虫的病鱼,可灭活自由生活阶段的刺激隐核虫,防止再次对宿主的重复感染从而有效控制刺激隐核虫病。

刺激隐核虫病是海水鱼类养殖业危害重大的寄生虫病[4,6],易发生多次重复感染或导致鱼类继发细菌病,进而造成死亡[26]。滋养体阶段的刺激隐核虫寄生于鱼的真皮内,药物难以杀灭,是其难以治疗的主要原因。杀灭水体中自由生活阶段的刺激隐核虫和切断寄生虫的传播途径是目前预防和治疗该病的重要策略,生产中,定期轮换养殖池或通过垫布移除水体中刺激隐核虫包囊等物理方法或依赖如甲醛、硫酸铜等化学药物杀虫可以有效控制刺激隐核虫病[7,9,27]。但物理方法在实际生产应用中耗时耗力,工人更偏向使用化学药物。虽然福尔马林对鱼的毒性较低,但生产中大量不合理的使用会导致许多不良后果,如造成病原菌耐性、对鱼的毒性、污染环境、药物残留导致的食品安全问题等等。本试验结果虽然表明一定范围内的福尔马林质量浓度对大黄鱼无显著影响,但大黄鱼是应激性很强的鱼类[5],大量和长期使用福尔马林易造成大黄鱼自身抗病力下降,导致其他疾病的爆发[16-18]。因此实际生产上要根据滋养体在鱼体的寄生期为3~7 d和包囊从形成到孵化出幼虫至少需要3 d时间的规律,每隔3 d用125 mg/L的福尔马林对鱼池进行药浴处理,处理3次,可有效杀灭水体中的刺激隐核虫,防止该寄生虫对大黄鱼的重复感染。
[1] Colomi A,Burgess P.CryptocaryonirritansBrown 1951,the cause of ‘white pot disease’ in marine fish:an update [J]. Aquarium Sciences and Conservation,1997,1(4):217-238.
[2] Colorni A. Aspects of the biology ofCryptocaryonirritans,and hyposalinity as a control measure in cultured gilthead sea breamSparusaurata[J].Diseases of Aquatic Organisms, 1985(1):19-22.
[3] Wilkie D W, Gordin H. Outbreak of cryptocaryoniasis in marine aquaria at Scripps Institution of Oceanography[J]. California Fish and Game,1969,55(3):227-236.
[4] 陈燕婷.福建省夏季网箱养殖鱼类主要病害情况及对策[J].中国水产,2011(9):48-51.
[5] 刘家富.大黄鱼养殖与生物学[M].厦门:厦门大学出版社,2013:2-8.
[6] 肖友红. 大黄鱼人工养殖技术概述[J].中国水产, 1998(7):30-31.
[7] 苏跃中.福建省主要养殖区海水网箱养殖鱼类刺激隐核虫病的调查及防控对策[J].水产科技情报,2009,36(1):4-7.
[8] 黄玮,李安兴.集约化海水养殖中刺激隐核虫病的综合防治[J].科学养鱼,2004,20(3):44-46.
[9] Jiang B,Li Y W,Abdullahi A Y,et al.Placemat and rotational culturing:a novel method to controlCryptocaryonirritansinfection by removing tomonts[J].Aquaculture, 2016(459):84-88.
[10] Hirazawa N,Goto T,Shirasu K.Killing effect of various treatments on the monogeneanHeterobothriumokamotoieggs and oncomiracidia and the ciliateCryptocaryonirritanscysts and theronts [J]. Aquaculture, 2003,223(1/4):1-13.
[11] Colorni A.Biology ofCryptocaryonirritansand strategies for its control [J].Aquaculture, 1987,67(1/2):236-237.
[12] 邱军强,刘玮,杨先乐,等.刺激隐核虫免疫学研究进展[J].中国病原生物学杂志,2011,6(10):787-789.
[13] Hang F X,Hargreaves J A,Kingery W L,et al.Accumulation,distribution,and toxicity of copper in sediments of catfish ponds receiving periodic copper sulfate applications[J].J Environ Aqua,2001(30):912-919.
[14] 闫茂仓,邵鑫斌,单乐州,等.福尔马林防治鮸鱼Miichthysmiiuy(Basilewsky)刺激隐核虫(Cryptocaryonirritans)的研究[J].现代渔业信息,2008,11(23):17-20.
[15] 杨廷宝,林蠡,陈勇,等.福尔马林处理对石斑拟合片盘虫和斜带石斑鱼的影响[J].中山大学学报:自然科学版,2003,42(4):56-63.
[16] Pillay T V R,Kutty M N. Aquaculture:principles and practices[M].Oxford:Blackwell Publishing,2005.
[17] Buchmann K,Bresciani J,Jappe C. Effects of formalin treatment on epithelial structure and mucous cell densities in rainbow trout,Oncorhynchusmykiss(Walbaum),skin[J].Journal of Fish Diseases,2004,27(2):99-104.
[18] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Formaldehyde,2-butoxyethanol and 1-tert-butoxypropan-2-ol[R].Lyon:World Health Organization, International Agency for Research on Cancer,2006.
[19] Dan X M,Li A X,Lin X T,et al.A standardized method to propagateCryptocaryonirritanson a susceptible host pompanoTrachinotusovatus[J].Aquaculture,2006,258(1/4):127-133.
[20] 邱彦涛,宋微波.3种药物对扇形游仆虫Euplotesvannus(纤毛门,寡毛目)的急性毒性作用[J].应用与环境生物学报,2003,9(6):623-626.
[21] 邱彦涛,宋微波.3种药物对寡毛双眉虫Diophrysoligothrix(纤毛虫门,腹毛目)的急性毒性[J].应用与环境生物学报,2003,8(6):623-626.
[22] Shinn A,Taylor N,Wootten R. Development of a management system for the control ofIchthyophthiriusmultifiliis[J].Trout News,2005,40(5):21-25.
[23] Bodensteiner L R,Sheehan R J,Lewis W M,et al.Effects of repetitive formalin treatments on channel catfish juveniles[J].J Aquatic Animal Health,1993(3):59-63.
[24] Smith S D,Gould R W,Zaugg W S,et al.Safe prerelease disease treatment with formalin for fall chinook salmon smolts[J].Progressive Fish-culturist,1987,49(2):96-99.
[25] Powell M D,Speare D J,Fulton A E,et al.Effects of intermittent formalin treatment of Atlantic salmon juveniles on growth,condition factor,plasma electrolytes,and hematocrit in freshwater and after transfer to seawater[J].J Aquatic Animal health,1996 (2):64-69.
[26] Yin F,Gong Q,Li Y, et al.Effects ofCryptocaryonirritansinfection on the survival, feeding, respiratory rate and ionic regulation of the marbled rockfishSebastiscusmarmoratus[J]. Parasitology,2014(141):279-286.
[27] Hirazawa N,Oshima S,Hara T,et al. Antiparasitic effect of medium-chain fatty acids against the ciliateCryptocaryonirritansinfestation in the red sea breamPagrusmajor[J]. Aquaculture,2001,198(3/4):219-228.

