活细胞在线监控L-羟脯氨酸补料发酵工艺的研究
蔡萌萌,户红通,刘子强,徐庆阳,2,3,陈宁,2,3*
1(天津科技大学 生物工程学院,天津,300457) 2(代谢控制发酵技术国家地方联合工程实验室,天津,300457)3(天津市氨基酸高效绿色制造工程实验室,天津,300457)
L-羟脯氨酸是胶原蛋白的主要组成成分,具有抗氧化、抗辐射、减肥、治疗疾病等作用,在医药、生化、食品及美容业等方面具有广泛应用。L-羟脯氨酸的生产方法有生物提取法、化学合成法和微生物发酵法。目前,国内生产L-羟脯氨酸的主要方法是生物提取法,但该方法存在纯化步骤长,成本高,废弃物污染严重等缺点[1];化学合成法也因成本高昂而不适合工业生产[2];微生物发酵法具有原料来源广泛,反应所需能耗低,环境污染小等优点。
可靠的活细胞量是发酵过程中重要的参数之一,有代谢活力的细胞量与生产效率密切相关[3]。发酵过程中需要根据细胞数量来调节补料[4],传统的补料策略通常是根据发酵液的吸光度来调节,但吸光度反映的是发酵液中的细胞总量,包括死细胞和活细胞,同时它的数值会在一定程度上受培养基成分的影响,所以单纯根据吸光度并不能对发酵过程进行准确的调控。活细胞在线检测仪能够实时监测发酵过程中的电容,只有具有完整细胞膜的细胞才能被极化形成电容,而细胞膜破裂的死细胞和发酵液中的培养基颗粒等不会形成电容,所以不会被检测到[5],且电容值和活细胞数量之间存在线性关系[6],根据该数值调控L-羟脯氨酸发酵,能够有效地控制发酵过程中副产物的形成,提高产品产量和糖酸转化率。
本实验在安装有活细胞在线检测仪的发酵罐中进行L-羟脯氨酸的发酵,发酵过程中根据电容值进行补料调节,通过对传统补料发酵与活细胞在线监控补料发酵的代谢流量进行分析,确定活细胞在线监控补料技术对L-羟脯氨酸发酵的影响,为进一步提高L-羟脯氨酸产量,提高糖酸转化率,减少副产物的形成奠定基础。
1 材料与方法
1.1 菌种
Escherichiacoli4HYP,由天津科技大学代谢工程研究室提供。
1.2 培养基
斜面培养基:蛋白胨10 g/L,酵母粉5 g/L,KH2PO41 g/L,MgSO40.4 g/L,NaCl 10 g/L,琼脂20 g/L,卡那霉素50 mg/L。
种子培养基:葡萄糖30 g/L,酵母粉6 g/L,柠檬酸0.5 g/L,(NH4)2SO41 g/L,KH2PO42 g/L,VB11 mg/L,VH0.3 mg/L,卡那霉素50 mg/L。
1.3 培养方法
1.3.1 菌种活化
在无菌条件下,取2环保菌管中的菌种接种于斜面培养基中,37 ℃恒温静置培养12 h,再将斜面菌种接种于250 mL茄形瓶中,37 ℃恒温静置培养12 h。
1.3.2 5 L罐种子培养
在无菌条件下,将适量无菌水倒入茄形瓶中,用接种环将菌体悬浮,然后采用火焰接种的方式将菌悬液接种于5 L种子罐培养基中进行培养。培养温度为37 ℃,初始通气量为2 L/min,初始搅拌转速为200 r/min,通过自动流加25%的氨水控制培养基pH为7.0~7.2,当溶氧低于25%时,通过搅拌和通风控制溶氧在25%~30%,以泡敌消泡,每隔2 h测样、记录数据,当OD600值达到15左右时,准备接入发酵培养基。
1.3.3 30 L罐发酵培养
在小学语文教学中,通过阅读教学可以培养学生的综合能力,提高学生的语文素养,因此,教师要加强阅读教学,使阅读教学发挥重要的作用,确保学生阅读学习的有效性,要提倡新课改的教学理念,创新教学方法,合理地运用多元化教学方式,使小学语文阅读教学工作得到良好的进展,使其发挥重要的教学价值,下面对小学语文阅读教学策略进行详细的分析和探讨。
按10%的接种量将种子液接种至装有发酵培养基的30 L发酵罐中,培养温度为37 ℃,通过自动流加25%的氨水控制培养基pH为7.0~7.2,通过搅拌和通风控制溶氧在25%~30%,当培养基中葡萄糖耗尽时,以一定的脉冲比流加80%的葡萄糖溶液,当溶氧无法达到25%时,保持最大转速和通风继续发酵,发酵过程中,以泡敌消泡,每隔2 h测样、记录数据。
1.4 分析方法
1.4.1 pH值测定
采用pH 6.4~8.0的精密pH试纸及发酵罐附带的pH电极进行测定。
1.4.2 菌体浓度测定
见参考文献[7]。
1.4.3L-羟脯氨酸含量测定
取适量发酵液于13 000 r/min离心2 min,获得发酵上清液,取20 μL上清液加入1 mL 5%双氧水溶液中,滴2滴1% CuSO4溶液,然后加入1 mL 10% NaOH溶液,摇匀后室温反应10 min,直至淡黄色消失,不再产生气泡,加入1 mL 1%对二甲氨基苯甲醛硫酸溶液,摇匀后沸水浴5 min,颜色由粉红色变为暗红色,冷却后加入10 mL蒸馏水,摇匀后在560 nm处测吸光度,根据标准曲线求得L-羟脯氨酸浓度。其中标准曲线的绘制方法为:分别配制质量浓度为0.0、2.0、4.0、6.0、8.0、10.0 g/L的L-羟脯氨酸标准溶液,按照上述方法进行测定,绘制标准曲线。
1.4.4 有机酸含量测定
采用高效液相色谱法检测有机酸含量。色谱柱Aminex HPX-87H Column(300 mm×7.8 mm);流动相5 mmol/L H2SO4;柱温30 ℃;流速0.5 mL/min;紫外检测波长215 nm。
1.4.5 氨基酸副产物测定
采用Elite-AAA氨基酸分析仪进行测定。
1.4.6 活细胞在线检测
使用来自ABER公司的活细胞在线检测仪,将其连接在30 L发酵罐上,121 ℃、20 min原位灭菌,在接入种子液前进行清零处理,接种后进行计数处理,活细胞在线检测仪即可将发酵液中的电容信号经过信号处理和软件分析计算自动得出电容值。
1.4.7L-羟脯氨酸生物合成代谢流平衡模型的建立
见参考文献[8-11]。
2 结果与分析
2.1 活细胞在线监控补料发酵对补糖速率的影响及最佳补糖策略的确定
常规补料发酵L-羟脯氨酸是根据OD600值调整补糖速率,活细胞在线监控补料发酵是根据活细胞在线检测仪显示的电容值进行补料调节,发酵过程中,OD600值和电容值的变化趋势如图1所示。

图1 OD600值与电容Fig.1 OD600 and capacitance
由图1可以看出,在菌体生长的迟缓期和对数期,OD600值和电容值的增长趋势大致相同,当菌体生长达到稳定期之后,OD600依然表现出轻微增长的趋势,而电容值则先呈稳定状态,然后出现明显下降的趋势。这是因为稳定期时,菌体生长和死亡的数量处于动态平衡之中,吸光度只能反映出细菌总数,不能区分死、活细胞,所以OD600只能表现出菌体数缓慢增长的状态,而活细胞在线检测仪是检测发酵液中活菌体形成的电容体系,细胞膜通透性发生变化的死菌体不会被检测到,因此,电容值能及时反映出活菌数状态[12]。稳定期之后,菌体生长进入衰亡期,菌体死亡数量大于生长数量,此时,电容值呈明显下降趋势,OD600值仍呈稳定状态。
为了比较常规补料发酵和活细胞在线监控补料发酵的区别,确定活细胞在线监控补料发酵的最佳补糖策略,本实验对补糖策略1、2、3、4和5进行了比较,其中,策略1是常规补料发酵,策略2、3、4和5是活细胞在线监控补料发酵,具体补糖速率如图2所示。不同补糖策略对L-羟脯氨酸产量及乙酸积累量的影响如图3所示。
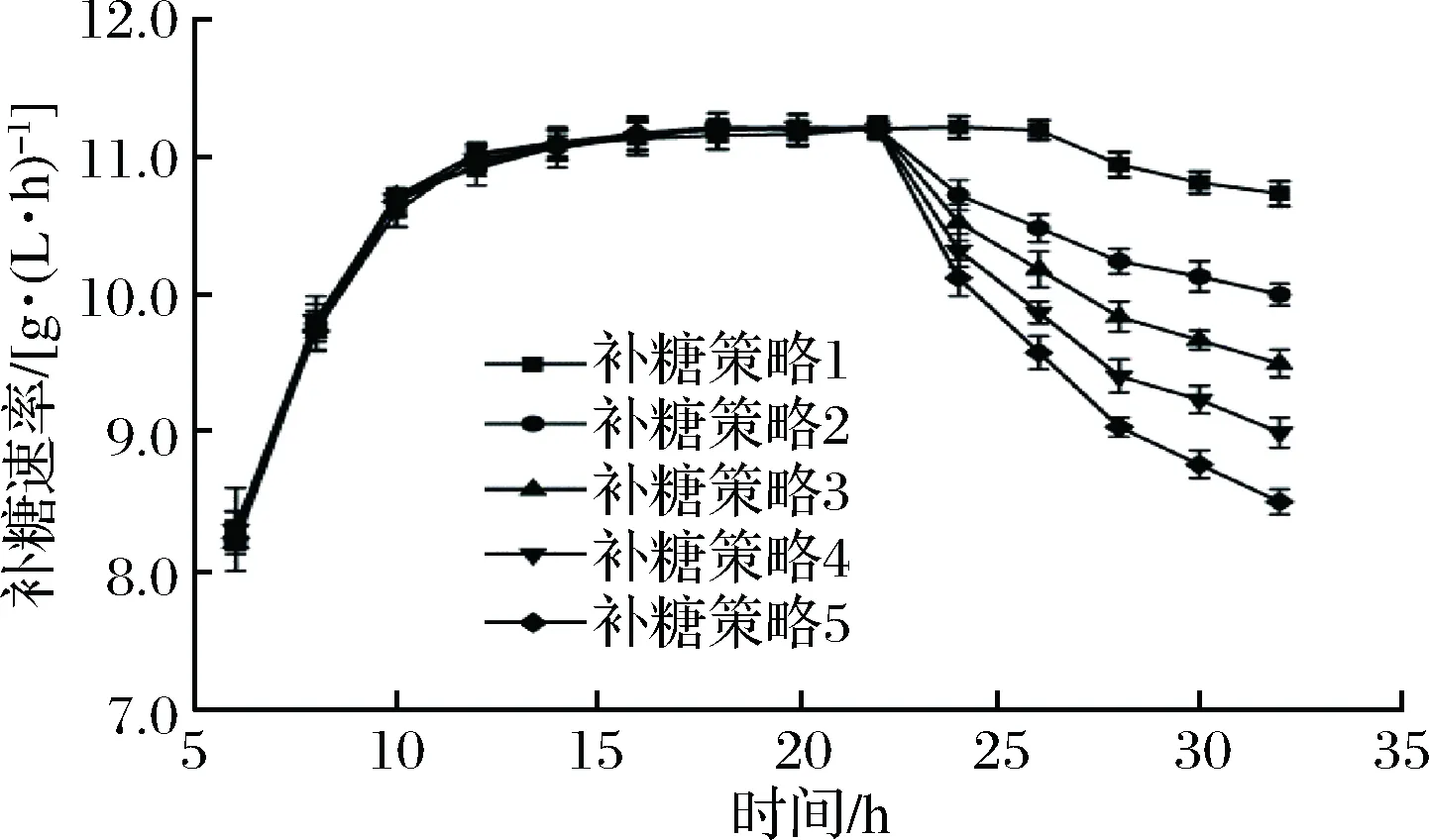
图2 活细胞在线监控发酵对补糖速率的影响Fig.2 Effect of online monitoring feed fermentation of living cells on sugar supplement rate

图3 不同补糖策略对L-羟脯氨酸产量及乙酸积累量的影响Fig.3 Effect of different sugar supplement strategies on the L-hydroxyproline production and accumulation of acetic acid
由图2可以看出,在菌体生长稳定期之前,常规补料和活细胞在线监控补料两种补料方式的补糖速率基本相同,但稳定期之后,OD600值仍呈缓慢上升趋势,而电容值能呈现出活菌数减少的趋势。因此,采用常规补料发酵策略不能及时对补糖速率进行调整,而活细胞在线监控补料能够在发酵中后期及时降低补糖速率,从而减少副产物的形成,降低生产成本。由图3可知,随着中后期补糖速率的降低,发酵液中乙酸积累量逐渐减少,同时也降低了对菌体的抑制作用,产量得以提高,但以策略5(发酵中后期及时降低补糖速率,最终降到8.5 g/(L·h))进行补糖时,可能是由于补糖量不能满足菌体需要,最终导致产量较低,所以,确定策略4(发酵中后期及时降低补糖速率,最终降到9 g/(L·h))为最佳的补糖策略,此时,L-羟脯氨酸产量最高,达42.03 g/L,乙酸积累量为2.75 g/L,比常规发酵降低了48.69%。
2.2 活细胞在线监控补料发酵对L-羟脯氨酸产量的影响
采用活细胞在线监控补料发酵对L-羟脯氨酸产量的影响如图4所示。
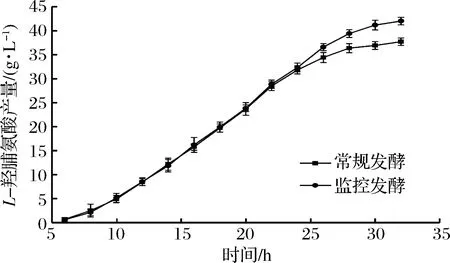
图4 活细胞在线监控补料发酵对L-羟脯氨酸产量的影响Fig.4 Effect of online monitoring feed fermentation of living cells on L-hydroxyproline production
采用活细胞在线监控补料发酵,在发酵前24 h,L-羟脯氨酸产量和常规补料发酵的产量大致相同,这是因为发酵22 h之前,两种补料发酵方式的控制条件相同,补糖速率也基本一致,但22 h之后,监控发酵及时调整补糖速率,将补糖速率降低,有效地抑制了副产物的形成,而常规发酵却没有及时对补糖速率进行调整,导致副产物积累,对菌体产生抑制作用,24 h之后,监控发酵的产量明显超过常规发酵的产量,最终,发酵32 h,活细胞在线监控补料发酵L-羟脯氨酸的产量达到42.03 g/L,较常规补料发酵的37.73 g/L提高了11.39%。
2.3 活细胞在线监控补料发酵对糖酸转化率的影响
在工业生产过程中,较高的糖酸转化率可以给企业带来更高的经济效益,采用活细胞在线监控补料发酵对L-羟脯氨酸糖酸转化率的影响如图5所示。
由图5可以看出,在发酵22 h之前,常规补料发酵与活细胞在线监控补料发酵L-羟脯氨酸的糖酸转化率基本一致,但22 h之后,活细胞在线监控补料发酵降低补糖速率,常规发酵却未及时做出调整,导致副产物积累,对菌体产生抑制作用,所以,监控发酵的糖酸转化率明显超过常规发酵的糖酸转化率,最终达19.79%,较常规补料发酵提高了14.92%。所以,活细胞在线监控补料发酵可以在一定程度上提高葡萄糖转变为L-羟脯氨酸的效率,对降低L-羟脯氨酸生产成本,提高工厂效益有重要的意义。

图5 活细胞在线监控补料发酵对糖酸转化率的影响Fig.5 Effect of online monitoring feed fermentation of living cells on glucose conversion rate
2.4 活细胞在线监控补料发酵对L-羟脯氨酸代谢流的影响
基于L-羟脯氨酸代谢网络,得到化学计量平衡式和代谢节点处反应速率方程,分别见表1和表2。
根据发酵过程中菌体的生长情况,假设22~28 h这一阶段细胞处于拟稳态,测定此时间段葡萄糖、丙氨酸、乳酸、乙酸、赖氨酸和L-羟脯氨酸的胞外浓度,分别计算其积累或消耗速率,再利用MATLAB软件计算L-羟脯氨酸生物合成途径的代谢流分布情况,得到的结果如图6和图7所示。

表1 化学计量平衡式Table 1 Stoichiometric equation

表2 代谢节点处反应速率方程Table 2 Reaction rate equation of metabolic nodes

图6 常规补料发酵时L-羟脯氨酸合成代谢流分布Fig.6 Metabolic flux distribution of L-hydroxyproline without online monitoring feed fermentation of living cells

图7 活细胞在线监控补料发酵时L-羟脯氨酸合成代谢流分布Fig.7 Metabolic flux distribution of L-hydroxyproline with online monitoring feed fermentation of living cells
6-磷酸葡萄糖(glucose 6-phosphate, G6P)、丙酮酸(pyruvic acid, Pyr)和异柠檬酸(isocitric acid, ICI)是L-羟脯氨酸生物合成代谢途径的关键节点。G6P决定着流向糖酵解途径(glycolytic pathway, EMP)和磷酸戊糖途径(pentose phosphate pathway, HMP)的流量分布,HMP途径能够为L-羟脯氨酸合成中心代谢途径的关键反应提供还原力,使更多的代谢流流向L-羟脯氨酸;Pyr是EMP途径进入三羧酸循环(tricarboxylic acid cycle, TCA)的入口,当EMP途径的代谢流量超过TCA循环的代谢能力时,会使代谢流流向副产物,造成副产物的积累;ICI的合成需要CO2固定反应和乙醛酸循环提供草酰乙酸(oxalacetic acid, OAA),而ICI又是L-羟脯氨酸合成的前体物,同时也是TCA循环转向乙醛酸循环的入口代谢物,所以ICI对调节TCA循环和乙醛酸循环之间的流量分配具有重要作用。由图7可知,常规发酵进入EMP途径和HMP途径的代谢流分别为63.40、36.60,生成乙酸的代谢流为5.83,从ICI进入乙醛酸循环和TCA循环的代谢流分别为4.44、151.58,L-羟脯氨酸合成的代谢流为23.20,而活细胞在线监控补料发酵进入EMP途径的的代谢流为58.01,进入HMP途径的代谢流为41.99,生成乙酸的代谢流为5.54,从ICI进入乙醛酸循环和TCA循环的代谢流分别为3.69、147.43,L-羟脯氨酸合成的代谢流为26.96。所以,采用活细胞在线监控补料发酵,EMP途径和乙醛酸循环的代谢流分别减少了8.50%、16.89%,HMP途径的代谢流增加了14.73%,乙酸合成的代谢流减少了4.97%,L-羟脯氨酸合成的代谢流提高了16.21%。
3 结论
本研究利用活细胞在线监控技术调节L-羟脯氨酸补料发酵,能够在发酵中后期根据活细胞量及时调整补糖策略,确定了活细胞在线监控补料发酵的最佳补糖策略,避免了因补糖过多导致的副产物大量积累,或补糖过少导致的L-羟脯氨酸产量下降等问题,提高了葡萄糖利用率,降低了生产成本。采用活细胞在线监控补料发酵,在发酵中后期及时降低补糖速率,最终降到9 g/(L·h)时最佳,最终,L-羟脯氨酸产量提高了11.39%,乙酸积累量减少了48.69%,糖酸转化率提高了14.92%,EMP途径和乙醛酸循环的代谢流分别减少了8.50%、16.89%,HMP途径的代谢流增加了14.73%,乙酸合成的代谢流减少了4.97%,L-羟脯氨酸合成的代谢流提高了16.21%。
[1] 张自强,赵东旭,杨新林.羟脯氨酸的研究与开发[J].氨基酸和生物资源,2006 (1):55-58+62.
[2] JURCZAK J,PROKOPOWICZ P,GOBIOWSKI A.Highly stereoselective synthesis ofcis-(2R,3S)-3-hydroxyproline[J].Tetrahedron Letters,1993,34(44):7 107-7 110.
[3] 李兰,王泽建,金勇,等.电容法在线测定发酵过程中毕赤酵母浓度的研究[J].中国生物工程杂志,2014,34(3):91-95.
[4] RØNNEST N P,STOCKS S M,LANTZ A E,et al.Introducing process analytical technology (PAT) in filamentous cultivation process development: comparison of advanced online sensors for biomass measurement[J].Journal of Industrial Microbiology & Biotechnology,2011,38(10):1 679-1 690.
[5] DUCOMMUN P,BOLZONELLA I,RHIEL M,et al.On-line determination of animal cell concentration[J].Biotechnology & Bioengineering,2001,72(5):515-522.
[6] KIVIHARJU K,SALONEN K,MOILANEN U,et al.Biomass measurement online: the performance of in situ measurements and software sensors[J].Journal of Industrial Microbiology and Biotechnology,2008,35(7):657-665.
[7] 杨梦晨,户红通,蔡萌萌,等.L-色氨酸清液发酵工艺研究[J].食品与发酵科技,2017,53(2):29-33;39.
[8] 陈宁,刘辉.柠檬酸钠对L-亮氨酸发酵代谢流分布的影响[J].高校化学工程学报,2008 (3):478-483.
[9] 宋翔,谢希贤,徐庆阳,等.苹果酸对L-谷氨酸发酵代谢流迁移的影响[J].生物加工过程,2009,7(5):58-62.
[10] 马雷,程立坤,徐庆阳,等.柠檬酸钠对L-异亮氨酸发酵及代谢流量分布的影响[J].天津科技大学学报,2010,25(3):14-18.
[11] 朱文泽,谢希贤,徐庆阳,等.柠檬酸钠对L-组氨酸发酵代谢流分布的影响[J].生物技术通讯,2009,20(2):202-204+212.
[12] 刘力,桑跃,武永超,等.活细胞在线检测器在长双歧杆菌BBMN68培养中的应用研究[J].中国奶牛,2015(15):36-39.

