重组胶原酶Bacillus cereus ColM13的酶学及结构特性分析
刘丽莉,杨陈柳,李玉,梁严予,孟圆圆,代晓凝,陈珂
(河南科技大学 食品与生物工程学院,河南 洛阳,471023)
我国是畜产品的生产大国,具有丰富的牛骨资源,然而只有为数有限的蛋白酶可以引起牛骨胶原蛋白的降解,导致长期以来,我国绝大多数牛骨资源尚未得到有效的开发利用[1-2]。如果能够利用生物酶工程技术的优势,对牛骨进行深加工,开发功能性骨蛋白肽,不仅可以解决牛骨资源浪费问题,而且还能够带来一定的经济效益,将为我国畜禽骨骼资源的深度开发利用提供新的研究思路。牛骨骼中的胶原蛋白经酶解后,可以得到骨胶原多肽,它不仅能够抗氧化、抗衰老、促进矿物质吸收等,而且在营养吸收方面,比胶原蛋白效果更佳[3-5]。
目前有关微生物源胶原蛋白酶的产生菌的报道有溶组织梭菌[6],Bacillussp.MO-1[7],CandidaalbicansURM 3622[8]和VibriovulnificusCYK279H[9]等等,但是这些菌株大部分为致病菌,在产胶原蛋白酶时,病原菌也产生相应的毒素,并不适合大规模生产。因此,目前市售的胶原蛋白酶菌株及相关研究都很少[10-11]。如赵妍嫣等[12]采用胰蛋白酶作用于骨胶原,结果表明与胶原蛋白相比,酶解后的蛋白肽有更好的乳化性和溶解性; ZHANG等[13]将牛骨胶原通过6种常规蛋白酶处理与不处理进行对比发现,处理后的产物胶原蛋白肽可以降低血压。但这些研究所采用的蛋白酶对骨骼的降解程度仍未达到较佳的工业利用价值。本研究以蜡样芽胞杆菌BacilluscereusMBL13-U来源的目的基因为模板,成功构建出工程菌pET30a-ColM13/BL21,对工程菌表达纯化出的重组胶原酶(ColM13)的酶学性质进行研究,并对经BSC和ColM13处理的胶原蛋白进行结构特性分析,结果表明,与BacilluscereusMBL13-U分离纯化出的胶原酶(BSC)相比,ColM13对骨胶原蛋白有更好的降解效果,这为今后的工业化生产提供了理论依据。
1 材料与方法
1.1 材料与试剂
牛跟踺Ⅰ型胶原蛋白,源叶生物有限公司;工程菌pET30a-ColM13/BL21,本课题组构建的表达胶原蛋白酶活性的菌株;茚三酮,天津光复精细化工研究所;其他试剂均为分析纯。
1.2 仪器与设备
H1650型高速冷冻离心机,湘仪实验室仪器有限公司;PHS-3C型pH计,上海精科有限公司;UV2600型紫外可见分光光度计,日本岛津有限公司;Perten DA7200型FT-IR红外光谱仪,德国Bruker公司;荧光分光光度计,美国Aglient Cary Elipse公司。
1.3 方法
1.3.1 ColM13的分离纯化
1.3.1.1 LB培养基(含卡那霉素)及配制方法
向100 mL的去离子水中加入NaCl 1.0 g,酵母粉0.5 g,蛋白胨1.0 g,于121 ℃灭菌锅中灭菌20 min,冷却后向其中加入50 mg/mL Kana 100 μL。
1.3.1.2 ColM13的分离纯化
按1%接种量将工程菌pET30a-ColM13/BL21接种至LB液体培养基(含卡那霉素),在37 ℃、180 r/min的条件下过夜培养。向5 mL LB培养液(含Kana)中加入1%培养物,再恒温培养约3~4 h至细菌的OD600值为0.3~1.0左右。在37 ℃的培养条件下,向工程菌培养液中加入1‰ IPTG(100 mmol/L)进行诱导,诱导时间为4 h。将培养物以5 000g离心,时间10 min,收集沉淀。然后用配好已灭菌的800 μL PBS溶液吹打洗涤,进行超声波破碎后离心(破碎条件为冰浴、400 W、20 min、超声2 s间歇3 s),上清即为ColM13的粗酶液,然后使用Ni-NTA亲和层析对ColM13进行纯化[14]。
1.3.2 ColM13最适温度及热稳定性研究
分别在不同温度下(20、30、37、40、45、50、55、60、70 ℃)测定ColM13酶活,以确定ColM13的最适温度,将最适温度下确定的ColM13酶活定为100%,其余温度下测定的ColM13酶活与之相比得到相对酶活;将ColM13分别在20、30、37、40、45、50、55、60、70 ℃的条件下处理1 h,冷却后在最适温度下测定ColM13酶活,将未处理的ColM13酶活定为100%,其余温度条件下测得的ColM13酶活与之相比得到相对酶活,ColM13酶活采用茚三酮显色法进行测定[15-16]。
1.3.3 ColM13最适pH及pH稳定性研究
分别在pH 3.0~11.0的条件下测定ColM13酶活,以确定ColM13的最适pH,将最适pH条件下测定的ColM13酶活定为100%,其余pH值下测定的ColM13酶活与之相比得到相对酶活;将ColM13分别在pH 3.0~11.0的条件下处理1 h,然后在最适pH下测定酶活,以未处理的重组酶活作为100%,其余pH值下测得的ColM13酶活与之相比得到其相对酶活。
1.3.4 蛋白酶抑制剂对ColM13酶活性的影响
在反应体系中加入PMSF,EDTA,EGTA和β-巯基乙醇等蛋白酶抑制剂,在最适反应条件下测ColM13酶活力,以未添加抑制剂的ColM13酶活作为100%,加入抑制剂测得的ColM13酶活与之相比得到其相对酶活。
1.3.5 BSC的分离纯化
以蜡样芽胞杆菌BacilluscereusMBL13-U为出发菌种,从发酵制备的粗酶液中分离纯化出降解骨胶原蛋白的胶原酶(BSC),分离纯化步骤参照文献[17]。
1.3.6 紫外(UV)扫描分析
将骨胶原蛋白分别用BSC和ColM13进行处理,在近紫外区对处理过的样品进行200~400 nm的全波长扫描。
1.3.7 差示扫描热量(DSC)分析
将经BSC、ColM13处理前后冷冻干燥的样品,放入DSC铝坩锅中,加盖密封铝坩锅后,以空铝坩锅作为参比。30 ℃保持1 min,从30 ℃升温到150 ℃,升温速率为5 ℃/min,120 ℃保持1 min。
1.3.8 荧光光谱分析
将骨胶原蛋白分别用BSC和ColM13进行处理,分别将其放入荧光分光光度计中。实验中设置激发波长为280 nm,扫描波长为280~700 nm进行扫描[18]。
1.3.9 红外光谱分析
将一定量干燥后的KBr和经BSC、ColM13处理前后冷冻干燥过的样品置于玛瑙研钵中,尽量研磨成粉末状,装样,进行手动压片,取出样品小心轻放入样品室。采用傅立叶变换红外光谱仪对样品在400~4 000 cm-1区间扫描。
1.4 数据处理
采用Origin 8.5软件对试验数据进行统计分析。
2 结果与分析
2.1 温度对ColM13酶活力的影响
对ColM13在不同温度条件(20~70 ℃)下的酶活力进行测定,结果如图1所示。由图1-a可知,温度在20~50 ℃范围内ColM13酶活力随着反应温度的升高而逐渐增高;50 ℃时,酶活达到最大值;55 ℃时,酶活仍能够保持在85%以上。继续升高温度,ColM13酶活力呈显著性下降,这可能是因为较高的反应温度破坏了酶的空间结构,从而酶活力下降[19]。因此,ColM13的最佳反应温度为50 ℃。将ColM13在不同温度条件下温育1 h后,测定其残余酶活力结果如图1-b所示,在55 ℃以下的温度(20~55 ℃)温育1 h后,ColM13酶活力仍能够保持80%以上;当温育时的温度达到55 ℃以上(60 ℃、70 ℃),随着温度的升高,残余的ColM13酶活力明显下降,几乎完全失活。因此,当预处理的温度低于55℃时,ColM13具有较高的热稳定性。
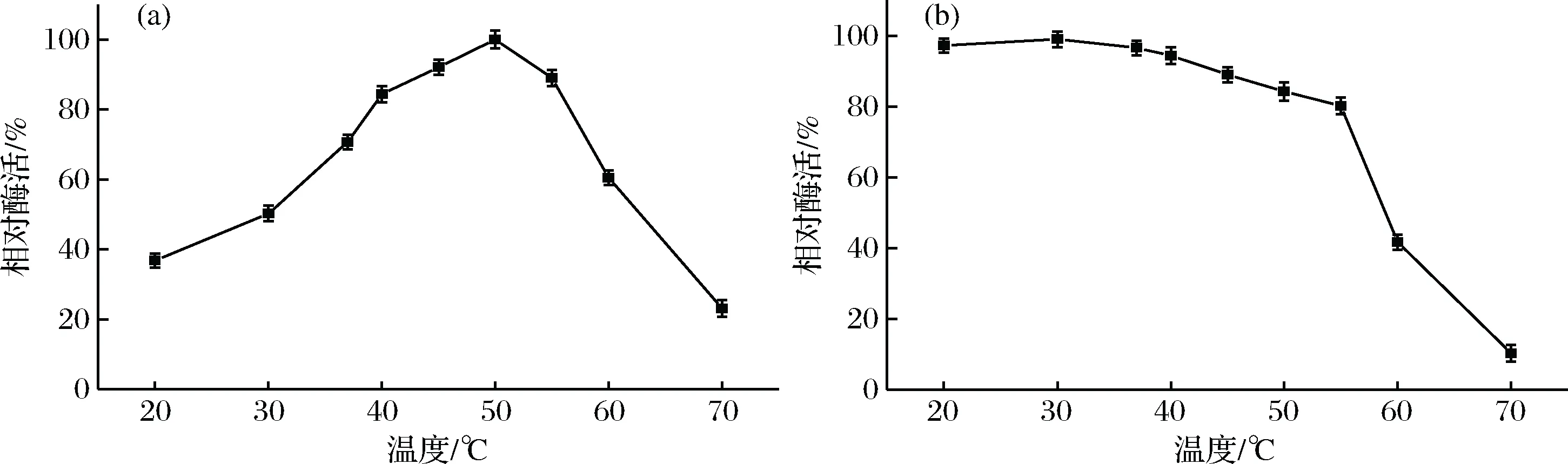
图1 温度对重组ColM13相对酶活的影响(a);重组ColM13的热稳定性分析(b)Fig.1 The influences of temperature on relative activity of recombinant ColM13(a); Temperature stability analysis of recombinant ColM13(b)
2.2 pH对ColM13酶活力的影响
对ColM13在不同pH反应体系(3.0~11.0)下的酶活力进行测定,结果如图2所示。

图2 pH对重组ColM13相对酶活的影响(a);重组ColM13的pH稳定性分析(b)Fig.2 The influences of pH on relative activity of recombinant ColM13(a); pH stability analysis of recombinant ColM13(b)
由图2-a可知,当反应体系在pH 8.0时,ColM13酶活力达到最高;在偏酸、偏碱性的环境中,ColM13酶活会随着酸碱性的增加而酶活力逐渐降低。因此,ColM13酶活的最适pH值为pH 8.0。ColM13酶活呈现这种现象可能是因为酸、碱环境对酶分子活性中心的催化基团和活性基团的离子化状态影响较大,同时影响着酶分子活性部位上的相关基团的解离[19]。此外,将ColM13在不同pH的溶液温育1 h,以测定其对酸、碱溶液的耐受性,残余酶活力情况如图2-b所示。在pH 3.0~6.0的范围内,随着溶液pH值的逐渐增高,ColM13酶活力也随之上升;在pH 6.0的条件下,酶活力达到最高;在pH 6.0~9.0的条件下处理ColM13,其酶活仍能够保持80%以上;当继续升高溶液的pH,ColM13酶活开始下降,但酶活仍在30%以上,这可能是由于ColM13酶对碱性溶液呈现较好的耐受性。因此,在pH 6.0~9.0的范围内,ColM13具有较好的稳定性。
2.3 抑制剂对ColM13酶活力的影响
分别用1 mmol/L PMSF,EDTA,EGTA和β-巯基乙醇预处理1 h,然后测定其残余酶活,以未加抑制剂的为对照,结果如图3所示。

图3 抑制剂对重组ColM13酶相对酶活的影响Fig.3 The influences of different inhibitors on relative activity of recombinant ColM13 enzyme
由图3可知,在反应体系中添加PMSF、β-巯基乙醇后,ColM13酶活几乎不受影响,其酶活仍保持在80%以上;然而,添加EDTA、EGTA后,ColM13酶活在30%以下。结果表明,金属蛋白酶抑制剂EDTA、EGTA对ColM13有显著的抑制作用。
2.4 UV光谱分析

图4 胶原蛋白酶解前后的紫外光谱分析Fig.4 Analysis of UV spectrum before and after enzymatic hydrolysis of collagen

2.5 DSC扫描分析
采用DSC对一定量的骨胶原蛋白和经BSC、ColM13处理后冷冻干燥的样品进行分析,结果如图5所示。

图5 热收缩温度分析Fig.5 Analysis of differential scanning calorimetry
由图5可以看出,3者的DSC热变性温度曲线均出现了明显的放热峰,其原因是蛋白质受热变性导致分子构象发生了变化。蛋白质的热稳定性与其氨基酸组成相关,疏水性氨基酸比亲水性氨基酸比例高的蛋白质一般热稳定较好[23]。胶原蛋白经过BSC和ColM13处理后的热变性温度均升高,这是因为酶解后的胶原蛋白的球状结构遭到破坏,埋藏在分子内部的疏水基团被释放出来,同时游离出脯氨酸残基和赖氨酸残基,从而使其热稳定性提高[24]。胶原蛋白经BSC和ColM13处理后的热变性温度分别升高了4.75 ℃和8.25 ℃,表明ColM13处理的胶原蛋白具有更好的热稳定性。
2.6 荧光光谱分析
蛋白质中含有的色氨酸、酪氨酸和苯丙氨酸时产生荧光的主要原因。激发波长280 nm主要激发色氨酸和酪氨酸,激发波长293 nm仅激发色氨酸[25-26]。骨胶原蛋白中不含有色氨酸残基,因此选择激发波长为280 nm进行荧光试验,如图6所示。

图6 荧光光谱分析Fig.6 Analysis of fluorescence spectroscopy

2.7 FT-IR光谱分析
骨胶原蛋白和及其降解物胶原蛋白肽的红外光谱分析,见图7。
由图7可知,经BSC和ColM13处理过的胶原蛋白的红外图谱几乎相重合,说明胶原蛋白经2种酶处理后形成的产物在微观结构上有很大的相似性。牛骨胶原蛋白和胶原蛋白肽的酰胺A均出现在3 320 cm-1附近,这是由N—H伸缩振动引起的,是蛋白的特征吸收,经过两种酶的降解作用,胶原蛋白肽的吸收峰强度增强,是酶解后的胶原蛋白肽中N—H伸缩振动与氢键形成了缔合体[28]所导致的。两种酶处理后的胶原蛋白肽在2 962.98 cm-1和2 960.56 cm-1出现强吸收峰,是—CONH—的特征吸收峰;1 700~1 600 cm-1为酰胺Ⅰ带,是由多肽骨架的—CONH—的伸缩振动引起,酶解产物在1 653.04 cm-1和1 653.37 cm-1出现强吸收峰,表明酶解后产物为胶原多肽[29]。强吸收峰的原因是由于2种酶破坏了维系胶原蛋白三螺旋结构的氢键,增加了二级结构中α-螺旋、β3折叠等结构的数量。1 360~1 200 cm-1为酰胺Ⅲ带,二者在此波数范围内均出现特征吸收,为C—H伸缩振动和N—H弯曲振动所产生的,但是胶原蛋白肽具有较强的吸收峰强度,表明在两种酶作用下骨胶原蛋白的肽链发生断裂,酶解使胶原蛋白二级结构发生明显变化[29]。

图7 红外光谱图分析Fig.7 Analysis of fourier transform infrared spectrometer
3 结论
(1) 本试验以课题组成功构建的特异性降解骨胶原蛋白的工程菌pET30a-ColM13/BL21为材料,以酶活为指标,通过研究温度、pH、抑制剂对ColM13的影响,对工程菌所产ColM13的酶学特性进行分析,得出ColM13的最适反应温度为50 ℃,最适反应pH为pH 8.0;其在20~55 ℃和pH 6.0~9.0范围内预处理后仍保持80%的酶活;PMSF、β-巯基乙醇对ColM13酶活性影响不大,金属蛋白酶抑制剂EDTA、EGTA对ColM13有显著的抑制作用。

[1] 安广杰, 胡加松, 王章存,等.猪骨蛋白酶解制取多肽钙的研究综述[J].郑州轻工业学院学报(自然科学版), 2013,28(6):27-31.
[2] 刘丽莉, 马美湖, 余秀芳,等.胶原蛋白酶产生菌的筛选及酶的分离纯化[J].生物工程学报, 2010, 26(2):194-200.
[3] GELSE K, PÖSCHL E, AIGNER T.Collagens-structure, function, and biosynthesis[J].Advanced Drug Delivery Reviews, 2003, 55(12):1 531-1 546
[4] HORN M M, MARTINS V C A, PLEPIS A M D G.Interaction of anionic collagen with chitosan: effect on thermal and morphological characteristics[J].Carbohydrate Polymers, 2009, 77(2):239-243.
[5] 柳林, 韦术敏, 程仕伟,等.产胶原酶的琥珀葡萄球菌分离鉴定及其培养优化研究[J].中国酿造, 2016, 35(1):62-67.
[6] BICSAK T A, HARPER E.Purification of nonspecific protease-free collagenase fromClostridiumhistolyticum[J].Analytical Biochemistry, 1985, 145(2):286-291.
[7] OKAMOTO M, YONEJIMA Y, TSUJIMOTO Y, et al.A thermostable collagenolytic protease with a very large molecular mass produced by thermophilicBacillussp.strain MO-1[J].Applied Microbiology and Biotechnology, 2001, 57(1):103-108.
[8] LIMA C A, RODRIGUES P M B, PORTO T S, et al.Production of a collagenase fromCandidaalbicans, URM3622[J].Biochemical Engineering Journal, 2009, 43(3):315-320.
[9] KANG S I, JANG Y B, KONG C J Y.Purification and properties of a collagenolytic protease produced by marine bacteriumVibriovulnificusCYK279H[J].Biotechnology and Bioprocess Engineering, 2005, 10(6):593-598.
[10] ZHANG X X, LI Y, WANG S Y, et al.Identification of a collagenase produced byBacilluscereusR75E isolated from human colostrum[J].Applied Biochemistry and Microbiology, 2015, 51(5):511-521.
[11] 杨光垚.胶原蛋白酶的纯化及其基因的克隆与表达研究[D].成都:四川大学, 2004.
[12] 赵妍嫣, 胡林林, 方芳, 等.骨胶原蛋白的酶解工艺条件[J].食品科学, 2010, 31(22): 153-155.
[13] ZHANG Yu-hao, MA Liang, CAI Lu-yun, et al.Effect of combined ultrasonic and alkali pretreatment on enzymatic preparation of angiotensin converting enzyme (ACE) inhibitory peptides from native collagenous materials[J].Ultrasonics Sonochemistry, 2017, 36(5): 88-94.
[14] Lee J M, Lee J, Nam G H, et al.Heterologous expression and enzymatic characterization of γ-glutamyltranspeptidase fromBacillusamyloliquefaciens[J].Journal of Microbiology, 2017, 55(2):147-152.
[15] 万骥, 王丹, 傅婷, 等.韭菜β-木糖苷酶的分离纯化与部分性质研究[J].食品科学, 2016, 37(7): 104-109.
[16] 李陈.一种新的短小芽孢杆菌胶原蛋白酶的分离、纯化及酶学性质研究[D].成都: 四川农业大学, 2008.
[17] 刘丽莉.BacilluscereusMBL13-U胶原蛋白酶的分离纯化及其降解动力学分析[J].食品与发酵工业, 2017,43(12):13-19.
[18] 俞园园, 刘学谦.类人胶原蛋白与Ca(Ⅱ)相互作用的荧光光谱研究[J].化学工程, 2013, 41(9):1-4.
[19] 庄志凯.凡纳滨对虾虾头内源性蛋白酶分离纯化与酶学特性研究[D].湛江:广东海洋大学, 2011.
[20] 温慧芳, 陈丽丽, 白春清,等.基于不同提取方法的鮰鱼皮胶原蛋白理化性质的比较研究[J].食品科学, 2016, 37(1):74-81.
[21] LIN Y K, DENG C L.Comparison of physical-chemical properties of type I collagen from different species[J].Food Chemistry, 2006, 99(2):244-251.
[22] 张晓洁, 张宇昊, 马良,等.超声辅助提取兔皮胶原蛋白及其理化特性[J].食品与机械, 2017, 33(1):167-171.
[23] GHRIBI A M, GAFSI I M, SILA A, et al.Effects of enzymatic hydrolysis on conformational and functional properties of chickpea protein isolate[J].Food Chemistry, 2015, 187(11):322-330.
[24] 吴雷, 郑娟, 刘文涛,等.鸡关节软骨Ⅱ型胶原蛋白结构及性能表征[J].食品与发酵工业, 2016, 42(11):86-90.
[25] 魏晓芳, 刘会洲.热变性对蛋白质结构及泡沫行为的影响[J].过程工程学报, 2000, 21(4):379-383.
[26] 杨伟, 袁芳, 高彦祥.鱼胶原蛋白肽与表没食子儿茶素没食子酸酯相互作用的研究[J].光谱学与光谱分析, 2015, 35(1):184-188.
[27] 肖岚, 李诚, 付刚, 等.5种蛋白酶对猪皮胶原蛋白水解效果的比较研究[J].食品研究与开发, 2015, 36(17): 10-14.
[28] 琚海燕, 刘新华, 但卫华, 等.牛跟腱Ⅰ型胶原纤维的微观结构与理化性能分析[J].功能材料, 2015(15): 15 031-15 034.
[29] 钟朝辉, 李春美, 顾海峰,等.温度对鱼鳞胶原蛋白二级结构的影响[J].光谱学与光谱分析, 2007, 27(10):1 970-1 976.

