L-鼠李糖异构酶的研究进展及应用前景
陈佳俊,陈自卫,张文立,江波,张涛,沐万孟
(江南大学,食品科学与技术国家重点实验室,江苏 无锡,214122)
L-鼠李糖异构酶(EC 5.3.1.14,L-rhamnose isomerase,L-RI)具有广泛的底物谱,能够可逆催化包括L-鼠李糖与L-鼠李酮糖以及D-阿洛糖与D-阿洛酮糖在内的多对五元、六元酮醛糖之间的异构化反应[1],在生物转化法生产稀有糖中具有重要作用。稀有糖(rare sugar)是一类重要的碳水化合物,在食品、医药、化工等领域中具有非常重要的作用。国际糖协会(ISRS)对稀有糖的定义为“在自然界中存在但含量极少的一类单糖及其衍生物”[2]。D-阿洛糖是一种很有应用前景的稀有糖,其在结构上和D-葡萄糖在C-3互为差向异构体,同时和D-阿洛酮糖互为醛酮糖异构体(见图1),具有清除活性氧自由基、抑制高盐诱导类高血压、冷冻防护、免疫抑制、抑制肿瘤、抗炎症等生理功能[3]。

图1 D-葡萄糖、D-阿洛糖和D-阿洛酮糖的Fisher投影式Fig.1 Fisher projection formulas of D-glucose, D-allose and D-psicose
研究表明,L-RI在生物法工业化生产D-阿洛糖中具有巨大的潜力,文中综述了近年来国内外关于L-RI的结构功能、催化机理、酶学性质及其应用于生物法生产D-阿洛糖方面的研究进展。
1 L-RI的结构
KORNDORFER等人在2000年首次通过多重同晶置换法成功解析了来自大肠杆菌(E.coli)的L-RI晶体结构(PDB登录号:1D8W)[4]。来自E.coli的L-RI在晶体中以紧密的四聚体形式存在(见图2-a),表观相对分子质量在188 kDa左右,E.coliL-RI的单亚基结构由420个氨基酸组成,亚基结构大体包括3个功能域:N-端结构域、中心结构域和C-端结构域。中心结构域是由8个α-螺旋(见图2-b,α1-α8)和8个β-折叠(见图2-b,β1-β8)共同组成的(β/α)8桶状核心区域。N-端和C-端的残基通过几段α-螺旋无规卷曲成一个小结构域(见图2-b,蓝色为N-端残基,红色为C-端残基),参与单体间的相互作用及活性部位的构成。E.coliL-RI结构中还存在两个可能用于金属离子结合的位点,一个称作“Zn2+”点,被认为是酶的底物结合位点,用于帮助稳定底物的构象,参与协调的关键氨基酸残基为Glu234、Asp267、His294和Asp334;另一个“Mn2+”点则被认为是酶的催化位点,用于帮助质子转移来实现底物的催化过程,参与协调的关键氨基酸残基为His262和Asp296。这些组成L-RI活性中心的关键氨基酸残基在已报道的L-RI中均高度保守。
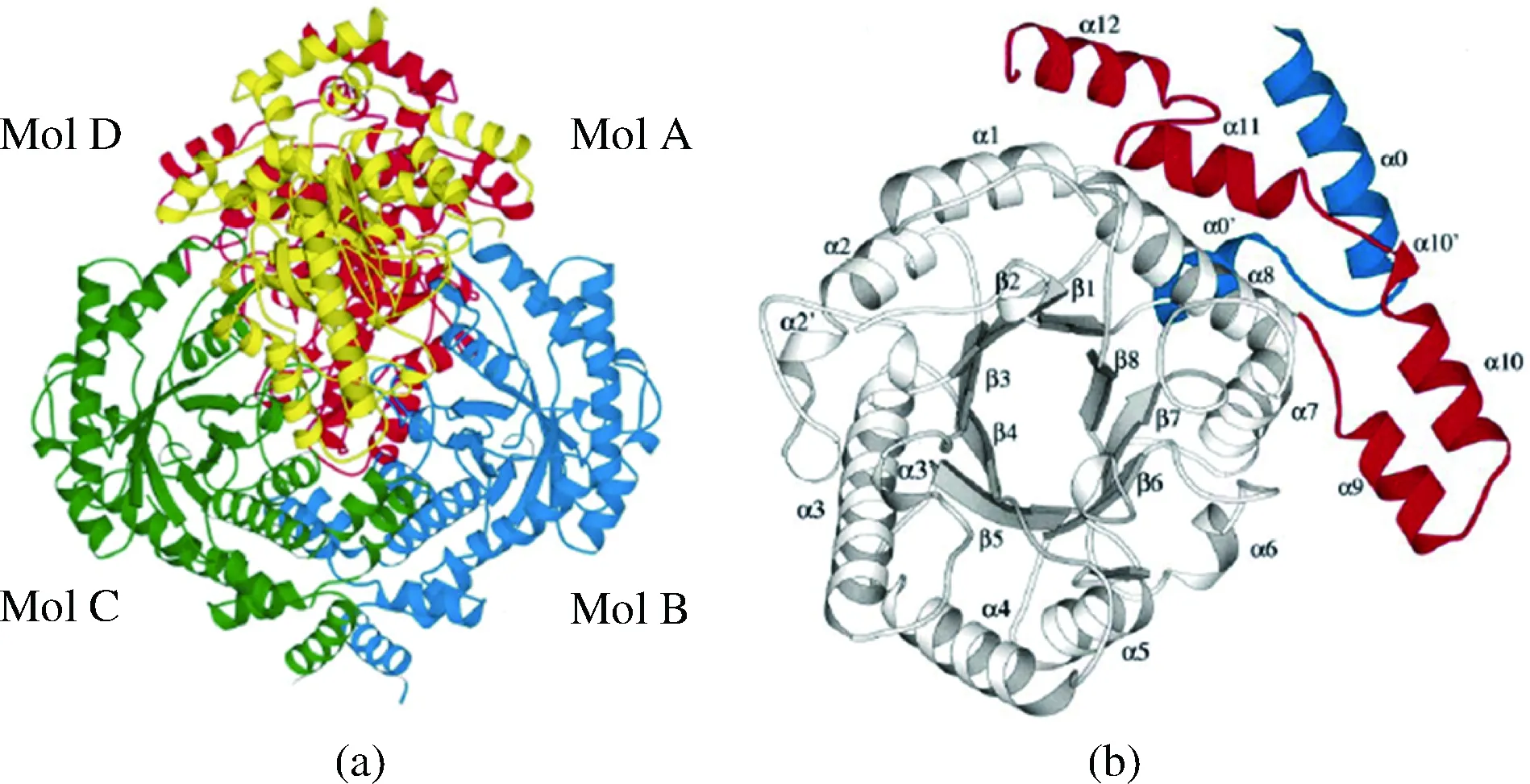
图2 E. coli L-RI的四聚体结构(a)与亚基结构(b)[4]Fig.2 Tetrameric structure (a) and subunit structure (b) of L-RI from E. coli[4]
同时,海藻糖异构酶(fucose isomerase, PDB登录号:1FUI)[5],磷酸甘油醛异构酶(triose phosphate isomerase, PDB登录号:1TIM)[6],6-磷酸葡萄糖异构酶(glucose 6-phosphate isomerase, PDB登录号:1PGI)[7],磷酸甘露糖异构酶(phosphomannose isomerase, PDB登录号:1PMI)[8]和木糖异构酶(xylose isomerase, PDB登录号:3XIM)[9]等醛酮糖异构酶的晶体结构已经被陆续报道。通过同源性比较发现,E.coliL-RI的晶体结构与木糖异构酶(D-xylose isomerase,D-XI)最为接近,序列相似度达到13%,推测二者来源于同一前体基因。二者的(β/α)8桶状核心区域十分相似,但与D-XI不同的是,E.coliL-RI在活性中心区域周围存在一些强疏水性的氨基酸残基(Val53、Ile105、Tyr106、Phe336),这一特殊的疏水环境对应在底物的C-6附近,推测是用于底物识别,从而解释了E.coliL-RI对L-鼠李糖的底物亲和力高于L-甘露糖。
2 L-RI的催化机理
KORNDORFER等人通过对E.coliL-RI晶体结构的分析,推测金属离子介导的负氢离子转移机制可能是L-RI催化L-鼠李糖异构化生成L-鼠李酮糖的主要反应机制[4]。YOSHIDA等人又对P.stutzeri来源的L-RI晶体结构进行了解析,并研究了该酶与反应产物L-鼠李糖和D-阿洛糖在结晶状态下的结合情况来推测其催化机理[10]。3年后该团队又通过X射线结构分析,进一步对P.stutzeriL-RI的催化过程进行了研究,得到如图3所示的催化预测过程[11]。
他们认为,L-RI活性中心的催化位点(见图3 Mn2)存在两种形式,即AD型和BC型(见图3-A和图3-D),并通过金属离子位移的方式实现两种形式之间的互换。其中AD型用于识别五元环的酮糖底物(见图3-B),底物的O-1、O-2和O-3与金属离子Mn1和Mn2形成配位键,Asp327参与呋喃糖的开环,并协助质子从O-2转移至O-5。开环后,具有催化活性的水分子(W4)介入协助从O-1到O-2的质子转移,再通过Trp179保护的负氢离子(H-)进攻C-2,实现酮糖到醛糖的异构化反应。而BC型则用于识别六元环的醛糖底物(见图3-E),底物的O-2, O-3与金属离子Mn1形成配位键。与AD型不同,参与吡喃糖开环的是具有催化活性的水分子。开环后,通过Mn2的位移使催化位点由BC型变为AD型,激活W4介入协助从O-2到O-1的质子转移,再由H-进攻C-1,完成醛糖到酮糖的异构化反应。
3 L-RI的微生物来源及其酶学性质
3.1 L-RI的微生物来源
研究发现,L-RI广泛存在于各种微生物中,包括E.coli[12]、Lactobacillusplantarum[13]、Pseudomonassp. strain LL172[14]、Pseudomonasstutzeri[15]、BacilluspallidusY25[16]、ThermoanaerobacteriumsaccharolyticumNTOU1[17]、ThermotogamaritimaATCC 43589[18]、MesorhizobiumlotiTono[19]、BacillushaloduransATCC BAA125[20]、CaldicellulosiruptorsaccharolyticusATCC 43494[21]、DictyoglomusturgidumDSMZ6724[22]、BacillussubtilisATCC 23857[23]、B.subtilisstr.168[24]、ThermobacilluscompostiKWC4[25]、CaldicellulosiruptorobsidiansisOB47[26]和Clostridiumstercorarium[27],表1给出了已经被报道的L-RI的十多种微生物来源,并概括了这些不同微生物来源的L-RI的酶学性质。

表1 不同微生物来源的L-RI酶学性质比较Table 1 Comparison of biochemical properties of L-RIs from various microbial sources
注:NR: 未见报道。
3.2 L-RI的酶学性质
3.2.1L-RI反应最适温度
反应温度是生物催化醛酮糖异构反应中一个非常重要的参数,D-阿洛糖与D-阿洛酮糖之间的异构化反应发生在较高的温度可以适当提高反应速率,使反应平衡向生成D-阿洛糖的方向移动,提高产物产量,还可以降低D-阿洛酮糖的黏度,提高D-阿洛酮糖的溶解度。但是过高的温度容易增加非酶褐变,生成副产物,导致生产成本大幅提高,无法满足实际工业化生产的需求。
来源于不同微生物的L-RI的最适温度均保持在较高的温度(≥60 ℃),例如来自B.subtilisATCC 23857[23]、T.maritimaATCC 43589[18]和C.saccharolyticusATCC 43494[21]的L-RI,最适温度分别为60、85和90 ℃。C.saccharolyticusATCC 43494[21]是迄今为止报道的最为耐热的L-RI。但不同微生物来源的L-RI,其高温耐热性存在明显差异,通过比较发现嗜热微生物来源的D.turgidumDSMZ6724[22]、T.maritimaATCC 43589[18]和C.saccharolyticusATCC 43494[21],其L-RI的最适温度和高温耐热性相当高,具备工业化生产D-阿洛糖的潜力。
3.2.2L-RI反应最适pH值
目前已经被鉴定报道的十多种不同微生物来源的L-RI的最适pH均在中性及碱性范围内。B.haloduransATCC BAA-125[20]、C.saccharolyticusATCC 43494[21]和T.saccharolyticumNTOU1[17],这三者来源的L-RI最适pH值均为7.0;来自M.lotiTono[19]和P.stutzeri[15]的L-RI,其最适pH达到9.0。而C.saccharolyticusATCC 43494[21]的L-RI在pH 6.0时仅能残留20%左右的相对酶活。总体来说,目前鉴定报道的L-RI大多能在中性及碱性范围内进行催化作用,在酸性范围内催化活力相对较低。
目前工业上生物法合成D-阿洛糖主要是利用两步酶反应来实现,先利用D-阿洛酮糖3-差向异构酶(D-psicose 3-epimerase, DPE)将D-果糖差向异构化为D-阿洛酮糖,再利用L-RI将D-阿洛酮糖酮醛异构化为D-阿洛糖[3]。因为DPE的最适pH值为7.5~9.0[28],L-RI最适pH值大多为7.0~8.5。所以D-阿洛糖的工业生产反应pH值最好为7.5~8.5之间催化环境不宜过碱,否则会大大增加底物的非特异性褐变,同时催化环境也不能过酸,过酸的情况下会对L-RI催化过程的质子解离产生不利影响。
3.2.3 金属离子与L-RI
金属离子是醛酮糖异构酶重要的辅因子,通常结合在酶的活性中心,对于醛酮糖异构酶蛋白空间结构的稳定具有重要作用。L-RI与其他醛酮糖异构酶一样,通常需要金属离子的参与来发挥酶活。研究表明不同微生物来源的L-RI大多数都呈现出严格的金属离子依赖性,Mn2+和Co2+是常见的两种依赖离子。如来自C.saccharolyticusATCC 43494和T.saccharolyticumNTOU1的L-RI,这两种L-RI在当金属离子浓度很低(0.1 mmol/L)或不添加金属离子时,不具备催化活力,而适当添加Co2+则会明显提高酶活力[17, 21]。
YOSHIDA[10]等人通过对P.stutzeriL-RI晶体结构的解析发现在L-RI的活性区域内,存在2个供金属离子结合的位点(见图4, M-1、M-2),金属离子与配体结合形成六配位的畸变八面体构型,与M-1结合的配体包括Glu219、Asp254、His281、Asp327和2个水分子(W-1、W-2),与M-2结合的配体包括His257、Asp289和4个水分子(W-2、W-3、W-4、W-5)。结合位点M-1用于稳定底物的构象,促进酶与底物的结合;催化位点M-2用于帮助质子转移来实现底物的催化。

图4 P. stutzeri L-RI的金属离子结合位点[10]Fig.4 Metal-binding site of the P. stutzeri L-RI[10]
3.2.4L-RI的酶反应动力学参数
L-RI具有广泛的底物谱,能够催化包括多对五元、六元酮醛糖之间的异构化反应,表2中比较了不同来源的L-RI对3种底物的动力学参数。
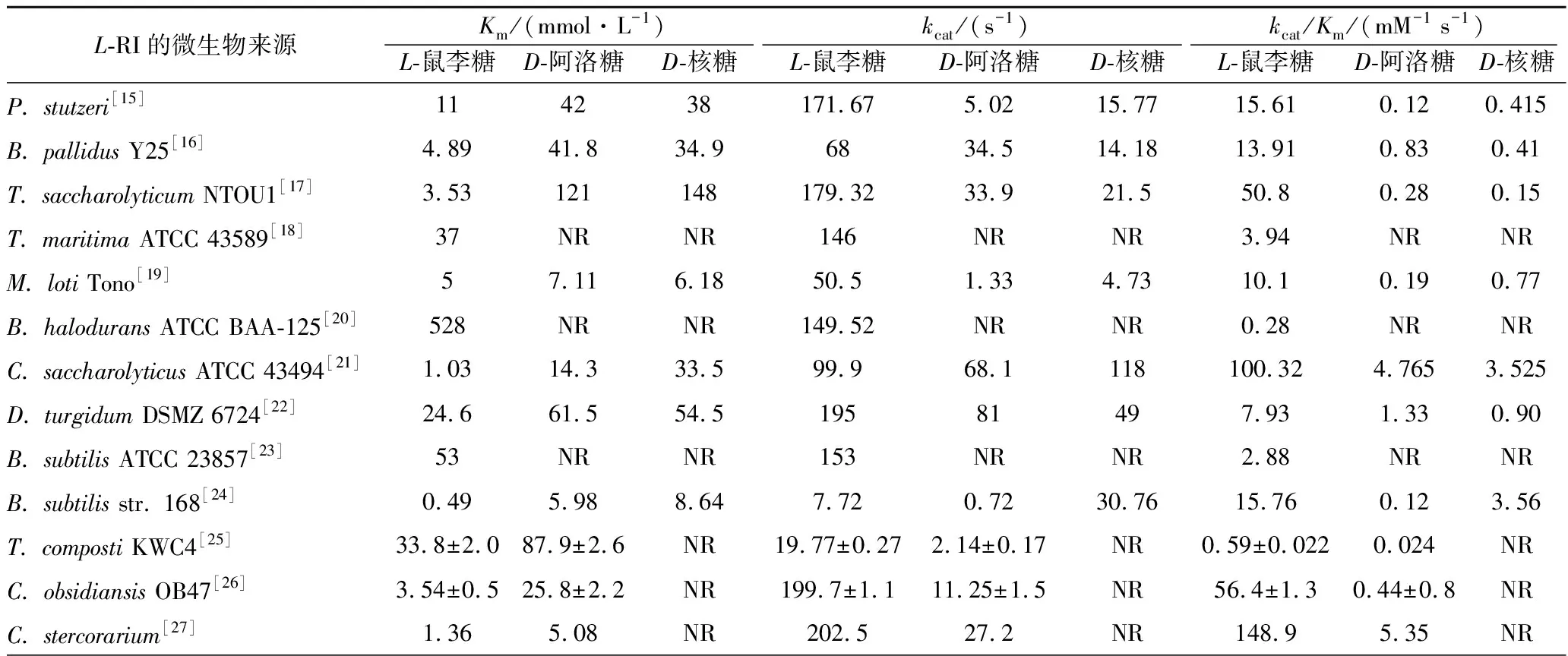
表2 不同微生物来源的L-RI动力学参数比较Table 2 Comparison of kinetic parameters of L-RI from various microbial sources
注:NR:未见报道。
所有报道的微生物来源的L-RI具备一个共同点,即对L-鼠李糖都有更高的亲和力,更易催化L-鼠李糖到L-鼠李酮糖的异构化反应。同时,不同微生物来源的L-RI对各种底物的特异性存在一定的差异,例如来源于E.coli的L-RI能催化L-鼠李糖、L-来苏糖和L-甘露糖的异构化反应,但D-阿洛糖和D-核糖都无法作为底物,而来源于P.stutzeri的L-RI则有着更广泛的底物谱[4,10]。KORNDORFER和YOSHIDA等人通过对L-RI晶体结构的解析发现,E.coliL-RI中存在1个由Val53、Ile105、Tyr106和Phe336形成的特殊疏水腔来识别底物,导致其具有严格的底物特异性[4]。而P.stutzeriL-RI的底物结合位点与底物1、2和3位置的结合形式与E.coliL-RI一致,而与底物4、5和6位置的结合形式更接近于D-木糖异构酶(D-XI),不存在疏水腔,底物仅仅与邻近的Phe66形成疏水相互作用,因而具有更广泛的底物特异性[10]。
YOSHIDA等人还发现329位的丝氨酸(Ser)对于P.stutzeriL-RI催化过程的底物特异性影响较大。研究中,引入突变体S329F(突变为苯丙氨酸,等效对应于E.coliL-RI)、S329K(突变为赖氨酸,等效对应于D-XI)、S329L(突变为亮氨酸)和S329A(突变为丙氨酸,设计为空白对照)[29]。结果发现,突变体L-RI的米氏常数Km均有不同程度的增加,同时催化效率kcat/Km均有不同程度的降低,表明该位置影响着酶与底物的结合和催化。同时,还发现将P.stutzeriL-RI的C端截去2个残基(I429、I430)后的突变体,其催化效率有了一定的提高,可能是由于疏水的C端正处于P.stutzeriL-RI亚基与亚基分子的表面,部分覆盖了活性部位,阻碍了底物的结合以及产物的释放。
4 L-RI与D-阿洛糖的生产
目前为止,利用不同微生物来源的酶进行D-阿洛糖合成的情况如表3所示。由表3可以发现,目前已经报道的能以D-阿洛酮糖为底物合成D-阿洛糖的微生物来源的酶主要包括半乳糖-6-磷酸异构酶(Galactose-6-phosphate isomerase, GPI),核糖-5-磷酸异构酶(ribose-5-phosphate isomerase, RPI)和L-鼠李糖异构酶(L-RI)。来自C.thermocellum和来自T.lettingae的RPI分别能够在pH 7.5,50 ℃和pH 8.0,70 ℃下获得33%和32%的平衡转化率[32-34]。来自L.lactis的GPI能够在pH 7.0,30 ℃下以100 g/LD-阿洛酮糖生成25 g/LD-阿洛糖,但其最适反应温度较低,仅仅为30 ℃,且会伴随副产物D-阿卓糖的生成[35]。P.stutzeriL-RI是最早报道的用以生产D-阿洛糖的L-RI。为了提高D-阿洛糖的生产效率,MENAVUVU和MORIMOTO等人利用戊二醛交联法,对P.stutzeriL-RI进行了固定化,采用固定化酶连续反应器的方式后,P.stutzeriL-RI平衡转化率由游离态下的25%,提高到了30%,但无论是游离态,还是固定化态,P.stutzeriL-RI在催化D-阿洛酮糖生产D-阿洛糖过程中始终伴随着副产物D-阿卓糖的产生[30-31]。

表3 利用不同微生物来源的酶以D-阿洛酮糖为底物生产D-阿洛糖Table 3 D-allose production from D-psicose by enzymes from various microbial sources
继P.stutzeriL-RI的研究后,对微生物来源的生产D-阿洛糖的L-RI的研究工作不断开展。来自T.saccharolyticumNTOU1的L-RI,在pH 7.0,75 ℃时有最大酶活,转化D-阿洛酮糖为D-阿洛糖时,平衡比例为66∶34,75 ℃时半衰期为2 h,无副产物产生[17]。重组T.compostiKWC4 L-RI最适pH为7.5,最适温度为65 ℃,65 ℃半衰期为3.65 h,没有副产物生成,平衡转化率为23.34 %[25]。在目前报道的能以D-阿洛酮糖为底物生产D-阿洛糖的微生物来源的L-RI中,重组C.stercorariumL-RI具有最高的比活力和催化效率(kcat/Km),在pH 7.0,75 ℃时有最大酶活,转化D-阿洛酮糖为D-阿洛糖时平衡转化率为33%,时空产率高达79.6 g/(L·h),无副产物生成[27]。这些酶在pH值、耐热性方面与P.stutzeriL-RI相比有了明显改善,且催化D-阿洛酮糖生成D-阿洛糖的反应过程中没有副产物的生成,减少了下游分离产物和底物的成本,因此在生物转化法工业化生产D-阿洛糖中具有巨大的潜力。
由于生物法生产D-阿洛糖的底物——D-阿洛酮糖本身是一种很有应用前景的稀有糖,在食品、保健和医疗领域具有重要的应用价值[28],,因此将D-阿洛酮糖作为底物,生产代价过高,不能满足工业化生产的要求。韩文佳等人提出的双酶偶联转化系统,即利用D-阿洛酮糖3-差向异构酶(DPE)和L-鼠李糖异构酶(L-RI)双酶偶联反应,以2%的D-果糖为底物,反应经10 h达到平衡,得到D-阿洛酮糖和D-阿洛糖的产量分别为5.12和2. 04 g/L,将果葡糖浆等富含果糖的低附加值原料转化为含有功能性稀有糖的高附加值混合糖液,是D-阿洛糖工业化生产中降低底物成本的有效方案[36]。
5 研究展望
虽然L-RI在生物转化法生产D-阿洛糖中具有巨大的潜力,但要利用L-RI实现D-阿洛糖的大规模工业化生产,还有一些技术和方法需要进一步研究完善。
(1)分子改造方面。目前还没有能在偏酸性范围内催化D-阿洛酮糖转化为D-阿洛糖的L-RI的报道,碱性的催化环境会增加底物的非特异性褐变,导致底物成本上升,不利于工业化生产;另外,目前被报道的微生物来源的L-RI大多都呈现出严格的金属离子依赖性,催化时都需要二价金属离子的存在来保证最大酶活,而过多添加金属离子不利于L-RI的实际生产应用。
随着L-RI 晶体结构的解析,进一步确定酶的反应机制及酶活性中心的氨基酸,并根据活性中心氨基酸残基及可能影响酶活性中心的氨基酸残基, 选择性地进行定点突变设计以L-RI的最适pH以及减少L-RI对金属离子的依赖性将对D-阿洛糖的工业化生产具有重要的现实意义。
(2)L-RI的固定化研究。尽管已有些较成熟的L-RI 的固定化方法被建立,但由于被研究的L-RI种类及固定化方法有限,固定化L-RI生产对D-阿洛糖的研究仍具有很大的空间。新种属酶或分子改造的优质酶的不断涌现及新固定化方法的研究都将会使固定化L-RI生产D-阿洛糖的技术不断创新。
(3)食品级基因工程菌的构建与应用。L-RI的食品级基因工程菌的研究仍然是L-RI研究中未涉足的领域,大肠杆菌仍然是目前用于表达L-RI的首选宿主,但D-阿洛糖作为一种新型的功能性稀有糖,用大肠杆菌作为宿主菌存在着安全隐患,因此L-RI食品级基因工程菌的构建与应用将成为新的研究热点。

