白扁豆多糖对人胃癌细胞凋亡的作用及其机制*
张艳姿, 柯瑞君, 蒋盼若, 杨林军, 陈佳玉
(1. 温州医科大学检验学院、生命科学学院, 浙江温州 325035; 2. 绍兴文理学院医学院,浙江绍兴312000; 3. 台州市立医院,浙江台州318000; 4. 台州学院医学院,浙江台州318000)
胃癌是世界常见的消化道恶性肿瘤之一,其发病率和死亡率均居我国恶性肿瘤第2位[1]。目前,手术切除仍是治疗胃癌的最佳方法。但临床上由于缺乏早期胃癌特异性诊断指标、胃癌早期患者临床症状不明显等原因,很多胃癌患者确诊时已达到胃癌进展期甚至是晚期[2],其术后5年生存率不足20%[3]。因此,寻找对胃癌有治疗效果、毒副作用小的药物一直是研究的重点和难点。
白扁豆具有抗菌、抗病毒、提高细胞免疫功能的作用[4]。近年来,越来越多的研究证实,多糖在提高人体免疫功能、抗肿瘤、抗病毒、抗氧化及降血糖等过程中起着重要作用[5-7],但白扁豆中的多糖对胃癌的作用及其作用机制研究尚未见报道。本文拟探讨白扁豆多糖诱导胃癌细胞凋亡的作用及其机制,以期为白扁豆多糖用于胃癌治疗提供依据。
1 材料与方法
1.1 材料
细胞周期检测试剂盒(凯基生物,江苏);Cell Titer96 Aqueous Non-radioactive Cell proliferation Assay (MTS, Promega);Annexin V-PE/7-AAD apoptosis assays kit (BD);JC-1线粒体膜电位检测试剂盒(天晶公司,上海);RPMI 1640培养液、0.25%胰酶液、胎牛血清(fetal bovine serum,FBS,Gibco);TrizolReagent、SuperScriptIII First-Strand Synthesis System(Invitrogen);Hoechst 33342染色液 (Solarbio,上海)。其他试剂均为国产分析纯。白扁豆多糖为本实验室从药用白扁豆提取的多糖[8],纯度为92%。人胃癌细胞株HGC-27和SGC-7901均购自ATCC细胞库;引物由上海生工合成。
1.2 细胞培养及MTS法检测细胞增殖活性的抑制率
取对数生长期的HGC-27和SGC-7901细胞,胰酶液消化后,用含10% FBS的RPMI 1640培养液悬浮细胞,将HGC-27和SGC-7901细胞的密度调整为5×103cells/ml,分别接种于96孔细胞培养板中,200 μl/孔,各设3个复孔。将细胞置于5% CO2、37 ℃细胞培养箱中培养。待细胞贴壁后,分别用不同浓度的白扁豆多糖(终浓度为16 μg/ml、8 μg/ml、4 μg/ml、2 μg/ml、1 μg/ml、0 μg/ml)作用于该细胞,每个药物浓度设3个复孔。加药后24 h、48 h和72 h时,分别向各培养孔内加入20 μl MTS溶液,再将其放回培养箱中继续培养3 h。用酶标仪检测490nm处吸光度(A490nm值),按下式计算药物对细胞增殖的抑制率:抑制率(%)=[1-(实验组平均A490nm值/对照组平均A490nm值)]×100%。
1.3 JC-1法检测细胞膜电位
取细胞悬液,调整其最终密度为1×104cells/ml,接种到6孔培养板中,每孔2 ml,置于5% CO2、37 ℃培养箱中培养。待细胞融合度达到80%时,分别换成含0 μg/ml、4 μg/ml白扁豆多糖的完全培养液,各设3个复孔,于5% CO2、37 ℃条件下培养24 h。弃去培养液,用PBS洗涤细胞2次,每孔加入1 ml细胞培养液和1 ml JC-1染色工作液,充分混匀,于37 ℃细胞培养箱中孵育20 min。弃上清液,用预冷的JC-1染色缓冲液洗涤细胞2次。每孔加入1 ml细胞培养液,置荧光倒置显微镜下观察。
1.4 流式细胞仪检测细胞凋亡
取对数生长期的HGC-27和SGC-7901细胞,胰酶液消化后,用含10% FBS的RPMI 1640培养液将HGC-27和SGC-7901细胞的密度调整为5×104cells/ml,接种到6孔培养板中,每孔2 ml,置于5% CO2、37 ℃培养箱中培养。待细胞融合度达到90%,将培养基换成含有0 μg/ml、4 μg/ml白扁豆多糖的完全培养液,各设3个复孔,于5% CO2、37 ℃条件下培养24 h。弃去培养上清,用PBS洗涤细胞2次,用不含EDTA的胰酶液消化6孔板内的细胞,500×g离心5 min收集细胞,以4 ℃预冷的PBS洗涤细胞2次,每次洗涤后于4 ℃、500×g离心5 min,弃上清。每孔加入250 μl 1×Binding Buffer重悬细胞,调整细胞密度为1×106cells/ml;取100 μl细胞悬液于5 ml流式管中,同时加入5 μl Annexin V/PE和5 μl 7-AAD,轻轻混匀。避光、室温下反应15 min,加入400 μl 1×Binding Buffer,充分混匀,用流式细胞仪检测细胞的凋亡率。
1.5 流式细胞仪检测细胞周期
胰酶液消化后回收的上述经0 μg/ml或4 μg/ml白扁豆多糖作用24 h的HGC-27和SGC-7901细胞,用4 ℃预冷的PBS洗涤细胞2次,每次洗涤后于4 ℃、600×g离心5 min回收细胞。每组取5×106个细胞,分别加入1 ml冰浴预冷的70% 乙醇,轻轻吹打混匀,4 ℃条件下固定2 h。4 ℃、600×g离心5min,弃上清,用4℃预冷的PBS于同样条件下离心洗涤细胞2次。向细胞沉淀中加入100 μl RNase A,37 ℃水浴孵育30 min,加入400 μl PI染色液,混匀,置于4 ℃避光作用30 min,流式细胞仪于激发波长488 nm下检测。
1.6 QPCR法检测细胞内基因转录水平
分别取上述经0 μg/ml或4 μg/ml白扁豆多糖作用24 h的HGC-27和SGC-7901细胞,完全弃去培养液,PBS洗涤细胞2次;按照Trizol试剂说明书提取细胞总RNA,经Nanodrop仪器定量。取5 μg RNA样品,用SuperScriptIII First-Strand Synthesis System逆转录合成cDNA后,以GAPDH基因为内参,QPCR法进行Bax、Bcl-2和caspase-3基因表达水平的检测,试剂用量参照说明书,引物序列见表1。
Tab.1The primer sequence
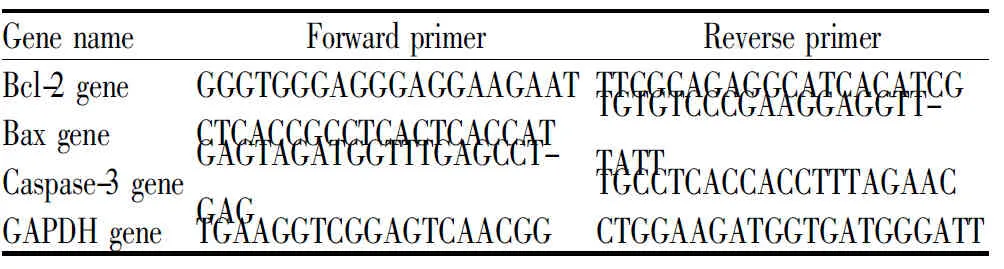
Gene nameForward primerReverse primerBcl-2 geneGGGTGGGAGGGAG-GAAGAATTTCGCAGAGGCATCA-CATCGBax geneCTCACCGCCTCACT-CACCATTGTGTCCCGAAGGAG-GTTTATTCaspase-3 geneGAGTAGATGGTTT-GAGCCTGAGTGCCTCACCACCTT-TAGAACGAPDH geneTGAAGGTCGGAGT-CAACGGCTGGAAGATGGTGATGG-GATT
2 结果
2.1 MTS法检测细胞增殖活性
MTS法检测结果(表2)显示,胃癌细胞HGC-27和SGC-7901经浓度为16 μg/ml、8 μg/ml、4 μg/ml、2 μg/ml、1 μg/ml白扁豆多糖作用24 h、48 h和72 h后,其增殖活性受到不同程度的抑制,差异有统计学意义(P<0.05),其受抑制程度与药物浓度和作用时间有关。当白扁豆多糖浓度为4 μg/ml、作用时间为24 h时,胃癌细胞HGC-27和SGC-7901的细胞增殖抑制率分别为(52.12±2.27)%和(43.47±2.34)%,与0 μg/ml白扁豆多糖组差异显著(P<0.01),因此选择此浓度和作用时间进行后续白扁豆多糖作用的机制研究。


WLP(μg/ml)HCG-27SGC-790124 h48 h72 h24 h48 h72 h0000000110.03±0.9821.12±3.22*37.24±3.41**9.42±1.1717.67±2.84*25.71±2.66*225.17±1.19*38.22±5.17**48.15±6.15**21.22±2.04*31.17±5.19**49.38±5.27**452.12±2.27**61.19±5.33**71.01±5.44**43.47±2.34**56.52±4.68**73.43±6.22**869.28±6.46**78.58±4.62**89.34±2.01**54.41±5.49**61.22±7.14**80.42±7.64**1678.27±5.31**87.31±3.16**92.62±2.40**59.97±6.74**89.52±8.45**94.18±6.32**
*P<0.05,**P<0.01vsthe group treated with 0 μg/ml white lentil polysaccharides(WLP)
2.2 白扁豆多糖对细胞线粒体膜电位的影响
荧光倒置显微镜检测结果(图1)显示,胃癌细胞HGC-27和SGC-7901经4 μg/ml白扁豆多糖作用24 h后,细胞线粒体膜电位明显下调。
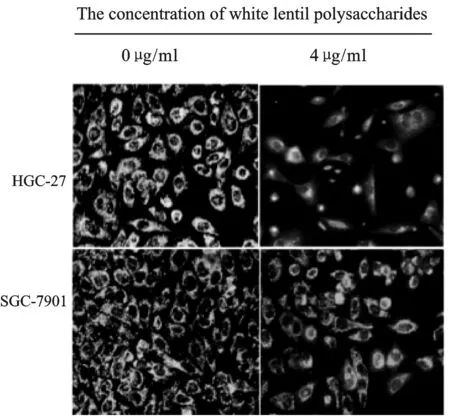
Fig.1Effect of white lentil polysaccharides on mitochondrial membrane potential of gastric cancer cell lines HGC-27 and SGC-7901(40 ×)
2.3 流式细胞仪检测细胞凋亡
结果如图2所示,经4 μg/ml白扁豆多糖处理后,HGC-27和SGC-7901细胞凋亡率分别为53.15%和38.77%,较PBS处理组(8.07%和6.03%)明显增加,差异有统计学意义(P<0.05)。实验证实,4 μg/ml白扁豆多糖能诱导HGC-27和SGC-7901细胞的凋亡。

Fig.2The inducing apoptosis effect of white lentil polysaccharides on gastric cancer cell lines examined by a flow cytometery(n=3)
*P<0.01vsthe group treated with 0 μg/ml white lentil polysaccharides
2.4 流式细胞仪分析细胞周期
结果如图3所示,与未用药处理组比较,经4 μg/ml白扁豆多糖处理后,处于G1、S、G2期的HGC-27和SGC-7901细胞的比例无明显变化。因此,4 μg/ml白扁豆多糖对HGC-27和SGC-7901细胞的细胞周期无明显影响(P>0.05)。
Fig.3Effect of white lentil polysaccharides on the cell cycle of gastric cancer cell lines HGC-27 and SGC-7901(n=3)
2.5 QPCR检测结果
QPCR检测结果(图4)证实,与未用药处理组比较,经4 μg/ml白扁豆多糖作用24 h后,胃癌细胞HGC-27和SGC-7901的凋亡相关蛋白Bax和caspase-3基因转录水平明显升高,而Bcl-2基因转录水平明显下调(P<0.01)。
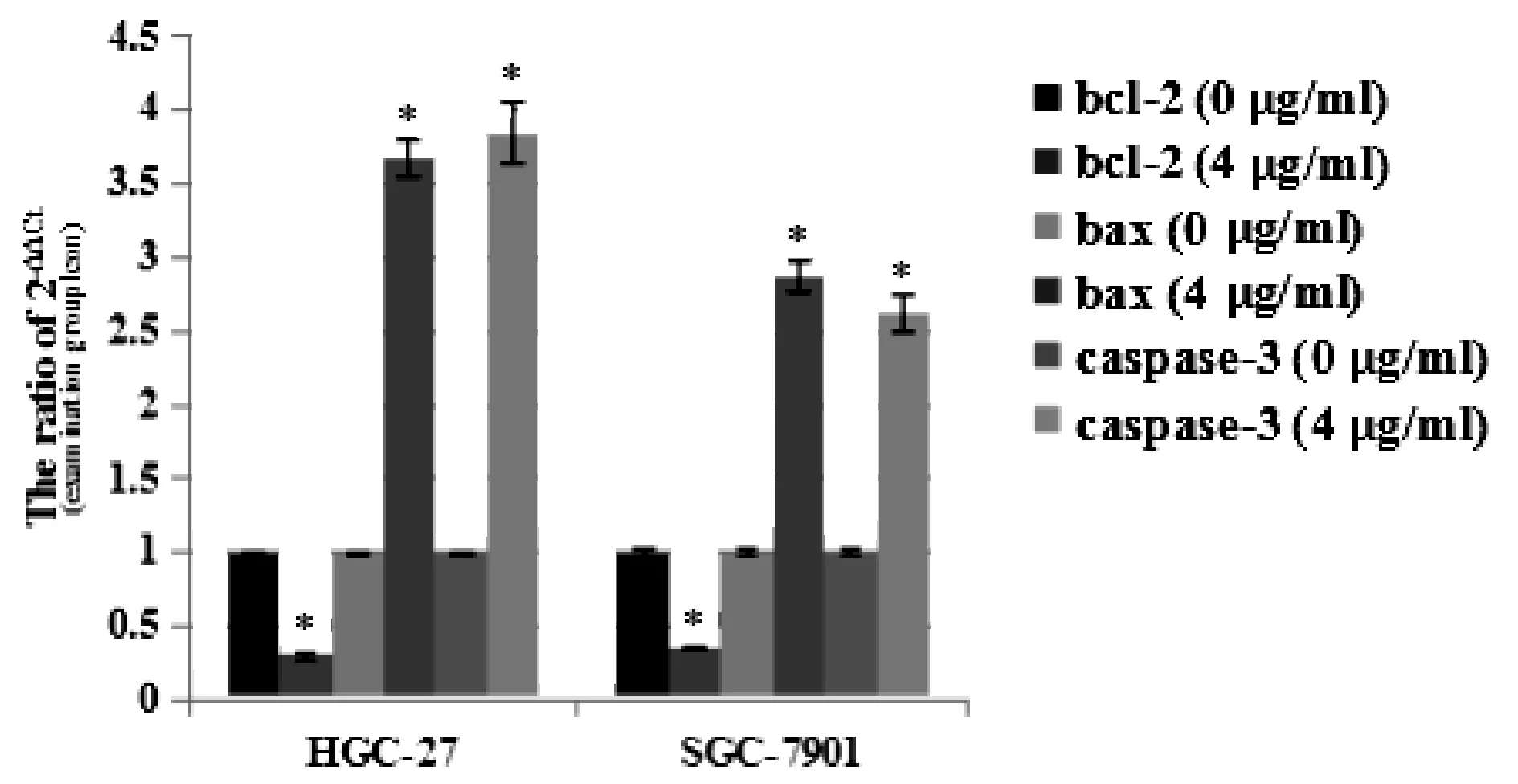

*P<0.01vsthe group treated with 0 μg/ml white lentil polysaccharides
3 讨论
细胞凋亡是由多种基因控制的细胞程序性死亡,是维持机体内环境稳定的基础。它控制着细胞生长与分化的方向,当细胞凋亡受抑制时,便可以引起包括胃癌在内的一系列肿瘤的发生。胃癌严重威胁人类健康。因此,探索促进胃癌细胞凋亡的新药物并揭示其作用机制一直是胃癌治疗研究的热点和靶点。
近年来,越来越多的研究证实,多糖在提高机体免疫功能、抗肿瘤等过程中起着重要作用[4],如枸杞多糖可以诱导人白血病HL-60细胞的凋亡[9]、(1→3)-β-D-葡聚糖连接的香菇多糖对S180荷瘤小鼠的肿瘤也有较高的抑制作用[5]。但目前有关白扁豆多糖抗胃癌的作用研究尚未见报道。本研究发现,经不同浓度的白扁豆多糖作用后,胃癌细胞HGC-27和SGC-7901的细胞凋亡率明显增加,细胞增殖活性均受到不同程度的抑制,且其受抑制程度与药物作用的浓度和时间有关。用药前后HGC-27和SGC-7901的细胞周期无明显变化。因此,白扁豆多糖可通过促进胃癌细胞的凋亡来发挥抗胃癌作用。
为了揭示白扁豆多糖诱导胃癌细胞凋亡的作用机制,本研究进行了细胞内凋亡相关基因mRNA水平分析和细胞膜电位观察。结果证实,经4 μg/ml白扁豆多糖作用后,胃癌细胞HGC-27和SGC-7901的线粒体膜电位明显降低,细胞内Bax、caspase-3基因的转录水平显著增加,而Bcl-2基因转录水平却较未用药组明显下降。Bcl-2蛋白家族在调控细胞凋亡的过程中发挥着至关重要的作用,Bax和Bcl-2是该家族中最具代表性的蛋白质[10,11]。在细胞正常生长和分化过程中,Bax为Bcl-2活性的主要调控因子[12],它与Bcl-2的表达处于动态平衡状态。当药物作用导致细胞内Bax基因表达增多时,Bax不仅可以直接与细胞内的Bcl-2形成异二聚体,发挥其抑制Bcl-2的抑凋亡作用,而且还可以移位到细胞线粒体上[13],导致线粒体膜通透性增高,细胞膜电位下降,激活细胞凋亡过程中最重要的终末剪切酶caspase-3[14],进而引起细胞广泛的损伤和变性,最终导致细胞凋亡的发生[15]。因此,白扁豆多糖可以通过调节胃癌细胞内Bax/Bcl-2和caspase-3基因的表达来促进胃癌细胞凋亡。
白扁豆是一种常用中药,我国很多地区都有栽培,资源十分丰富。其营养丰富,价格低廉。此外白扁豆多糖对正常细胞无明显的毒副作用[16]。因此,将白扁豆多糖作为抗肿瘤药物成分进行开发有较好的应用前景。本研究为白扁豆多糖的进一步临床用药研究奠定了基础。

