静脉应用rt-PA联合亚低温治疗对急性脑梗死患者NIHSS评分、颅内压和血清SOD、MDA水平的影响
孙瑾 吴瑞杰 朱军 刘浩 李夫民
急性脑梗死是目前临床上常见的一种急重危病。根据《2016年中国脑血管病防治指南》显示,目前临床上主要是采用在急性脑梗死发病4.5 h内使用重组人组织型纤溶酶原激活剂(recombinant tissue plasminogen activator,rt-PA)静脉溶栓的治疗方法[1]。据相关文献显示,亚低温治疗对急性脑梗死患者具有确切的保护作用,有利于恢复和改善患者在脑梗死急性期损害的神经功能[2]。目前临床上关于脑卒中损伤神经功能的作用机理普遍认可的一种说法是氧化应激反应,即系指脑卒中患者体内活性氧族(reactive oxygen species,ROS)的产生机制失调,造成其抗氧化防御体系失衡,导致神经组织发生损伤[3]。ROS通过和细胞膜上的不饱和脂肪酸发生氧化反应,产生丙二醛(malondialdehyde,MDA),而超氧化物歧化酶(superoxide dismutase,SOD)是存在于机体内的一种抗氧化酶,可阻止ROS和细胞膜上的不饱和脂肪酸发生氧化反应,即通过测量血清中MDA和SOD的水平可间接观察到机体内的氧化应激的反应程度。本研究就本院50例急性脑梗死患者来分析静脉应用rt-PA联合亚低温治疗对急性脑梗死患者美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分、颅内压和血清SOD、MDA水平的影响。
1 资料与方法
1.1 一般资料 将本院2015年10月-2017年10月行rt-PA静脉溶栓的50例急性脑梗死患者作为研究对象,均入住本院神经内科ICU,并随机分为对照组和观察组各25例。其中对照组男24例,女26例,年龄46~82岁,平均年龄(62.14±9.35)岁,起病至溶栓时间为1~6 h,平均为(3.14±0.55)h。观察组男21例,女29例,年龄43~84岁,平均年龄(64.25±10.47)岁,起病至溶栓时间为1~5 h,平均为(3.09±0.71)h。2组患者性别比、年龄、起病至溶栓时间,NIHSS评分等比较均无明显差异(P均>0.05),具有可比性。溶栓适应证和禁忌症参照欧洲协作组急性卒中研究Ⅲ中的相关标准和美国成人缺血性脑卒中急性期处理指南[4]。本研究内容已通过本院医学伦理委员会批准,且所有受试者均自愿签署知情同意书。
1.2 治疗 对照组采用常规治疗并配合rt-PA(商品名:爱通力,德国勃林格殷格翰大药厂生产,注册证号S20110052)静脉溶栓,剂量为0.6 mg/kg;首先于1 min内经静脉推注总剂量的10%~15%,剩余剂量溶于生理盐水100 mL并经静脉连续滴注1 h。观察组在rt-PA静脉溶栓治疗的同时联合亚低温全身治疗24 h,观察时间分别为治疗1、3、7 d。其中亚低温治疗应用亚低温治疗仪(HGT-200双毯,南京三德医疗器械有限公司提供),亚低温温度设置为28 ℃,水温控制在6~12 ℃,患者鼓膜温度保持在33~35 ℃。采用 OMRON 红外线耳式温度计测量患者鼓膜温度。2组患者均在治疗期间严密监测电解质和生命体征状况,观察组患者在亚低温治疗结束后于室温下进行复温,每3~5 h复温1 ℃,在12~24 h使体温恢复为36.5~37.5 ℃。2组患者的温度测量方法相同。
1.3 SOD及MDA水平测定 以溶栓开始时间为起点,分别在1、3、7 d后抽取2组患者外周静脉血5 mL,3500 r/min离心5 min,并于-80 ℃下保存。采用编号双盲法对所有指标统一测定,其中采用化学比色法测定SOD水平,采用硫代巴比妥酸比色法测定MDA水平,试剂盒由上海信裕生物科技有限公司提供,并严格按照试剂盒使用说明进行操作。
1.4 神经功能评分及ICP监测 分别记录2组患者溶栓前和治疗1、3、7 d后的NIHSS评分以及颅内压。采用闪光视觉诱发电位无创技术测定颅内压,并由相应的程序自动计算出颅内压值。
1.5 疗效评估 根据2015年国际脑卒中NIHSS评分标准[5],2组患者在治疗14 d后进行临床疗效评估。NIHSS 评分降低91%~100%为基本治愈;降低46%~90%为显效;降低18%~45%为有效;降低17%以下为无效。总有效率=(基本治愈+显效+有效)/总例数×100%。

2 结 果
2.1 2组患者治疗前后NIHSS评分比较 两组患者治疗1、3、7 d后NIHSS评分均比溶栓前低(P均<0.05);2组患者治疗1、3、7 d后NIHSS评分比较均无明显差异(P>0.05)(表1)。
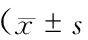
表1 2组患者治疗前后NIHSS评分比较,分)
注:与同组溶栓前比较,*P<0.05
2.2 2组患者治疗前后ICP比较 溶栓前2组患者ICP比较无明显差异(P>0.05)。2组患者治疗1、3、7 d后ICP均显著比溶栓前降低(P均<0.05)。观察组治疗3、7 d后ICP较对照组降低更明显(P<0.05)(表2)。
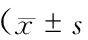
表2 2组患者治疗前后ICP比较,分)
注:与同组溶栓前比较,*P<0.05;与对照组比较,△P<0.05
2.3 2组患者临床疗效 经过7 d治疗后观察组和对照组的治疗有效率分别为84.00%、80.00%(表3)。

表3 2组患者临床疗效比较[n(%)]
2.4 2组患者治疗前后血清SOD、MDA水平比较 2组患者治疗前血清SOD、MDA水平比较均无明显差异(P>0.05);观察组溶栓1、3、7 d 后血清SOD水平比溶栓前升高,血清MDA水平比溶栓前下降(P<0.05);对照组治疗3、7 d后血清SOD水平比溶栓前升高,血清MDA水平比溶栓前下降(P<0.05)。其中,观察组治疗1、3、7 d后血清SOD水平显著高于对照组(P<0.05),血清MDA水平显著低于对照组(P<0.05)(表4)。
3 讨 论
急性脑梗死患者在发病4.5 h内使用rt-PA静脉溶栓的治疗方法已是目前临床上治疗急性脑梗死的超早期的最佳的治疗方法之一。本研究发现,急性脑梗死患者使用rt-PA静脉溶栓治疗后NIHSS评分比溶栓前显著下降,证明该治疗方法疗效确切。近年来,随着亚低温疗法在神经内科的普及,其疗效也逐渐得到广大医师和患者的认可和信任,逐步被认为是神经保护的最佳方法之一[6]。根据相关的文献显示,亚低温疗法可以极大改善脑缺血动物模型的大脑皮层功能,促进神经干细胞生长,具有阻滞脑氧代谢、过量释放神经递质、炎症反应,阻滞钙超载,从而起到保护血脑屏障,缓解神经元凋亡和减轻神经功能缺损等作用[7]。
同时,rt-PA的活性会随着温度的下降而降低,当温度下降至32~34 ℃时rt-PA的活性相应会下降2% ~4%,目前临床上已经证实亚低温治疗可以延长急性脑梗死缺血早期甚至再灌注期的溶栓治疗时间窗[8],由此推测静脉应用rt-PA联合亚低温治疗对急性脑梗死患者的疗效更佳。根据相关文献报道,静脉应用rt-PA联合亚低温治疗持续亚低温1 d为最佳观察时间点,而且低温开始及持续时间与急性脑梗死患者的神经保护、预后有密切联系[9]。本研究的结果也符合以上观点。
本研究发现,2组患者治疗1、3、7 d后ICP均比溶栓前降低,观察组治疗3、7 d后ICP显著低于对照组。造成这种现象的原因可能是,亚低温治疗在一定程度上缓解炎性反应和脑细胞水肿,减少脑梗死后ICP,而通过rt-PA静脉溶栓后实现血管再通,实现缺血半暗带再滋润,从而改善脑组织坏死,可显著有效减少ICP[10]。因此,静脉应用rt-PA联合亚低温治疗对急性脑梗死具有较高的可行性,对改善患者生活质量,降低致残率具有较大的意义。
静脉应用rt-PA联合亚低温治疗对急性脑梗死的作用机制可能是脑梗死后机体神经细胞损伤加重,使得自由基大量生成,加重脑损伤,而在大脑缺血后神经元内产生氧化应激而引起死亡[11-12]。有关研究显示,急性脑梗死患者在使用rt-PA静脉溶栓后会降低氧化反应,促进缺血再灌注损伤,降低梗死面积[13]。同时,已有大量研究证明亚低温疗法可有效保护缺血性和外伤性脑损伤,特别是在脑缺血再灌注的初期阶段尽早实施亚低温疗法能够有效避免细胞凋亡[14-15]。因此,静脉应用rt-PA和亚低温治疗均有降低脑梗死后氧化应激的作用。本研究也发现2组患者治疗后血清SOD、MDA水平明显下降,且观察组溶栓1、3、7 d后血清SOD水平比溶栓前升高,血清MDA水平比溶栓前下降,而对照组治疗3、7 d后血清SOD水平比溶栓前升高,血清MDA水平比溶栓前下降。其中,观察组治疗1、3、7 d后血清SOD水平显著高于对照组,血清MDA水平显著低于对照组。由此可知,静脉应用rt-PA联合亚低温治疗急性脑梗死的效果更佳。
综上所述,静脉应用rt-PA联合亚低温治疗可能通过减轻患者的氧化应激反应而有利于急性脑梗死患者的预后。

表4 2组患者治疗前后血清SOD、MDA水平比较(mmol/L)
注:与同组溶栓前比较,*P<0.05;与对照组比较,△P<0.05

