多代发酵泡菜母水微生物多样性及其理化指标动态研究
邓维琴,伍亚龙,陈功,,李恒,,张伟,朱翔,王勇,游敬刚,张其圣,*
1( 四川省食品发酵工业研究设计院,四川 成都,611130) 2(四川东坡中国泡菜产业技术研究院,四川 眉山,620030)
泡菜是指以新鲜蔬菜等为主要原料,添加或不添加辅料,经食用盐或食用盐水渍制等工艺加工而成的蔬菜制品[1-2]。四川泡菜是中国泡菜的典型代表。传统四川泡菜(家庭陶坛式泡菜)以新鲜蔬菜为原料,以不同浓度盐水利用蔬菜表面自带的微生物发酵而成。多代循环发酵是传统四川泡菜最常见的发酵形式,即取出发酵成熟的泡菜后,再加入新鲜蔬菜发酵。如此反复循环,形成含有大量乳酸菌、酵母菌等微生物和丰富氨基酸、有机酸[3]的泡菜母水生态系统;发酵成熟的泡菜具有鲜、香、嫩、脆的特点。
微生物是影响泡菜品质的重要因素。研究表明,主导四川泡菜发酵的微生物主要是乳酸菌,如植物乳杆菌(Lactobacillusplantarum)、耐酸乳杆菌(Lactobacillusacetotolerans)、短乳杆菌(Lactobacillusbrevis)、食窦魏斯氏菌(Weissellacibaria)、高丽魏斯氏菌属(Weissellakoreensis)等[4-5]。乳酸菌不仅可以抑制泡菜中腐败微生物的生长,其代谢产生的多种氨基酸、维生素还能有效提高泡菜的营养品质[6]。另外,乳酸菌通过同型或异型发酵产生各种有机酸使泡菜表现出酸性,并产生多种酮类、醛类和酯类物质等,赋予泡菜制品良好的口感和香味[7-8]。同时,泡菜发酵也伴随着各种真菌的消长。其中,酵母菌通常作为主导真菌在发酵过程中产生乙醇、甘油等醇类物质,也对抑制腐败微生物有较大作用。泡菜中常见的酵母菌包括清酒假丝酵母菌(Candidasake) 、掷孢酵母(Sporisoriucamicdor) 、胶红酵母(Rhodotorulamucilaginosa) 、毕赤酵母属(Pichiagaleiformis)、克鲁维毕赤酵母(Pichiakluyveri)等[9-11]。
泡菜中的微生物种类和数量极多,但其种群与构成并不是一成不变的,在不同的发酵时期微生物种群和构成有一定的差异。传统四川泡菜采用“母水发酵”工艺,母水的形成与微生物及其代谢产物有密切的关系[8,12]。然而随着发酵蔬菜代数的增加,泡菜始终能保持良好的品质和口感,这说明泡菜母水中微生物、理化指标具有一定的稳定性。目前已有的报道多是针对单次发酵泡菜或者泡菜母水中微生物、理化指标[13-14]的研究,而针对不同发酵代数的泡菜母水中微生物的种类及动态变化的研究还未见报道。
本课题旨在对多代发酵四川泡菜母水中微生物和总酸、pH、盐度、亚硝酸盐含量等指标的动态变化作研究,初步揭示了传统四川泡菜多轮发酵母水生态系统中乳酸菌、酵母菌及各指标的动态变化规律,以期为指导传统四川泡菜的工业化改造提供理论参考。
1 材料与方法
1.1 试验材料
原料:莲花白、白萝卜、胡萝卜、生姜、辣椒、花椒购于眉山当地市场;无碘食用盐,购自四川省盐业公司;陶制泡菜坛,购自眉山当地市场。
试剂:无水乙醇(96%~100%),成都市科龙化工有限公司;细菌基因组DNA提取试剂盒、DNA回收试剂盒,天根生化科技(北京)有限公司;真菌DNA提取试剂盒,OMEGA公司;Bacterial DNA Isolation Kit,2×PCR Mix,成都福际生物技术公司;Biomiga EZgene TM Fungal gDNA Miniprep kit,美国Biomiga公司;乳酸、乙酸、酒石酸、琥珀酸、柠檬酸、苹果酸、丙酮酸标准品,色谱纯,上海阿拉丁生化科技股份有限公司。
培养基:MRS培养基、孟加拉红培养基、PDA培养基,北京路桥技术有限公司;琼脂糖,北京索莱宝科技有限公司。
模式菌株戊糖乳杆菌Lactobacilluspentosus(1.2437)和植物乳杆菌Lactobacillusplantarum(1.2439),购自中国普通微生物菌种保藏管理中心。
1.2 仪器与设备
2030型HPLC,日本岛津制作所;L6S紫外分光光度计、雷磁PHS-3C pH计,上海仪电科学仪器股份有限公司;T2002型电子天平,常熟市天量仪器有限责任公司;SHZ-D(Ш)循环式真空泵,巩义市予华仪器有限责任公司;DZKW-4电子恒温水浴锅,北京中兴伟业仪器有限公司;YM75Z75L不锈钢立式压力蒸汽灭菌器,上海博讯实业有限公司;漩涡混合器QL-901,海门市其林贝尔仪器制造有限公司;SW-CJ-IFD超净工作台,江苏苏净集团有限公司;超纯水仪,四川优普超纯科技有限公司;TGL-20BR台式冷冻离心机、T960梯度PCR热循环仪、IY04S-3E型凝胶成像分析系统,成都一科仪器设备有限公司;DYCP-31DN琼脂糖水平电泳仪,成都智诚科灵仪器仪表有限责任公司。
1.3 方法
1.3.1 泡菜母水制备
泡菜母水的制备方法如图1所示,原辅料配比如表1所示。具体步骤为:1)将新鲜原料用清水冲洗干净,并按照要求进行切分;2)先将处理后的原辅料投入到2.5 L的陶制泡菜坛中,再将食盐加入纯净水中溶解并加入坛内;3)密封后的泡菜坛置于(23±5) ℃下密封发酵;4)新鲜疏菜密封发酵5 d后,揭开坛盖用干净的玻璃棒轻微搅拌坛内泡菜,再静置10 min后,于液面下10 cm处四周及中间共5点取泡菜及母水样品(10 mL)混合后待测,此为第1代泡菜母水。再向坛内加入新鲜原料及原料总重量2%的食盐,密封后发酵2 d,继续取样,此为2代泡菜母水。此后每隔2 d取出成熟泡菜与泡菜水,并加入新鲜蔬菜进行下一代泡制,如此不断重复,连续泡菜20代;5)泡菜坛内生姜与辣椒在泡渍发酵5代后更换相同质量的新鲜生姜、辣椒和花椒,即在第5代、10代、15代、20代时将坛内的泡生姜、泡辣椒和花椒取出,加入相同质量的新鲜生姜、辣椒和花椒,同时加入新鲜生姜和辣椒总质量2%的食盐。

表1 泡菜制备原辅料配比Table 1 Raw material ratio of paocai preparation
1.3.2 乳酸菌和酵母菌计数与分离纯化
将1 mL泡菜母水加入至9 mL无菌生理盐水中,进行梯度稀释,选取适宜稀释度,分别涂布100 μL于MRS固体培养基和孟加拉红固体培养基上计数。其中,MRS固体培养基37 ℃培养48 h,孟加拉红固体培养基28 ℃培养48~72 h,同时以未接种菌株的培养基作为空白对照。
1.3.3 乳酸菌分离纯化及鉴定
观察MRS培养基中典型菌落的菌落特征,分别挑取不同形态的菌株进行分离纯化,反复纯化1~2次后,进行革兰氏染色检验,筛选革兰氏阳性的形态类似乳酸杆菌的无芽孢纯菌株。转接入液体MRS中培养18~24 h,将液体纯培养物保存于浓度为20%甘油中,-70 ℃保藏。采用DNA提取试剂盒(Bacterial DNA Isolation Kit)提取乳酸菌DNA。采用细菌通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′),1492R(5′-CTACGGCTACCTTGTTACGA-3′)进行16S rDNA扩增。PCR反应体系如表2所示,反应程序:94 ℃,3 min,94 ℃,30 s,56 ℃,30 s,72 ℃,30 s,72 ℃,5 min,PCR阳性扩增产物由成都擎科梓熙生物技术有限公司测序。将测序结果通过BLAST与GenBank数据库中已鉴定提交的序列进行比对,利用软件Mega5.0构建系统发育树。
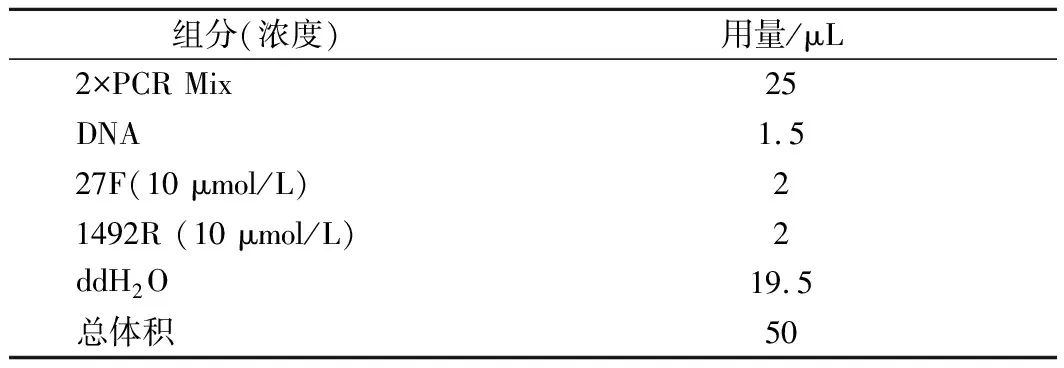
表2 16S rDNA的PCR扩增体系Table 2 16S rDNA PCR reaction system
由于植物乳杆菌(L.plantarum)和戊糖乳杆菌(L.pentosus)的16S rDNA同源性非常接近,均为99%以上,传统的系统发育树无法将其一一区分,因此采用TORRIANI等人[15]报道的recA基因的特异性引物paraF,pentF,p1anF和pREV,利用多重PCR技术进一步区分鉴别到种或亚种。recA基因的扩增体系如表3所示,反应程序:94 ℃,3 min;94 ℃,30 s;56 ℃,30 s;72 ℃,30 s;72 ℃,5 min;将扩增后的PCR产物采用2%琼脂糖电泳检测,根据电泳条带判别:L.plantarum318 bp,L.pentosus218 bp。
1.3.4 酵母菌分子鉴定及系统进化分析

表3 recA基因的PCR扩增体系Table 3 recA PCR reaction system
采用(Biomiga EZgeneTMFungal gDNA Miniprep Kit)试剂盒提取酵母菌DNA。PCR扩增正向引物为NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)、反向引物为NL4(5′-GGTCCGTGTTTCAAGACGG-3′)扩增26S rDNA片段,反应体系同上,反应程序:94 ℃,4 min,94 ℃,60 s,55 ℃,40 s,72 ℃,90 s,72 ℃,10 min。PCR阳性扩增产物由成都擎科梓熙生物技术有限公司测序。将测序结果利用BLAST程序在GenBank数据库中进行比对,利用软件Mega5.0构建系统发育树。
1.3.5 理化指标测定
参照GB/T 12456—2008 食品中总酸的测定法测定总酸[16];采用pH计测定样品pH;参照GB/T 12457—2008 测定样品盐度[17]。亚硝酸盐检测参照GB 5009.33—2016进行测定[18]。
有机酸测定:
(1)标准曲线的制作
准确称取有机酸标品(乳酸、乙酸、酒石酸、琥珀酸、柠檬酸、苹果酸、丙酮酸)10 mg 溶于1 mL超纯水中,依次稀释得到不同质量浓度(0.5、2、4、6、8、20、40 g/L)的标样,采用0.22 μm滤膜过滤后,待HPLC检测分析。
(2)样品检测
取泡菜水样于离心管中,12 000 r/min离心1 min,取上层清液,0.22 mm滤膜过滤后,HPLC检测分析。HPLC检测条件:色谱柱Carbomix®H-NP,柱温55 ℃;流动相为H2O 2.5 mmol/L H2SO4(3∶1,V∶V);流速:0.6 mL/min,进样体积10 μL,柱温55 ℃;紫外检测器波长210 nm。
2 结果与分析
2.1 多代发酵泡菜母水中乳酸菌和酵母菌数量变化
以微生物总数为横坐标,泡菜发酵代次(分别以G1代表第1代泡菜,G2代表第2代发酵泡菜,以此类推)为横坐标做图分析四川泡菜母水发酵生态系统中酵母菌与乳酸菌计数结果,如图2所示。1代泡菜母水中酵母菌数量为7×106CFU/mL,2代泡菜母水中酵母菌上升至3×107CFU/mL,并在此后的整个进化过程中基本保持稳定。采用SPASS 软件对不同代数之间泡菜母水中酵母菌数量之间进行ANOVA 检验(LSD法),第1代泡菜母水中酵母菌数量与其他代数泡菜间有显著差异,其余代数泡菜母水间酵母菌数量差异均不显著(p>0.05),说明不同代数泡菜母水中酵母菌数量维持一定的稳定。从第1代到第5代泡菜母水中的乳酸菌数量不断增加,从1代的5×107CFU/mL迅速增加至5代的3×108CFU/mL,从5代开始至18代,乳酸菌数量基本维持稳定,且20代泡菜母水中的乳酸菌数量有所上升,达到1×109CFU/mL。采用SPASS 软件对不同代数泡菜母水中乳酸菌数量进行ANOVA 检验(LSD法),第1代泡菜母水中乳酸菌数量与其他代数泡菜母水间差异显著,第5代与第7代发酵泡菜母水间乳酸菌含量差异显著,其余代数泡菜母水间乳酸菌数量差异均不显著(p>0.05),说明不同代数泡菜母水间乳酸菌数量无明显差异。
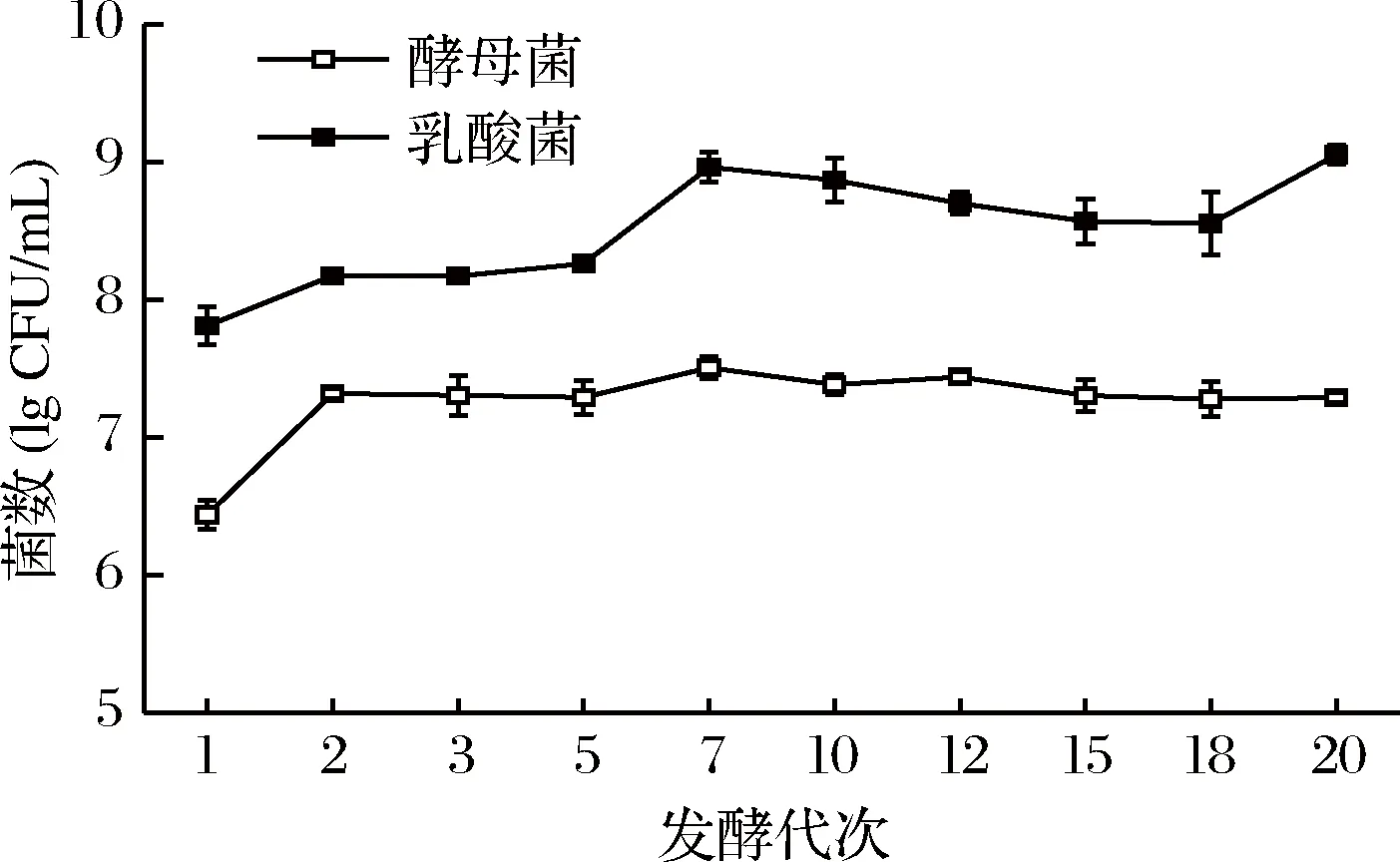
图2 泡菜母水进化过程中乳酸菌与酵母菌总数的变化Fig.2 The changes of the total number of Lactic acid bacteria and yeast during the aged paocai brine evolution
2.2 多代发酵泡菜母水中乳酸菌菌群
根据细菌在平板上的菌落形态,挑取单菌落进行分离纯化,经过多次划线、镜检和形态学观察,共分离出89株革兰氏阳性、无芽孢的乳酸菌。经16S rDNA序列测序,在GenBank数据库中比对,利用软件Mega5.0构建系统发育树,结果如图3所示。泡菜母水中的乳酸菌群主要包括2个类群,分别为Lactobacillaceae和Leuconostocaceae。其中Lactobacillusbrevis有15株;1CR6鉴定为Lactobacilluscitreum。系统发育树中,1CR7、20CR10等菌株与L.pentosus和L.plantarum同源性很高,16S rDNA测序方法无法鉴定到种。采用特异性PCR方法对73 株L.plantarum族乳酸菌进行分型,部分电泳结果见图4。a为模式菌株L.plantarumCGMCC 1.2439,PCR目标产物长度为318 bp;b为模式菌株L.pentosusCGMCC1.2437,PCR目标产物长度为218 bp;其中3、6泳道目标产物长度为218 bp,对应菌株可判定为L.pentosus;泳道4、5目标产物为318 bp,对应菌株可判定为L.plantarum。经种特异性PCR鉴定的结果有4株L.plantarum,69株L.pentosus。
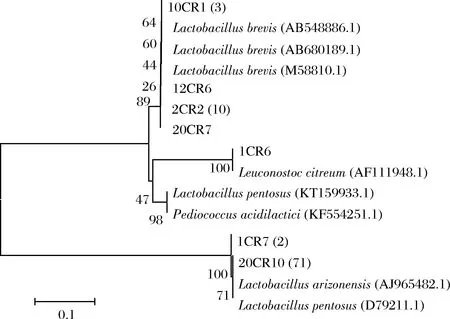
图3 泡菜母水中分离的乳酸菌16S rDNA细菌系统发育树Fig.3 Phylogenetic tree of paocai brine bacteria based on 16S rDNA sequences
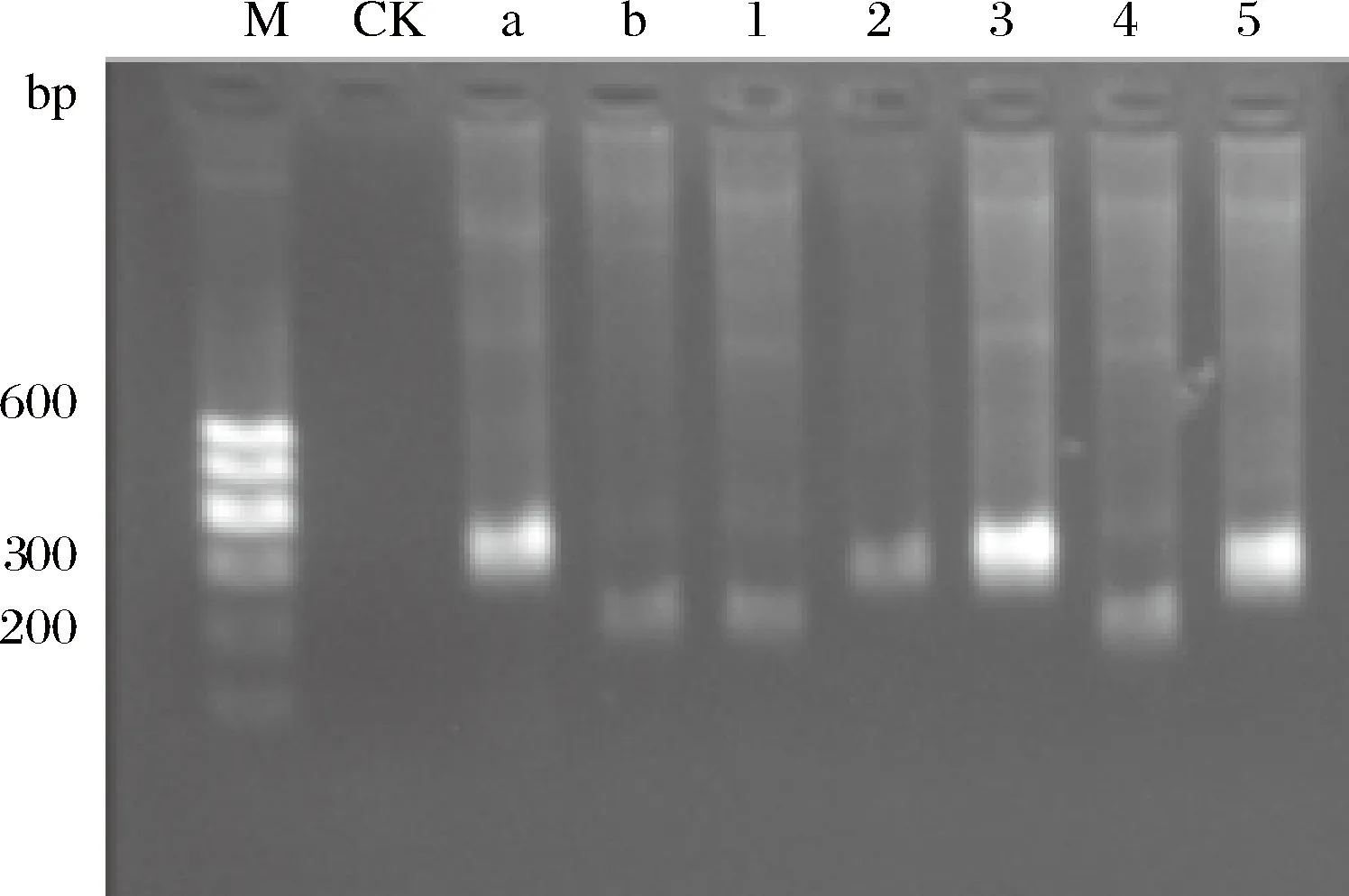
a-植物乳杆菌模式菌株;b-戊糖乳杆菌模式菌株图4 种特异性PCR电泳图Fig.4 Species-specific PCR electrophoretogram
2.3 多代发酵泡菜母水中酵母菌菌群
从孟加拉红平板上挑取酵母菌典型单菌落,于孟加拉红培养基多次划线纯化,经过镜检和形态学观察,共分离纯化出酵母菌59株,采用26S rDNA序列测序。将测序结果利用通过BLAST在GenBank数据库中进行比对,下载相似度较高的模式菌株序列,利用软件Mega5.0构建系统发育树,结果如图5所示。酵母菌主要包括4个种,分别为Kazachstaniaexigua、Candidatropicalis、Pichiamembranifaciens和Pichiakudriavzevii。

图5 泡菜母水中分离的酵母菌株26S rDNA系统发育树Fig.5 Phylogenetic tree of paocai brine yeast based on 26S rDNA sequences
2.4 多代发酵泡菜母水中理化指标分析
2.4.1 多代泡菜母水中总酸和pH的变化
总酸和pH是衡量泡菜发酵的重要指标,对微生物的生长和代谢产物的形成具有重要影响[19]。泡菜母水进化过程中pH和总酸的变化如图6所示。

图6 多代发酵泡菜母水中总酸和pH的变化Fig.6 The changes of pH and total acid during the multigeneration fermented paocai brine
前3代发酵泡菜母水中pH值由pH 4.0下降至pH 3.6,第4代直至第20代基本稳定在pH 3.6左右。采用SPASS软件对不同代数之间泡菜的pH值进行ANOVA 检验(LSD法),所有代数间泡菜pH值彼此差异均不显著(p>0.05),说明不同代数泡菜间pH无明显差异。多代发酵泡菜母水中总酸有较大波动:前1~5代,总酸从0.58 g/100 mL迅速上升至0.72 g/100 mL,在6~8代略有下降,9~17代又迅速上升至1.05 g/100 mL,18代迅速下降,此后基本稳定在0.9 g/100 mL左右。泡菜中的总酸主要是泡菜微生物代谢产生的有机酸,与泡菜发酵微生物之间有密切关系。前期发酵泡菜母水(1~3代)中,总酸迅速升高;在后期发酵泡菜母水中,可能由于有机酸和H+进一步积累,乳酸代谢途径因乳酸的积累产生反馈抑制作用,泡菜母水中的总酸呈现一定的下降趋势。采用ANOVA 检验(LSD法)对不同代数之间泡菜中总酸进行检验,不同代数间泡菜中pH之间差异不显著(p>0.05),说明泡菜中总酸变化不显著。
泡菜母水的pH和总酸有一定关系,一般情况下总酸含量越高,pH值越低,但二者之间没有明确的线性关系。本研究中,总酸直观地反映了泡菜母水中的有机酸积累情况,而pH值的变化则相对较小。泡菜母水中含有丰富的有机酸、有机酸盐等物质而具有较强的pH缓冲能力,只有当有机酸的积累超过了泡菜母水缓冲能力时,才会引起pH的显著变化。多代发酵泡菜在制作过程中不断取出成熟泡菜,再投加新鲜蔬菜,泡菜母水系统具有较强的pH缓冲能力,并在一定代数内维持稳定的pH环境,保证了传统泡菜相对稳定的风味与品质。
2.4.2 多代发酵泡菜母水中盐含量的变化
本研究模拟传统四川泡菜“老母水、鲜蔬菜、短时发酵”的制作过程,每次向泡菜坛内投入新鲜蔬菜的同时,补加一定量的食盐,确保在不同代数的泡菜中,泡菜水的盐含量能维持相对稳定。本实验控制泡菜母水中盐含量在2 g/dL左右。结果显示(图7),1~20代泡菜母水中的盐含量基本稳定在2 g/dL左右。所有代数泡菜母水中盐度无显著性差异(p>0.05),说明泡菜母水中盐度是稳定的。

图7 多代发酵泡菜母水中的盐分变化Fig.7 The changes of salinity during the multi-generation fermented paocai brine
2.5 泡菜母水进化过程中亚硝酸盐的变化
泡菜母水及泡菜中亚硝酸盐含量如图8所示,泡菜母水及泡菜中的亚硝酸盐含量随着泡菜制备代数的增加呈缓慢下降的趋势,1代泡菜母水及泡菜中的亚硝酸盐最高分别为3.2、2.2 mg/kg。此后随着发酵代数的增加,泡菜及泡菜母水中亚硝酸盐含量逐渐降低,到后期基本保持不变。第1代、第2代、第3代泡菜母水和泡菜中亚硝酸盐含量与其他代数泡菜母水中亚硝酸盐含量有显著性差异,其余代数泡菜母水中亚硝酸盐含量无显著性差异,说明发酵后期泡菜母水中亚硝酸盐含量维持稳定。泡菜母水及泡菜中的亚硝酸含量分别稳定在0.81 mg/kg和0.63 mg/kg左右。泡菜发酵时间越长,亚硝酸盐含量越低,后期稳定在0.63 mg/kg左右,远低于我国酱腌菜产品中的亚硝酸盐限量规定的20 mg/kg[20]。
泡菜中的亚硝酸盐主要是由蔬菜中硝酸盐还原生成。有报道称,蔬菜发酵过程中的大肠杆菌、副大肠杆菌、摩根氏变形菌等微生物因含有硝酸还原酶,可将蔬菜中的硝酸盐还原为亚硝酸盐,从而导致泡菜中的亚硝酸增加[21]。因此,泡菜中的亚硝酸盐含量与泡菜制备时所用的蔬菜原料和泡菜发酵微生物等有密切关系。本研究选用了传统四川泡菜制备中经常选用的白萝卜、胡萝卜、莲花白等原料,结果发现泡菜及泡菜母水中的亚硝酸盐含量随着泡菜发酵代数的增加呈下降趋势,这与泡菜发酵过程中微生物群落有直接关系。泡菜发酵过程中的乳酸菌含量逐渐增加,到后期泡菜母水逐渐进化为以乳酸菌为主要微生物群落的发酵系统。乳酸菌数量的增加及稳定的群落对泡菜发酵过程中的其他有害微生物如大肠杆菌等产生了抑制作用,减少了亚硝酸盐的生成。同时,乳酸菌及其代谢产物(有机酸)可以降解泡菜中的亚硝酸盐[22-23]。另外,多代循环式四川泡菜发酵过程中较低的pH可降低泡菜中的亚硝酸盐含量[24]。因此,以莲花白、胡萝卜、白萝卜等传统四川泡菜常用菜品为原料,采用传统家庭四川泡菜“泡菜母水、新鲜蔬菜、短时多代循环发酵”工艺生产的泡菜产品,其亚硝酸盐远远低于国家标准限定,无食用风险。

图8 多代发酵泡菜母水中泡菜水与泡菜中亚硝酸盐的变化Fig.8 The changes of nitrite content during the multi-generation fermented paocai brine
2.6 多代发酵泡菜母水中有机酸的变化
2.6.1 多代发酵泡菜母水中有机酸的动态变化
本研究利用HPLC检测了1~20代泡菜母水中的有机酸,柠檬酸、苹果酸、丙酮酸未检出,主要检出酒石酸、琥珀酸、乙酸和乳酸4种有机酸,它们在多代发酵泡菜中的动态变化如图9所示。

图9 多代发酵泡菜母水中有机酸的变化Fig.9 The change of organic acid during the multi-generation fermented paocai brine
酒石酸又称2,3-二羟基丁二酸,是泡菜中的重要酸味物质之一,发酵制品中常有检出。泡菜母水中的酒石酸含量较低,变化较小,第1代、第8代、第9代、第10代发酵泡菜与其他代数泡菜母水中酒石酸含量有显著差异,其余代数间泡菜母水中酒石酸含量无明显差异,后期基本稳定在0.2~0.4 g/L。
琥珀酸是蔬菜原料中常见的有机酸,在莲花白、胡萝卜、白萝卜中均有存在。另外,有报道称乳酸菌和酵母菌可在厌氧条件下通过PEP羧化激酶和PEP羧化酶途径固定CO2产生琥珀酸[25]。琥珀酸在泡菜母水进化过程中的变化呈现先缓慢上升,后逐渐稳定的变化趋势。第1、2、3、4、7代泡菜母水与其他代数发酵泡菜母水中琥珀酸含量有明显差异,其余代数间泡菜母水中琥珀酸含量差异不显著,说明后期泡菜母水中琥珀酸含量差异小。1代泡菜母水中的琥珀酸含量为0.395 g/L,此后缓慢上升,8代之后基本稳定,含量稳定在0.9±0.05 g/L。
乙酸是泡菜有机酸中的主要挥发性酸,少量乙酸可赋予泡菜独特的酸味和气味,也是泡菜风味成分乙酸乙酯的前体物质。第1、2、3、4、7代发酵泡菜中乙酸含量差异显著其余代数间发酵泡菜中乙酸含量差异不显著。乙酸含量在泡菜母水前期(1~9代)迅速增加,9代时达到最大值1.6 g/L;此后逐渐减少,到12代时基本稳定,最终稳定在1.2 g/L左右。酵母菌代谢产物乙醇是醋酸菌生长的基质,因此泡菜母水中的乙酸可能与泡菜母水发酵生态系统中的酵母菌有一定关系。最初几代发酵泡菜母水中酵母菌数量较少,代谢的乙醇数量很少,醋酸菌的活动较为平缓;随着酵母菌数量的增加和群落结构的稳定,泡菜母水中醋酸菌的活动逐渐旺盛,乙酸含量迅速增加;当泡菜母水中酵母菌和醋酸菌与优势微生物乳酸菌之间的相互竞争达成相对平衡时,泡菜母水中的乙酸含量逐渐稳定。
乳酸是乳酸菌的主要代谢产物之一,虽香气微弱,但酸味柔和持久,能赋予泡菜良好的风味;同时乳酸是酯化形成乳酸乙酯的前体物质,是泡菜主体风味成分之一。第1、2、5、9、10代发酵泡菜母水与其他代数发酵泡菜母水中乳酸含量差异显著,其余代数间泡菜母水中乳酸含量差异不显著。
前几代发酵泡菜母水中乳酸含量呈上升趋势,后几代泡菜母水乳酸含量基本保持在4 g/L以上,第20代泡菜母水中乳酸含量约为5.4 g/L。乳酸的变化与泡菜母水中的乳酸菌的数量和种类密切相关。最初几代发酵泡菜母水中的乳酸菌种类较多,但数量较少,乳酸发酵相对较为平缓;随着乳酸菌数量的迅速增加,泡菜母水中的乳酸迅速累积,乳酸含量快速增加;此后,由于乳酸菌数量和群落趋于相对稳定,泡菜母水中的乳酸含量的变化也趋于平缓。
3 结论
四川传统多代发酵泡菜母水发酵系统中主要菌群由乳酸菌和酵母菌组成,泡菜母水中酵母菌主要包括Kazachstaniaexigua、Candidatropicalis、Pichiamembranifaciens和Pichiakudriavzevii4种;乳酸菌群主要包括Lactobacillaceae和Leuconostocaceae2个类群。多代发酵泡菜母水进化过程中总酸有较大波动,但后期基本稳定在0.9 g/dL左右,pH基本稳定在3.6左右。泡菜及泡菜母水中亚硝酸盐含量逐渐降低,到后期基本保持不变,泡菜母水及泡菜中的亚硝酸盐含量基本稳定在0.63~0.81 mg/kg之间,远低于我国酱腌菜产品中的亚硝酸盐限量规定。泡菜母水中有机酸主要由酒石酸、琥珀酸、乙酸、乳酸组成。泡菜母水中4种主要有机酸含量随着发酵代数的增加逐渐积累增多,到后期(约10代后)基本均维持稳定。本研究结果初步揭示了四川传统多代发酵泡菜母水发酵系统中主要菌群由乳酸菌和酵母菌的组成,也揭示了多代发酵泡菜母水中盐分、亚硝酸盐、总酸、有机酸等理化指标到后期维持一定的稳态的现象,为指导传统四川泡菜工业化改造提供数据参考。

