酿酒葡萄品种遗传多样性的简单序列重复分析和分子身份证的建立
马文瑞,严密,刘业伟,江伟,全莉,王雪薇,武运*,薛洁*
1(新疆农业大学 食品科学与药学学院,新疆 乌鲁木齐,830052) 2(中国食品发酵工业研究院,北京,100015) 3(中国农业大学,北京,100083)
葡萄属于葡萄科(Vitaceae)葡萄属(VitisL.),分布于世界温带、亚热带,不仅可以鲜食,还能酿酒、制汁和制干,是重要的经济作物[1-2]。现在有一定栽培面积的优良品种主要为赤霞珠、美乐、霞多丽等[3-5]。随着我国葡萄酒产业发展,每年还有新品种不断引进,因此进行酿酒葡萄种质资源鉴定保护和葡萄酒鉴伪是我国葡萄酒行业规范发展和质量监控的重要措施。
葡萄繁殖方式主要为无性繁殖,不同葡萄酒产区间互相引种,并对外来优良新品种的引进,出现同名异物,同物异名等品种混淆问题,又因葡萄种间杂交过程中产生中间型和过渡型杂种的概率较高[6]。面对葡萄品种间极其丰富的多样性变异,传统的鉴定方法已经受到诸多限制,然而DNA指纹图谱技术的发展解决了这一问题。该技术能够从分子水平检测基因组中的遗传信息和序列多态性,兼备特异性和稳定性都较高的特点,能够快速对亲缘关系较近的种质个体进行鉴定[7]。
简单序列重复 (simple sequence repeats, SSR)技术也称微卫星技术,是目前广泛应用于植物种质资源鉴定、保护、遗传多样性分析和遗传图谱建立等方面的DNA指纹图谱分析技术。该技术具有共显性、灵敏度高、多态性高和重复性好等优点,可为植物种质资源遗传多样性分析,建立品种SSR指纹图谱提供便利[8-9]。温景辉等人利用SSR标记技术对20份葡萄原料进行了种质亲缘关系分析,所有种质总共分为4大类群,其中,亲缘关系较远的类群是山葡萄与欧亚种、美洲杂种,亲缘关系较近的类群是欧亚种与美洲种[10]。刘伟等人利用15对SSR引物对 21 种不同类型葡萄种质进行PCR扩增,对其遗传多样性进行了分析,SSR标记技术能够从分子水平上解析不同类型葡萄种质的遗传差异性,并能揭示材料间亲缘关系[11]。王慧玲等人利用9对SSR引物对13个新葡萄品种进行SSR分析,最终得到所有品种分子身份证,能够将所有供试材料有效区分[12]。樊秀彩等人筛选出能扩增出父本特异性条带的7对SSR引物对239株山葡萄和河岸葡萄的杂交后代进行鉴定,161株后代具有父本的特异性条带,另外,后代中还出现了新的条带,表明杂交后代产生了丰富的变异[13]。
本研究选取新疆天山北麓葡萄酒产区10个优良红白酿酒葡萄品种为试材,利用SSR标记分析技术,通过非变性聚丙烯酰胺凝胶扩增片段图谱,分析红白酿酒葡萄品种之间的亲缘关系,建立10个酿酒葡萄品种的分子身份证。
1 材料与方法
1.1 材料与试剂
选取新疆天山北麓葡萄酒产区的10个优良酿酒葡萄品种果实(表1),置于-80 ℃冰箱贮藏备用。

表1 十个酿酒葡萄品种及其分子身份证编码Table 1 Ten Vitis vinifera varieties and its molecular ID
10×PCR buffer[100 mmol/L Tris-HCl (pH 8.3),500 mmol/L KCl,15 mmol/L MgCl2],dNTPs,TaqDNA聚合酶和6×Loading Buffer等购买于TaKaRa宝生物工程(大连)有限公司;D2000 DNA marker购买于天根生化科技(北京)有限公司;所有PCR引
物,毛细管电泳所用引物5′-FAM(蓝色)标记均由生工生物工程(上海)股份有限公司合成;HIDI,LIZ500购买于美国 ABI 公司;其他试剂均为分析纯购自北京化工厂。
1.2 仪器与设备
测序列分析仪(3730XL),美国 ABI 公司;VeritiTM96-Well Thermal Cycler 梯度PCR仪,美国ABI公司;垂直电泳槽(JY-CZ-BL),北京君意东方电泳设备有限公司;电泳仪(BG-Power600),北京百晶生物技术有限公司;凝胶成像系统(Tanon 1600),天能科技(上海)有限公司;BioSpec-nano核酸蛋白检测仪,德国Eppendorf公司;微量移液器,德国Eppendorf公司。
1.3 方法
1.3.1 酿酒葡萄品种总DNA提取及质量检测
根据葡萄特性,将传统的十六烷基三甲基溴化铵法(hexadecyl trimethyl ammonium bromide, CTAB)进行改良,有效提高了葡萄总DNA的质量。具体步骤参考齐玲倩等人的《水果果肉中总DNA提取方法的比较研究》[14]。使用0.8%琼脂糖凝胶电泳检测DNA的片段大小和质量,并使用核酸蛋白仪检测样品总DNA的浓度和纯度,将样品浓度稀释至40 ng/μL。
1.3.2 PCR扩增和非变性聚丙烯酰胺凝胶电泳检测
本研究根据葡萄公共遗传图谱NCBI,确定选用12对国际通用的SSR引物用于PCR扩增,引物序列见表2。

表2 十二对SSR引物及其退火温度Table 2 Twelve sequence and annealing temperature of SSR primer
注:F-上游引物;R-下游引物;Tm-退火温度。
酿酒葡萄普通SSR-PCR扩增反应,采用25 μL反应体系,其中包含有Mg2+浓度2.5 mmol/L,dNTPs为0.15 mmol/L,Taq酶为1.5 U,引物为0.5 μmol/L,DNA含量为40 ng/25 μL,剩余用双蒸水补足[18]。
SSR-PCR反应程序:95 ℃预变性5 min;94 ℃变性50 s,退火温度60 s,72 ℃延伸1 min,共35个循环,最后72 ℃延伸7 min。
SSR-PCR扩增产物,采用8%非变性聚丙烯酰胺凝胶电泳检测,200 V,120 min。银染显色主要操作如下:染色 15 min,蒸馏水冲洗1~2次,显色5 min,再次用蒸馏水冲洗1~2次,直至条带清晰为止。
1.3.3 PCR扩增和毛细管电泳检测
综合1.3.2非变性聚丙烯酰胺凝胶电泳图谱结果和经济成本角度考虑,最终选取多态性良好,重复性较好的5对SSR引物进行正向引物的5′-FAM标记,它们分别是VrZAG62,VrZAG79, VVMD5,VVMD27和VVS2。
酿酒葡萄SSR-PCR扩增反应,采用25 μL反应体系,其中包含有Mg2+浓度2.0 mmol/L,dNTPs为0.2 mmol/L,Taq酶为1.0 U,引物为0.5 μmol/L,DNA含量为40 ng/25 μL,剩余用双蒸水补足。SSR-PCR反应程序第一阶段:95 ℃预变性3 min;95 ℃变性30 s, 60 ℃退火30 s ,72 ℃延伸30 s,共10个循环。第二阶段:95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共20个循环,最后72 ℃修复延伸6 min。
SSR-PCR扩增反应产物,采用毛细管电泳法进行检测。具体步骤如下:吸取990 μL HIDI和10 μL LIZ500进行混匀,然后吸取10 μL混合物加入到96孔反应板中;迅速将96孔板置于平板离心机中,离心到500×g结束;对照上机检测表,在96孔板对应的孔中加入相对应的50 pg样品;再次将96孔板置于平板离心机中,离心到500×g结束;使用封板膜密封96孔板,振荡,再次离心到500×g结束;置于PCR仪中;变性程序为98 ℃,5 min,不加热盖,程序结束后立即冷却96孔板;然后将96孔板置于平板离心机中,离心到2 000×g结束;最后将PCR产物使用ABI 3730XL全自动基因分析仪进行检测分析。
1.3.4 数据分析
SSR-PCR产物通过非变性聚丙烯酰胺凝胶电泳分离、银染后拍照,根据电泳图谱多态性条带并赋值分析。相同电泳迁移率下的清晰条带赋值为“1”,无扩增条带的记为“0”,扩增条带不清晰将不进行统计,最终得到0/1数据矩阵结果,再利用NTSYSpc2.10e软件进行后续分析,不同酿酒葡萄品种之间的遗传相似系数利用NTSYSpc2.10e软件得出结果。首先利用软件中Similarity中的Qualitative Date功能计算不同品种间的遗传相似系数,然后采用非加权类平均法(unweighted pair-group method with arithmetic mean, UPGMA)进行聚类分析,最终利用Graphics功能得出聚类分析树状图。根据SSR-PCR非变性聚丙烯酰胺凝胶图谱,将所有品种不用引物的谱带进行有序编码转换,建立10个酿酒葡萄品种的分子身份证。根据每对引物对不同品种有效谱带分子量大小,从小到大有序编码为1~9,如果条带数超过9条,依次增加A~Z进行编码。如果SSR引物在其中一个样品中扩增出多个等位片段,选择分子量较小的分子量对其编码[19]。
根据ABI 3730XL出现的峰图与内标LIZ500 进行比较,根据峰面积和出峰时间得出每个样品在SSR位点的片段大小,使用Genemapper软件分析样品SSR数据,具体分析步骤参照尹玲等人的《我国新育成葡萄品种SSR指纹图谱的建立》[20]。最终得出酿酒葡萄品种在SSR位点的荧光指纹图谱。
2 结果与分析
2.1 SSR引物多态性分析
根据葡萄果实特性改良的 CTAB法提取总DNA,通过琼脂糖凝胶电泳和核酸蛋白仪测定样品DNA的质量,结果显示样品的DNA 的浓度和纯度已达到SSR分子标记要求,并将所有样品的DNA浓度稀释至40 ng/μL。SSR-PCR的聚丙烯酰胺凝胶电泳图谱显示,所有品种扩增条带清晰。本试验利用12对SSR引物在供试材料中检测到56个等位基因,SSR引物扩增的条带范围为13~28条,平均17.75条。片段长度介于100~800 bp,200~500 bp扩增片段较多。引物VVMD27扩增出 13 条条带,是扩增条带数最少的引物;VVMD8是扩增条带数最多的引物,多达 28 条。引物 VrZAG64扩增片段分子量范围最大,为150~800 bp;引物 VVS2扩增片段分子量范围最小,为140~340 bp。12对SSR引物共扩增213条扩增片段,均为多态性条带,多态性百分率为 100%,具体见表3。
2.2 酿酒葡萄品种的遗传相似系数分析
本研究根据图谱结果,得出 0/1矩阵统计结果,对不同品种之间的遗传距离进行了计算,结果见表4。10个酿酒品种中,不同样品间的遗传相似系数变化范围在0.67~0.85之间,平均遗传相似系数为0.76。其中“赤霞珠”和“美乐”之间遗传相似系数最高,为0.85,“小芒森”与“贵人香”,遗传相似系数相对最低,为0.67。

表3 不同SSR引物对10个酿酒葡萄品种的SSR-PCR 扩增产物多态性比较Table 3 Comparison of the polymorphism of SSR-PCR amplified products of 10 Vitis vinifera varieties withdifferent SSR primers
2.3 不同酿酒葡萄品种的SSR聚类分析
以所有样品的扩增图谱为基础,根据0/1数据矩阵结果,使用NTSYSpc2.10e软件进行UPGMA法聚类分析得出 10个酿酒葡萄品种的聚类树状图,见图1。结果显示10个样品在遗传相似系数 0.73处产生了分离,将所有10份试验样品分成 2类。
第 1个大类包含有所有的红葡萄品种,占所有样品的70%,当遗传相似系数是0.76时,又分成了3个亚类,第1个亚类是“赤霞珠”和“美乐”,第2个亚类是“蛇龙珠”和“品丽珠”,均为欧亚种,这4个品种相对较近,原因是“品丽珠”是“赤霞珠”,“美乐”和“蛇龙珠”的亲本之一。第3个亚类是“西拉”,“马瑟兰”和“小芒森”,其亲缘关系与第1和第2个亚类相对较远。
第2个大类包含白葡萄品种和麝香葡萄,在遗传相似系数 0.78时,又分成了2个亚类,第1个亚类有“霞多丽”和“贵人香”,第2个亚类是“玫瑰香”,单独为一个分支。

表4 十个酿酒葡萄品种的遗传相似系数Table 4 Genetic diversity of 10 Vitis vinifera varieties
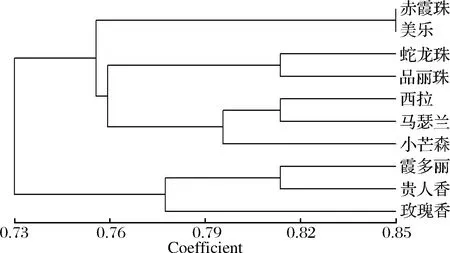
图1 基于SSR标记的10个酿酒葡萄品种聚类分析树状图Fig.1 UPGMA dendrogram of 10 Vitis vinifera varieties based on SSR results
2.4 酿酒葡萄品种分子身份证构建
12对引物对10个酿酒葡萄品种扩增的等位基因谱带大小分布范围及赋值标准见表5。用筛选出的12对引物按照多样性指数由低到高的顺序进行区分,其中前6对引物就可以区分所有的试验样品,并构建了10个酿酒葡萄品种分子身份证编码,具体见表1。在所有引物扩增的结果中,每个品种最少有1个特异等位基因,如引物VrZAG79扩增结果显示,“赤霞珠”,“美乐”,“西拉”,“马瑟兰”和“霞多丽”均有1个特异等位基因。如引物VVS2扩增结果显示,“霞多丽”,“贵人香”,“玫瑰香”,“小芒森”,“蛇龙珠”,“西拉”和“马瑟兰”均有1个特异等位基因。
2.5 酿酒葡萄品种荧光标记DNA指纹图谱的建立
5对5′-FAM标记的SSR引物VrZAG62,VrZAG79, VVMD5,VVMD27和VVS2,对所有供试品种进行毛细管电泳。基于每个引物 PCR 产物片段大小,根据毛细管电泳峰图的峰型以及每个峰值的大小建立,10个不同酿酒葡萄品种基于5对SSR 引物的分子标记图谱,图2为部分酿酒葡萄品种在荧光标记VrZAG79位点上的毛细管电泳谱图。

表5 不同SSR引物对10个酿酒葡萄品种的扩增产物片段大小及赋值标准Table 5 Alleles size range amplified of 10 Vitis vinifera varieties by SSR and encoded standard

图2 部分酿酒葡萄品种在荧光标记VrZAG79位点上的毛细管电泳图谱Fig.2 Capillary electrophoresis of VrZAG79 loci for some Vitis vinifera varieties
3 讨论与结论
随着分子标记技术和基因测序技术的快速发展,随机扩增片段多态性(random amplified polymorphic DNA, RAPD)、限制性片段长度多态性(restriction fragment length polymorphism, RFLP) 、扩增片段长度多态性(amplified fragment length polymorphism, AFLP) 、SSR、简单序列重复区间(inter-simple sequence repeat, ISSR)和单核苷酸多态性(single nucleotide polymorphism, SNP)等分子标记技术已经广泛应用于物种的起源、演化以及遗传变异等相关研究,在水稻[21]、大麦[22]、玉米[23]、苦瓜[24]、杏[25]、桃[26]等许多材料上均有报道。相对于传统的形态学标记技术,分子标记技术对物种的亲缘关系进行分析更加直接准确。SSR标记是一种共显性分子标记,其检测所需DNA量少,且耗时短,多态性好,重复性好,信息量大,能够高效精准地对亲缘关系相对较近的品种或个体进行分析鉴定,从而在葡萄种质遗传多样性分析,葡萄品种资源保护鉴定和DNA指纹图谱构建等方面得到了较广泛的应用。但应用 SSR标记进行红白酿酒葡萄品种间的遗传多样性和指纹图谱建立研究相对较少,同时由于酿酒葡萄种质的亲缘关系较近,仍有很多优良种质未得到评价与鉴定。本研究特选取红白酿酒葡萄品种进行品种间遗传多样性分析和分子身份证的建立[27]。
种质资源的遗传多样性能够反映个体在特定生长环境下基因的丰富程度,是品种种质研究工作中的基础,因此品种间亲缘关系分析和指纹图谱构建对于品种选育,鉴定和保护有重要意义[28]。郭印山等人利用49对SSR引物对20 份葡萄材料进行了亲缘关系分析,研究数据显示,遗传相似系数为0.672时,所有葡萄品种分为3大类群。第1大类包括2份欧美杂种和1份美洲种;第2大类为8份欧亚种葡萄品种;第三大类包括2份山欧杂种和2份山葡萄品种[29]。董志刚等人采用SSR标记技术对15份葡萄种质进行了聚类分析,结果显示,将其分成两大类,第1大类是山欧杂种,第2大类是欧亚种和欧美杂种[30]。由以上前人研究结果可见,欧亚种和美洲种这2个葡萄种质类群的亲缘关系相对较近,而山葡萄与二者亲缘关系相对较远。本试验以10个红白酿酒葡萄品种为试材,利用SSR标记探讨红白酿酒葡萄品种的亲缘关系,聚类分析结果显示,所有试验酿酒葡萄品种亲缘关系较近,在遗传相似系数 0.73处产生了分离,将所有样品分成 2类,第1大类包含所有红葡萄品种,第2大类包含所有白葡萄品种。其中小芒森聚为第1大类,原因可能是其亲本之一为红葡萄品种。
利用SSR分子标记技术构建葡萄品种的 DNA 指纹图谱,可为保护优良葡萄品种种质资源、鉴定和检测葡萄品种及其葡萄酒真实性和纯度提供了客观科学的参考依据。DNA指纹图谱分析常用的方法为特征谱带法和引物组合法,两者结合则大大提高了鉴别效率。成冰等人利用14对SSR引物对13个酿酒白葡萄品种进行扩增,结果显示特异性条带率为25.00%,其中,VrZAG79条带总数,多态性条带和特异性条带均为最多,且所有品种的遗传差异性较大。2个引物VrZAG62和VVIb66可分别鉴定所有试验品种[31]。杜晶晶等人利用9对引物对80份葡萄种质资源进行分子身份证编码,并能够区分所有品种,表明 SSR 标记技术可以高效鉴定葡萄品种[19]。尹玲等人对国内24个新葡萄品种,利用6对SSR荧光标记引物进行毛细管电泳,能够明确区分所有供试品种,并建立其指纹图谱[20]。本试验利用6对SSR引物对10个红白酿酒葡萄品种进行等位基因赋值并构建了供试材料的分子身份证编码,其中,10个品种均有特征性引物,VVS2是7个品种的特征性引物。同时筛选出5对多态性高,稳定性好的SSR引物荧光标记并进行毛细管电泳,得出10个酿酒葡萄品种的SSR标记的荧光图谱。
本试验利用12对SSR引物对10个酿酒葡萄品种进行了遗传多样性研究,由亲缘关系远近将其分成2个类群。并依据所有样品的聚丙烯酰胺凝胶电泳图谱,选用6对引物对所有试验材料进行了分子身份证编码,研究表明 SSR标记从分子水平上解析了红白酿酒葡萄品种的遗传多样性,一定程度上对酿酒葡萄品种选育,鉴定和保护有重要意义。同时,采用了5'-FAM荧光标记 SSR引物和毛细管电泳技术,最终得出的10个酿酒葡萄品种的SSR荧光图谱,有利于丰富国际葡萄品种数据库,也对葡萄品种及其葡萄酒真实性和纯度的检测提供了参考依据。

