产阿魏酸酯酶的枝状枝孢霉筛选、发酵特性及在黄酒中应用研究
李翠翠 , 毛 健 , 刘双平 , 周志磊 , 孟祥勇
(1.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;2.江南大学 食品学院,江苏 无锡214122;3.江南大学 食品安全与营养协同创新中心,江苏 无锡 214122;4.国家黄酒工程技术研究中心,浙江 绍兴 312000;5.江南大学 (如皋)食品生物技术研究所,江苏 如皋 226500)
阿魏酸(ferulic acid,FA)是植物界普遍存在的一种酚酸,具有抗动脉粥样硬化、抗血栓、降血脂、抗菌消炎、抗肿瘤等多种生理功能[1-2]。阿魏酸在食品中的研究和应用始于日本,2008年,日本批准将阿魏酸作为特定保健用食品素材。2010年,FDA公布可将阿魏酸作为有益于人体健康的益生元功能配料,应用于食品饮料和膳食补充剂[3-4]。
阿 魏 酸 酯 酶 (feruloylesterases,FEA,EC 3.1.1.73)是羧酸酯水解酶的一个亚类,属胞外酶。阿魏酸酯酶主要生物功能是水解多糖与阿魏酸连结的酯键,从而将阿魏酸及其他苯丙烯酸释放出来,目前利用阿魏酸酯酶及其他辅助酶作用于麦麸,释放大量阿魏酸已得到广泛研究。在食品工业中,利用阿魏酸酯酶来降解植物细胞壁中的阿魏酸酯键,可以得到有药用价值和保健功能的游离阿魏酸[5]。阿魏酸酯酶的来源广泛,可以从多种微生物的胞外酶中分离得到,真菌、细菌和酵母等都可以分泌出阿魏酸酯酶。
国内外有关微生物产阿魏酸酯酶的相关研究较多,如Donaghy等[6]报道以阿魏酸甲酯为碳源时,黑曲霉液态发酵产酶活力达到28 U/L,青霉菌达到32 U/L,以麦麸为碳源时,米曲霉液态发酵产酶活力达到72 U/L。Tenkanen等[7]报道以去淀粉麦麸为碳源时,土曲霉液态发酵产酶活力达到60 U/L,以木质纤维为碳源时,泡盛曲霉液态发酵产酶活力达到90 U/L。Tai等[8]的研究中以小麦麸皮为碳源时,塔宾曲霉阿魏酸酯酶活力能够达到33.78 U/L。王洪川等[9]报道侧孢霉液态发酵产酶活力达到2.0 U/L。Shin等[10]报道以玉米皮为碳源时,轮状镰刀霉菌液态发酵产酶活力达到23.9 U/L。Crepin等[11]研究发现粗糙脉孢菌阿魏酸酯酶基因经重组在毕赤酵母中表达,最高酶活达到85 U/L。Johnson等[12]以去淀粉麦麸为碳源液态培养,链酶球菌产酶活力最高达到130 U/L。但这些菌发酵产阿魏酸酯酶的活力普遍较低,严重限制了其在食品工业中的应用[13-14]。因此筛选出新的高阿魏酸酯酶能力的野生型菌株对富含阿魏酸功能性食品的开发具有重要价值。
本文从黄酒麦曲中分离筛选出高产阿魏酸酯酶的枝状枝孢霉菌株(Cladosporium cladosporioides),目前国内外均未见此菌株产阿魏酸酯酶的相关报道,对其进行液态发酵测定酶活,属于目前野生菌液态发酵中产酶活力最高菌株[13]。之后对该菌株的发酵特性及其在功能性食品开发中的应用进行了研究,以黄酒为例,开发富含阿魏酸的功能性黄酒,证明菌株在产阿魏酸酯酶及富含阿魏酸功能性食品开发方面具有很大潜力。
1 材料与方法
1.1 材料
1.1.1 样品材料 黄酒麦曲来源于浙江塔牌绍兴酒有限公司。
1.1.2 化学试剂 阿魏酸乙酯、反式阿魏酸标准品购自阿拉丁试剂公司;DNA凝胶回收试剂盒来自AXYGEN公司;TaqDNA聚合酶来自上海桑尼生物科技有限公司;DNA marker来自Takara公司;其他常规试剂均为国产或进口分析纯。麦麸购自无锡米市。
1.2 实验方法
1.2.1 培养基 斜面培养基:马铃薯琼脂固体培养基(PDA 固体培养基),马铃薯 200 g,蔗糖 20 g,琼脂 18 g, 蒸馏水 1 000 mL,pH 自然,1×105Pa灭菌20 min。
种子培养基:液体PDA培养基,不加琼脂,pH自然,1×105Pa 灭菌 20 min。
初 筛 培 养 基 :NaCl 0.3 g, (NH4)2SO41.3 g,MgSO4·7H2O 0.3 g,K2HPO40.3 g, 琼脂粉 18 g,15 mL阿魏酸乙酯 (溶于10%V/V二甲基甲酰胺),蒸馏水 1 000 mL,pH 自然,1×105Pa 灭菌 20 min。
复 筛 培 养 基 :NaCl 0.3 g, (NH4)2SO41.3 g,MgSO4·7H2O 0.3 g,K2HPO40.3 g, 蒸馏水 1 L,pH 6.5。在250 mL三角瓶中称取10 g麦麸,再加入100 mL液体部分,于1×105Pa灭菌20 min。将培养24 h的种子液按体积比为4%的接种量接种到100 mL发酵培养基中,于30℃,200 r/min下培养一定时间[15]。
1.2.2 菌株筛选 麦曲预处理:取麦曲10 g,放置在含90 mL无菌蒸馏水与玻璃珠的250 mL三角瓶中,封口,在振荡仪上200 r/min振摇30 min,使其中微生物充分分散,制成10-1倍样品稀释液。
单菌落透明圈初筛:在超净工作台上用梯度稀释法得到 10-2、10-3、10-4、10-5、10-6、10-7倍样品稀释液, 取 10-4、10-5、10-6、10-7四个稀释梯度样液各 0.2 mL涂布于初筛培养基,放置在28℃培养箱内培养1-5 d后,观察透明圈大小。
产阿魏酸酯酶菌株的纯化:初筛培养后,根据初筛培养基上菌落周围透明圈的大小,挑取透明圈大的菌落进行梯度稀释,涂布于初筛平板上,28℃培养箱内培养1~3 d,得到产阿魏酸酯酶的微生物单菌落。取单菌落接种于PDA培养基,28℃培养箱内培养3 d,甘油-80℃保种,斜面4℃保种。
高阿魏酸酯酶活性菌株的复筛:通过分离纯化的初筛菌株接种于复筛培养基,由于复筛培养基中阿魏酸含量的多少可以间接反映菌株产阿魏酸酯酶能力的高低,所以本研究直接以复筛培养基中阿魏酸含量为检测指标,使得实验既简便又准确[16]。
1.2.3 阿魏酸测定
(1)标准溶液的制备。准确称取反式阿魏酸标品0.01 g,用乙醇定容至10 mL得到1 g/L的标准贮备液。 分别吸取 0.25,0.5,0.75,1,1.25,1.5,1.75 mL用乙醇定容到25 mL容量瓶,配制成10,20,30,40,50,60,70 mg/L, 于 280 nm 下测定吸光度值[17]。
(2) 色谱条件。 色谱柱:XBridgeTM C18 (4.6×250 mm,5 μm)
流动相:(B:0.01%冰乙酸水溶液;D:纯乙腈),流速1.0 mL/min。
梯度洗脱方法:起始时间,B溶液流量80%,D溶液流量20%,维持2 min;8 min,B溶液流量72%,D溶液流量28%;13 min,B溶液流量42%,D溶液流量 58%;19 min,B溶液流量 80%,D溶液流量20%,维持6 min,结束。得到的线性曲线关系为:Y=2.79×104X+6.65×103,R2=0.998 2。
(3)样品阿魏酸含量测定。取发酵液25 mL,加入20 mL乙酸乙酯分两次萃取,合并乙酸乙酯相,挥干乙酸乙酯,无水乙醇25 mL容量瓶定容,过0.22 μm有机滤膜测定。
(4)阿魏酸酯酶活性测定。测定步骤:取250 μL发酵粗酶液,加入250 μL、pH 6.0 Na2HPO4-C6H8O7缓冲溶液配制的阿魏酸甲酯溶液,在50℃反应10 min后加入 500 μL体积分数 10%冰乙酸,4℃、10 000 r/min 离心 20 min,过 0.22 μm 滤膜,HPLC法测定阿魏酸含量[10]。
空白对照为蒸馏水250 μL代替阿魏酸甲酯溶液,其他反应与测定组相同。
酶活定义:在50℃、pH 6.0条件下,每分钟酯解阿魏酸甲酯,生成1 μmol阿魏酸所需酶量定义为1个酶活力单位(U)。
1.2.4 菌种形态观察 将复筛得到的菌株在PDA平板培养基上培养,观察菌落外观形态、菌丝生长情况等。
1.2.5 菌株的分子鉴定 菌株在液态PDA中培养72 h,收集菌丝体,采用液氮研磨法[18]提取基因组DNA,用Fungi Identification PCR Kit进行PCR扩增菌株rDNA ITS1-5.8S-ITS2区。采用ITS通用引物,ITS1:5′-TCCGTAGGTGAACCTGCGG-3′,ITS4:5′-TCCTCCGCTTATTGATATGC-3′。PCR扩增程序:94 ℃ 5 min;95 ℃ 0.5 min,58 ℃ 0.5 min,72 ℃ 1 min,35个循环,72℃7 min。送上海桑尼生物科技有限公司纯化后测序。
1.2.6 发酵条件对菌株产阿魏酸的影响 采用单因素法,考察温度、初始pH、麦麸添加量、酒度等因素对菌株麦麸培养基发酵过程中产阿魏酸的影响,以此来确定菌株在黄酒体系中能否生长产酶,通过反添加来提高黄酒阿魏酸含量是否可行。本研究根据阿魏酸含量的高低能够反映发酵体系中阿魏酸酯酶能力的高低,直接以发酵液中阿魏酸含量为检测指标进行测量。
(1)温度对产阿魏酸的影响。麦麸发酵培养基转速200 r/min,接种量4%,初始pH 6.5,麦麸加量10%, 分别放在 24、26、28、30、32、34、36、38 ℃条件下培养3 d,发酵液体部分,离心,取上清液测定阿魏酸含量。
(2)初始pH对产阿魏酸的影响。麦麸发酵培养基转速200 r/min,接种量4%,麦麸加量10%,初始pH 分 别 为 3.5、4.0、4.5、4.8、5.1、5.3、5.6、6.0、6.5、7.0,在1.2.6.1节所测得的最优条件下,培养3 d,发酵液体部分离心,取上清液测定阿魏酸含量。
(3)麦麸添加量对产阿魏酸的影响。麦麸发酵培养基转速200 r/min,接种量4%,麦麸添加量分别为 1%、2%、3%、4%、5%、7%、10%、15%, 在 1.2.6.1、1.2.6.2节所测得的最优条件下培养3 d,发酵液体部分,离心,取上清液测定阿魏酸含量。
(4)酒精度对产阿魏酸的影响。麦麸发酵培养基转速200 r/min,接种量4%,酒度分别为5%、7%、9%、11%、13%、15%,在 1.2.6.1、1.2.6.2、1.2.6.3 节所测得的最优条件下培养3 d,发酵液体部分,离心,取上清液测定阿魏酸含量。
1.2.7 菌株生长曲线及发酵过程阿魏酸酯酶活性变化曲线测定 将纯化后的菌株斜面孢子接种于PDA液体培养基中,培养120 h,每隔12 h定量取发酵液,4℃,10 000 r/min离心10 min,洗涤沉淀,相同条件下离心,沉淀部分105℃烘干至恒重,测菌丝质量。以培养时间为横坐标,菌丝干重为纵坐标,绘制菌株的生长曲线。
将菌株种子培养基按4%的接种量接入麦麸发酵培养基,30℃,pH 4.8,麦麸加量 5%,酒度9%的条件下,培养120 h,每隔12 h定量取发酵液体部分,离心,取上清液测定阿魏酸酯酶活性,绘制菌株发酵过程阿魏酸酯酶活性变化曲线。
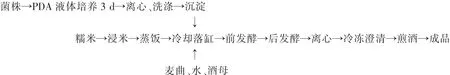
1.2.8 菌株在黄酒酿造中的应用 本实验采用机械化黄酒酿造工艺,以糯米为主要原料,在落缸阶段控制菌株加入量分别为 0,0.005%,0.010%,0.015%,0.020%,0.025%(以菌株干重占原料糯米比重计),考察菌株反添加对黄酒阿魏酸含量及黄酒基本理化指标的影响。
黄酒酿造工艺流程:
2 结果与分析
2.1 菌株初筛及平板分离纯化结果
根据初筛菌株能够产生透明圈,初步筛选到15株潜在的高产阿魏酸菌株。各菌株产生透明圈情况见表1。在初筛培养基上28℃培养3 d后,根据菌落透明圈的大小,发现菌株S1、S11、S13透明圈最大,铺满了整个平板,说明这3株菌生长能力旺盛,能够分泌阿魏酸酯酶,利用阿魏酸乙酯作为碳源,在此底物培养基上迅速繁殖生长。根据透明圈与菌落大小的比值,发现菌株 S2、S3、S5、S8、S10、S12 比值均大于2,初步判断这几株菌分解利用阿魏酸乙酯的能力相对较强。

表1 菌株的初筛结果Table 1 Initial screening results of strain
利用PDA固体培养基对所筛15株菌进行分离纯化,最终根据单菌落形态的不同,确定以下9株菌具备较高的产阿魏酸酯酶能力(表2)。另外,从菌落形态及特征可以看出大部分可能是霉菌,只有菌株S13白色绒毛菌落凸起生长10 mm,生长旺盛,怀疑可能是放线菌。
2.2 菌株复筛实验结果
根据复筛培养基中阿魏酸含量的多少可以间接表征阿魏酸酯酶活力的高低,菌株复筛实验直接测定了发酵液第3、4、5天阿魏酸的含量 (表3),初步判定菌株S2产阿魏酸酯酶能力较强,这与初筛实验结果是相一致的,并测定其粗酶活为103.2 U/L。
并在同样的培养条件下,测定了高产阿魏酸酯酶的商业模式菌株黑曲霉ATCC 16404发酵液阿魏酸含量,发现在发酵第3天,菌株S2产阿魏酸量是黑曲霉ATCC 16404的3.7倍,由此可见,本实验所筛菌株对阿魏酸酯酶微生物的研究具有重要意义。

表2 菌落形态记录Table 2 Observation of colony shape feature
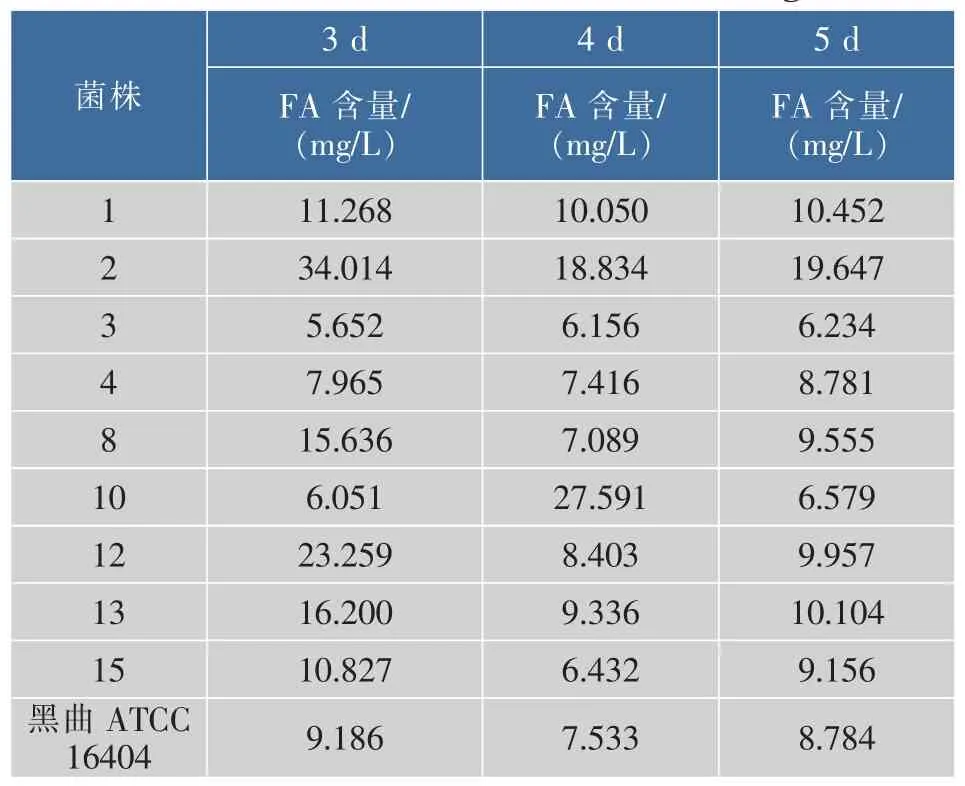
表3 菌株的复筛实验结果Table 3 Result of the second screning
2.3 菌株的鉴定
菌落形态观察:图1为S2菌株在初筛平板上的形态,根据菌株能够分解阿魏酸乙酯产生透明圈判断菌株具备产阿魏酸酯酶能力。图2为S2菌株在PDA平板上分离纯化后的结果,菌株菌落厚,呈厚绒毛状,与培养基结合紧密,不易挑起。颜色初为烟褐色至绿褐色,后期为黑褐色至黑色。菌落背面黑色。
菌株ITS1-5.8S-ITS2扩增:提取菌株S2总DNA作为模板,PCR扩增rDNA ITS1-5.8S-ITS2区,经测序目的基因序列长度为525 bp,GenBank序列号:KP900248.1。菌株S2的rDNA ITS1-5.8SITS2序列与Cladosporium cladosporioides strain FR5-SAR1同一性达到100%,分子进化树见图3,菌株S2与C.cladosporioides在构建的进化树的同一分枝上,结合菌株的形态特征及rDNA ITS1-5.8S-ITS2序列分析结果,判定菌株S2为枝状枝孢霉 (Cladosporium cladosporioides), 保藏编号为CCTCC NO:M2015549。本文筛选到一株来源于黄酒麦曲的具有产阿魏酸酯酶能力的枝状枝孢霉,但是其产酶的水平尚不清楚,因此后续实验中进一步将对其产酶能力进行评价,并对其在黄酒酿造中的应用进行探究。

图1 S2菌株在初筛培养基上的菌落形态Fig.1 Colony morphology of S2 strain on the Initial screening plate
图2 S2菌株PDA分离纯化后的菌落形态Fig.2 Colony morphology of S2 strain on the PDA plate after Purification

图3 菌株S2 的rDNA ITS1-5.8S-ITS2 序列的系统发育树分析Fig. 3 Phylogenic tree analyze based on rDNA ITS1 -5.8S-ITS2 sequences of strain S2
2.4 发酵条件对阿魏酸产生量的影响
根据现有报道,发酵条件对微生物发酵产阿魏酸酯酶活力有较大的影响。范韵敏等[19]的研究中发现起始pH对发酵产阿魏酸酯酶影响较大,通过对其优化之后酶活力提高32倍。方圆等[20]的研究中对发酵温度、时间优化后的酶活力也有所提高。李干等[21]的研究中通过对pH,培养基进行优化之后,酶活力提高37%。
另外,发酵条件的控制直接影响黄酒的品质,本研究结合微生物阿魏酸酯酶产生条件及黄酒发酵条件,选取培养温度、初始pH、麦麸添加量、酒度作为4个基本指标,考察发酵条件对阿魏酸产生量的影响,为菌株在黄酒酿造中的应用奠定基础。
2.4.1 温度对阿魏酸产生量的影响 温度的控制是保证微生物正常生长、产物正常合成的必要条件,温度过高,菌体易于衰老,发酵周期缩短,微生物细胞中对温度较敏感的组成成分(如蛋白质、酶、核酸等)会受到不可逆的破坏,温度过低,微生物生长缓慢,产物产量降低。
实验结果表明,在30℃左右,该菌株在麦麸发酵培养基中产阿魏酸能力达到最高,发酵效果最好,27~30℃也是黄酒酿造前酵阶段的最适温度,说明该菌株在黄酒中可能具有较好的产酶能力(图4)。

图4 培养温度对产阿魏酸的影响Fig.4 Effect of cultivation temperature on FA production
2.4.2 pH对阿魏酸产生量的影响 pH是微生物生长的一个重要的环境条件,对微生物的生长、发育以及代谢过程都有很大的影响。当细胞处于不正常的环境中时,出于保护自身的本能和抵御外界环境伤害的需要,细胞可能会对其代谢产物的合成和分泌做出调整。由图5可知,在初始pH 3.5~7.0的条件下,该菌株均能代谢产生阿魏酸酯酶,且产酶量变化较大。当pH值在4.0~5.0的范围内,高的阿魏酸含量反映出菌株较强的阿魏酸酯酶活力。说明弱酸条件有利于该菌体的发酵产酶,偏中性条件会导致产酶量急剧下降。
黄酒酿造过程中,醪液中pH变化范围一般在4.0~5.0之间,这与上述菌株产阿魏酸酯酶的最适pH范围相吻合,所以将该菌株反添加到黄酒酿造过程中,pH条件是可行的。
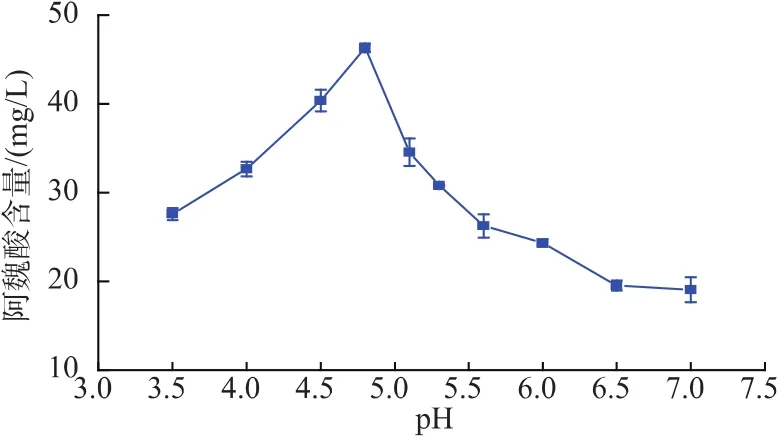
图5 pH对产阿魏酸的影响Fig.5 Effect of pH on FA production
2.4.3 麦麸添加量对阿魏酸产生量的影响 麸皮中丰富的营养元素为菌体生长提供了充足的营养,结合在麸皮多糖上的阿魏酸对阿魏酸酯酶产生起到诱导作用,同时麦麸含量的多少也会影响到培养基发酵产酶情况。由图6可知,当麦麸添加量达到5%时,菌株在麦麸发酵培养基中产阿魏酸能力达到最高,出现这一现象的可能原因是随着麦麸含量的继续增加,发酵体系中微生物生长所需要的碳源、氮源充足,已经不再成为菌株生长及产酶的主要限制因素,而此时固形物的增多可能会影响到发酵体系的溶氧及基质的传递速度等,从而影响阿魏酸的产生[21]。
在黄酒酿造过程中,诱导阿魏酸酯酶产生的麦麸主要来源于麦曲的带入,而且在整个体系中的含量均小于5%,所以不会对菌株发酵产生阿魏酸起到抑制作用。
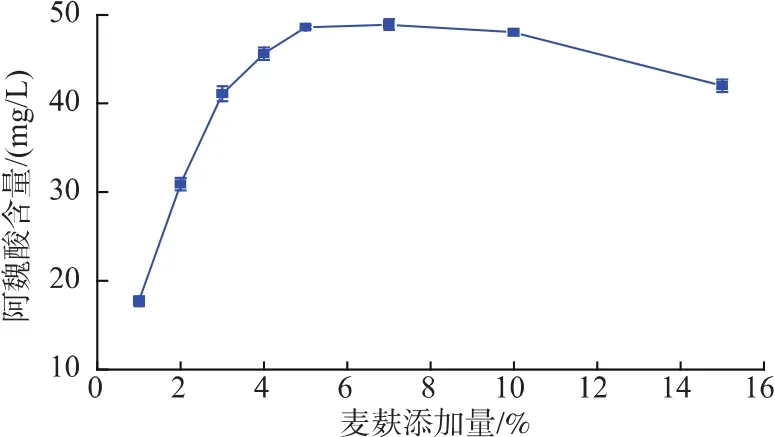
图6 麦麸添加量对产阿魏酸的影响Fig.6 Effects of Wheat bran content on FA production
2.4.4 酒度对阿魏酸产生量的影响 酒精含量对微生物生长、繁殖起到重要作用,据报道,当酒精度大于10%时,会对霉菌的生长及代谢产物的产生有较大影响[22]。图7表明,该菌株随着酒度的增加,产阿魏酸能力提高,当酒度达到9%时,醪液阿魏酸含量达到最高,在0~15%的酒度范围内,与对照组相比,菌株产阿魏酸基本不受抑制。由此判定,低酒度对菌株产阿魏酸酯酶能力起到促进作用。
黄酒酿造阶段,发酵醪液酒度会逐渐上升,最终达到15%左右,如果将该菌株加入到黄酒酿造阶段,则在发酵初期,酒度的上升会促进菌株代谢产生阿魏酸酯酶,这对提高黄酒阿魏酸含量具有重要意义。这也体现了该菌株在产阿魏酸酯酶方面耐受酒精的优势。

图7 酒度对产阿魏酸的影响Fig.7 Effects of alcohol content on FA production
2.5 菌株生长情况及阿魏酸酯酶活性变化
菌株的生长情况及代谢产阿魏酸酯酶情况会影响到其在黄酒中的应用效果,生长旺盛同时处于产酶能力最强阶段的菌株反添加到黄酒酿造阶段对黄酒阿魏酸的提高起到重要作用。本研究考察了菌株在液体种子培养基中的生长情况,同时又考察了菌株在麦麸诱导培养基中的产酶情况,从而决定反添加菌株培养多久最适宜加入到黄酒酿造中。
由图8可知,0~24 h内,S2菌株处于生长适应期,菌体数量稍有波动,但还是处于一个比较低的菌密度。菌株在麦麸发酵培养基中阿魏酸酯酶活性较低,小于40 U/L。
24~72 h内,菌株进入快速生长时期,此时期营养充足,菌株生长速率远远大于死亡速率,菌体数目大量增加,合成大量代谢产物,供菌体生长繁殖。同时,由菌株产酶曲线得知,此阶段菌株阿魏酸酯酶合成增加,酶活在72 h时达到最高,为175.4 U/L。
72 h以后,菌体数量的增加导致代谢副产物的积累,使得生长受到抑制,菌株生长进入衰亡期,阿魏酸酯酶等代谢产物的合成也相应减少。
根据上述实验综合分析,认为将培养72 h的菌株种子培养液离心、洗涤得到的沉淀加入到黄酒发酵过程中比较合适。此时,菌株正处于生长旺盛期,产阿魏酸酯酶能力也处于最强阶段,所以将此时刻的菌株反添加到黄酒酿造中,最有可能对提高黄酒阿魏酸含量起到促进作用。
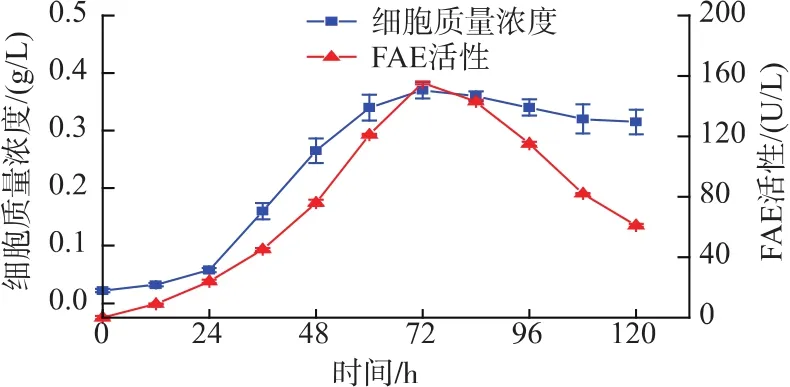
图8 S2菌株的生长情况及FAE活性变化曲线图Fig.8 Growth curve of strain S2 and FAE activity
2.6 菌株在黄酒酿造中的应用
阿魏酸是黄酒中重要的功能性物质,根据现有报道成品黄酒阿魏酸含量一般都在5 mg/L以下[23],所以本研究从微生物调控方向入手,通过筛选黄酒中高产阿魏酸酯酶菌株,对其产酶特性进行研究,再经富集培养,将其反添加到黄酒酿造过程中,以期提高黄酒阿魏酸总体含量,加强对黄酒保健方向的研究。
从图9可以看出,随着菌株添加量的增加,黄酒阿魏酸含量逐渐升高,当菌株添加量为0.010%时,阿魏酸含量相比对照组达到了150%,之后稍有下降。实验同时测定了该发酵条件下,黄酒基本理化指标、综合评价,发现其符合清爽型半干黄酒理化指标要求(表4)。这说明菌株反添加对黄酒功能性物质阿魏酸含量的提高具有一定作用,同时不会带来其他不良影响。
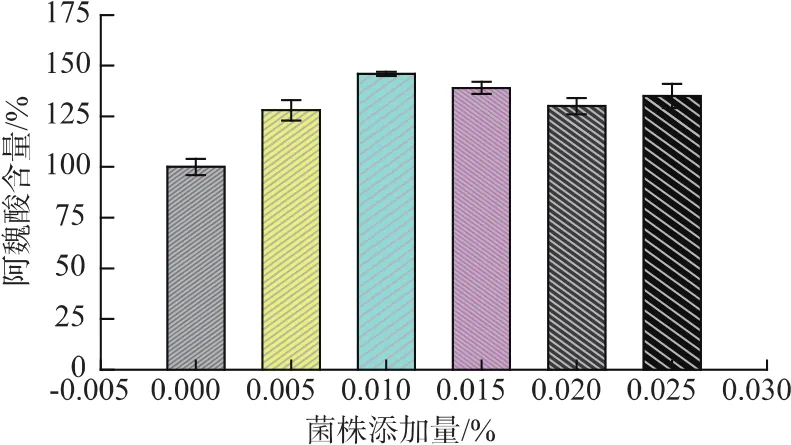
图9 菌株添加量对黄酒阿魏酸含量的影响Fig.9 Effect of strain S2 content on FA production during Chinese rice wine brewing
从食品安全健康的角度考虑,菌株来自黄酒体系本身,并非外源加入,不会对黄酒酿造体系产生不良影响,而且菌株自身产酶能力很高,不需要经过转基因等手段得到,会让消费者更加放心,这为黄酒及传统发酵食品功能及香气等特性强化的研究奠定了一定的基础。

表4 黄酒基本理化指标(0.010%菌株添加量)Table 4 Basic physical and chemical indexes of Chinese rice wine(0.010%strain content)
3 结语
黄酒麦曲含有复杂的微生物体系[24],根据现有报道,黄酒中含有一定量的阿魏酸,这说明了黄酒麦曲中可能存在能够代谢产生阿魏酸酯酶的微生物,从而将麦麸中结合态的阿魏酸游离出来。所以本研究从黄酒麦曲入手,通过初筛复筛,从黄酒麦曲中筛选出能够产生阿魏酸酯酶的枝状枝孢霉菌株,保藏编号为CCTCC NO:M2015549。目前国内外还未见此菌株产阿魏酸酯酶的相关报道,同时对其产酶活力进行测定,发现是目前野生菌液体发酵中产酶能力最高的,达到175.4 U/L,说明了此菌在阿魏酸酯酶生产方面具有较高的研究与应用价值。
本研究中枝状枝孢霉菌株筛选自黄酒麦曲,在温度30℃、初始pH 4.0~5.0,麸皮加量小于5%,酒度0~15%的条件下,菌株发酵产阿魏酸酯酶活力较好,说明菌株产酶特性与黄酒发酵条件切合。通过富集培养,将其反添加到黄酒酿造过程中,黄酒中功能性物质阿魏酸含量提高到原来的150%。另外该菌株来源于黄酒麦曲本身,通过反添加不会破坏黄酒体系的稳定性,对黄酒品质没有影响,这进一步验证了利用反添加方式强化黄酒功能特性思路的可行性,证明该菌株在富含阿魏酸功能性食品开发方面具有比较好的应用潜力。而且该菌株是野生型菌株,未经过任何基因改造,避免了消费者对所开发富含阿魏酸功能性食品的担忧。同时本研究为黄酒及传统发酵食品功能及香气等特征的强化研究带来了新的思路。

