甘油激酶的表达纯化及在酮糖合成中的应用
吴晓茹, 李子杰, 中西秀树, 高晓冬
(江南大学 生物工程学院,江苏 无锡 214122)
稀有糖的定义是自然界中存在但含量很低的单糖及其衍生物[1],单糖中如D-阿洛酮糖、D-山梨糖在自然界中含量稀少,属于稀有糖范畴。单糖衍生物中包括各种单糖对应的糖醇(如木糖醇、山梨糖醇)、环醇、去氧糖(如鼠李糖、岩藻糖)、氨基糖(如葡萄胺)、分支碳链糖(如D-芹菜糖)等[2]。稀有糖有很多用途,既可以作为食品添加剂改善其理化性质,还可以作为前体物质来合成具有生物活性的产物,因此稀有糖在食品、医药和保健等领域有很大的潜在应用[3-4],如D-阿洛酮糖具有保护胰腺β岛细胞、改善胰岛素敏感度和葡萄糖耐受性、减少腹部脂肪积累、清除活性氧自由基等作用,是一种很有前途的无能量的功能性甜味剂[5],但是目前大部分稀有糖的合成路线仍然有限,并且大多以较昂贵的前体物质进行合成,导致稀有糖的价格还是很高。
在醛缩酶家族中,磷酸二羟基丙酮 (dihydroxyacetone phosphate,DHAP)依赖型醛缩酶的应用最为广泛[6-7]。该类醛缩酶能催化供体DHAP与受体醛进行缩合反应,生成的产物有两个新的立体中心,并且一般是由醛缩酶决定立体中心的构型,而不依赖于底物的结构[8]。该类醛缩酶虽然可以接受多种醛分子作为受体,但对供体分子DHAP具有很严格的专一性[9]。由于DHAP的价格昂贵且不稳定,很大程度上限制了该酶类大规模的合成应用[10]。目前,最具有应用前景的是将DHAP的酶法合成与醛缩酶催化的缩合反应偶联。DHAP的酶法合成主要途径如下:一种是在氧气存在下,磷酸甘油氧化酶(GPO)氧化L-3-磷酸甘油生成DHAP;另一种是利用甘油激酶或者二羟基丙酮激酶,以二羟基丙酮为底物,ATP为辅助因子来生成DHAP;还有一种就是甘油首先被甘油激酶 (glycerol kinase,GK)磷酸化生成L-3-磷酸甘油,进而被GPO氧化为DHAP。Fessner等人首次建立了“一釜合成法”:首先在氧气的存在下L-3-磷酸甘油被GPO氧化为DHAP,然后在醛缩酶的催化下,生成的DHAP与醛受体进行缩合反应得到酮糖-1-磷酸,最后在酸性磷酸酶作用下脱去磷酸基团,得到目标糖化合物[11]。在Israel等人的工作中,用二羟基丙酮作为底物,以ATP为辅因子,在二羟基丙酮激酶的作用下生成DHAP,同时在乙酸激酶的催化乙酰磷酸实现ATP的再循环,在FucA醛缩酶的催化下DHAP与各种醛进行缩合反应,所有的反应都在“一釜”里进行[12]。
本研究旨在利用“一釜多酶法”合成策略,进一步降低成本(用便宜的底物代替L-3-磷酸甘油)。本论文中用到的甘油激酶可以催化甘油反应生成L-3-磷酸甘油,在反应中要有Mg2+和ATP的参与[13]。GK酶是甘油代谢过程中的限速酶,1,6-二磷酸果糖(FBP)会抑制该酶的活性[14]。GK是一种常见的酶,可以从不同生物组织中提取得到,目前主要是从大肠杆菌和嗜热脂肪芽胞杆菌中发酵生产[15]。血清中甘油三酯的含量是临床上诊断心血管系统疾病的重要指标,甘油激酶是酶法测定血液中甘油三酯的关键酶之一[16]。
基于本实验室前期利用GPO纯酶结合DHAP依赖型醛缩酶采用“一釜四酶法”合成稀有糖的基础[17-21],本论文中为了进一步降低成本,以甘油作为底物,把甘油激酶用于“一釜多酶法”体系合成包括稀有糖在内的一系列酮糖。
1 材料与方法
1.1 材料和仪器
1.1.1 质粒和菌株 大肠杆菌 MG1655、DH5α和Rosetta(DE3)本实验室保存。菌株BL21/pET28arhaD、BL21/pET28a-fda、BL21/pET28a-fucA、Rosetta/pET43a-rhaD、Rosetta/pET28a-glpO为实验室前期构建[17-21]。Rosetta/pET28a-glpK为本实验所构建。用于基因扩增的引物在华大基因合成。
1.1.2 酶、试剂及耗材 限制性内切酶、DNA连接酶及KOD DNA聚合酶购于TaKaRa公司 (大连);咪唑购于上海生工;甘油、D-果糖、腺苷-5'-三磷酸二钠盐(ATP)购于国药集团化学试剂有限公司;D-甘油醛(D-glyceraldehyde)购于上海相辉医药科技有限公司;过氧化氢酶(catalase)、异丙基-β-D-硫代半乳糖苷 (IPTG)、 卡那霉素、D-阿洛酮糖 (D-psicose)、D-山梨糖 (D-sorbose)、 酸性磷酸酶(acid phosphatase from sweet potato,AP) 购 于 Sigma-Aldrich;黄素腺嘌呤二核苷酸二钠盐水合物购于阿拉丁;Ni2+亲和层析柱购于GE;BCA蛋白浓度测定试剂盒(加强型)购于碧云天(南通);氧气购于新南气体;Aminex HPX-87H 色谱柱(300×7.8 mm)购于Bio-Rad公司;TLC硅胶铝板购于青岛海洋化工。
1.1.3 培养基及其他溶液配制 YT培养基:胰蛋白胨(tryptone)16 g/L,酵母抽提物(yeast extract)10 g/L,氯化钠(NaCl)5 g/L,琼脂(agar)20 g/L(固体培养基),湿热灭菌(121 ℃,20 min)。
TB 培养基:1.2%(W/V) 胰蛋白胨(tryptone),2.4%(W/V)酵母抽提物(yeast extract),0.4%(V/V)甘油,磷酸盐缓冲液为17 mM磷酸二氢钾(KH2PO4),72 mM 磷酸氢二钾(K2HPO4),湿热灭菌(121 ℃,20 min)。
用于蛋白纯化缓冲液:裂解细胞、平衡缓冲液为 25 mmol/L Tris-HCl(pH 8.0),150 mmol/L NaCl;洗涤缓冲液为 25 mmol/L Tris-HCl(pH 8.0),150 mmol/L NaCl,60 mmol/L咪唑;洗脱缓冲液为25 mmol/L Tris-HCl (pH 8.0),150 mmol/L NaCl,500 mmol/L咪唑;脱盐透析缓冲液为25 mmol/L Tris-HCl(pH 8.0),50 mmol/L NaCl。
1.1.4 主要仪器 超声破碎仪(南京新辰生物科技公司);高效液相色谱仪 (日立);蛋白纯化系统AVANT(AKTA);iMarK 酶标仪(Bio-Rad)。
1.2 实验方法
1.2.1 表达载体pET28a-glpK的构建 用KOD聚合酶进行PCR时,以大肠杆菌MG1655菌液为模板,以 glpK-F:5'-CCGGGAATTCATGACTGAAAAA AAATATATCGTTG-3'(EcoRⅠ)为上游引物。以glpK-R:5'-CCCAAGCTTTTATTCGTCGTGTTCTTC CC-3'(HindⅢ)为下游引物,来扩增基因glpK。使用限制性内切酶EcoRⅠ、HindⅢ分别对glpK基因片段和pET-28a质粒进行双酶切,经DNA连接酶连接后转化大肠杆菌DH5α,并涂布到YT卡那霉素(50 μg/mL)抗性平板上。挑选单菌落进行PCR鉴定,并提取质粒酶切鉴定,将筛选到的阳性转化子送至上海华大基因测序,从而得到正确编码的表达载体pET28a-glpK。
1.2.2 甘油激酶在大肠杆菌中的诱导表达 将重组质粒pET28a-glpK转化到 Rosetta(DE3)感受态细胞中,转化步骤同上,涂布到YT(卡那霉素)平板上,37℃过夜培养,然后挑取其中一个单菌落接种到LB(卡那霉素)液体培养基中,37℃过夜培养,取5 mL菌液接种到500 mL TB(卡那霉素)液体培养基中(1∶100),37 ℃振荡培养,约 3~4 h 后,转至16℃培养(降温),当菌体长到OD600约为0.8时,进行IPTG诱导表达(取样100 μL作为诱导前样品进行 SDS-PAGE 检测),然后加入 500 μL IPTG(浓度为100 mmol/L,终浓度为0.1 mmol/L)诱导,在16℃培养20 h后 (取样100 μL作为诱导后样品用来SDS-PAGE 检测),离心收集菌体(8000g,2min,4℃)。
1.2.3 甘油激酶的分离纯化 向收集的菌体中加入20 mL预冷的裂解液重悬细胞,置于冰上进行超声破碎,破碎约 30 min(破碎 5 s,间隔 5 s)后,显微镜观察细胞,直至破碎完成。将破碎好的菌体4℃12 000 g离心30 min,将上清液移到新的离心管中,利用该上清液来纯化目的蛋白(上清取样用来SDS-PAGE检测),使用蛋白纯化系统AVANT(AKTA)用镍亲和层析柱来纯化目的蛋白。首先,用平衡缓冲液平衡镍亲和层析柱(5 mL HisTrpTMHP),然后上清液以1.5 mL/min的流速流过镍柱,上样完毕后,用洗涤缓冲液洗去非特异性结合的杂蛋白,最后使用洗脱缓冲液洗脱目的蛋白,收集洗脱峰取样并进行SDS-PAGE检测。SDS-PAGE检测后剩余样品用透析袋(国药集团化学试剂有限公司)透析以除去高浓度的咪唑,将透析好的目的蛋白用BCA蛋白浓度测定试剂盒检测蛋白浓度。
1.2.4 醛缩酶以及磷酸甘油氧化酶的表达和纯化利用本实验室所保存的质粒,在大肠杆菌中表达纯化来源于大肠杆菌和海栖热袍菌的L-鼠李树胶糖-1-磷酸醛缩酶RhaD、来源于嗜热栖热菌的L-墨角藻糖-1-磷酸醛缩酶FucA、来源于肉质葡萄球菌D-果糖-1,6-二磷酸醛缩酶FruA和来源于肺炎链球菌的磷酸甘油氧化酶GPO[17-21]。
1.2.5 利用不同醛缩酶进行一系列酮糖的合成以甘油为前体,用“一釜多酶法”合成策略,进行一系列酮糖的合成。 反应体系如下 (1 mL):ATP(400 mmol/L,10 μL,4.0 mmol/L),MgCl2(200 mmol/L,10 μL,2 mmol/L),甘油(1 mol/L,25 μL,25 mmol/L),D-甘油醛(0.5 mol/L,50 μL,25 mmol/L),GK 酶(终质量浓度为0.5 mg/mL),磷酸甘油氧化酶GPO(终质量浓度为 0.2 mg/mL),过氧化氢酶(1 000 U,0.2 μL),FAD (68.7 mmol/L,0.2 μL,13.7 μmol/L), 醛缩酶(RhaDE.coli、FruA、FucA、RhaDT.mari) ( 终 质 量 浓 度 为0.5 mg/mL),补加50 mmol/L Tris-HCl(pH 8.0)缓冲液使反应总体积为1 mL[22]。反应在50 mL的离心管内进行,加入氧气至饱和,然后盖上橡胶塞,插入注射器针头连接一个充氧气的气球。
反应液在30℃下轻摇反应约12 h,取1 μL反应液通过TLC来检测(展开剂为正丁醇∶乙酸∶水=2∶1∶1(V∶V∶V),并使用茴香醛染液进行染色。反应终了后,向反应液中加入6 mol/L HCl调pH为4.6,然后加入 1.2 μL AP,在37℃轻摇反应 12 h,用 TLC来监测反应(展开剂为正丁醇∶乙酸∶水=2∶1∶1(V∶V∶V),反应完全后,用1 mol/L NaOH将pH调整到7.0。
用HPLC来检测酮糖的合成、产率及比例。HPLC检测条件如下:流动相为5 mmol/L H2SO4,流速为0.5 mL/min,柱温为60℃,示差检测器检测,进样量为20 μL。采用相同的HPLC工作条件进行和D-果糖、D-山梨糖、D-阿洛酮糖标准曲线的绘制。
2 结果与分析
2.1 甘油激酶基因的PCR扩增、克隆及鉴定
以大肠杆菌MG1655菌液为模板,扩增出一条约1 509 bp的条带,与预期的扩增产物大小吻合。按照1.2.1节方法构建重组质粒pET28a-glpK,重组质粒进行酶切验证,分别用EcoR I单酶切质粒pET-28a和重组质粒pET28a-glpK,用EcoRⅠ、HindⅢ双酶切重组质粒pET28a-glpK,双酶切重组质粒得到两个片段,其中大片段与线性pET-28a大小相当,1 500 bp处有一条带与glpK基因大小相同,表明重组质粒构建成功,见图1,测序结果与基因序列完全相同。
2.2 甘油激酶在大肠杆菌中的表达和纯化
根据图2,SDS-PAGE凝胶电泳分析结果显示,经IPTG诱导后菌体蛋白在约56 kDa处出现一条蛋白条带(泳道3),与预计大小吻合,未经IPTG诱导的菌体(泳道2)没有此条带,说明重组蛋白GK成功表达。同时菌体裂解上清出现清晰的目的蛋白条带(泳道4),表明重组蛋白GK以可溶性蛋白形式存在。经Ni2+柱纯化后的蛋白(泳道5),纯度可达90%以上,基本无杂质。从而表明该蛋白可以成功地在上清中表达和纯化。
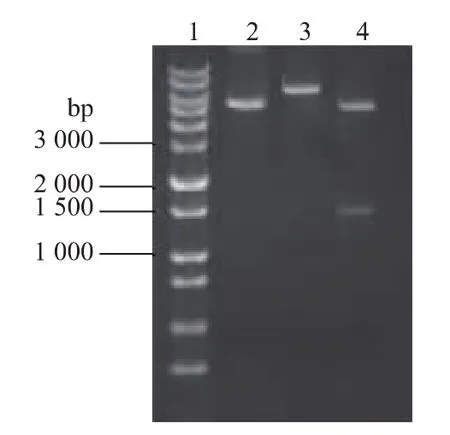
图1 重组质粒pET28a-glpK的酶切鉴定Fig.1 Restriction enzymatic analysis of recombinant plasmid pET28a-glpK

图2SDS-PAGE检测GK的表达与纯化Fig.2 SDS-PAGE analysis ofGK expressionand purification
2.3 TLC检测以甘油为前体的“一釜多酶法”反应
以甘油和D-甘油醛为底物,以ATP为辅助因子,在反应体系中加入GK、GPO和不同的醛缩酶RhaDE.coli、 RhaDT.mari、FucA、FruA 进行反应,反应过程示意如图3所示。图4为用TLC检测的结果,从图4(a-d)结果可以看出GK酶是可以催化甘油生成L-3-磷酸甘油,同时ATP变为ADP(用绿色箭头标出),然后在GPO和醛缩酶的作用下生成产物,生成的产物用展开剂展层并用茴香醛染液染色后,能够检测到酮糖-1-磷酸的生成,在TLC板上显示深靛蓝色,图中用红色箭头标出,调节pH值到4.7,加入酸性磷酸酶后,比较AP加入前后,可以发现酮糖-1-磷酸被脱掉磷酸生成新的物质酮糖,酮糖用黑色箭头标出,同时ADP变为AMP(用蓝色箭头标出)。
2.4 HPLC检测及比例测定

图3 以甘油作为起始底物通过“一釜多酶法”合成酮糖Fig.3 One-pet multienzymatic synthesis of ketoses with the substrate glycerol
为了进一步确定得到的产物,反应液用HPLC进行检测,并用D-山梨糖、D-阿洛酮糖和D-果糖标准品溶液,采用相同的HPLC检测条件,以浓度为横坐标,峰面积为纵坐标绘制标准曲线。

图4 TLC分析酮糖的生成Fig.4 TLC analysis of ketose synthsis
用甘油作为底物,首先利用GK、GPO和RhaDE.coli醛缩酶,以D-甘油醛为受体进行酮糖的合成。与前期结果一致,同时生成了稀有糖D-阿洛酮糖和D-山梨糖,通过HPLC分别测得D-阿洛酮糖的质量浓度为0.26 mg/mL,D-山梨糖的质量浓度为0.20 mg/mL,比例为D-阿洛酮糖/D-山梨糖=1.3/1,产量为0.46 mg,产率为 64%(见液相图 5(a)和表 1)(甘油和D-甘油醛相对于ATP来说是过量的,产率根据ATP的量计算,理论产生0.72 mg糖类)。为了验证GK酶与其他的DHAP依赖型醛缩酶是否可以偶联反应生成不同的产物 (酮糖),在相同的反应条件下,将GK酶分别与 FucA、FruA和RhaDT.mari应用于“一釜多酶法”合成体系中。结果表明,当醛缩酶为FucA以D-甘油醛为受体时,可以得到D-阿洛酮糖/D-山梨糖的比例约为0.4/1,质量浓度分别为0.09 mg/mL和0.25 mg/mL,产量为 0.34 mg,产率为47%(见液相图 5(b)和表 1);利用 FruA 醛缩酶,以D-甘油醛作为受体,通过HPLC检测其只生成D-果糖,说明FruA生成的产物具有很好的专一性,质量浓度为0.53 mg/mL,产率为74%(见液相图5(c)和表 1);利用 RhaDT.mari,以 D-甘油醛作为受体,通过HPLC测得D-阿洛酮糖/D-山梨糖的比例约为9/1,质量浓度分别为0.47 mg/mL和0.05 mg/mL,产量为 0.52 mg,产率为 72%(见液相图 5(d)和表 1)。 由此可知大肠杆菌来源的GK可以用甘油做底物,应用于“一釜多酶法”酮糖合成体系中,并且具有较高的活性,为该法进一步用于其他酮糖(如塔格糖等)及其衍生物的合成提供依据。


图5 HPLC分析酮糖的生成、比例及产率Fig.5 HPLC analysis of ketoses synthsis

表1 GK酶与不同醛缩酶的催化反应汇总表Table 1 Summary of GK and aldolases catalyzed reactions
3 结语
本研究成功地在大肠杆菌Rosetta(DE3)中表达、纯化了GK酶。在实验室前期工作的基础上,为避免在羟醛缩合反应中直接使用昂贵且不稳定的底物DHAP,以便宜的底物甘油作为前体物质,将GK成功应用于稀有糖的“一釜多酶法”合成中,并且具有较高产率,但仍需进一步降低成本,稀有糖的大量合成还有待于投入到真正的产业化研究中。

