微波杀灭虾源地衣芽孢杆菌孢子特性及效果
郭全友,王晓晋,2,姜朝军
微波杀灭虾源地衣芽孢杆菌孢子特性及效果
郭全友1,王晓晋1,2,姜朝军1
(1. 中国水产科学研究院东海水产研究所,上海 200090;2. 上海海洋大学食品学院,上海 201306)
为探讨微波和水浴对地衣芽孢杆菌孢子的杀菌效果和细胞壁结构的破坏作用,对不同温度和处理时间下水浴杀菌和微波杀菌处理前后孢子数量、核酸和蛋白质释放量及孢子萌发生长曲线的变化进行研究。结果显示,相同杀菌温度,微波对地衣芽孢杆菌孢子杀灭效果强于水浴,尤其是温度低于90 ℃;与Weibull拟合杀菌效果相比,线性拟合(2>0.56)比Weibull拟合(2>0.89)效果较差,但线性拟合结果更加直观;孢子悬液OD260 nm和OD280 nm先升高后下降,微波处理后孢子悬液OD260 nm和OD280 nm开始发生增长的时间均早于水浴,且微波处理在10 min内,OD260 nm和OD280 nm达到最大值,水浴处理在40 min内,OD260 nm和OD280 nm达到最大,说明微波处理导致的蛋白质和核酸泄露的时间均早于水浴;与水浴相比,微波处理后的芽孢萌发曲线延滞期均较长,水浴95 ℃处理100 min,延滞期即可延长8 min,而微波95 ℃处理10 min,芽孢不再萌发。结论:微波杀菌对地衣芽孢杆菌孢子的杀菌效果显著性强于水浴杀菌。通过对微波对枯草芽孢杆菌孢子杀菌效果的研究,可为靶向杀菌和微波杀菌在食品加工的应用提供理论基础。
微波;杀菌;食品加工;地衣芽孢杆菌;孢子
0 引 言
地衣芽孢杆菌()属厚壁菌门()芽孢杆菌科()芽孢杆菌属()与枯草芽孢杆菌,解淀粉芽孢杆菌和短小芽孢杆菌极其相似,革兰氏阳性菌,兼性厌氧。地衣芽孢杆菌能生成椭圆形抗逆性极强的芽孢,是鲍汁和玉米热狗肠等熟制即食食品中重要的腐败指示菌之一[1]。多数芽孢杆菌可分解有机物产酸产气并伴有不良气味,如地衣芽孢杆菌可产生胞外酶,如脂肪酶、淀粉酶和蛋白酶等,是导致食品腐败变质的主要原因[2]。研究表明地衣芽孢杆菌可产生外毒素具有强大的溶血活性[3],与食品中毒及肠胃炎的发生等相关[4]。为确保熟制即食制品在原料、处理、加工和流通环节中品质和安全问题,针对目标微生物采取高效杀菌和抑菌手段是十分关键的。
微波杀菌与传统热杀菌相比,不需传递介质且穿透性较强,能杀灭大多数微生物,降低食物中酶活性,保证食用安全和延长货架期[5]。Jamshidi等[6]发现接种大肠杆菌E. coliO157:H7(接种量3.2×107CFU/g)的鲜牛肉经微波70 ℃处理30 s即可被完全杀灭。Bauzakaszewska等[7]在鲑鱼和鳕鱼粉中接种大肠杆菌、沙门氏菌、肠球菌和梭状芽胞杆菌孢子,微波杀菌可使粪链球菌、梭状芽胞杆菌、金黄色葡萄球菌和沙门氏菌和李斯特菌等微生物失活或被杀灭[8-9]。微波杀菌效果受多方面因素影响,Morozov等发现,在1% NaCl溶液中,微波杀菌强于传统热杀菌[8,10]。微波杀菌可在短时间内杀灭大多数微生物,并抑制酶活性降低对食物品质的影响,如Marszałek等[11]发现微波120℃处理草莓果酱后,多酚氧化酶和过氧化酶有效活性分别降低98%和100%。微波杀菌时间对杀菌影响显著,微波短时杀菌,食物质构几乎不受影响,如一些蔬菜杀菌时间低于1 min,处理前后质构差异性不显著[12]。李桂芬等利用微波杀菌工艺处理带鱼段,750 W作用80 s,与未经处理带鱼段相比,延长货架期8 d[13]。Woo等[8,14]测定微波处理大肠埃希杆菌和枯草芽孢杆菌后的细胞密度,添加十二烷基硫酸钠(sodium dodecyl sulfate,SDS)的大肠杆菌细胞密度降低,但对枯草芽孢杆菌不存在影响。微波处理可破坏孢子,释放内容物DNA和蛋白质[15],但对分离自水产品的芽孢杆菌孢子的微波杀菌研究较少。
采用不同拟合方程可预测微波杀菌效果,杭峰等[16]通过SWeibull、Slogistic和Dose-response 模型,对50、55、60、65、70、80、90和100 ℃下微波处理大肠杆菌和金黄色葡萄球菌的杀菌进行拟合,表明Slogistic模型的拟合效果最佳。吴奕渠等[17]采用微波加热(50~90 ℃)下沙门氏菌、大肠杆菌和金黄色葡萄球菌的杀灭效果,结果表明,weibull模型可较好拟合杀菌曲线,在133 s后,菌数下降5个对数值。胡思卓等[18]综述了蜡样芽胞杆菌的杀菌动力学,主要包括线性模型、Weibull模型、Log-Logistic模型、Modified Gompertz模型和Biphasic模型。Evelyn 等发现超高压杀菌更适合非线性模型,热杀菌更适合线性模型拟合[19],但并未涉及微波杀菌模型分析。Staack等[20]发现红外线处理蜡样芽胞杆菌孢子,非线性模型拟合度更高,由于线性模型更加直观,仍选择线性模型拟合。可见,在线性拟合效果不佳时,可采用线性拟合粗略评估,再采用其他非线性模型拟合,使效应评价更加准确。
本研究以一株分离自胀袋南美白对虾即食虾仁的地衣芽胞杆菌为目标微生物,以水浴加热杀菌为对照,研究微波的杀菌效果,采用线性模型和Weibull模型拟合杀菌效果,并测定了杀菌前后芽孢悬液中蛋白质和核酸的变化,对比了杀菌前后芽孢萌发生长曲线的变化,为靶向杀菌和微波杀菌在食品加工中的应用提供理论基础。
1 材料与方法
1.1 试验菌株
试验所用菌株分离自即食南美白对虾,经16S rRNA 序列鉴定,与地衣芽孢杆菌(序列号:KU056999.1)的相似指数大于0.99,可认为是地衣芽胞杆菌,菌株用甘油封存,–20℃冻干保藏,活化待用。
1.2 试验试剂和仪器
营养琼脂培养基(AR),氯化钠(AR),磷酸二氢钠(AR),磷酸氢二钠(AR),均购自上海市国药集团化学试剂有限公司。
微波杀菌机:YO2G–03,南京永青食品保鲜科技发展有限公司;紫外分光光度仪:uv9100,美国LabTech公司;微生物生长曲线测定仪:Bioscreen C,芬兰;电热恒温水槽:DK-8D型,上海棱谱仪器仪表有限公司。
1.3 试验方法
1.3.1 芽孢悬液的制备
将菌株在营养琼脂培养基平板划线扩大培养,37 ℃培养7~8 d 左右进行芽孢染色检测芽孢率,待芽孢率≥90%时,用生理盐水反复洗脱刮下菌苔,于装有生理盐水的三角瓶中充分打散混匀;45 ℃水浴断链24 h,每隔4 h 于震荡器震荡1min,使芽孢分散为单个个体;80 ℃,30 min灭活营养体。充分混匀芽孢悬液,用生理盐水调整浓度到108CFU/mL。每个样品分装于2 mL冻存管中,存放4 ℃冰箱备用,即为芽孢悬液。
1.3.2 杀菌条件的设计
生理盐水稀释芽孢悬液到106CFU/mL,将装有200 mL孢子悬浮液的塑料烧杯置于微波杀菌机托盘中心,两边放置自来水400 mL作为负载,采用2.450×103MHz微波,调节功率到1.28 kW,采用温度探头S20MW-3测定不同时间的温度变化,悬浮液分别达到80、85、90、95和100℃,获取相应升温曲线;另采用水浴杀菌作对照,50 mL孢子悬浮液于塑料烧杯置于恒温水浴锅,达到上述所需温度,并获取相应升温曲线,如图1,图中以加热时间为横坐标,温度变化为纵坐标,将微波杀菌机/水浴锅设定到特定温度后,开启电源,待温度达到设定温度时开始计时,微波杀菌机内部设有温度探头,可实时测量温度,在温度低于设定温度时,微波杀菌机可陆续输出功率维持温度,在微波/水浴处理相应时间后,立即取出置于冰水浴冷却10 min。

图1 微波/水浴升温曲线
1.3.3 残存率测定
芽孢数采用平板计数,将未处理组和用生理盐水稀释到合适梯度的样品涂布于营养琼脂培养基平板上,(36±1)℃培养48 h,重复3次,计数,残存率测定用式(1),采用均值±标准偏差表示。

式中为残存率,为处理后芽孢数,CFU/mL;0为初始芽孢数,CFU/mL。
1.3.4 杀菌动力学
1)值(decimal reduction time)表示特定温度条件下,90%的原有残存活菌被杀死所需的时间(min);值是指在致死曲线中,致死时间增加或减少10倍时所需要减少或提高的温度值,值和值均反应微生物的耐受性[21]。
2)参照 Possas等[22]方法,采用Weibull模型分析杀菌效果。


3)拟合优度评价
采用2对拟合优度进行评价,(0<2<1)越大模型拟合度越好。
1.3.5 核酸和蛋白质测定
核酸和蛋白质的含量是指示微生物被破坏的重要指标,微波处理后的菌悬液中可检测到核酸和蛋白质的泄露。核酸中嘌呤碱和嘧啶碱有共轭双键,在紫外260 nm处有最大吸光值;蛋白质中含有酪氨酸、色氨酸和苯丙氨酸等苯环结构,最大吸光值在280 nm处。通过测定芽孢悬液中OD260 nm和OD280 nm值的变化,可指示芽孢悬液中核酸和蛋白质含量的变化[23]。
取处理前后的悬液5 mL于离心机中5 000 r/min离心10 min,测定上清液测定OD260 nm和OD280 nm值。
1.3.6 孢子萌发生长的测量
取50L水浴和微波处理前后的孢子悬液加350L营养肉汤接种于BioscreenC板中,每样3个平行。每2 h测1次OD600nm值,对处理前后芽孢萌发生长状态进行测试。
1.4 数据处理
试验数据均重复3次,采用平均值±标准偏差,采用SPSS18.0(PASW Statistics,inc)对由微波和水浴处理不同时间和温度所测得的残存率进行分析,按照线性模型和Weibull模型进行拟合,采用OriginPro 2017进行作图。并采用OriginPro 2017按照logistic模型对萌发生长曲线拟合做图。
2 结果与分析
2.1 地衣芽孢杆菌孢子对微波和水浴处理的D值和Z值分析
图2为微波和水浴在不同温度条件处理不同时间对地衣芽孢杆菌孢子的杀菌效果,表1为地衣芽孢杆菌孢子在微波和水浴条件下值和值的比较。图2a至图2e可见,随着处理时间的延长,微波和水浴中地衣芽孢杆菌孢子浓度逐渐下降,处理相同时间时,微波处理下孢子浓度下降速率大于水浴时下降速率。表1可见,微波和水浴处理时,随着温度的升高,值不断减小,尤其是90~95℃值变化最大,均减少20 min以上,且在相同温度处理条件下,水浴的值均大于微波,尤其是80 ℃时水浴值比微波值长约161 min,85 ℃时水浴值比微波值长约79 min,>90℃时水浴值与微波值相差较小。但微波处理的值远大于水浴值,可能是低于90℃和高于90℃时微波和水浴处理的值相差过于悬殊的原因。
2.2 Weibull杀菌模型拟合
图3为在80、85、90、95和100℃条件下处理不同时间,微波和水浴处理下地衣芽胞杆菌的杀菌效果。图3可知,温度和时间对杀菌效果均有影响。100℃水浴处理1 min芽孢存活率下降2.25 lg(CFU/mL),处理5 min芽孢存活率下降2.83 lg(CFU/mL),而95℃水浴处理5 min后存活率下降1.23 lg(CFU/ mL),80和85℃处理100 min,存活率下降仅为0.45和0.88 lg(CFU/ mL)。微波处理的残存率表现出同样趋势,可见<90 ℃时处理时间对芽孢残存率的影响大于温度对芽孢残存率的影响,≥90 ℃时温度对芽孢存活率的影响大于处理时间对芽孢存活率的影响。可见,采用温度>90℃的热处理芽孢杆菌孢子是十分必要的,这其他研究者的结论相一致,如Lindström等研究肉毒芽孢杆菌在85 ℃下降1个数量级需要98 min,但93 ℃下降一个数量级仅需要4.2 min[24],Kozmasipo等发现梭状芽孢杆菌孢子在80℃热处理175.6 min和95 ℃处理11.22 min可使芽孢存活量下降1个数量级[25],以及与Evelyn等[19]该研究蜡样芽胞杆菌孢子超高压处理,压力300~700 MPa以内,继续升高压力灭菌效果并没有显著性变化,但升高温度后杀菌效果产生显著性变化。

图2 不同温度条件下微波和水浴对地衣芽孢杆菌孢子的杀菌效果
图3可见,相同时间和温度条件下微波和水浴处理芽孢存活率不同。95和100℃处理5 min后,水浴和微波处理的芽孢残留率均显著降低,水浴处理后,芽孢存活率分别减少1.20和2.83 lg(CFU/mL),而微波处理后,芽孢存活率分别减少3.11和3.66 lg(CFU/g)。80和85℃处理5min后,微波处理后芽孢存活率下降0.107和0.63 lg(CFU/mL),水浴处理后存活率分别下降0.10、0.074 lg(CFU/mL),均<1 lg(CFU/mL)。80和85℃处理60 min后,微波处理后存活率是水浴处理后的一半。可见,80、85、90、95和100℃时,微波处理芽孢存活率均低于水浴。而杭峰等[26]研究发现微波和水浴低温(50、55、60和65℃)杀灭大肠杆菌()、乙型副伤寒沙门氏菌()和金黄色葡萄球菌()时,发现温度是主要作用,微波非热效应较弱,可能是杀菌温度过低时微波非热杀菌效不明显。

表1 地衣芽孢杆菌孢子在微波和水浴条件下D值和Z值
注:表示特定温度90%的微生物被杀死所需时间。表示在值变化10倍时,温度的变化。
Note:indicates the time required for microorganisms killed at a specific temperature of 90%.indicates the change in temperature when thevalue is changed 10 times.
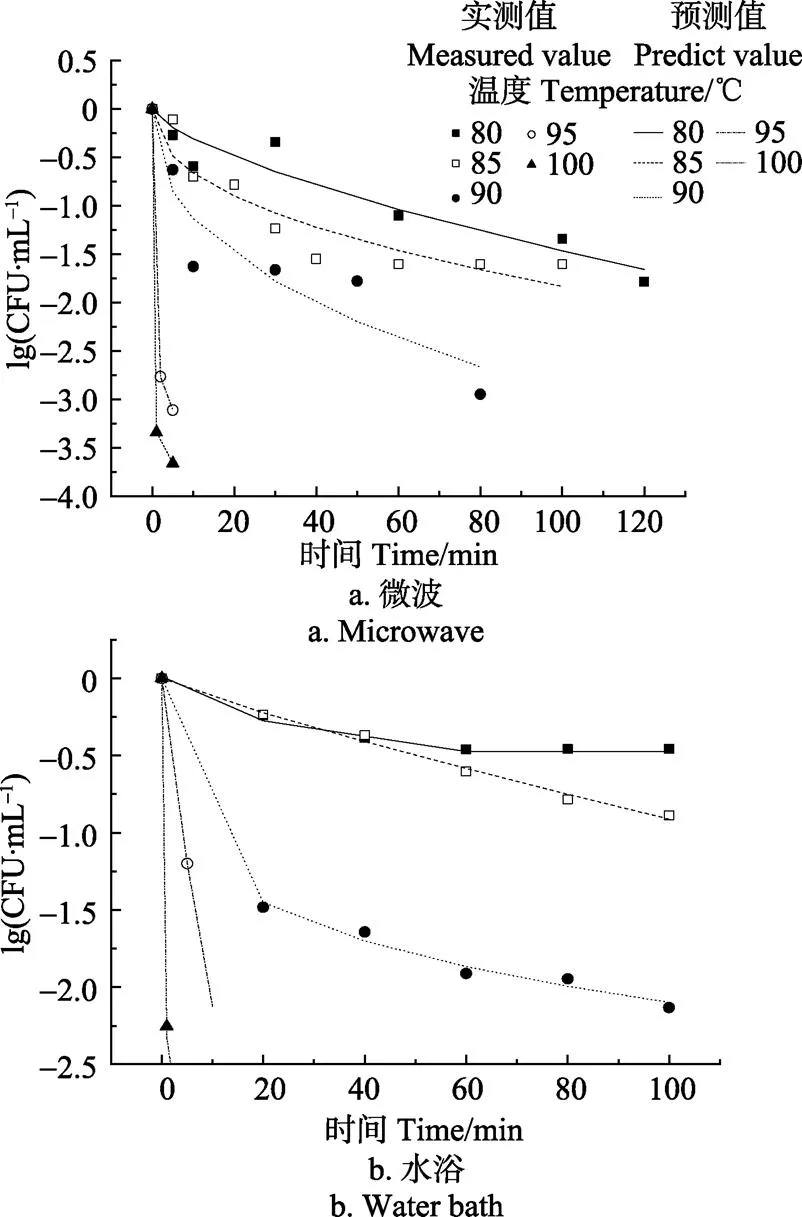
图3 微波和水浴处理不同时间、温度对地衣芽孢杆菌孢子的影响
2.3 模型拟合评价与比较
表2为微波和水浴对地衣芽孢杆菌孢子杀灭效果的模型拟合评价。表2可见,Weibull模型拟合2均大于0.89,而线性拟合的2微波杀菌效果大于90 ℃时均大于0.90,高于90 ℃时,2则下降。而对于水浴杀菌,拟合效果在85和95 ℃时,均高于0.95,其他则均较低。Weibull模型的拟合2整体评价优于线性模型,但对于杀菌效果,线性模型的直观性更好。
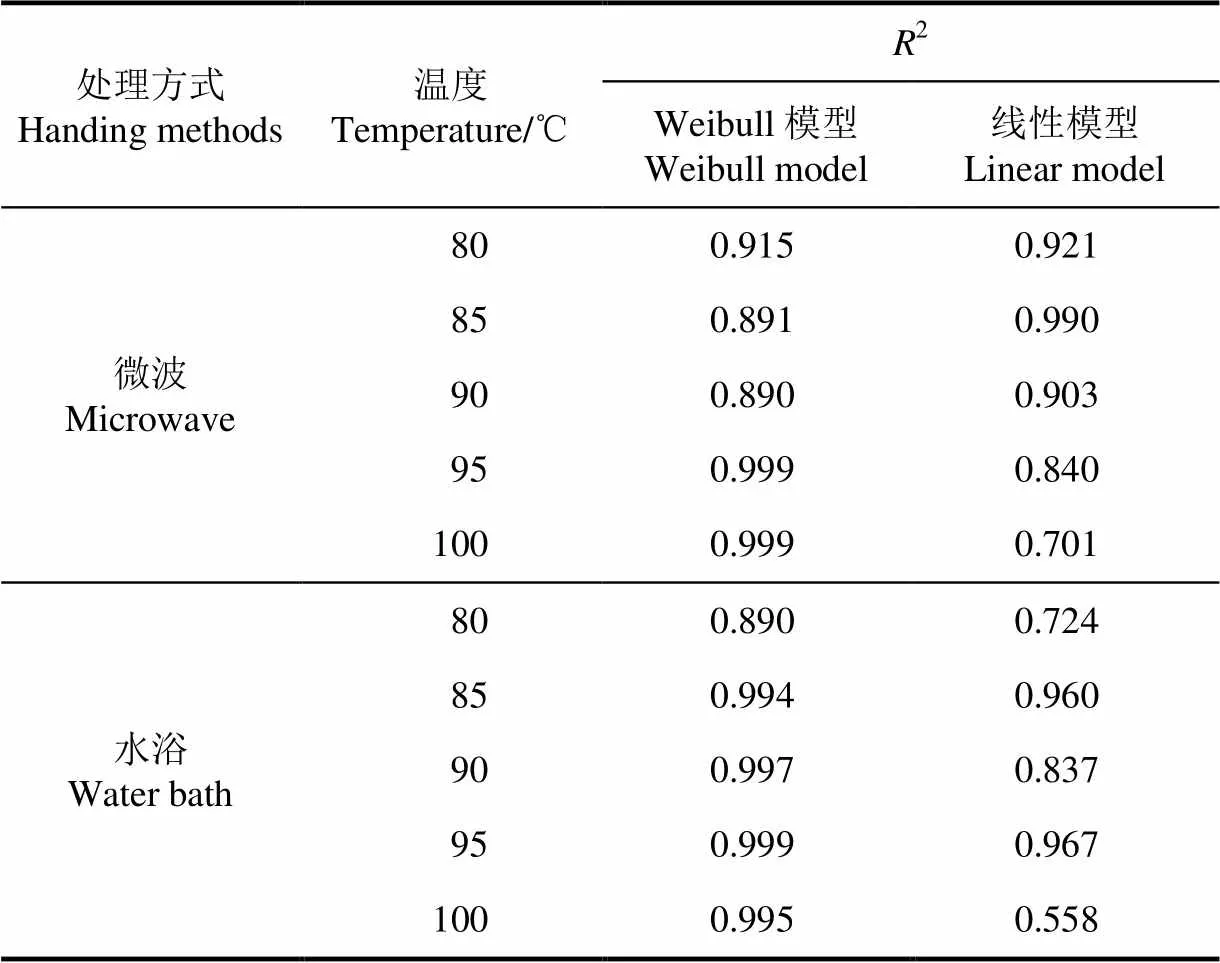
表2 Weibull模型拟合和线性模型拟合比较
2.4 地衣芽孢杆菌孢子蛋白质和核酸释放分析
图4a和图4b分别为水浴处理及为微波处理时地衣芽孢杆菌孢子OD260nm的变化曲线。图4可见,随着水浴和微波处理时间的延长,OD260nm呈现先增后减的趋势,即核酸含量先升高后下降,但OD260nm发生变化的时间不同。图4可见,水浴处理时,80与85℃的OD260nm均在40 min时达到最大,而90 、95 和100℃本别在20、10 和2 min时达到最大值;微波处理时,80和85℃的OD260nm均在5 min时达到最大值,90、95和100℃分别在10、 5和1 min时达到最大值。综上可知,90、95和100 ℃ 水浴处理最大释放量所需时间均为微波所需时间的2倍,80和85 ℃水浴所需时间为微波所需时间的8倍。可 见,微波处理孢子液释放核酸的时间要早于水浴处理的时间。
图5a和图5b分别是水浴处理和微波处理OD280 nm的变化曲线。图5可见,随着处理时间的延长,OD280 nm均呈现先增后降趋势,但发生变化的时间不同。图5a可见,水浴处理时,80 、85 、90 和95 ℃ OD280 nm变化趋势与OD260 nm变化趋势趋于一致,但100 ℃处理时,OD280 nm一直处于下降趋势,推测为蛋白质变性或在0~2 min内达到最大值。图5b可见,微波处理期间,OD280 nm的变化趋势与OD260 nm变化趋势趋于一致。由此可见,微波处理的OD280 nm变化时间早于水浴,即微波处理释放蛋白质的时间要早于水浴。图4和图5结果显示,蛋白质和核酸随着时间的延长释放量逐渐增大,这与李科静[27]微波处理霉菌中核酸和蛋白质含量变化一致。但Kim[15]研究中核酸和蛋白含量在并不存在下降趋势,可能因为处理时间存在差异和取样误差,细胞膜遭到破坏程度不同,核酸和蛋白质泄露无显著差异所致。

图4 水浴和微波处理期间OD260 nm的变化曲线
2.5 芽孢萌发状况
图6是经过微波和水浴处理后孢子的萌发生长曲线。由图可见Logistic模型对芽孢萌发生长曲线拟合效果良好(2>0.95)。图6可见,随着水浴处理温度的提高,80 和85 ℃时,延长处理时间其萌发生长曲线与处理前差异不显著,90 ℃开始时,萌发曲线的延滞期和稳定期存在显著差异,90 、95 ℃处理100 min后,延滞期分别延长5 和8 min。80 ℃微波处理30 min,延滞期延长5 min,85 ℃处理20 min延滞期即可延长8 min,而90 ℃处理10 min可延长8 min,95 ℃处理10 min,芽孢不再萌发,100 ℃处理1 min,即可延长延滞期10 min,处理2 min,即不再萌发。可见,水浴条件下,温度≤90 ℃,对延滞期影响不大,≥90 ℃时,延滞期和稳定期差异显著。微波处理条件下,80~100 ℃相同处理时间,延滞期和稳定期均差异显著。
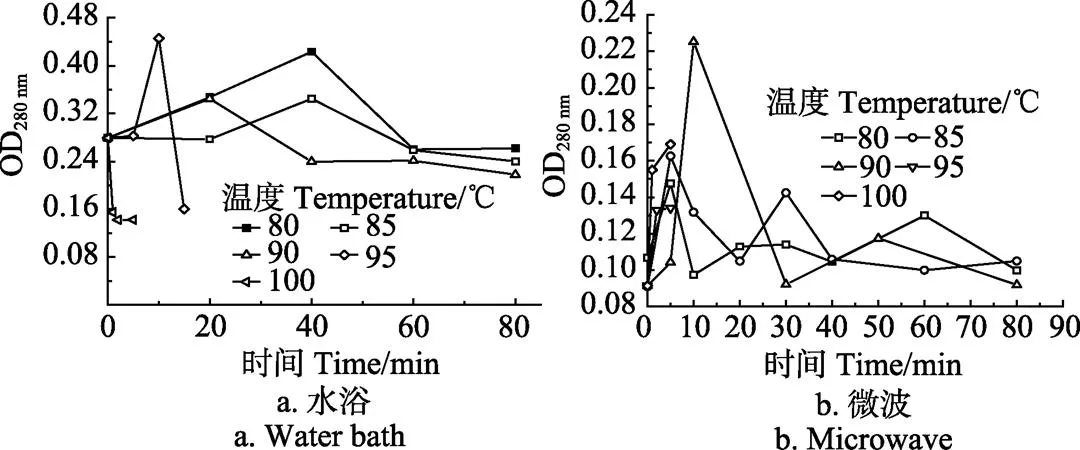
图5 水浴和微波处理期间OD280 nm的变化曲线
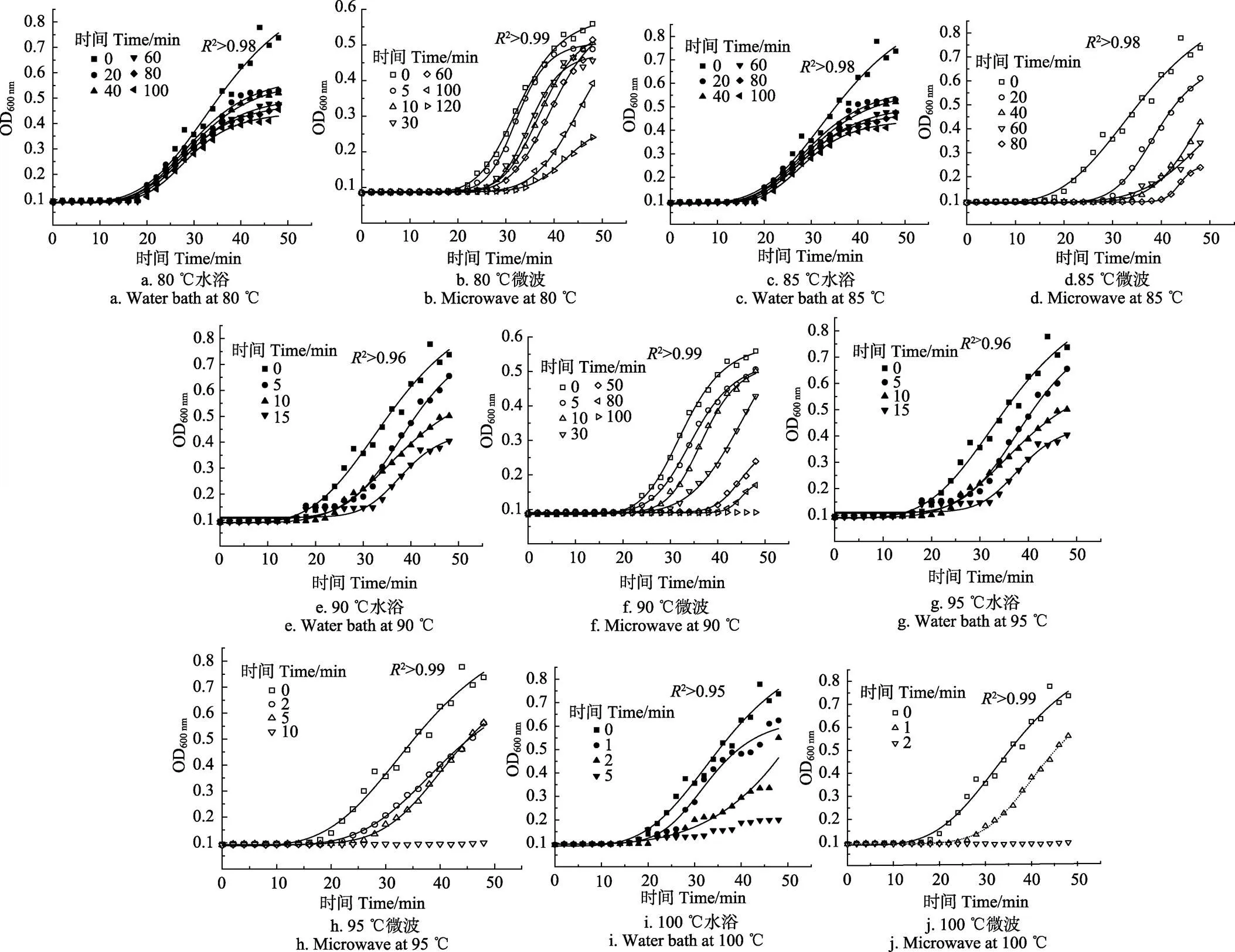
注:实线为拟合预测曲线,图中时间为微波或水域处理时间。
3 结 论
通过采用水浴杀菌和微波杀菌对不同温度-时间地衣芽孢杆菌孢子进行处理,采用线性拟合和Weibull模型对杀菌效果进行拟合,并对处理期间蛋白质和核酸的释放量进行研究,及杀菌前后孢子萌发状态进行分析。结果如下:
1)相同杀菌温度时,微波杀菌效果优于水浴,微波和水浴的杀菌均˃90 ℃时,杀菌效果均较显著;线性模型相比Weibull模型而言,杀菌效果拟合优度更好,但线性模型比较直观;微波处理蛋白质和核酸泄露的时间均早于水浴,且微波处理在10 min内,OD260 nm和OD280 nm达到最大值,水浴处理在40 min内,OD260 nm和OD280 nm达到最大;与水浴相比,微波处理后的芽孢萌发曲线延滞期均显著性延长,水浴95℃处理100 min,延滞期即可延长8 min,而微波95 ℃处理10 min,芽孢不再萌发。文中80和85 ℃微波杀菌效果明显强于水浴杀菌,90 ℃微波残存率变化明显大于水浴,但并不能将芽孢杀灭。95和100 ℃处理时,微波水浴的残存率均显著性下降,但微波将芽孢完全杀灭的时间要低于水浴。
2)微波和水浴最终都可将芽孢杀灭,但水浴100 ℃最少需要5 min,而微波最多需要2 min,而在实际杀菌中100 ℃温度可能过高,容易发生胀袋等现象。可考虑结合外界反压或加载降温设备,或采用较低杀菌温度与其他控菌方法结合(如添加Nisin)等。其次,可添加其他可以诱发芽孢萌发的物质,促进芽孢萌发,从而减少能耗,如肌醇、L-丙氨酸和尼生素等。可能在后续的研究中增加适量促进芽孢萌发的物质,提高微波杀菌效率,并对结合芽孢诱发剂的安全性和可行性进行深入探究。
[1] 陈晓,高晓平,李苗云,等. 肉制品致腐微生物溯源技术构建[J]. 食品科学,2013,34(14):178-181. Chen Xiao, Gao Xiaoping, Li Miaoyun, et al. Establishment of PCR-based technique for tracing spoilage microorganisms in meat products[J]. Food Science, 2013, 34(14): 178-181. (in Chinese with English abstract)
[2] Rey M W, Preethi R, Nelson B A, et al. Complete genome sequence of the industrial bacteriumlicheniformis and comparisons with closely relatedspecies[J]. Genome Biology, 2004, 5(10): r77.1-12.
[3] Elsersy N A, Mohamed E A H. Biochemical andlicheniformis strains isolated from shrimp and clam aquacultures[J]. African Journal of Microbiology Research, 2011, 5(14): 1830-1836.
[4] Salkinoja-Salonen M S, Vuorio R, Andersson M A, et al. Toxigenic strains oflicheniformis related to food poisoning[J]. Applied & Environmental Microbiology, 1999, 65(10): 4637-4645.
[5] 俞建峰,倪蕾,崔政伟,等. 凤爪的微波与巴氏组合杀菌工艺研究[J]. 食品与生物技术学报,2017,36(7):707-713.Yu Jianfeng, Ni Lei, Cui Zhengwei, et al. Research on pasteurization combined with microwave sterilization to chicken claws[J]. Journal of Food Science and Biotechnology, 2017, 36(7): 707-713. (in Chinese with English abstract)
[6] Jamshidi A, Seifi H A, Kooshan M. The effect of short-time microwave exposures oncoliO157:H7 inoculated onto beef slices[J]. African Journal of Microbiology Research, 2010, 22(4): 2371-2374.
[7] Bauzakaszewska J, Skowron K, Paluszak Z. Effect of microwave radiation on microorganisms in fish meals[J]. Annals of Animal Science, 2014, 14(3): 623-636.
[8] Woo I S, Rhee I K, Park H D. Differential damage in bacterial cells by microwave radiation on the basis of cell wall structure[J]. Applied & Environmental Microbiology, 2000, 66(5): 2243-2247.
[9] Kim J E, Choi H S, Lee DU, et al. Effects of processing parameters on the inactivation of Bacillus cereus spores on red pepper () flakes by microwave- combined cold plasma treatment[J]. International Journal of Food Microbiology, 2017, 263: 61-66.
[10] Morozov I I, Petin V G. Features of modifications of cytotoxic consequences of microwave and thermal heating[J]. 1998, 38(2): 232-237.
[11] Marszałek K, Mitek M, Skąpska S. Effect of continuous flow microwave and conventional heating on the bioactive compounds, colour, enzymes activity, microbial and sensory quality of strawberry purée[J]. Food & Bioprocess Technology, 2015, 8(9): 1864-1876.
[12] Vega-Miranda B D L, Santiesteban-López N A, López-Malo A, et al. Inactivation of salmonella typhimurium in fresh vegetables using water-assisted microwave heating[J]. Food Control, 2012, 26(1): 19-22.
[13] 李桂芬,娄永江. 微波能对带鱼杀菌保鲜的研究[J]. 中国水产,2001(3):64-66.
[14] Guo Q, Sun D W, Cheng J H, et al. Microwave processing techniques and their recent applications in the food industry[J]. Trends in Food Science & Technology, 2017, 67: 236-247.
[15] Kim S Y, Shin S J, Song C H, et al. Destruction oflicheniformis spores by microwave irradiation[J]. Journal of Applied Microbiology, 2009, 106(3): 877-885.
[16] 杭锋,陈卫,陈帅,等. 食品微波加热杀菌动力学描述模型的选择[J]. 农业工程学报,2008,24(6):49-52. Hang Feng, Chen Wei, Chen Shuai, et al. Comparison of inactivation kinetics models for microwave heating food[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2008, 24(6): 49-52. (in Chinese with English abstract)
[17] 吴奕渠,余恺,胡卓炎,等. 微波加热对三种微生物致死的Weibull模型[J]. 食品工业科技,2012,33(10):195-197. Wu Yiqu, Yu Kai, Hu Zhuoyan, et al. Weibull model on description of inactivation forandby microwave heating[J]. Science and Technology of Food Industry, 2012, 33(10): 195-197. (in Chinese with English abstract)
[18] 胡思卓,占文婷,徐圆融,等. 蜡样芽孢杆菌及其芽孢的杀菌技术和动力学研究进展[J]. 食品工业科技,2017,38(4):370-378. Hu Sizhuo, Zhan Wenting, Xu Yuanrong, et al. Research progress of pasteurization methodsand kinetics study of Bacillus cereus and its spores[J]. Science and Technology of Food Industry, 2017, 38(4): 370-378. (in Chinese with English abstract)
[19] Evelyn E, Silva F V M. Thermosonication versus thermal processing of skim milk and beef slurry: Modeling the inactivation kinetics of psychrotrophiccereus spores[J]. Food Research International, 2015(67): 67-74.
[20] Staack N, Ahrné L, Borch E, et al. Effects of temperature, pH, and controlled water activity on inactivation of spores ofcereus in paprika powder by near-IR radiation[J]. Journal of Food Engineering, 2008, 89(3): 319-324.
[21] Li R, Shi Y, Ling B, et al. Thermo-tolerance and heat shock protein of Escherichia coli ATCC 25922 under thermal stress using test cell method[J]. mirates Journal of Food & Agriculture, 2017, 29(2): 91-97.
[22] Possas A, Pérez-Rodríguez F, Valero A, et al. Modelling the inactivation ofmonocytogenes by high hydrostatic pressure processing in foods: A review[J]. Trends in Food Science & Technology, 2017, 70: 45-55.
[23] 钱静亚,马海乐,李树君,等. 温度、超声、nisin协同脉冲磁场杀灭枯草芽孢杆菌的研究[J]. 现代食品科技,2013(12):2970-2974. Qian Jingya, Ma Haile, Li Shujun, et al. Inactivation ofsubtilis by pulsed magnetic field combined with temperature, ultrasonic, and nisin[J]. Modern Food Science and Technology, 2013(12): 2970-2974. (in Chinese with English abstract)
[24] Lindström M, Nevas M, Hielm S, et al. Thermal inactivation of nonproteolytictype E spores in model fish media and in vacuum-packaged hot-smoked fish products[J]. Applied & Environmental Microbiology, 2003, 69(7): 4029-4036.
[25] Kozmasipos Z, Szigeti J, Ásványi B, et al. Heat resistance ofspores[J]. Anaerobe, 2010, 16(3): 226-228.
[26] 杭锋,周星浩,陈卫,等. 利用程序模拟水浴升温比较微波加热与水浴杀菌的值和值[J]. 食品与机械,2007,23(1):31-35. Hang Feng, Zhou Xinghao, Chen Wei, et al.and-value comparison between microwave heating and water bath sterilization while altering the microwave heating curve and employing program simulation[J]. Food & Machinery, 2007, 23(1): 31-35. (in Chinese with English abstract)
[27] 李科静. 大米中霉菌的微波杀菌工艺及机理研究[D]. 长春:吉林大学,2015. Li Kejing.Studies on Microwave Sterilization Process and Mechanism of Mold in Rice[D]. Changchun: Jilin University, 2015. (in Chinese with English abstract)
Inactivation characteristics and effect ofspores from spoiling shrimp by microwave sterilization
Guo Quanyou1, Wang Xiaojin1,2, Jiang Chaojun1
(1.200090,; 2.201306,)
is one of the three major cultured shrimps in the world, which has high nutritional and commercial value, containing various mineral elements, high proteinlow fat and a good proportion of fatty acids. Alive, fresh, frozen and preservedare main products in retail and wholesale market. Among them, ready-to-eat shrimp was one of popular products by the way of low temperature drying, mild sterilization and vacuum packaging and other minor processing, which has high nutrition value and easy to carry. However, the vacuum packaging ready-to-eat shrimp meat is easy to spoil and difficultly to store during processing, packaging and distribution. In previous study, the shelf life and dominated spoilage organisms of ready-to-eat shrimp stored at ambient temperature were carried out, andspp.(eg.) isolated from them at the end of shelf life were identified as dominated spoilage organisms. In order to investigate sterilization effects and mechanisms of microwave sterilization onspores isolated from ready-to-eat shrimp meat, the effects of different temperatures (including 80, 85, 90, 95 and 100 ℃) and different treated time by the microwave sterilization onspores were carried out, which water bath sterilization was used as a control group. The differences and changes ofspores in physico-chemical properties before and after water bath sterilization and microwave sterilization were analyzed. The results showed that at the same sterilizing temperature, the effects of microwave sterilization onspores were significantly different with water bath sterilization.spores were finally killed by means of microwave and water bath sterilization, but the microwave sterilization needed only two minutes, the water bath needed at least five minutes.2analysis showed that the weibull model (2>0.89) could better fit the inactivation curves of the two sterilization methods, but the linear model was more intuitive than weibull model. The time of protein and nucleic acid leakage in the spore suspension caused by the microwave treatment was earlier than that of the water bath, microwave treatment reached the maximum value of OD260 nmand OD280 nmwithin 10 min, while water bath treatment reached the maximum value of OD260 nmand OD280 nmwithin 40 min. Compared with the water bath, the spore germination curve after microwave treatment had a longer lag phase,95℃ water bath process 100 min, lag time can extend 8 min, and 95 ℃ with microwave for 10 min, spore germination. The difference of microwave sterilization water bath sterilization under different temperatures and time were investigated. It will provide theoretical and practical basis for optimization of product sterilization technology, targeted sterilization and reduction of bag expansion rate. Meanwhile, the mechanisms and dynamical equations of different sterile means are also further studied.
microwave; sterilization; food processing;; spores
10.11975/j.issn.1002-6819.2018.21.035
S932
A
1002-6819(2018)-21-0281-07
2018-06-06
2018-08-30
中央级公益性科研院所基本科研业务费专项资金(东海水产研究所)资助项目(2016M04)、上海市自然科学基金项目(16ZR1444900)
郭全友,男,副研究员,主要研究方向为水产品加工与安全控制。Email:dhsguoqy@163.com
郭全友,王晓晋,姜朝军. 微波杀灭虾源地衣芽孢杆菌孢子特性及效果[J]. 农业工程学报,2018,34(21):281-287. doi:10.11975/j.issn.1002-6819.2018.21.035 http://www.tcsae.org
Guo Quanyou, Wang Xiaojin, Jiang Chaojun. Inactivation characteristics and effect ofspores from spoiling shrimp by microwave sterilization[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(21): 281-287. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2018.21.035 http://www.tcsae.org

